Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Pediatría (Asunción)
versão On-line ISSN 1683-9803
Pediatr. (Asunción) v.41 n.3 Asunción dez. 2014
ARTÍCULO ORIGINAL
Portación de Staphylococcus aureus multiresistentes a antimicrobianos en cavidad bucal de niños que concurren para un tratamiento en una clínica odontológica, Paraguay
Carriage of Multidrug-resistant Staphylococcus aureus in the Oral Cavities of Children Presenting for Treatment at a Dental Clinic in Paraguay
Karina Cataldo Russomando(1), Ninfa Jacquett Toledo(1), Norma Fariña(2), Alicia Pereira(2), Fátima Rodríguez(3), Rosa María Guillen(3), Graciela Russomando(3)
1. Facultad de Odontología Pierre Fauchard, Universidad Autónoma del Paraguay. Asunción, Paraguay.
2. Laboratorio de Microbiología San Roque. Asunción, Paraguay.
3. Departamento de Biología Molecular y Biotecnología, Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. Paraguay.
Correspondencia: Dra. Graciela Russomando. Departamento de Biología Molecular y Biotecnología, Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. Río de la Plata y Lagerenza. Asunción, Paraguay. E-mail: grusso@rieder.net.py
Recibido: 30/05/201; Aceptado: 09/09/2014.
RESUMEN
Introducción: Staphylococcus aureus es un microorganismo que posee características particulares de virulencia y resistencia a los antibióticos para uso clínico cuya diseminación es de gran importancia en salud pública. Objetivo: Identificar S. aureus sensibles y resistentes a antimicrobianos, colonizantes en cavidad bucal de niños que concurrieron para un tratamiento a una Clínica Odontológica en Asunción. Materiales y Métodos: En este estudio descriptivo, observacional realizado de agosto a septiembre de 2013, se incluyeron niños de 2 a 15 años de edad. Hisopados de cavidad bucal fueron colectados y cultivados en agar-manitol-sal. Los aislados de S. aureus fueron caracterizados respecto a la susceptibilidad a 11 antibióticos y por métodos moleculares se buscó la presencia del gen mecA y del factor de virulencia pvl. Se empleó un cuestionario sobre datos socio-demográficos y factores de riesgo asociados a infección con S. aureus. Resultados: Se incluyeron 112 niños. Se aisló S. aureus en 37 (33%) hisopados y 35 (94,6%) aislados presentaban resistencia a al menos un antibiótico. Resultaron resistentes a: Penicilina (89%), Cloranfenicol (16,2%), Oxacilina (10,8%), Eritromicina (8%), Clindamicina (8%), Gentamicina (5,4%) y un aislado con resistencia intermedia a Ciprofloxacina (2,7%). Cuatro aislados de S. aureus presentaban resistencia a múltiples drogas, los mismos portaban el gen mecA. No se detectó portación del factor de virulencia PVL. Conclusión: La elevada portación en cavidad oral de S. aureus multiresistentes en niños sin factores de riesgo como hospitalización previa o consumo de antibióticos, implica un alto riesgo para posibles infecciones endógenas, además del potencial de transferencia de determinantes de resistencia entre gérmenes de flora bucal normal.
Palabras clave: Staphylococcus aureus, cavidad bucal, resistentes a antibióticos, mecA, Panton-Valentine leukocidin
ABSTRACT
Introduction: Staphylococcus aureus is a bacterium with special characteristics of virulence and resistance to the antibiotics used in clinical practice, and whose spread presents a significant public health challenge. Objective: To identify the presence of S. aureus colonizing the oral cavities of children presenting for treatment at a dental clinic in Asunción, Paraguay and determine its sensitivity or resistance to antibiotics. Materials and Methods: We conducted a descriptive observational study of children aged 2-15 years from August to September 2013. Swab samples from oral cavities were taken and cultivated in mannitol salt agar. Isolates from S. aureus were tested for susceptibility to 11 antibiotics and molecular methods were used to identify the presence of the mecA gene and Panton-Valentine leukocidin (PVL) virulence factor. A questionnaire was used to identify socio-demographic and risk factors associated with S. aureus infection. Results: The study included 112 children. S. aureus was isolated in 37 swab samples (33%), and resistance to at least one antibiotic was found in 94.6% (35) of these. Resistance was found to penicillin in 89%, chloramphenicol in 16.2%, oxacillin in 10.8%, erythromycin in 8%, clindamycin in 8%, gentamicin in 5.4%, and 1 isolate (2.7%) was identified with intermediate resistance to ciprofloxacin. Multiple-drug resistance was found in 4 isolates containing the mecA gene. No sample with the PVL virulence factor was detected. Conclusion: The high prevalence of multidrug-resistant S. aureus in children with no risk factors such as prior hospitalization or antibiotic administration implies a high risk of endogenous infection as well as potential transfer of resistance determinants between microorganisms of the normal oral cavity flora.
Keywords: Staphylococcus aureus, oral cavity, antibiotic resistance, mecA gene, Panton-Valentine leukocidin.
INTRODUCCIÓN
Staphylococcus aureus, es un patógeno frecuente en humanos, causando una amplia gama de síndromes desde infecciones leves de piel y tejidos blandos hasta infecciones de rápido progreso que ponen en riesgo la vida del paciente como la neumonía necrotizante, sepsis severa y fascitis necrotizante(1,2). Es un microorganismo que posee características particulares de virulencia y resistencia a los antibióticos de uso clínico cuya diseminación es de gran importancia en salud pública. La flora oral contiene > 300 especies de bacterias conocidas, además de organismos no cultivables que han sido descubiertos con técnicas moleculares, destacándose recientemente estudios de microbiota bucal por pirosecuenciación(3). Las especies de estafilococos reportadas más frecuentemente de muestras de la cavidad oral son S. epidermidis y S. aureus y con menor frecuencia S. haemolyticus, S. hominis, S. warneri, S. capitis, S. saprophyticus, S. xylosus y S. simulans (4).
La especie más representativa en la cavidad bucal es el S. aureus, su presencia como un componente de la flora oral es controversial y puede estar asociada a infecciones endodónticas, periodontales, periapicales e infecciones supurativas de las glándulas salivares, debajo de prótesis y en pacientes inmunocomprometidos. Se ha aislado principalmente de saliva, y de la biopelícula supra y subgingival(3,5). Cerca del 20–30% de los individuos son portadores persistentes de S. aureus lo cual significa que se encuentran siempre colonizados por esta bacteria y 30% son portadores intermitentes (colonizadores transitorios). La colonización aumenta significativamente el riesgo de infecciones por considerarse un reservorio del patógeno; las bacterias pueden introducirse en el organismo cuando las defensas del huésped están comprometidas(6,7).
Cepas de S. aureus resistentes a meticilina (SARM) emergieron de forma rápida luego del uso de este antibiótico para el tratamiento de infecciones ocasionadas por productores de B-lactamasas(2). Los SARM han sido patógenos nosocomiales importantes desde 1960, sin embargo en la pasada década, han emergido nuevas cepas de SARM en la comunidad, causantes de infecciones supurativas de piel y neumonías severas necrotizantes en personas jóvenes sanas sin aparentes factores de riesgo(8). Los aislados de SARM adquiridos en la comunidad (SAMR-CO) tienen diversas características que los distinguen de las cepas nosocomiales (SAMR-HA). SAMR-CO presentan resistencia a menos antimicrobianos que las cepas adquiridas en el ambiente hospitalario(8,9). La resistencia a meticilina en los estafilococos ha sido asociada al gen mecA que codifica una proteína de unión a la penicilina, PBP2A, con actividad transpeptidasa responsable de laresistencia intrínseca a todos los beta lactámicos. La detección del gen mecA por métodos moleculares es considerado el método de referencia. Los SARM-CO presentan diversos factores de virulencia, principalmente la leucocidina de Panton Valentine (PVL-Panton Valentine leukocidin)(1).
En Paraguay existen pocos estudios publicados sobre S. aureus, en un reporte del año 2005 se describen las variantes circulantes detectadas en muestras clínicas de pacientes hospitalizados en un hospital público(10). Por lo expuesto y con el fin de aportar más datos epidemiológicos sobre portación de S. aureus en población infantil se realiza este estudio que tiene por objetivo detectar la presencia de S. aureus colonizantes en cavidad bucal de niños que concurrieron para un tratamiento a una clínica odontológica, caracterizar a los aislados a través de métodos microbiológicos para resistencia antimicrobiana, detectar la presencia de genes de virulencia por métodos moleculares y evaluar la presencia de factores de riesgo asociados a infección en esta población.
MATERIALES Y MÉTODOS
Diseño y población: Este estudio observacional, descriptivo de corte transverso con muestreo no probabilístico de casos consecutivos, incluyó la participación de 112 niños de 2 a 15 años de edad que asistieron al consultorio de una clínica odontológica en Asunción, Departamento Central en los meses de agosto y septiembre de 2013. Fueron incluidos en el estudio aquellos niños que asistieron al consultorio los días jueves y sábado y cuyos padres dieron su consentimiento informado. Se excluyeron aquellos niños que habían recibido antibióticos en los últimos 15 días y aquellos que no brindaron datos clínicos necesarios para completar la ficha clínica epidemiológica diseñada para este trabajo.
Para la recolección de datos se utilizó un cuestionario estandarizado; en el cual se incluyeron datos socio demográficos y preguntas relacionadas a factores de riesgo asociadas a S. aureus como el uso de antibiótico en los últimos 3 meses, infección grave de la piel que ha requerido tratamiento en su casa o por un profesional médico en los últimos 6 meses (infecciones de la piel, abscesos, ulceras con pus). Exposición en la comunidad a S. aureus, lugar donde el niño se encuentra la mayor parte del tiempo (guarderías, escuela de futbol, etc), número de hermanos y personas que habitan la vivienda. Historia familiar de infecciones y otros antecedentes personales como patologías de base (inmunodeficiencia, cardiopatía, nefropatía, patología cutánea crónica, enfermedad pulmonar) e internación previa.
Análisis microbiológico: La toma de muestra de la cavidad bucal se realizó con hisopos estériles. Las muestras fueron cultivadas en agar-manitol salado, las colonias manitol positivas se cultivaron en agar sangre, identificándose S. aureus por las pruebas bioquímicas convencionales que incluyeron resultados positivos para catalasa, coagulasa, DNAsa y prueba de aglutinación de Látex para S. aureus. El estudio de sensibilidad se realizó por el método de difusión de disco según normas del Clinical and Laboratory Standards Institute (CLSI)(11) y se incluyeron 11 antibióticos. La resistencia a meticilina se determinó utilizando discos de oxacilina y cefoxitina.
Análisis moleculares: El 100% de los S. aureus aislados fueron analizados por métodos moleculares para la detección de los genes mecA y pvl. La extracción de ADN fue por el método de ebullición(12). La detección del gen de resistencia a meticilina, mecA y el factor de virulencia PVL se realizó por la técnica reacción en cadena de la polimerasa (PCR) empleando cebadores específicos y condiciones de amplificación descritas previamente por Murakami y Lina respectivamente(13,14). Los productos de PCR fueron visualizados en geles de acrilamida al 1% con tinción de bromuro de etidio.
Asuntos Éticos: Se contó con el permiso previo de las autoridades de la clínica y del responsable del servicio de microbiología participante del presente protocolo. Se solicitó el consentimiento informado a los padres y aquellos que aceptaron ingresar al protocolo fueron sometidos al cuestionario clínico-epidemiológico y a la toma de muestra. El procedimiento de toma de muestra no es invasivo, ni cruento por lo que no conllevó molestias o riesgos para la salud de los niños.
Asuntos estadísticos. Los datos obtenidos del estudio fueron almacenados en una base de datos, utilizando una planilla electrónica Excel en base al cuestionario de investigación; se utilizó estadística descriptiva.
RESULTADOS
Un total de 112 muestras de hisopados de la cavidad bucal fueron colectadas y cultivadas en agar-manitol salado, las colonias manitol positivas se cultivaron en agar sangre, identificándose S. aureus por las pruebas convencionales (Figura 1).
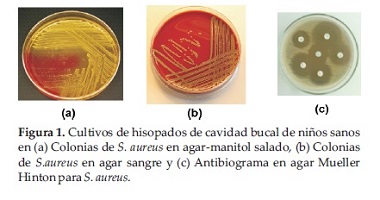
El 51% de los niños participantes eran del sexo femenino y el 25,9% eran menores de 5 años. En relación a la procedencia de los niños incluidos en el proyecto, el 33,9% provenían de Asunción, el 61,6% del Departamento Central y los restantes procedian de los Departamentos de Paraguari, Cordillera y Chaco-i. Se observaron caries pequeñas y grandes en el momento de la consulta en 93 niños (83%).
El promedio de habitantes por vivienda de los participantes fue de 6 personas (Tabla 1). En el examen clínico al momento de la consulta odontológica se diagnosticó gingivitis en 7 niños (6,2%) y fístula y mucosa oral con eritema en 4 niños respectivamente (3,6%). Del total de estos 11 niños en los que se observaron afecciones odontológicas 3 presentaron S aureus con resistencia a penicilina y cloranfenicol.

Se aisló S. aureus en 37 niños generando una frecuencia de portación de 33%. Del total de niños portadores de S. aureus el odontograma registró tres o más superficies afectadas en 32 (83,8%), con un promedio de 3 caries pequeñas y 2 caries extensas por niño. Así mismo de este grupo, 2 (5,4%) niños manifestaron infección en la piel en los últimos 6 meses y en el momento de la toma de muestra, como también manifestaron tener familiares con infección en la piel y en ambos casos los aislados fueron resistentes a penicilina (Tabla 1).
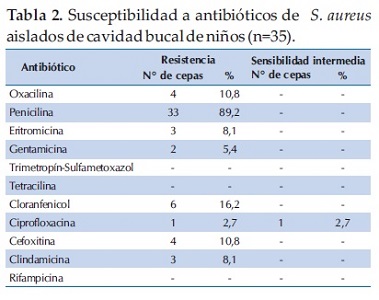
Se detectó resistencia a penicilina en el 89,2% de los aislados de S. aureus, seguido en frecuencia por los niveles de resistencia a cloranfenicol (16,2%) y oxacilina (10,8%) (Tabla 2). No se detectaron aislados de S. aureus resistente a trimetoprim sulfametoxazol ni rifampicina. La asociación de resistencia simultánea a antibióticos mostró que 35 aislados de S. aureus (94,6%) fueron resistentes a al menos un antibiótico y 4 (10,8%) aislados presentaron resistencia a más de tres antibióticos (resistencia múltiple) y además fueron portadores del gen mecA que confiere resistencia a meticilina (Figura 2). Los aislados multirresistentes provenían de niños de 5, 7, 8 y 15 años, mientras que la asociación de antibióticos a los cuales eran resistentes los aislados de S. aureus se muestra en la tabla 3. No se detectó la presencia del factor de virulencia PVL en los aislados de S. aureus analizados en este trabajo.
Del total de niños portadores de S aureus, 7 (18,9%) manifestaron haber consumido antibiótico en los últimos 3 meses. En los aislados provenientes de estos niños se detectó resistencia a penicilina en 5 de ellos, 1 a penicilina y cloranfenicol y 1 no presentó resistencia a los antibióticos testados. Tres niños tenían antecedentes de internación en los últimos 3 meses, con edades de 5, 6 y 7 años, detectándose en los tres casos resistencia a penicilina. Un total de 14 niños manifestaron tener cuadros respiratorios de los cuales tos, asma y neumonía fueron las manifestaciones clínicas comunes. Los casos de niños portadores de cepas multiresistentes al momento de la consulta presentaban pequeñas caries que no requerían de un tratamiento muy invasivo, por lo que en estos casos el riesgo de infección era bajo.
DISCUSIÓN
Se conoce poco sobre el rol de los estafilococos en la cavidad oral de individuos sanos y enfermos. El resultado de portación de S. aureus en cavidad bucal detectado en este trabajo es del 33% y el gen de resistencia a meticilina (mecA) es similar a lo encontrado en el estudio de Miyake y colaboradores(15) quienes hallaron igual porcentaje de portación en niños japoneses de 1 a 5 años. En una revisión llevada a cabo en el año 2001 reportaron un estudio sobre portación en la cavidad oral en 307 niños de 1 a 5 años, donde el 33% eran portadores de S. aureus y 5% de éstos eran resistentes a meticilina; 19% de los S. aureus aislados producían una toxina exfoliativa y el 40% producía una enterotoxina(7). Jackson y colaboradores encontraron cifras de portación del 5% en 124 niños con cáncer inmunocomprometidos, a raíz de estos resultados los autores sugirieron que se realice un cultivo bacteriano de rutina en la cavidad bucal de pacientes pediátricos neutropénicos(16).
Un estudio publicado en el año 2009 por Miller y col.(17) realizado en Manhatan, en 321 viviendas con 914 habitantes, hallaron una prevalencia de S. aureus del 25%, 0,4% SARM y 97 (11%) individuos con infecciones severas de la piel en los últimos 6 meses. Sin embargo, no se encontró correlación entre colonización nasal e infecciones activas en piel, por lo que recomiendan el estudio de portación en otros sitios del cuerpo que podrían ser cruciales en la transmisión. En nuestro estudio tan solo 2 niños manifestaron infección en la piel y sus familiares también por lo que podría aportar evidencia hacia una transmisión intrafamiliar, éste hecho ha sido apuntado por varios autores incluyendo a Knox y col (18). Un estudio genético comparativo de los aislados de S. aureus en boca y en piel podría aportar mayor información sobre esta asociación.
Diversos autores han indicado la necesidad de profundizar el estudio del rol de S. aureus en cavidad oral(19). En un estudio realizado en Uruguay en niños que asistían a consultorios odontológicos, con el fin de demostrar que el uso de un antimicrobiano puede modificar la composición de los gérmenes de la microflora normal, describen que el 84,6% de los niños habían consumido antibióticos previamente a la consulta(20). En nuestro estudio con el fin de evitar la asociación de consumo de antibiótico como factor de riesgo para la selección de gérmenes resistentes en cavidad oral, hemos ingresado al estudio solo aquellos niños cuyos padres manifestaban que los niños no consumieron antibiótico en los últimos 15 días.
Es mucha la información científica referente a portación de S.aureus en niños en áreas como piel, fosas nasales, etc.(21-24); contrastando con lo correspondiente a la cavidad oral, muy poco enfocada como objeto de investigación; ésta situación revela la necesidad de realizar investigaciones con diferentes poblaciones y diseños con el objeto de aportar datos que muestren la situación real de los pacientes en cuanto a la portación bucal de S. aureus y patrón de resistencia antimicrobiana. Aún más teniendo en cuenta el riesgo de las infecciones bucales como puerta de entrada a enfermedades sistémicas. En la boca se hallan presentes varias bacterias que por lo general se mantienen bajo control con una buena higiene bucal como el cepillado y el uso de hilo dental diarios. Cuando las bacterias patógenas crecen fuera de control, pueden ocasionar infecciones en las encías y de esta manera convertirse la cavidad oral en un puerto de entrada al torrente sanguíneo. Incluso en ciertas condiciones los gérmenes de la flora normal pueden advenir como patógenos pudiendo ser agentes de posibles infecciones endógenas como por ejemplo endocarditis bacteriana, bacteriemia en el paciente neutropénico(25).
Los aislados de S. aureus estudiados en este trabajo, en base a los antecedentes clínicos, parecen corresponder a cepas adquiridas en la comunidad, ya que no hay antecedentes de hospitalización. Si bien sólo la décima parte de los aislados fueron SARM-CO y ninguno de ellos portaba el factor de virulencia PVL, no se puede descartar el riesgo de que los mismos bajo ciertas condiciones del huésped puedan ocasionar patologías graves. Es importante resaltar que a nivel mundial las cepas SARM-CO se han asociado a infecciones graves en niños sin factores de riesgo y previamente sanos. Las cepas adquiridas en la comunidad tienen un patrón de susceptibilidad a antimicrobianos diferente a las de origen hospitalario. Demuestran solamente resistencia a meticilina y buena respuesta a clindamicina, cotrimoxazol y tetraciclinas. Provocan infecciones de la piel preferentemente (85-90% de los casos) y en ~10% causan infecciones graves (ej. sepsis o neumonía necrosante más frecuentemente) que pueden ocasionar la muerte del paciente(26, 27).
Los resultados de este trabajo nos abren camino a seguir profundizando sobre la importancia de la resistencia bacteriana y su relación con el consumo de antimicrobianos a nivel clínico y social, con enfoques epidemiológicos en salud bucodental en escolares. Los datos generados en trabajos futuros de investigación pueden convertirse en un instrumento básico en la planificación de los programas de prevención y de asistencia dental. Es sorprendente la escasez de conocimiento sobre el papel de los estafilococos orales en la salud y la enfermedad, por lo que ahondar en esta área puede conducir a beneficios múltiples como la mejora de los regímenes de descolonización para la erradicación de SARM y el reconocimiento de la boca como una posible fuente bacteriemia de estafilococos.
CONCLUSIÓN
El presente estudio demuestra una vez más que las infecciones causadas por S. aureus representan un desafío para las instituciones sanitarias en nuestro país en cuanto al manejo y control de su diseminación. El 33% de los niños de 2 a 15 años que asistieron a la clínica odontológica eran portadores de S. aureus, y el 94,6% de los aislados eran resistentes a al menos un antibiótico testado, esto implica un alto riesgo como agentes de posibles infecciones endógenas y un riesgo potencial de transferencia de determinantes de resistencia entre gérmenes de flora normal. Además, este trabajo aporta nueva información referente a la portación en cavidad bucal de cepas multiresistentes (10,8%) y resistentes a meticilina (mecA) de S.aureus en niños que no refieren hospitalización previa ni consumo de antibióticos. Esta información en el ámbito odontológico es relevante y debe ser considerada ya que este germen puede comprometer el resultado final del tratamiento llevando al paciente a un cuadro clínico de mayor gravedad y poca respuesta al tratamiento antibiótico.
REFERENCIAS
1. Killic A, Li H, Stratton Ch, Tang Y. Antimicrobial susceptibility patterns and Staphylococcal cassette chromosome mec types of, as well as Panton-Valentine leukocidin occurrence among, methicillin resistant Staphylococcus aureus isolates from children and adults in middle Tennessee. J Clin Microbiol.2006;44(12):4436-40. [ Links ]
2. Boyle-Vavra S, Daum RS. Community-acquired methicilin-resistnt Staphylococcus aureus: the role of Panton-Valentine leukocidin. Lab Invest.2007;87:3-9. [ Links ]
3. Keijser BJ, Zaura E, Huse SM, van der Vossen JM, Schuren FH, Montijn RC, ten Cate JM, Crielaard W. Pyrosequencing analysis of the oral microflora of healthy adults. J Dent Res. 2008; 87(11):1016-20. [ Links ]
4. Smith AJ, Jackson MS, Bagg J. The ecology of Staphylococcus species in the oral cavity. J Med Microbiol. 2001;50:940-46. [ Links ]
5. Negroni M. Microbiología estomatológica: fundamentos y guía práctica. 2ª ed. Buenos Aires: Editorial Médica Panamericana; 2009. [ Links ]
6. Wertheim HF, Melles DC, Vos MC, van Leeuwen W, van Belkum A, Verbrugh HA, Nouwen JL. The role of nasal carriage in Staphylococcus aureus infections. Lancet Infect Dis. 2005; 5(12):751-62. [ Links ]
7. Lowy F. Antimicrobial resistance: the example of Staphylococcus aureus. J Clin Invest. 2003;111(9):1265-73. [ Links ]
8. Kim ES, Song JS, Lee HJ, Choe PG, Park KH, Cho JH, Park WB, Kim SH, Bang JH, Kim DM, Park KU, Shin S, Lee MS, Choi HJ, Kim NJ, Kim EC, Oh MD, Kim HB, Choe KW. A survey of community-associated methicillin-resistant Staphylococcus aureus in Korea. J Antimicrob Chemother. 2007;60(5):1108-14. [ Links ]
9. Mandell G, Bennett J. Enfermedades infecciosas: principios y prácticas. 6ª ed. Madrid: Elsevier; 2006. [ Links ]
10. Mayor L, Ortellado J, Menacho C, Lird G, Courtier C, Gardon C, Meugnier H, Bes M, Vandenesch F, Etienne J. Molecular characterization of methicillin-Resistant Staphylococcus aureus isolates collected in Asunción, Paraguay. J ClinMicrobiol. 2007;45(7):2298-2300. [ Links ]
11. Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; 16th informational supplement, CLSI document M100-S16. Wayne, PA. Clinical and Laboratory Standards Institute; 2006. [ Links ]
12. Zhang K, Sparling J, Chow BL, Elsayed S, Hussain Z, Church DL, Gregson DB, Louie T, Conly JM. New quadriplex PCR assay for detection of methicillin and mupirocin resistance and simultaneous discrimination of Staphylococcus aureus from coagulase-negative staphylococci. J Clin Microbiol. 2004;42(11):4947-55. [ Links ]
13. Murakami K, Minamide W, Wada K, Nakamura E, Teraoka H, Watanabe S. Identification of methicillin-resistant strains of staphylococci by polymerase chain reaction. J Clin Microbiol. 1991;29(10):2240-2244. [ Links ]
14. Lina G, Piemont Y, Godail-Gamot F, Bes M, Peter MO, Gauduchon V, Vandenesch F, Etienne J. Involvement of Panton-Valentine leukocidin-producing Staphylococcus aureus in primary skin infections and pneumonia. Clin Infect Dis. 1999;29:1128-32. [ Links ]
15. Miyake Y, Iwai M, Sugai M, Miura K, Suginaka H, Nagasak N. Incidence and characterization of Staphylococcus aureus from the tongues of children. J Dent Res. 1991;70:1045-1047. [ Links ]
16. Jackson MS, Bagg J, Kennedy H, Michie J. Staphylococci in the oral flora of healthy children and those receiving treatment for malignant disease. Microb Ecol Health Dis. 2000;12:60-64. [ Links ]
17. Miller M, Cook HA, Furuya EY, Bhat M, Lee MH, Vavagiakis P, Visintainer P, Vasquez G, Larson E, Lowy FD. Staphylococcus aureus in the community: colonization versus infection. PLoS One. 2009;4(8):e6708. [ Links ]
18. Knox J, Uhlemann AC, Miller M, Hafer C, Vasquez G, Vavagiakis P, Shi Q, Lowy FD. Environmental contamination as a risk factor for intra-household Staphylococcus aureus transmission. PLoS One. 2012;7(11):e49900. [ Links ]
19. Smith AJ, Robertson D, Tang MK, Jackson MS, MacKenzie D, Bagg J. Staphylococcus aureus in the oral cavity: a three-year retrospective analysis of clinical laboratory data. British Dent J. 2003;195(12):701-703. [ Links ]
20. Verolo C, Viera J, Pivel L. Prevalencia de la resistencia bacteriana en flora bucal en niños de 4 a 8 años. Odontoestomatología. 2010; 13 (16): 51-9. [ Links ]
21. Ochoa TJ, Mohr J, Wanger A, Murphy JR, Heresi GP. Community-associated methicillin-resistant Staphylococcus aureus in pediatric patients. Emerg Infect Dis. 2005;11(6):966-68. [ Links ]
22. Paganini H, Della MP, Muller B, Ezcurra G, Uranga M, Aguirre C, Kamiya M, Ensinck G, Miranda MR, Ciriaci C, Hernández C, Casimir L, Rial MJ, Schenonne N, Ronchi E, Rodríguez Mdel C, Aprile F, De Ricco C, Saito V, Vrátnica C, Pons L, Ernst A, Morinigo S, Toffoli M, Bosque C, Monzani V, Mónaco A, Pinheiro JL, López Mdel P, Maninno L, Sarkis C. Infecciones por Staphylococcus aureus resistente a meticilina adquiridas en la comunidad en niños antes sanos y en niños relacionados al hospital en la Argentina. Rev Chil Infectol. 2009;26(5):406-12. [ Links ]
23. Rafee Y, Abdel-Haq N, Asmar B, Salimnia T, Pharm CV, Rybak Pharm MJ, Amjad M. Increased prevalence of methicillin-resistant Staphylococcus aureus nasal colonization in household contacts of children with community acquired disease. BMC Infect Dis. 2012;12:45. [ Links ]
24. Hernández T, Toraño G, González M, González I. Staphylococcus aureus resistente a la meticilina: detección de portadores entre niños hospitalizados y niños sanos de la comunidad. Rev Cubana Med Trop. 2003;55(3):153-61. [ Links ]
25. Adén F, Aranzamendi R, Castillo V, Muñoz M, Gareca C, Baspineiro B, Burgos Praxt R, Perdoménico O. Mediastinitis necrosante descendente secundaria a una infección odontológica. Arch Argent Pediatr. 2004;102(2):132-36. [ Links ]
26. Plata K, Rosato AE, Wegrzyn G. Staphylococcus aureus as an infectious agent: overview of biochemistry and molecular genetics of its pathogenicity. Acta Biochim Pol. 2009;56(4):597-612. [ Links ]
27. Boyle-Vavra S, Ereshefsky B, Wang Ch, Daum RS. Successful multiresistant community-associated methicillin-resistant Staphylococcus aureus lineage from Taipei, Taiwan, that carries either the novel Staphylococcal Chromosome Cassette mec (SCCmec) type VT or SCCmec Type IV. J Clin Microbiol. 2005;43(9):4719-4730. [ Links ]














