Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Pediatría (Asunción)
versão On-line ISSN 1683-9803
Pediatr. (Asunción) v.41 n.2 Asunción ago. 2014
CASO CLÍNICO
Síndrome DRESS y necrólisis epidérmica tóxica por el uso de lamotrigina: a propósito de dos casos
DRESS syndrome and Toxic Epidermal Necrolysis Due to Lamotrigine: a Report of Two Cases
Luís Alberto Chamorro Noceda, Elva Avalos Morínigo, Liz Mabel Vega, Laura Rojas de Recalde, Zoilo Morel, Myriam Palacios de Giménez (1)
1. Servicio de Pediatría del Hospital Central del Instituto de Previsión Social. Asunción, Paraguay.
Correspondencia: Dr.Luís Alberto Chamorro Noceda. E-mail: lachamorro@click.com.py
Recibido: 12/02/2014; Aceptado: 05/05/2014.
RESUMEN
Las reacciones adversas cutáneas a medicamentos (RACM) son una variedad de las múltiples reacciones adversas a los medicamentos (RAM). El Síndrome DRESS es una de ellas y está caracterizada por rash cutáneo, afectación de vísceras y eosinofilia. La Necrólisis Epidérmica Tóxica (NET) o Síndrome de Lyell es otra afección dentro del grupo de las RACM, parecida al Síndrome de Stevens Johnson (SSJ), del cual se diferencia por la extensión de las lesiones cutáneas en más de 30% de la piel. Estas reacciones adversas pueden ser causadas por una variedad de medicamentos entre ellos los antiepilépticos y la asociación de la Lamotrigina con el Ácido Valproico, por acumulación y alargamiento de la vida media del primero. Se presenta el caso de una niña con el antecedente de haber sido tratada con antiepilépticos, entre ellos el Ácido Valproico y que luego de 15 días de ser introducida la Lamotrigina, presentó rash cutáneo, fiebre, alteración de las enzimas hepáticas y eosinofilia importante, cumpliendo los criterios diagnósticos de Síndrome DRESS. El segundo caso corresponde a un niño que estando en tratamiento con antiepilépticos, entre ellos Ácido Valproico se le agregó Lamotrigina por una Epilepsia de difícil control y 20 días después presentó lesiones de piel con afectación de mucosas que se fueron agravando, requiriendo internación en UTI, el cuadro clínico fue compatible con NET. Ambos pacientes tuvieron una evolución favorable.
Palabras clave: Síndrome DRESS, Síndrome de hipersensibilidad a fármacos, necrólisis epidérmica tóxica, lamotrigina, ácido valproico.
ABSTRACT
Adverse cutaneous drug reactions (ACDR) are one of many types of adverse drug reactions (ADR). DRESS syndrome is one of these, and is characterized by a skin rash, organ involvement, and eosinophilia. Toxic epidermal necrolysis (TEN), or Lyell’s syndrome, is another disease of the ACDR group, and is similar to Stevens-Johnson syndrome (SJS), from which TEN is differentiated by the extension of cutaneous lesions to more than 30% of the skin. These adverse reactions can be caused by a variety of medications, among them anticonvulsives and use of lamotrigine with valproic acid, due to a resulting increased accumulation and half-life of the lamotrigine. We present the case of a female child previously treated with anticonvulsives, including valproic acid, who at 15 days after introduction of lamotrigine presented skin rash, fever, altered liver enzymes, and significant eosinophilia, thereby meeting the diagnostic criteria for DRESS syndrome. The second case is that of a male child in treatment with anticonvulsives including valproic acid, to which lamotrigine was added due to refractory epilepsy, and who 20 days later presented skin lesions with mucosal involvement which worsened with symptoms compatible with TEN and required ICU hospitalization. Both patients progressed favorably.
Keywords: DRESS syndrome, drug hypersensitivity syndrome, lamotrigine, valproic acid.
INTRODUCCIÓN
Las reacciones adversas cutáneas a medicamentos (RACM) son una variedad de las múltiples reacciones adversas a los medicamentos (RAM). En adultos el 5.5 % de pacientes hospitalizados son debidos a RAM, de los cuales 2.2 % son RACM; mientras en los niños internados las RACM son la mayoría de las RAM, estimándose que 2.5 % de niños atendidos en forma ambulatoria tratados con drogas presentan RACM y en muchos ocurren en conjunción con una virosis o con desórdenes autoinmunes y más del 12 % de los niños tratados con antibióticos experimentan RACM (1).
Las (RACM) o farmacodermia, son un grupo heterogéneo de dermatosis causadas por el efecto nocivo de medicamentos que ingresan al organismo por diferentes vías. Poseen una gran variedad de expresión clínica que van desde formas leves como exantemas, urticaria, eritema multiforme menor, hasta aquellas formas severas como el síndrome de Stevens-Johnson (SSJ), Necrólisis Epidérmica Tóxica (NET) también llamado Síndrome de Lyell, Eritema Pigmentado Fijo Ampollar (EPFA) y el Síndrome DRESS (2). Un estudio realizado por Rosa Castro y col. en una revisión de 41 pacientes internados por RACM en el Servicio de Dermatología del Instituto Especializado del Niño de Lima, encontró que el 63.4% correspondían a urticaria, SSJ y DRESS con 12.2% cada uno, EPFA con 7.3% y 5% con NET (3).
El Síndrome DRESS es una RACM de variada gravedad e idiosincrática, que se desarrolla en general dos a seis semanas después de la introducción del medicamento y aunque no se conoce bien el mecanismo patogénico, algunos lo explican por la existencia de un defecto en la desintoxicación que producen metabolitos reactivos, los que actúan como haptenos que desencadenan una respuesta inmune específica contra el fármaco, mediada por linfocitos Th2 que segregan interleuquinas 4 y 5 inductoras de eosinofilia en sangre y órganos como la piel.
El cuadro clínico que puede simular una variedad de patologías (4), consiste en una erupción cutánea de variada expresión, acompañada de fiebre, compromiso multivisceral y alteraciones hematológicas como eosinofilia o linfocitos atípicos. Para distinguir este síndrome de las otras formas de farmacodermia, Bouquet y colaboradores introdujeron en 1996 el término “Síndrome DRESS” (acrónimo del inglés: Drug Reaction with Eosynophilia and Sistemic Syntoms), que es causado por una variedad de medicamentos entre los que se destacan los anticonvulsivantes Carbamacepina, Fenitoína, Lamotrigina, Fenobarbital, Ácido Valproico, Difenilhidantoína; diversos antibióticos (Minociclina, Sulfonamidas, β-lactámicos) y algunos antirretrovirales o infecciones virales; en su gran mayoría los pacientes deben ser internados porque el cuadro reviste cierta gravedad (5), su incidencia oscila de 1/1.000 a 1/10.000 casos.
El Síndrome de Stevens-Johnson y la Necrólisis Epidérmica Tóxica se caracterizan por presentar lesiones cutáneas, que resultan del desprendimiento de la unión dermo-epidérmica tanto de la piel, como de los epitelios extracutáneos y de las membranas mucosas. Se diferencian por la extensión de las lesiones de la superficie cutánea afectada: menor al 10% en el caso de SSJ y mayor al 30% en casos de NET, en los casos intermedios que abarcan entre el 10% al 30% se habla de SSJ/NET, lo que hace presumir que son el mismo síndrome con una patogenia común y que se diferencian nada más que por la extensión de la superficie cutánea afectada. La incidencia de NET es muy baja y varía entre 1.2 a 7 casos por millón (6).
Normalmente los queratinocitos tienen una expresión débil del ligando de Fas (Fas-L), que se localiza en el espacio intracelular, previniendo así la unión del ligando con el receptor Fas (CD95) que es el receptor principal de la muerte celular programada de estas células; en la epidermis normal la formación de la capa córnea es un proceso fisiológico que se observa por la apoptosis de las capas más altas del estrato espinoso. En el SSJ y en la NET se produce la apoptosis masiva de todas las capas de la epidermis, debido a que en condiciones patológicas el receptor Fas se expresa en la superficie de los queratinocitos, favoreciendo la unión con el ligando Fas-L. Los macrófagos y linfocitos T citotóxicos CD8+ también parece que juegan un papel importante ya que luego de la exposición a medicamentos o a algunos microorganismos, se cree que los mismos pueden expresar y producir mayor cantidad de Fas-L, perpetuando la apoptosis inducida por el factor de necrosis tumoral alfa TNFα que actúa sobre el receptor TNF-R1 o el receptor Fas-L, presente en los mismos, con una estructura intracelular, que comparten una secuencia denominada el dominio de la muerte, por medio de la activación de la vía de las caspasas (7).
Las mismas proteasas producidas a partir de pro-enzimas (sin función catalítica) son las más específicas de la naturaleza ya que al “cortar” una proteína lo hacen reconociendo la secuencia de aminoácidos, desencadenando un reacción en cascada al igual que la que se desencadena con la activación de la coagulación y del sistema del complemento, que lleva a la proteólisis irreversible, induciendo cambios en la membrana celular que presenta moléculas que atraen a los macrófagos que las fagocitan (8); la reacción de apoptosis masiva que ocurre en la NET desencadena un proceso inflamatorio por la liberación de citokinas por los macrófagos, superados en su capacidad de eliminación de las células apoptóticas. La apoptosis puede ser ocasionada por diversos fármacos como antiepilépticos (9), Sulfonamidas, Oseltamivir (10), por Mycoplasma Pneumoniae o infecciones producidas por herpes virus (11).
En nuestro país existe poca información sobre RACM en pediatría y la única publicación sobre el tema fue realizada por Arnaldo Aldama y col. en el año 2004 (12) donde describen 47 casos en niños de 0 a 15 años, que constituyen el 20.2% del total de 231 pacientes atendidos por farmacodermia, tanto entre los internados como en la consulta externa en un período de 10 años en el Hospital Nacional de Itauguá y que representan al 3% de los pacientes atendidos por diferentes patologías en el Servicio de Dermatología en el mismo período de tiempo.
Dada la escasa ocurrencia de casos graves de RACM en la práctica pediátrica, por tanto a su escaso conocimiento y debido a que los exantemas virales son comunes en los niños, el pediatra a menudo se enfrenta al dilema diagnóstico de si se trata de una infección o de una RACM, cuando el niño que estaba recibiendo un medicamento presenta rash cutáneo generalizado, situación a veces no fácil de discernir. Por este motivo se presentan dos casos de RACM que fueron internados en el Servicio de Pediatría del Hospital Central del Instituto de Previsión Social, por Síndrome DRESS y Necrólisis Epidérmica Tóxica; en ambos casos la aparición del cuadro clínico se inició posterior al uso del fármaco Lamotrigina que fue asociado al Ácido Valproico semanas antes del ingreso, en el contexto del tratamiento de cuadros epilépticos de difícil control.
CASOS CLÍNICOS
Caso Clínico 1
R.M.C. de 7 años de edad, sexo femenino, procedente de Ñemby, conocida por antecedente de Toxoplasmosis congénita con Hidrocefalia secundaria, portadora de VDVP (válvula de derivación ventrículo peritoneal) y Epilepsia de difícil control que requirió el uso consecutivo de varias drogas antiepilépticas entre ellas Ácido Valproico, a los cuales se agregó Lamotrigina aproximadamente 15 días antes de su internación. Presentó rash cutáneo que se inició en el rostro y luego fue extendiéndose al tronco y las extremidades, no dolorosas ni pruriginosas, agregándose al día siguiente fiebre intermitente, con escalofríos, graduada hasta 38. 8°C, siendo medicada con paracetamol gotas y medios físicos. Consultó con facultativo desde el inicio, quien lo medicó con Clorfeniramina, Gentamicina crema y Cefalexina que recibió 2 días.
Ante la no mejoría del cuadro clínico por persistencia de la fiebre y del exantema cutáneo, se solicita control laboratorial, luego de retorno del Hemograma que mostró, Hg: 12.8 grs%, Hto: 36.5%, G.B: 4.970/mm3, N: 70 %, L: 29%, E: 1%, Plaquetas: 70.000/mm3, ante la sospecha de Dengue se le suspende la medicación y debido a la poca ingesta de líquidos en 24 hs de evolución y por haber presentado pico febril, acude al Servicio quedando internada en Urgencias Pediátricas del Hospital Central del Instituto de Previsión Social por 24 hs y posteriormente se decide su traslado a Sala de Medicina Interna.
Al examen físico: Paciente escolar con peso: 15,5 kilos, Talla: 120 cm., PC: 46,5 cm., IMC: 14,8 (Entre 0 y +2 DE) en regular estado general, reactiva a los estímulos, con buena mecánica respiratoria y hemodinámicamente estable, en que llamaba la atención el rash cutáneo generalizado. PA: 100/60 mmHg; FR: 22/m; FC: 120/m; Tº axilar: 37º.2 C.
Al examen neurológico se constata nistagmos horizontal (portadora de Toxoplasmosis ocular), pupilas simétricas, isocóricas, foto-reactivas. No ha presentado signos de Hipertensión Endocraneana ni signos meníngeos. Reflejos osteo-tendinosos sin alteraciones.
La piel presentó exantema máculo-papular entre 0.5 a 1 cm. de diámetro, abarcando los 4 miembros, tronco, abdomen y en menor cantidad en el rostro, de color rosado, algunas con vesículas, no pruriginosas, ni dolorosas a la palpación, vitreo-presión negativa, de distribución simétrica, signo de Nikolsky negativo, respetando el cuero cabelludo y las mucosas. El resto del examen físico no ofrecía particularidades (Figura 1).
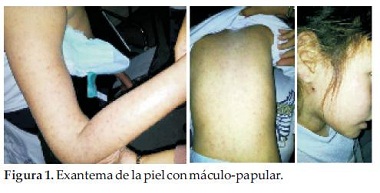
Exámenes realizados el día del ingreso: Hg: 11.9%, Hto: 33.4%, GB: 5.070/mm3, N: 35%, L: 50%, E: 15%, Plaquetas: 60.000/mm3, GOT: 303 U, GPT: 163 U, FA: 485, Bilirrubina total: 0.87 mg/ml, urea: 26 mg/ml, Creatinina: 0.49, Na: 141 mEq/l, Cl: 104 mEq/l, K: 5.4 mEq/l, siendo negativos el hemocultivo, al igual que los estudios para Dengue e Influenza A y B. Hidratada con esquema para Dengue, siguió haciendo picos de fiebre en forma aislada por dos días más, tratada en forma sintomática, fue mejorando progresivamente y el Hemograma de control reveló: Hg: 11.3grs%, Hto: 34 %, GB: 3.950, N: 11%, L: 64%, E: 23%, Plaquetas: 82.000/mm3.
Se realizó biopsia de piel cuyo informe es compatible con Eritema multiforme urticariforme.
Los cortes muestran epidermis de aspecto conservado, dermis papilar, subpapilar y reticular con vasos sanguíneos dilatados y congestivos, rodeados por linfocitos, histiocitos, eosinófilos y en menor número de neutrófilos que se extienden al espesor del tejido conectivo, de aspecto edematoso. No se observaron atipias ni microorganismos.
En ese contexto se le dio de alta médica al quinto día con los diagnósticos de Síndrome DRESS en una niña con Encefalopatía motora crónica no progresiva y portadora de una Epilepsia secundaria de difícil control.
Caso Clínico 2
A.N.B. de 7 años de edad, sexo masculino, procedente de Luque con el diagnóstico de Epilepsia hecho un año antes, tratado con Levetiracetam y Ácido Valproico, a los cuales debido al difícil control de las crisis convulsivas se agregó Lamotrigina cuya dosis fue en aumento gradual; al cabo de 20 días presentó lesiones en piel, de tipo máculo-papulosas y pruriginosas, localizadas especialmente en todos los miembros, que mejoraron parcialmente a los 3 días con la administración de Clorfeniramina y Prednisona por vía oral. Las mismas reaparecieron en forma de habones múltiples en miembros y cara, y de nuevo se atenuaron con uso de Clorfeniramina y Dexametasona por vía EV.
Tres días previos al ingreso relatan la aparición de nuevas lesiones con características de habones en mejillas, región torácica y miembros, con el dato de haber empeorado con el correr de las horas, en coincidencia con el aumento de la dosis plena de Lamotrigina (7 mg/kg/día), en esta oportunidad no se obtuvo mejoría con el tratamiento con Clorfeniramina y Dexametasona; en ningún momento presento fiebre ni cuadro infeccioso previo.
Internado en regular estado general, lúcido, con taquipnea, hemodinámicamente estable, visualizándose lesiones eritemato-violáceas con predominio en el rostro que además se presentaba con edema facial y bipalpebral (Figura 2), el tronco y los miembros superiores; y lesiones ampollares en región anterior del tronco, con presencia de signo de Nikolsky positivo, hiperemia con secreción conjuntival de ambos ojos, el cual fue tratado con colirio de tobramicina. La analítica sanguínea reveló Hemograma GB:12.500/mm3, N:55%, L:35%, M:1%, E:5%, Plaquetas:279.000/mm3, GOT:34 UI; GPT:32UI; Urea:18 mg/dl; Creatinina:0.28 mg/dl.
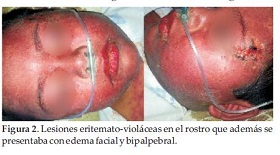
Con el diagnóstico inicial de Síndrome de Stevens Johnson se le administró Inmunoglobulina Humana 2g/kg/día con poca respuesta a la misma, y debido al delicado estado y al empeoramiento del cuadro clínico por la aparición de lesiones en mucosa bucal y extensión de las lesiones cutáneas al 60% del cuerpo, fue trasladado a UTIP, donde permaneció internado por 7 días.
Durante su permanencia en la UTIP, fue tratado por el equipo de cirugía del quemado, se le realizó curaciones con suero fisiológico y vaselina y cubierto con vendajes en tronco y miembros; presentó picos febriles persistentes, taquipneico, requirió la administración de O2 por cánula nasal, manteniéndose lúcido. Recibió alimentación parenteral que luego se pasó a alimentación enteral por sonda, cobertura antibiótica con Vancomicina y Ceftazidima por 5 días, los dos hemocultivos al igual que el urocultivo tuvieron un retorno negativo y el Hemograma de control: Hg:6.7grs%, GB: 14.390/mm3; NS:45%; NB:3%; L:32%; M:3%; E:5%; Granulaciones tóxicas: 25%; Plaquetas: 213.000/mm3, fue transfundido con GRC en dos ocasiones; los perfiles renal y hepático fueron normales. Ante la ocurrencia de episodios de crisis convulsivas, los mismos fueron tratados con Topiramato con buena respuesta. La ecografía abdominal reveló hepatomegalia leve y la ecocardiografía fue normal; la biopsia de piel reveló lesiones compatibles con Eritema multiforme mayor.
El paciente siempre mantuvo su estado de conciencia normal y las lesiones de la piel fueron mejorando paulatinamente, siendo dado de alta con el diagnóstico de: Necrólisis Epidérmica Tóxica en un niño portador de una Epilepsia criptogenética.
DISCUSIÓN
Las reacciones adversas a medicamentos RAM abarcan dos tipos de reacciones, las de Tipo A relacionadas con conocidos efectos farmacológicos de una droga, son dosis dependientes, predictibles, de leve a moderada severidad y ocurren en las mayorías de las RAM; mientras que las reacciones tipo B no relacionadas a los efectos farmacológicos conocidos de una droga, son dosis independientes (pueden ocurrir con dosis mínimas), son impredecibles, idiopáticas, a menudo serias y ocurren en pequeña proporción de las RAM. Tales reacciones son categorizadas como reacciones de hipersensibilidad inmunológicas (verdaderamente alérgicas), pseudoalérgicas y reacciones idiosincráticas a las drogas. Las reacciones adversas cutáneas a medicamentos RACM en los niños son a menudo RAM del tipo B, pueden ser impredecibles, por mecanismos complejos y con dificultad en su identificación, a menudo aparecen luego de un período de 2-3 semanas del inicio de la medicación (13).
El síndrome DRESS, el SSJ y la NET se han descrito en numerosas ocasiones asociadas al uso de diversos medicamentos (14,15), el uso de Carbamacepina (16,17), Fenobarbital (18,19), así como a tuberculostáticos (20), Penicilina (21) o derivados de la Penicilina (22), Sulfonamidas (23), así como también a infecciones por Herpes virus (24) o Mycoplasma Pneumoniae (25).
La Lamotrigina (LTG) es un compuesto feniltriacínico sin ninguna relación con los restantes antiepilépticos, cuyo uso está aprobado como tratamiento de la Epilepsia en monoterapia y como terapia añadida en crisis generalizadas tónico-clónicas y crisis parciales de todo tipo, así como también en el trastorno bipolar. Su mecanismo de acción se debe fundamentalmente a que estabiliza las membranas neuronales por su acción inhibitoria sobre los canales de sodio voltaje-dependientes, reduciendo con ello la acción neuronal repetitiva sostenida al estabilizar la membrana celular, evitando la liberación pre-sináptica de aminoácidos excitadores como el ácido glutámico y el aspartato, bloqueando la neurotransmisión excitatoria típica de estos aminoácidos, en una acción similar a la Fenitoína y la Carbamacepina, además de otros mecanismos de acción (26); A. García-Escrivá y col. en un estudio de seguimiento de 39 pacientes tratados con Lamotrigina cuyas edades variaban de 12 a 61 años, tuvieron una respuesta favorable en el 76.9% de los casos y efectos adversos en el 17.9%, pero éstos sólo se manifestaron como irritabilidad e insomnio y ninguno presentó RACM (27).
La Lamotrigina se metaboliza en un 95% en el hígado mediante la enzima UDP-glucuronil transferasa, siendo eliminado por la orina en un 90% en forma de metabolitos inactivos conjugados con el ácido glucurónico y el 10% excretados en forma inalterada; su vida media se ve afectada por la medicación concomitante, de tal modo que se reduce aproximadamente a 14 horas cuando es administrada junto a inductores enzimáticos como la Carbamacepina y la Fenitoína y aumenta a una vida media de 40 horas cuando se combina con el Ácido Valproico, por reducción de su metabolización debido a que utiliza la misma enzima hepática UDP-glucuronil transferasa (28). De tal modo que el uso de Ácido Valproico concomitante con el uso de Lamotrigina puede aumentar el riesgo de RACM como el Síndrome DRESS, la NET o SSJ (29-32) y puede explicar en parte lo ocurrido con los dos pacientes referidos ya que ambos estaban recibiendo entre otros antiepilépticos el Ácido Valproico, al cual se le agregó Lamotrigina dos semanas antes de la aparición del Síndrome DRESS y NET para el manejo de una Epilepsia refractaria, lo que podría haber elevado los niveles de Lamotrigina por acumulación, debido a la prolongación de su vida media.
En el primer caso el cuadro clínico caracterizado por fiebre, rash cutáneo y los datos de laboratorio: eosinofilia por encima de 500/mm3 en números absolutos que fue aumentando en hemogramas sucesivos, la elevación de las enzimas hepáticas que traducían la inflamación del hígado (sin una hepatomegalia detectable) y el antecedente de haber estado en tratamiento con drogas antiepilépticas durante largo tiempo entre ellas el Ácido Valproico (tal vez responsable de la plaquetopenia que tuvo la paciente), al cual se agregó Lamotrigina 15 días antes de la aparición de los síntomas, puede explicar la aparición de los signos y síntomas atribuibles al Síndrome DRESS.
En el segundo caso, al inicio fue diagnosticado como Síndrome de Stevens-Johnson (SSJ), pero debido a la característica de la extensión de las lesiones de la piel abarcando más del 60 % del cuerpo, se concluyó con el diagnóstico final de Necrólisis Epidérmica Tóxica o Síndrome de Lyell. También como en el caso anterior tuvo el antecedente de haber estado recibiendo Ácido Valproico, al cual se agregó Lamotrigina 20 días antes de la aparición de los síntomas y signos clínicos.
El manejo del Síndrome DRESS se basa en tratamiento de sostén y en algunos casos el uso de corticoides podría reducir los síntomas derivados de la reacción de hipersensibilidad, debido a la inhibición de la IL-5 sobre la acumulación de los eosinófilos in vivo, en los casos en que varios órganos estén comprometidos (33).
En relación al tratamiento del SSJ y NET o SSJ/NET no hay consenso sobre el uso corticoides e Inmunoglobulina Humana endovenosa; sin embargo numerosos trabajos hablan del uso beneficioso de la última (34-37) y en nuestro medio hay una referencia sobre su uso favorable en un caso (38). El mecanismo de acción favorable de la Inmunoglobulina se debe a que interfiere la unión del Fas-L con el receptor Fas, evitando las reacciones en cascada que dan inicio a la apoptosis celular. Hay datos contradictorios sobre su uso como los realizados en dos centros infantiles de EEUU en donde la terapia con Inmunoglobulina se asoció en uno de ellos a mayores secuelas oculares; en dicho estudio Finkelstein y col. (39) que es hasta ahora el seguimiento evolutivo más largo (siete años) de 55 pacientes con SSJ y NET, encontraron que uno de cada cinco casos de SSJ tuvo una recurrencia una vez y en tres casos más de dos veces, lo cual habla que en algunos pacientes existe una predisposición genética que explicaría la recurrencia en una o más ocasiones. Las secuelas ocurrieron en 42% de los casos, lo que coincide con otras publicaciones (40).
En el segundo caso de NET presentado, al parecer el uso de la Inmunoglobulina no fue lo suficientemente favorable, ya que el paciente debió ser trasladado a UTIP para un tratamiento más intensivo ante su agravamiento.
Las RACM pueden ser ocasionadas por diferentes fármacos por una reacción idiosincrática impredecible, donde destacan por su frecuencia los anti-comiciales, situación potencial que podría ocurrir cuando se asocian más de uno de estos medicamentos, hecho bastante frecuente en el tratamiento anti-comicial cuando se trata de epilepsias refractarias o de difícil control. El tiempo transcurrido de más de dos semanas desde la introducción de la Lamotrigina en asociación al Ácido Valproico y la posterior aparición del cuadro clínico presentado por cada uno de los pacientes, hace sospechar la relación causal existente con la droga en ambos casos, aunque no se pudo realizar el monitoreo de Lamotrigina en sangre como hubiera sido deseable, por cuestiones técnicas.
De tal manera que se debería evaluar en detalle, sopesando los beneficios y los riesgos, cuando en el curso del tratamiento anti-comicial de un niño que esté siendo medicado con Ácido Valproico se plantee asociar la Lamotrigina, por los conocidos efectos farmacodinámicos que resultan de la combinación de ambas drogas, ya que potencialmente pueden dar lugar a la aparición de una RACM, y que es el motivo de la presentación de ambos casos.
REFERENCIAS
1. Segal A, Doherty K, Leggott and Zlotoff B. Cutaneous reactions to drug in children. Pediatrics. 2007;120(4):1083-94. [ Links ]
2. Cervini AB, Bujan M, Pierini AM. Farmacodermias en la infancia. Dermatol Argent. 2011;17(2):100-109. [ Links ]
3. Castro R, Ballona R, Gallosa ME, Febres S, Silva D, Catacora J. Manifestaciones cutáneas de las reacciones adversas a medicamentos: revisión de 41 pacientes hospitalizados en el Servicio de Dermatología del Instituto Especializado de Salud del Niño durante 1995-2003. Dermatol Pediatr Lat. 2004;2(1):11-20. [ Links ]
4. Osuna J, Toledo ME, Herrera V, Ramírez C. Reacción por drogas con eosinofilia: síndrome DRESS, un gran simulador. Dermatol. 2013;11(2):142-47. [ Links ]
5. Nogales MA, Samela PC, Buján MM, Cervini AB, Bocian M, Lanoel A, Pierini AM. Síndrome de DRESS: experiencia en un hospital pediátrico. Arch Arg Dermatol. 2010;60:47-51. [ Links ]
6. García Doval I, Rougeou JC, Prado C. Necrólisis epidérmica tóxica y síndrome de Stevens-Johnson: clasificación y actualidad terapéutica. Actas Dermosifililogr. 2000;91:541-51. [ Links ]
7. Hernández CA, Restrepo R, Mejica M. Síndrome de Stevens-Jonhson y Necrólisis Epidérmica Tóxica. Rev Asoc Colomb Dermatol. 2011;19:67-75. [ Links ]
8. Roseto A, Brenner C. Apoptosis o la muerte celular programada. Arch Argent Pediatr. 1999;97(4):253-64. [ Links ]
9. Clavijo R, D avila I, García MJ. Síndrome de Stevens Johnson: una forma grave de las reacciones a medicamentos. Biomedicina. 2011;6(3);26-34. [ Links ]
10. Luna P, Zuazagab M, Chedeb C, Entinb E, Larraldea M. Necrólisis epidérmica tóxica postratamiento con oseltamivir: presentación de un paciente. Arch Argent Pediatr. 2010;108(3):e76-e78. [ Links ]
11. Tablante C, Madrid G, Madrid E, González C, Solórzano C, Blanco C. Síndrome de Stevens Johnson: necrólisis epidérmica tóxica de etiología multifactorial. Academ Biomed Digital [Internet]. 2006 ene-mar [citado 3 feb 2014]; 26. Disponible en: http://vitae.ucv.ve/?module=articulo&rv=6&n=269 [ Links ]
12. Aldama A, Rivelli V, Gorostiaga G, Mendoza G. Farmacodermia en niños. Pediatr (Asunción). 2004;31(2):112-16. [ Links ]
13. Telechea H, Speranza N, Giachetto G. Síndrome de Stevens Johnson: una enfermedad habitualmente producida por medicamentos. Arch Pediatr Urug. 2008;79(3):229-34. [ Links ]
14. Giner Muñoz T. Hipersensibilidad medicamentos. Pediatr Integral. 2005;9(8):623-41. [ Links ]
15. Ureña M, Ávila M, París M, Fangezitcht I, Odio C. Síndrome de Stevens Johnson: experiencia del Hospital Nacional de Niños durante los últimos diez años. Acta Pediatr Costar. 1997;11:118-22. [ Links ]
16. Román Castellini EV, López Torres O, Ponce Rodríguez FM, Velazco Elizalde C. Síndrome DRESS por ingestión de Carbamacepina: reporte de un caso pediátrico. Rev Med Electrónica [Internet]. 2011 [citado 5 feb 2014]; 33(6). Disponible en: http://scielo.sld.cu/scielo.php?pid=S1684-18242011000600011&script=sci_arttext [ Links ]
17. Magliano J, Álvarez M, Salmentón M. Síndrome DRESS por Carbamacepina. Arch Pediatr Urug. 2009;80(4):291-95. [ Links ]
18. Silva N, Bastidas R, Betancourt C. Necrólisis epidérmica tóxica: a propósito de un caso. Dermatología Venezolana. 2007;45(7):16-19. [ Links ]
19. Iglesias JF. Necrólisis epidérmica tóxica (síndrome de Lyell): presentación de un caso. Arch Domin Pediatr. 1977;13(3):113-18. [ Links ]
20. Luque G, Bisero E, Sclavo L, Inwentarz S, Favier M, Jaime S. Síndrome de DRESS por tuberculostáticos: a propósito de un caso. 6º Congreso Argentino de Neumología Pediátrica. Buenos Aires; Sociedad Argentina de Pediatría; 2012. [ Links ]
21. Orbak Z, Sepetcigil O, Karakelleoglu C, Gülses S. Penicillin V-induced drug rash with eosinophilia and systemic symtoms. West Indian Med J. 2010;59(6):722-25. [ Links ]
22. Monteiro Bugni V, de Sande MT, Ascensão Terreri LR, Nunes NA, Len CA, Lupoli Barbosa CM, Esteves Hilário MO. Síndrome DRESS e lupus eritematoso sistêmico juvenil em menina de dois anos de idade. Rev Bras Reumatol. 2008;48(4):257-60. [ Links ]
23. González IC. Síndrome DRESS (Drug rash with eosinophilia and systemic symptoms) por sulfonamidas. Med Cut Iber Lat Am. 2006;34(3-4):120-26. [ Links ]
24. Descamps V, Collot S, Mahé E, Houhou N, Crickx B, Ranger-Rogez S. Active human herpesvirus infection in a patient with drug rash with eosinophilia and systemic symptoms. J Invest Dermatol. 2003;121(1):215-16. [ Links ]
25. Calvano RA, Scacchi MF, Sojo MM, Díaz SM, Volonteri VI, Giachetti AC. Necrólisis epidérmica tóxica asociada a infección aguda por Mycoplasma Pneumoniae. Arch Argent Pediatr. 2013;111(1):e24-e27. [ Links ]
26. Culy CR, Goa KI. Lamotrigine: a review of its use in children epilepsy. Paediatr Drugs. 2000;2(4):299-330. [ Links ]
27. García-Escrivá A, López-Hernández N, Álvarez-Saúco M, Pampliega-Pérez A, Oliver-Navarrete C, Asensio-Asensio M, Moltó-Jordá JM, Palao-Sánchez A. Lamotrigina en epilepsia refractaria. Rev Neurol. 2004;38(4);301-308. [ Links ]
28. Valdivia A, Abadal J. Epilepsia de difícil control en pediatría: nuevas drogas antiepilépticas. Rev Cubana Pediatr. 2005;77(3):43-48. [ Links ]
29. Andreoli MX, Tellez M, Guglielmone A, Velázquez CM, Dilsizan VN. Progresión a necrólisis epidérmica tóxica por uso de Lamotrigina: a propósito de un caso. Rev Argent Dermatol. 2008;89(3):188-92. [ Links ]
30. Gutiérrez Díaz A, Rodríguez LR, Breña Escobar D, Busto Aguiar R, Font Pavón L, Reyes Carmenate V, Marino Hereira T. Alteraciones hematológicas asociadas al síndrome de hipersensibilidad por anticonvulsivantes en una paciente tratada con lamotrigina. Rev Med Electrón [Internet]. 2009 Jun [citado 08 Feb 2014]; 31(3) Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1684-18242009000300015&lng=es. [ Links ]
31. Conforti R, Ferreira M, Abeldaño A, La Forgia M, Pellerano G, Kien C. Síndrome de Stevens-Johnson: necrólisis epidérmica tóxica asociada a lamotrigina, presentación de un caso. Dermatol Argent. 2007;13(3):190-94. [ Links ]
32. Fernández-Calvo C, Olascoaga J, Resano A, Urcola-Echeverría J, Turneu A, Zubizarreta J. Síndrome de Lyell asociado a lamotrigina. Rev Neurol. 2000;31:1162-64. [ Links ]
33. Tats S, Simonart T. Management of drug rash with eosinophilia and systemic symptoms (DRESS syndrome): an update. Dermatology. 2003;206:353-56. [ Links ]
34. Molgó M, Carreño N, Hoyos-Bachiloglua R, Andresen M, González S. Uso de inmunoglobulina humana endovenosa en pacientes con necrólisis epidérmica tóxica, síndrome de sobreposición Stevens-Johnson necrólisis epidérmica tóxica. Rev Med Chile. 2009;137(3):385-89. [ Links ]
35. Sánchez-Michaca VJ, Sánchez-Torres R, Espinosa-Dzib MP, Jiménez-Urueta PS, García-Galavis JL. Necrólisis epidérmica tóxica tratada con inmunoglobulina: informe de un caso. Acta Pediatr Mex. 2009;30(2):104-108. [ Links ]
36. Kühn L, Ramírez D, Gamboa JD. Uso de la inmunoglobulina intravenosa en el tratamiento de la necrólisis epidérmica tóxica y síndrome de Stevens Johnson. Anal Pediatr. 2007;67(1):68-73. [ Links ]
37. Sotelo-Cruz N. Síndrome de Stevens Johnson y necrólisis epidérmica tóxica en los niños. Gaceta Med Mex. 2012;148:265-75. [ Links ]
38. Genes L, Rivarola C, Araya S, Arbo A, Lezcano M. Terapia con inmunoglobulina endovenosa en el síndrome de Stevens Johnson: reporte de un caso. Resúmenes de temas libres. Pediatr (Asunción). 2004;31(Supl.):50-51. [ Links ]
39. Finkelstein Y, Gordon S, Acuna P, George M, Pope E, Ito S, Neil S, Koren G, Shannon MW, Garcia-Bournissen F. Recurrence and outcomes of Stevens Johnson Syndrome and toxic epidermal necrolysis in children. Pediatrics. 2011;128(4):723-28. [ Links ]
40. Sheridan RL, Schultz JT, Ryan CM, Schnitzer JJ, Lawlor D, Driscoll DN, Donelan MB, Tompkins RG. Long consequences of toxic epidermal necrolysis in children. Pediatrics. 2002;109(1):74-78. [ Links ]














