Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.41 no.1 Asunción Apr. 2014
ARTÍCULO DE REVISIÓN
Infección Urinaria: aspectos relevantes y puesta al día
Urinary Tract Infection: Relevant Facts and Update
Leticia Florentín de Merech, Víctor García Bellenzier, Miguel Franco Valdez (1)
1. Departamento de Nefrología Pediátrica, Hospital de Clínicas, Facultad de Ciencias Médicas, Universidad Nacional de Asunción, San Lorenzo, Paraguay.
Correspondencia: Leticia Florentín de Merech. Av. Gral. Bernardino Caballero 362. Asunción, Paraguay. E-mail: leticiamerech@yahoo.com.ar.
Recibido: 4/02/2014; Aceptado: 28/03/2014.
RESUMEN
El enfoque del siguiente trabajo se basa, fundamentalmente, en los cambios que se fueron dando en los últimos años en el manejo de las infecciones urinarias del niño. Independientemente de la edad y el sexo, sistemáticamente se realizaban estudios por imágenes como la cistouretrografía, buscando detectar uropatías como el Reflujo Vesicoureteral, considerado causal del daño renal y que corrigiéndolo, muchas veces, por vía quirúrgica, podía prevenirse la Nefropatía por Reflujo. Con el avance en el conocimiento de la fisiopatología de la Infección urinaria, de los controles ecográficos prenatales y de nuevos trabajos de investigación, pudo evidenciarse que existen también otros factores capaces de producir cicatriz o daño renal, como por ejemplo la Pielonefritis Aguda sin uropatías, por alteración de la inmunidad innata del sistema urinario, las cicatrices congénitas prenatales y la evidencia de Reflujos Vesicoureterales que no producen cicatriz. Adquiere entonces relevancia la “Nefropatía Cicatrizal” sobre la “Nefropatía por Reflujo”, con las consecuentes restricciones e indicaciones más precisas de la Cistouretrografía miccional. La centellografía renal con DMSA, de alta sensibilidad para detectar cicatrices renales, va adquiriendo mayor protagonismo. Por lo tanto, la tendencia actual consiste en solicitar solo aquellos estudios que aporten datos relevantes sobre el paciente (con el menor daño posible), que nos permitan implementar medidas de protección renal y, en lo posible, ayuden a prevenir el daño renal. Como estrategia muy importante de prevención de daño renal adquirido, se recomienda iniciar de inmediato el tratamiento antibiótico empírico ante la sospecha de infección urinaria. Entre otros aspectos, en este trabajo se contemplan también la profilaxis antibiótica y el tratamiento antibiótico oral versus parenteral.
Palabras clave: Infección Urinaria, Pielonefritis Aguda, inmunidad innata, cicatriz, daño renal, cistouretrografía, centellografía renal con DMSA, profilaxis antibiótica.
ABSTRACT
The focus of this article is on changes that have occurred in recent years in the management of urinary-tract infections in children. In the past, independently of age and gender, studies such as cystourethrogram were performed systematically to detect uropathies such as vesicoureteral reflux, which were considered to cause kidney damage, and that when surgically corrected could prevent nephropathy caused by reflux. With advances in knowledge of the pathophysiology of urinary tract infection, prenatal ultrasound monitoring, and new research studies, it became apparent that other factors existed that could produce renal scarring or other renal damage, such as acute pyelonephritis, due to alteration of the innate immunity of the urinary tract system, prenatal congenital scars, or reflux unrelated to scarring. The term scarring nephropathy acquires more relevance than reflux nephropathy, with indications for cystourethrograms becoming more restricted. Renal scintigraphy with dimercaptosuccinic acid (DMSA), which is highly sensitive for renal scars, is becoming more widely used. The current trend is toward individualized assessment of each patient, with only the studies that provide the data most relevant for knowing how to protect the kidneys, and which do the least harm, being requested. One very important strategy recommended for preventing acquired kidney damage is the use of antibiotics when any suspicion of urinary tract infection exists. This article addresses both antibiotic prophylaxis and the question of oral versus parenteral antibiotic administration.
Keywords: Urinary tract infection, pyelonephritis acute, innate immunity, cicatrix, renal injury, cystourethrography, renal scintigraphy, dimercaptosuccinic acid (DMSA), prophylaxis, antibiotics.
INTRODUCCIÓN
Las infecciones urinarias (IU) junto con las respiratorias, son las enfermedades bacterianas más frecuentes en la infancia. La importancia de esta patología se basa en su potencial asociación con anomalías del tracto urinario y la morbilidad que ocasiona, como también la posibilidad de producir complicaciones como Urosepsis, afectación del parénquima renal con sus temibles secuelas como Hipertensión Arterial, cicatrices renales por Pielonefritis a repetición y el subsiguiente riesgo de Insuficiencia Renal Crónica (1). Actualmente se sabe que el Reflujo Vesicoureteral (RVU), uropatía frecuente en la infancia, no es el único causal del daño renal ya que hay pacientes con RVU sin daño renal y daño renal sin RVU (1,2).
PATOGENIA
Es muy importante considerar que el tracto urogenital no tiene una barrera física típica de defensa, tampoco un drenaje permanente de fluidos que por arrastre actúe protegiendo al sistema. En cambio, posee diversos mecanismos de defensa. Entre los más importantes tenemos el flujo unidireccional de la orina y la capacidad de las células uroepiteliales de atrapar bacterias e impedir su fijación. La microscopía electrónica ha puesto en evidencia que la internalización bacteriana al uroepitelio produce una respuesta inmune celular a través de mediadores inflamatorios, condicionando posibles secuelas cicatrizales (2-4). El sistema urinario también cuenta con una inmunidad de tipo celular que es innata, con diversos disparadores endógenos: las Proteínas de Tamm-Horsfall, el Sistema Complemento, las Citoquinas y los Receptores Toll-Like (1,3,5). Dichos receptores, al reconocer moléculas patógenas de los microorganismos, proceden a activar los leucocitos y otras células inflamatorias contra la invasión bacteriana. Los receptores Toll-Like más relevantes en infecciones urinarias son TLRs 2, 4 y 11. Los TLRs 2 detectan lipoproteínas de bacterias Gram (+); los TLRs 4 se expresan en el tracto urinario bajo y detectan lipopolisacáridos de bacterias Gram (-); los TLRs 11 se expresan en todo el riñón y al reconocer a E. Coli enteropatógena, protegen al riñón de la IU ascendente producida por dicha bacteria (1,5,6). Considerando que la IU alta o Pielonefritis Aguda (PNA) puede o no estar asociada con anomalías anatómicas del tracto urinario, en aquellos niños con IU recurrentes sin causas anatómicas ni funcionales demostrables, la infección puede deberse a una alteración del balance entre los factores antimicrobianos y los componentes del sistema inmune, con la consiguiente invasión y multiplicación bacteriana. La variabilidad individual en la respuesta celular (susceptibilidad genética a la IU) puede explicar porqué algunos pacientes (especialmente niños) desarrollan IU recurrentes y/o deterioro renal progresivo y otros no (2,6-10).
¿ES INFECCIÓN URINARIA?
El sub diagnóstico, al no tratarse la infección, lleva a secuelas renales y complicaciones. Por otro lado, el sobre diagnóstico implica estudios, tratamiento y seguimiento innecesarios. Por lo tanto, es de suma importancia establecer el diagnóstico de forma fiable y segura. Si bien, la confirmación diagnóstica es fundamental; ante la simple sospecha de IU el pediatra debe iniciar de inmediato un tratamiento empírico en base a la sensibilidad bacteriana local, supeditado luego al resultado del urocultivo (Tablas 1 y 2).


¿PIELONEFRITIS O CISTITIS ?
Ante un paciente con sospecha de IU es de suma importancia tratar de hacer un diagnóstico de localización, si se trata de una infección urinaria alta o baja, por sus implicancias pronosticas y terapéuticas. Solo las IU altas tienen riesgo de producir daño permanente del parénquima renal, pero, debe considerarse que ninguno de los parámetros clínico-laboratoriales pueden confirmar o descartar en forma absoluta una PNA, aunque siempre sirven de orientación. En líneas generales, el tratamiento de la PNA es diferente al de la Cistitis.
Por otro lado, la clasificación por “gravedad” también es de mucha utilidad, considerando que la IU puede cursar con repercusión sistémica o circunscribirse al sistema urinario. En este caso, el niño conserva buen estado general por lo que puede ser tratado en forma ambulatoria, aun ante sospecha de PNA (Tabla 3).

En cuanto a la clasificación por “riesgo” de lesión renal, ante la presencia de criterios de riesgo alto, las posibilidades de que el paciente esté cursando una PNA son muy elevadas. Por el contrario, si los criterios indican riesgo bajo, muy probablemente esté cursando una Cistitis (Tablas 4 y 5).


ESTUDIO DE LA ORINA
Si bien la piedra angular sobre la que se basa el diagnóstico de IU es el urocultivo, el estudio completo de la orina es mandatorio. Mientras se espera el informe, sirven de orientación el análisis de la orina por tira reactiva, sedimento y tinción de Gram, de acuerdo a la disponibilidad. Tener presente que no toda leucocituria y/o microhematuria se deben a IU, pudiendo estos evidenciarse en casos de niños con fiebre por otras causas, deshidratación, glomerulonefritis, etc. Ante la sospecha de IU, con un sedimento urinario con leucocitos abundantes y piocitos, la presencia en el mismo de cilindros leucocitarios da el sello de IU alta o PNA ya que dichos cilindros se moldean solo en los túbulos renales. Pero la detección de dichos cilindros está condicionada al procesamiento inmediato de la orina para su estudio, antes de los 45 minutos de la micción. En caso de orinas diluidas por ingesta de líquidos, retención urinaria menor de 3 horas, tratamiento antibiótico previo o administración de ácido acetil salicílico o vitamina C, los urocultivos pueden ser falsamente negativos. Los falsos positivos en su mayoría se deben a contaminación, generalmente por higiene inadecuada antes de la recolección de la orina (9-11).
El mejor método de recolección de la orina para el urocultivo, independientemente de la edad y el sexo, es al acecho, previa higiene, chorro medio y en frasco estéril. La técnica correcta para la higiene de la zona perineal debe ser rutinariamente trasmitida por el pediatra a los padres del niño. El horario óptimo es a la mañana temprano ya que se asegura una permanencia en vejiga de por lo menos 3 horas, en aquellos niños con control de diuresis. Para el lavado debe utilizarse agua previamente hervida y entibiada, jabón nuevo de glicerina, gasa estéril y frasco estéril para urocultivo. Se procede a higienizar toda la zona perineal con las piernas abiertas, labios bien abiertos en las niñas y retracción prepucial en el varón, enjuague abundante, sin secar, dejar escurrir el agua, luego se invita a iniciar la diuresis desechando la primera parte de la micción y recogiendo la siguiente (chorro medio) en el frasco estéril. En la manipulación del frasco deberá evitarse tocar la parte interna del mismo de modo a no contaminarlo. El frasco debidamente cerrado, debe trasportarse de inmediato al laboratorio en un recipiente con hielo (9-11). Otras opciones son el cateterismo vesical (en casos de urgencias como sepsis o imposibilidad de obtener la muestra al acecho) y la punción suprapúbica, especialmente ante anomalías genitourinarias o lesiones perineales como candidiasis, entre otras, que puedan contaminar la muestra. El uso de bolsa colectora es responsable del 85% de los falsos positivos por lo que su uso debería estar proscripto(9,10). El interés y responsabilidad del pediatra por llegar a un diagnóstico certero, se pone en evidencia cuando dedica un tiempo de la consulta a entrenar a los padres sobre la técnica correcta de recolección de la orina para el urocultivo, de lo contrario se corre el riesgo de realizar estudios y tratamientos innecesarios basados en un falso diagnóstico de IU (11).
Ante el primer episodio de IU, ¿qué estudios por imágenes se deben solicitar?
Como la IU puede ser la primera y/o única manifestación para detectar uropatías, es mandatorio estudiar el árbol urinario de todo paciente ante el primer episodio de IU confirmada, pero adecuando a cada niño los estudios a realizar. Los estudios por imágenes recomendados, luego del primer episodio de IU febril, son: Ecografía renal y vesical, Cistouretrografía miccional y post miccional (CUGM) y Gammagrafía con Tecnecio 99-Acido Dimercaptosuccínico (DMSA) (Tabla 6).

La realización de estos estudios tiene como objetivo identificar malformaciones y/o factores de riesgo de infecciones recurrentes y daño renal permanente. En años anteriores, su papel principal consistía en la detección de uropatías. La uropatía más frecuente en la infancia es el Reflujo Vesicoureteral (RVU) con sus diversos grados (I a V). Detectado el reflujo, principalmente a través de la CUGM, el objetivo siguiente se enfocaba en la corrección del mismo, la mayoría de las veces quirúrgicamente, con el fin de prevenir el desarrollo del daño renal denominado “Nefropatía por Reflujo”. Con los años se evidenció que numerosos pacientes, especialmente varones con RVU severos detectados desde el nacimiento o ya en la etapa prenatal, a pesar de la cirugía exitosa en etapas tempranas de la vida con el avance de los años terminaban igualmente desarrollando una insuficiencia renal crónica terminal (15-19). Más adelante, pudo comprobarse que esos pacientes con RVU primarios severos y bilaterales evidenciados muy precozmente, se acompañan de displasia renal, siendo por lo tanto no prevenible el daño renal ya instalado básicamente (20-22). Por otro lado, los RVU leves y moderados tienden a desaparecer espontáneamente, especialmente en menores de tres años, y en general no producen daño renal (proteinuria, hipertensión arterial, complicaciones durante y después del embarazo e insuficiencia renal crónica). En los últimos 15 años, la pregunta clave fue determinar cuál es la importancia del RVU en el desarrollo de dicho daño, considerando que la mayoría de los reflujos tienen remisión espontánea, que existe reflujo sin daño renal como también daño renal sin reflujo, además de la existencia del daño renal congénito (displasia renal asociada). Conociendo su invasividad e irradiación, se inician los cuestionamientos al estudio sistemático de las vías urinarias con CUGM luego del primer episodio de IU en la infancia (16,17,23,24). Se empieza a utilizar el término “Nefropatía cicatricial” para resaltar la importancia que fue adquiriendo la escara o cicatriz del parénquima renal, independientemente de la presencia o no de RVU (Tabla 7).

Luego de estas consideraciones y conforme vemos en la tabla 8, puede comprenderse la relevancia que ha adquirido en los últimos años la centellografía renal con DMSA.

Hacia un nuevo modelo en imágenes. Fundamentos
Podemos decir que la importancia que el RVU por sí mismo pueda tener en la génesis de cicatrices renales tras una IU, es cuestión no totalmente resuelta, ya que algunas escuelas jerarquizan la detección del daño renal con DMSA solicitado en primer lugar, mientras que otros siguen considerando que la detección del RVU es lo más importante indicando CUG al inicio. Lo que sí puede sostenerse es que no hay correlación entre la presencia de RVU (especialmente leve a moderado) y el hallazgo de cicatrices renales tras un primer episodio de IU febril y que, probablemente, la persistencia de cicatriz es independiente de la presencia del RVU. Hoy se prefiere el termino de “nefropatía cicatricial” en lugar del clásico “nefropatía por reflujo”(20). Los protocolos clásicos, sistemáticos, que incluyen la realización de CUGM a todos los niños luego del primer episodio de IU, evidencian en su mayor parte RVU de bajos grados considerados hallazgos no relevantes, dado que no llevan a procedimientos ni terapéuticas capaces de prevenir las IU recurrentes o la formación de cicatrices (13,25).
Ante esta disyuntiva y a modo de sugerencia, se presentan las Guías actualizadas del Comité de Nefrología Pediátrica de la Sociedad Argentina de Pediatría del módulo Infección Urinaria: diagnóstico por imágenes (27)(Figuras 1, 2, 3 y 4).
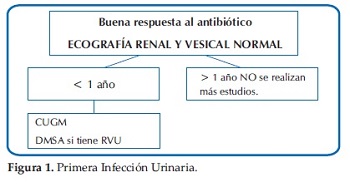
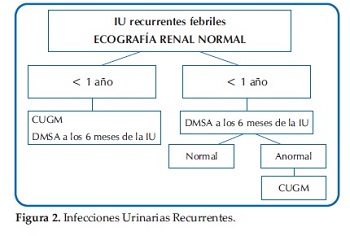
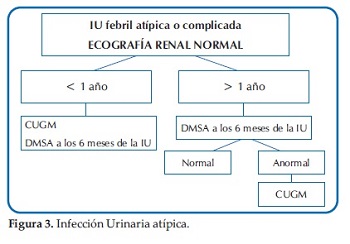

Para la interpretación final, se deberán valorar no solo los métodos de imágenes sugeridos, sino también todos los aspectos clínicos y de laboratorio.
Tratamiento antibiótico
El tratamiento antibiótico empírico inicial realizado precozmente es clave en la IU, ya que está comprobado que reduce las complicaciones y secuelas renales. En las IU febriles, reduce el porcentaje de hallazgos compatibles con PNA (DMSA en fase aguda) (26,28).
El antibiótico será apropiado teniendo en cuenta los siguientes aspectos:
- Bacterias protagonistas y sus resistencias
- Situación clínica (riesgo renal-gravedad)
- Antecedentes: antibioticoterapia y/u hospitalización previas o presencia de anomalías urinarias, todo lo cual aumenta el riesgo de resistencia bacteriana.
Las bacterias protagonistas, por orden de frecuencia son: E Coli (80%), Proteus M, Klebsiella y Enterococcus Faecalis. Raramente Pseudomona.
E Coli tiene alta resistencia a la ampicilina, amoxicilina y trimetoprim sulfametoxazol, con resistencia creciente a la amoxicicilina-acido clavulánico y a la cefalosporina de primera generación. Otros gérmenes no E Coli pueden verse en pacientes con anomalías del tracto urinario, exposición previa a antibióticos o antecedente de hospitalización (9-11,29).
Tratamiento de la Infección Urinaria alta (Pielonefritis Aguda)
Duración 10 días, 14 días en PNA con grave compromiso del parénquima renal o en menores de tres meses con hemocultivos +. Utilizar bactericidas. Mantener la quimioprofilaxis hasta la evaluación radiológica.
Opciones para el tratamiento parenteral(30):
* Cefalosporinas de 3ra generación:
Ceftriaxona: 50-80 mg/kp/día c/12 o 24 hs (EV o IM).
Cefotaxima: 100-150 mg/kp/día c/ 8 hs (EV o IM).
Ceftazidima: 150 mg/kp/día c/ 8 hs (EV o IM).
* Aminoglucósidos:
Gentamicina: 3-5 mg/kp/día c/ 8-12 hs (EV o IM).
Amikacina: 15 mg/kp/día c/ 8-12 hs (EV o IM).
* Carbapenémicos:
Imipenem: 50 mg/kp/día c/12 hs (EV).
Meropenem: 60 mg/kp/día, c/8hs (EV).
Tratamiento oral. Bactericidas(30):
* Cefalexina: 50 mg/Kp/día, c/ 8hs.
* Cefadroxilo: 30 mg/kp/día, c/ 12 hs
* Cefixima: 8 mg/kp/día
- Periodo neonatal y menores de tres meses: la IU debe ser considerada alta, requieren internación y, al inicio del tratamiento, debe utilizarse siempre la vía parenteral. Previo a la antibioticoterapia, realizar punción lumbar y extraer material para hemocultivo y urocultivo. Se trata como una sepsis, con dos antibióticos, con posible localización meníngea. Por la frecuente incidencia de enterococos, se sugiere ampicilina + gentamicina; o ampicilina + cefotaxima o ceftriaxone (evitar en recién nacidos ictéricos por el riesgo de kernícterus) (30).
En general, por la nefro y ototoxicidad, se recomienda restringir el uso de aminoglucósidos a determinadas situaciones como el caso de pacientes con importante compromiso del estado general, en el periodo neonatal y ante la presencia de uropatías, buscando alternativas menos tóxicas por el antibiograma.
La medicación parenteral no es imprescindible, dependiendo del estado general y la tolerancia. A las 48-72 hs, si se normalizan la clínica y el laboratorio, el antibiótico debe pasarse a la vía oral, para disminuir la nefrotoxicidad del mismo. Las quinolonas no están recomendadas en los niños, salvo en casos de única opción ante resistencia bacteriana múltiple (11,30,31).
Tratamiento de la Infección Urinaria baja o Cistitis: por vía oral
- Cefalexina: 50 mg/kp/día en 3 dosis.
- Nitrofurantoína: 4-6 mg/kp/día en 2-3 dosis, en mayores de 2 meses de edad. No utilizar en IU por Proteus Mirábilis dado que esta bacteria es naturalmente resistente a la Nitrofurantoína, por lo tanto será ineficaz. Para minimizar los trastornos digestivos que produce, utilizar la forma macrocristalina, de absorción más lenta.
- Amoxicilina + inhibidores de Beta Lactamasa: dosificar por amoxicilina a 60-80 mg/kp/día en 2 dosis.
- Trimetoprim (6 mg/kp/día) sulfametoxazol, en 2 dosis. En mayores de 4 meses de edad. No utilizarlo en forma empírica por la alta resistencia bacteriana, mayor a 30 % en América Latina. Por lo tanto solo debería utilizarse cuando se tiene el antibiograma y éste indica sensibilidad. El tiempo de duración, por periodos cortos de 3-5 días, máximo 7 días. En pediatría no se utilizan las monodosis, por su inefectividad y por presentar elevadas recurrencias de los episodios de IU (11,30,31).
¿Antibiótico oral o parenteral?
Si bien la cistitis se trata por vía oral, los casos de PNA pueden tratarse según el caso, por vía oral o parenteral. Está suficientemente comprobado que no hay diferencias en seguridad, eficacia ni riesgo de cicatrices renales a largo plazo, entre el tratamiento oral o parenteral, incluso en lactantes mayores (11,32).
Las indicaciones de tratamiento antibiótico inicial por vía parenteral son: pacientes menores de 3 meses de edad, IU febril con antecedentes de RVU de alto grado, presencia de factores de riesgo, intolerancia oral y mal cumplimiento terapéutico. Fuera de estas situaciones, puede iniciarse tratamiento antibiótico por vía oral, aún con sospecha de PNA (11,32).
Profilaxis antibiótica
Está indicada en los pacientes con IU febril hasta tener los estudios por imágenes solicitados, y en las infecciones urinarias recurrentes de diversas causas. Una toma nocturna de Nitrofurantoína a 2 mg/kp/dosis o Trimetoprim sulfametoxazol a 2 mg/kp/dosis (se dosifica por Trimetoprim). En neonatos, Cefalexina a 20 mg/kp/dosis.
Es importante además el control de los factores predisponentes de IU como constipación, malos hábitos miccionales, leucorrea, higiene inadecuada, entre otros (28).
En el pasado, al detectarse una uropatía, la conducta sistemática consistía en continuar la profilaxis antibiótica hasta que la uropatía se resuelva. Sin embargo, numerosos autores concluyen en que no existe certeza de que la profilaxis antibiótica en niños con RVU ofrezca un beneficio clínico importante (33-36). Por otro lado, Pennesi M y col concluyen en que la profilaxis antibiótica continua en pacientes con RVU de grados II a IV no disminuye la tasa de Pielonefritis ni la incidencia de cicatrices renales o su progresión, y que la clave de la protección renal está en la detección y tratamiento precoz de la Pielonefritis Aguda (33).
Aplicabilidad clínica
La profilaxis antibiótica en niños con RVU se realiza desde los años 70 por un probable beneficio conceptual y en base a investigaciones en animales, no en la demostración de su eficiencia en humanos. Las publicaciones más recientes coinciden en que la profilaxis no disminuye el número de IU en niños con RVU de grados II, III y IV en los primeros años de vida, especialmente en menores de 30 meses, periodo en el cual el riñón es más susceptible. Además, la administración de antibióticos a bajas dosis y por tiempo prolongado, favorece las resistencias bacterianas. Todo ello sugiere que no es necesaria la profilaxis antibiótica en niños con RVU de grado leve a moderado (33).
La suspensión de la profilaxis es razonable y segura cuando el RVU no desaparece con el tiempo, sugiriéndose para ello respetar determinados criterios (Tabla 9).

Se concluye resaltando que los estudios solicitados deberían ser solo aquellos que, con una adecuada estimación de riesgos y costos, permitan implementar medidas beneficiosas para el niño, resultando en un mejor pronóstico de su enfermedad. En vez de los estudios sistemáticos preconizados antiguamente, una estrategia personalizada sería la mejor opción para brindar a cada paciente.
Con respecto a la profilaxis antibiótica por tiempo prolongado, no solo ha demostrado su inefectividad para prevenir el daño renal sino que, además, puede predisponer a IU severas por gérmenes multiresistentes (31).
Finalmente, se sugiere también valorar la vía oral como alternativa a la parenteral en el tratamiento de las PNA, incluso en lactantes, salvo las excepciones señaladas.
REFERENCIAS
1. San José González MA, Méndez Fernández P. Infección del tracto urinario en la infancia: nuevas guías, nuevos modos. Bol Pediatr. 2009;49:227-43. [ Links ]
2. Mak RH, Kuo H. Pathogenesis of urinary tract infection: an update. Curr Opin Pediatr. 2006;18:148-52. [ Links ]
3. Webb NT, Brenchley PE. Cytokines and cell adhesion molecules in the inflammatory response during acute pyelonephritis. Nephron Exp Nephrol. 2004;96(1): e1-6. [ Links ]
4. Ganz T. Defensins: antimicrobial peptides of innate immunity. Nat Rev Inmunol. 2003;3(9):710-20. [ Links ]
5. Takeda K, Kaisho T, Akiras S. Toll-Like receptors. Annu Rev Immunol. 2003;21:335-76. [ Links ]
6. Anders HJ, Bannas B, Schlondorff D. Siggnaling danger: toll-like receptors and their potential roles in kidney disease. J Am Soc Nephrol. 2004;15(4):854-67. [ Links ]
7. Svanborg EC, Briles D, Habberg L, et-al. Genetic factors in host resistance to urinary tract infection. Infection. 2002;12:1286-93. [ Links ]
8. Zhang D, Zhang G, Hayden M, Greenblatt MB, Bussey C, Flavell RA, et al. A toll-like that prevents infection by uropathogenic bacteria. Science. 2004;303:1522-26. [ Links ]
9. Cambiano C, Rígoli A, Florentín de Merech L. Infección urinaria. En: Voyer L, Ruvinsky R, Cambiano C, eds. Pediatría. 3ª Edición. Buenos Aires: Ediciones Journal; 2011. p.1081-88. [ Links ]
10. FlorentÍn de Merech L, Lascurain A, Troche A, Martínez M, Báez D. Consenso de Infección Urinaria: Pautas de diagnóstico y tratamiento. Pediatr (Asunción). 2011;38(1):68-72. [ Links ]
11. Ochoa Sangrados C, Malaga Guerrero S. Manejo diagnóstico y terapéutico de las infecciones del tracto urinario en la infancia. An Pediatr (Barc). 2007;67(5):517-25. [ Links ]
12. Dayan P, Hanson E, Bennett J, Langsam D, Miller S. Clinical course of urinary tract infections in infants younger than 60 days of age. Pediatr Emerg Care. 2004;20(2):85-88. [ Links ]
13. San José González MA, Méndez Fernández P. Infección urinaria en la infancia y pruebas de imagen: hacia un nuevo modelo. Galicia Clin. 2009;70(3):13-24. [ Links ]
14. Whiting P, Westwood M, Bojke L, Palmer S, Richardson G, Cooper J, et-al. Clinical effectiveness and cost-effectivenes of tests for the diagnosis and investigation of urinary tract in infection in children: a systematic review and economic model. Health Technol Assess. 2006;10(36):1-154. [ Links ]
15. Sty JR, Wells RG, Starshak RJ, Schroeder BA. Imaging in acute renal infection in urinary tract infection in children. Am J Roentgenol. 1987;148(3);471-77. [ Links ]
16. Harrison MR, Golbus MS, Filly RA, Anderson RL, Flake AW, et al. Fetal Hydronephrosis: selection and surgical repair. J Pediatr Surg. 1987;22(6):556-58. [ Links ]
17. Brophy M, Austin P, Yan Y, Coplen DE. Vesicoureteral reflux and clinical outcomes in infants whit prenatally detected hydronephrosis. J Urol. 2002;168(4 Pt 2):1716-19. [ Links ]
18. Areses R, Arruebarrena D, Urbieta MA, Alzuela MT, Eizaguirre L, Rodríguez F, et-al. Severe primary vesicoureteral reflux in infants: afollow-up of 203 cases. Nefrología. 2004;24(2):131-41. [ Links ]
19. Hodson EM, Wheeler DM, Vimalchandra D, Smith GH, Craig JC. Intervenciones para el reflujo vesicoureteral primário (Revisión Cochrane traducida). En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. [ Links ]
20. Phan V, Traubici J, Hershenfield B, Stephens D, Rosenblum N, Geary D. Vesicoureteral reflux in Infants whith isolated antenatal hydronephrosis. Pediatr Nephrol. 2003;18(12):1224-28. [ Links ]
21. Marra G, Oppezzo C, Ardissino G, Dacco V, Testa S, Avolio L, et-al. Severe vesicoureteral reflux and chronic renal failure: a condition peculiar to male gender?. J Pediatr. 2004;144(5):677-81. [ Links ]
22. Craig JC, Irwig LM, kinght JF, Roy LP. Does treatment of vesicoureteric reflux in childhood prevent end-stage renal disease attributable to reflux nephropathy?. Pediatrics. 2000;105(6):1236-41. [ Links ]
23. Yerkes E, Adams M, Pope J, Brock J. Does every patient with hydronephrosis need voiding cystourethrooografy?. J Urol. 1999;162(3 Pt 2):1218-20. [ Links ]
24. Hansson S, Dhaney M, Sigstrom O, Sixt R, Stokland E, Wennerstrom M, Jodal V. Dimercapto-succinil acid scintigraphy instead of voiding cystourehrography for infants with urinary tract infection. J Urol. 2004;172(3):1071-73. [ Links ]
25. Muga Zuriarrain O, Onate Vergara E, Sota Busselo L, Arruebarena Lizarraga D, Ubetagoyena M. Estudios por imagen en la primera infección urinaria con fiebre en lactantes. Es necesaria la cistouretrografía miccional?. An Pediatr (Barc). 2008;69(6):521-25. [ Links ]
26. Enríquez G, Carreño JC, Barber I. Guías radiológicas para el estudio de enfermedades nefrológicas en Pediatría. En: Protocolos diagnóstico terapéuticos de la AEP: nefrología pediátrica. 2ª Edición. Madrid: Asociación Española de Pediatría; 2008. p. 33-47. [ Links ]
27. Alconcher L, Cobeñas C, Tombesi M. Diagnóstico por imágenes: guías actualizadas del Comité de Nefrología Pediátrica de la Sociedad Argentina de Pediatría, Módulo de Infección Urinaria. Buenos Aires: NEFROPED; 2013. [ Links ]
28. Sociedad Argentina de Pediatría, Comité de Nefrología. Pautas de Nefrología Pediátrica. Buenos Aires: SAP; 2003. [ Links ]
29. Wennerstrom M, Hansson S, Jodal U, Sixt R, Stokland E. Renal function 16 to 26 years after the first urinary tract infection in childhood. Arch Pediatr Adolesc Med. 2000;154(4):339-45. [ Links ]
30. Pautas de diagnóstico y tratamiento en Nefrología Pediátrica. 2ª ed. Buenos Aires: NEFROSAP; 2008. [ Links ]
31. Finnell SM, Carroll A, Downs S. Diagnosis and management of an initial UTI in febrile infants and young children. Pediatrics. 2011;128:489-94. [ Links ]
32. Juan Echevarría Zárate, Elsa Sarmiento Aguilar, Fernando Osoles Plenge. Infección del tracto urinario y manejo antibiótico. Acta Med Per. 2006; 23(1):26-31. [ Links ]
33. Pennesi M, Travan L, Peratoner L, Bordugo A, Cattaneo A, Ronfani L, et-al. Is antibiotic prophylaxis in children with vesicoureteral reflux effective in preventing pyelonhritis and renal scars?: a randomized, controlled trial. Pediatrics. 2008;121(6):e 1489-94. [ Links ]
34. Willians GJ, Wei L, Lee A, Craig JC. Uso prolongado de antibióticos para La prevención de infecciones urinarias recurrentes en niños. En: La Biblioteca Cochrane Plus, 2008 Número 4. Oxford: Update Software Ltd. [ Links ]
35. Comway PH, Cnaan A, Zaoutis T, Henry BV, Grundmeier RW, Keren R. Recurrent urinary infection in children: risk factors and association with prophylactic antimicrobials. JAMA. 2007; 298 (2):179-86. [ Links ]
36. Garin EH, Olavarría F, García Nieto V, Valenciano B, Campos A, Young L. Clinical significance of primary vesicoureteral reflux and urinary antibiotic prophylaxis after Acute Pyelonephritis: A multicenter rabdomized, controlled study. Pediatrics. 2006;117(8):626-82. [ Links ]














