Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.36 no.2 Asunción Aug. 2009
ARTICULO ORIGINAL
Incidencia de Hipotiroidismo Congénito en 14 Regiones Sanitarias del Paraguay
Incidence of Congenital Hypothyroidism in 14 Health Regions of Paraguay
Marta Ascurra1,2, Stella Rodríguez1,2, Adriana Valenzuela2, Fabiola Blanco2, Lourdes Ortiz2, Margarita Samudio1.
1. Instituto de Investigaciones en Ciencias de la Salud (IICS).Universidad Nacional de Asunción.
2. Programa de Prevención de la Fibrosis Quística y Prevención del Retardo Mental, Ministerio de Salud Pública y Bienestar Social.
Solicitud de Sobretiros: Dra. Marta Ascurra. Centro de Salud Nº 9. Herminio Giménez c/ Gral. Aguiar. Asunción – Paraguay. E-mail: mascurra@sce.cnc.una.py
Artículo recibido el 14 de Abril de 2009, aceptado para publicación 8 de agosto de 2009.
RESUMEN
El Hipotiroidismo Congénito, una de las causas tratables más comunes de retardo mental, ocurre en aproximadamente uno en 3000 recién nacidos. Se investiga la incidencia del hipotiroidismo congénito en Paraguay, país considerado endémico para los Desordenes por Deficiencia de Yodo. Han sido recolectadas 53.360 muestras de sangre obtenidas por punción del talón y recogidas en papel de filtro, de octubre de 1999 a febrero del 2007, en 76 sitios de toma de muestra distribuidos en 14 de las 18 regiones sanitarias del país. El tamizaje se llevó a cabo en principio como parte de un proyecto piloto y luego dentro del Programa de Prevención de la Fibrosis Quística y del Retardo Mental. La hormona estimulante de las tiroides fue medida por el método de ELISA y un valor >20UI/ml fue considerado como punto de corte para el re-llamado. Se obtuvo resultado en el 96% (52.526) de las muestras. El 0,08% (40/52.526) arrojó resultado positivo y se confirmó Hipotiroidismo Congénito en 35 casos, incidencia de 1 por cada 1.501 recién nacidos, con una razón de 6:1 para el sexo femenino: masculino. Esta incidencia de Hipotiroidismo Congénito es la más alta reportada para Latinoamérica, lo que refuerza la importancia de la implementación de este tipo de programa en la lucha contra la erradicación de los Desórdenes por Deficiencia de Yodo.
Palabras claves: Hipotiroidismo congénito, diagnóstico, epidemiología, prevención, deficiencia de Yodo, recién nacido, Paraguay.
ABSTRACT
Congenital hypothyroidism is one of the most common treatable causes of mental retardation, occurring in approximately 1 in 3,000 newborns. We investigated the incidence of congenital hypothyroidism in Paraguay, where iodine deficiency disorders are considered endemic. Between October 1999 and February 2007, a total of 53,360 blood samples from 76 sampling stations in 14 of the country’s 18 health regions were taken by heel prick and collected on filter paper. Screening was initially carried out as part of a pilot project and later as part of the program for prevention of cystic fibrosis and mental retardation. Thyroid-stimulating hormone was measured by the ELISA method, and a value of >20 IU/ml was considered the cutoff point for recall. Results were obtained in 96% (n: 52,526) of samples. Positive results were found in 0.08% (40/52,526) and congenital hypothyroidism was confirmed in 35 cases, an incidence of 1 in 1,501 births, with a female to male ratio of 6:1. This incidence of congenital hypothyroidism is the highest yet reported in Latin America, a fact that emphasizes the importance of implementing this type of program in the fight to eliminate iodine deficiency disorders.
Key words: Congenital hypothyroidism, diagnosis, epidemiology, prevention, iodine deficiency, newborn, Paraguay.
INTRODUCCIÓN
Siendo el Hipotiroidismo Congénito (HC) la causa más frecuente de retardo mental del recién nacido, su diagnóstico clínico es difícil debido a la falta de especificidad de sus síntomas sumado a una baja frecuencia de presentación. En Latinoamérica ocurre en aproximadamente 1 en 2777 recién nacidos, con valores reportados para los países limítrofes al Paraguay que oscilan entre 1 en 2225 para Argentina, 1 en 3150 para Brasil y 1 en 3171 para Bolivia (1).
Paraguay reporta un promedio anual de 90.000 nacimientos con un subregistro del 40% (2). Debido a su situación geográfica de mediterraneidad, el país presenta una inadecuada disponibilidad de yodo en el suelo y en el agua, considerándosele por lo tanto a su población susceptible de sufrir Desordenes por Deficiencia de Yodo (DDI). Con la finalidad de corregir esta situación, se promulgó en el año 1980 la ley Nº 836 del Código Sanitario que obliga la yodación de la sal destinada al consumo humano (3) y cuya reglamentación quedó establecida en el Decreto 3597 de 1999, a cargo del Instituto Nacional de Alimentación y Nutrición (INAN).
En el país no se cuenta con datos publicados de incidencia de hipotiroidismo en población pediátrica o adulta. Existen datos limitados sobre el consumo de sal yodada y sobre yoduria. Una encuesta llevada a cabo por el INAN en el año 2000 en escolares de 13 regiones sanitarias, reveló que el 16% de dicha población, no consumía sal yodada y que el 7,7% tenía valores de yoduria inferiores a 100 µg/l (3). Esta situación mejoró para el año 2006 según el informe anual del INAN en escolares de 17 regiones sanitarias, donde se vio que disminuyó tanto la proporción de los que no consumían sal yodada (1,1%), como de los que tenían valores de yoduria inferiores a 100 µg/l (3,3%) (4).
En octubre del año 1999, en el Hospital Regional del Departamento de la Cordillera, correspondiente a la Tercera Región Sanitaria, se dió inicio a un programa piloto de detección neonatal, el cual fue el propulsor de la Ley N° 2.138 que creó el Programa de Prevención de la Fibrosis Quística y Prevención del Retardo Mental provocado por el Hipotiroidismo Congénito y la Fenilcetonuria, y del Decreto Nº 2.126 que lo incorpora al Ministerio de Salud Pública y Bienestar Social (MSPyBS) (5).
En el presente trabajo se presentan los resultados del estudio para la detección del Hipotiroidismo Congénito (HC), llevado a cabo en niños y niñas de 0 a 60 días de vida nacidos en 14 regiones sanitarias del Paraguay, de octubre de 1999 a febrero de 2007.
MATERIAL Y MÉTODO
El Paraguay se halla dividido geográficamente en 17 Departamentos. El MSPyBS del Paraguay para su atención se encuentra organizado en 18 Regiones Sanitarias (RS), que corresponden a los 17 departamentos más la capital. Cada región sanitaria tiene a su cargo un Hospital Regional ubicado en la capital departamental, Centros y Puestos de Salud, ubicados en los distritos, que conforman la red de salud del MSPyBS.
En octubre de 1999, se dio apertura al primer sitio de toma de muestra del Programa de Prevención de la Fibrosis Quística y Prevención del Retardo Mental en el Hospital Regional de la Tercera Región Sanitaria. Luego de la promulgación de la Ley 2.138, de manera paulatina fueron implementándose nuevos sitios en las demás regiones sanitarias del país; la incorporación del Programa al Ministerio de Salud, le proporcionó mayor empuje, habilitándose 76 sitios para la toma de muestra, distribuidos en 14 regiones sanitarias hasta febrero del 2007. Tanto el proyecto piloto como la ley consideraron que la gratuidad del diagnóstico y del tratamiento, aseguraba la cobertura a todos los recién nacidos (Ley Nº. 2.138).
Al inicio del programa, se procedía a la extracción de la muestra de sangre a los recién nacidos antes del alta y los niños de hasta 60 días de vida eran llevados a sitios de toma de muestra en los consultorios de inmunización y control de niño sano. A los prematuros se les tomaba la primera muestra, recién cuando volvían para control. La toma de sangre se realizaba previo consentimiento informado a los padres, de acuerdo a la Declaración de Helsinki 2000 y según protocolo aprobado por el Comité de Ética de Investigación del Instituto de Investigaciones en Ciencias de la Salud.
Las muestras de sangre fueron obtenidas por punción del talón y colectadas en papel de filtro (S&S 903), adosada a una ficha que contenía: el nombre del sitio donde se tomó la muestra, fecha de la toma de muestra, lugar del parto, nombre del niño/niña y de la madre, fecha de nacimiento, sexo, edad gestacional, edad materna, estado civil, dirección, teléfono. La ficha conteniendo el papel de filtro era enviada al laboratorio del Programa situado en Asunción (capital) en forma quincenal, hasta tanto, la misma era conservada en el refrigerador. No fueron procesadas muestras con más de un mes de envío, muestras con coágulos, insuficientes y contaminadas.
La hormona estimulante de la tiroides (TSH) fue medida según el método de enzima inmuno-análisis con lectura colorimétrica (ELISA) usando un kit comercial (MP Biomedical, NY). Siguiendo las indicaciones del fabricante, se consideró un valor >20 UI/ml como punto de corte para el re-llamado. Los casos positivos fueron confirmados en suero con la medición de TSH y tiroxina (T4), (MP Biomedical, NY).
Para el resguardo de la confidencialidad de los participantes se han utilizado códigos en el manejo de los datos. A todos los niños con confirmación de HC se les realizó ecografía cervical para la aproximación etiológica. Todos recibieron tratamiento con L-tiroxina (levotiroxina) con dosis inicial de 9 a 13,5 µg/Kg, posteriormente ajustadas según hallazgo clínico y laboratorial.
Estudios de TSH y T4 fueron realizados también a las madres que referían antecedentes de patología tiroidea.
RESULTADOS
Se obtuvieron muestras de sangre de talón de 53.360 niños/as, menores o igual a 60 días de vida, alcanzándose resultado laboratorial en 96% (52.526) de dichas muestras. La distribución del número de muestras por año, por RS, por número de sitios, así como los casos de HC detectados se presentan en la Tabla 1. El porcentaje de re-llamado fue de 0,08%, que correspondió a 40 niños/as con valores de TSH ≥ 20 µUI/ml. En 35 casos se confirmó el diagnóstico de Hipotiroidismo Congénito, correspondiendo 30 al sexo femenino y 5 al masculino, razón de 6:1. La incidencia de HC en esta serie fue de 1 por cada 1.501 recién nacidos. No se encontró ningún resultado falso negativo.

En la Tabla 2 se muestra la RS, el número de sitios, el número de muestras y el número de HC detectados diferenciados por sexo.
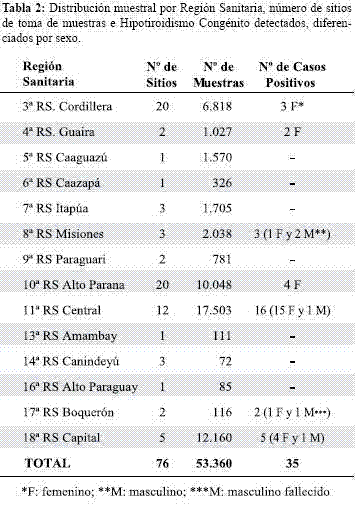
Características de los niños/niñas. En el momento de la toma de muestra el 71,2% de los niños/niñas (n=37.996) tenía entre 1 y 15 días de vida (Figura 1).
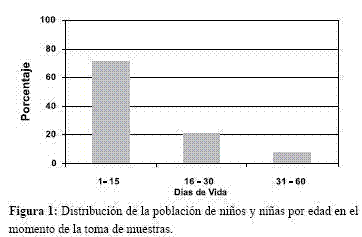
El 49,4% (n=25.825) correspondió al sexo femenino y 50,6% (n=26.471) al masculino. En 50.965 niños/niñas se tuvo datos sobre la edad gestacional, de estos el 2,8% (n=1.442) se encontraba dentro del rango de prematurez. En el 61,0% (n=29.568) de los casos, se obtuvo el resultado antes de los 15 días de vida (Figura 2).
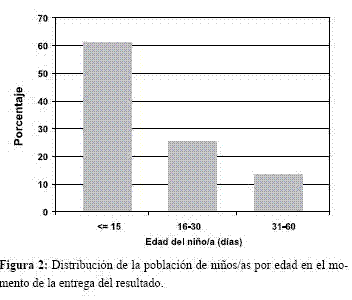
Características de las madres. El 1,3% (n=632) de las madres tenía menos de 15 años de edad; el 20,3% (n=11.109) entre 16 y 20; el 28,2% (n=15.460) entre 21 y 25; el 18,7% (n=10.266) entre 26 y 30; el 11,9% (n=6.522) entre 31 y 35; el 6,4% (n=3.521) entre 36 y 40; y el 1,8% (n=1.010) más de 41 años (Figura 3).
De 51.765 nacimientos, en el 95,9% (n=41.329) fue atendido por un profesional de la salud. El niño o niña en estudio era el primer hijo en el 45% (n=41.335) de los casos. A cinco de las treinta y cinco madres de niños/as con detección de HC, se les realizó estudios de TSH y T4, a dos de ellas se les hizo el diagnóstico de hipotiroidismo, ambas se hallan bajo tratamiento.
Niñas/niños con HC. De los 35 casos positivos de HC, el nivel promedio de TSH fue 127,4mU/L (39-380) y la edad media para el inicio del tratamiento fue de 50 días (10 a 140 días).
Los niveles de tiroxina total fueron obtenidos en 21/35 pacientes, obteniéndose una media de 1,73 µg/dl (0,25 – 4,2).
El tratamiento se inició con levotiroxina a dosis de 9 a 13,5 µg/Kg, con ello se logró la disminución de la TSH a valores normales al mes de iniciado el tratamiento a una media de 5,4 mU/L (0,48 – 11,75). Cinco pacientes ya han superado los 3 años de vida y en todos ellos se estableció la necesidad de incremento progresivo en la dosis de levotiroxina, por detección de TSH >5 µUI/ml durante el seguimiento, correspondiendo a un hipotiroidismo permanente.
Se logró identificar la etiopatogenia en 16 pacientes, de los cuales 7 correspondieron a agenesia; 6 a hipoplasia; 2 a displasia y una a ectopia de la glándula tiroidea.
DISCUSIÓN
La incidencia de HC reportada en este estudio constituye la más alta de Latinoamérica. Sin embargo, es necesario aclarar que, para aseverar taxativamente que esta situación forma parte de la realidad del país es necesario contar con una casuística mucho mayor. Por el momento es posible sostener este dato, ya que el mismo se ha mantenido en forma sistemática desde el inicio del Programa (1,5).
En cuanto al género, el más afectado es el femenino. La incidencia de niñas que resultaron afectadas es mayor a la de los niños, con un valor de 6:1, para una proporción de niñas y niños evaluados de 1:1. Este dato se corresponde con los reportados a nivel mundial, aunque aún no se ha dilucidado si se debe a una susceptibilidad particular asociada al género o a una sobrevivencia mayor de los fetos femeninos (6,7).
El porcentaje de re-llamado coincide con lo publicado por algunos autores (8), sin embargo no se relaciona con la hipótesis de que el índice de re-llamado es mayor en las regiones con deficiencia de yodo (9,10). Esto puede explicarse porque la edad de los niños en el momento de la toma de muestra era superior a la reportada en otros estudios, considerando que en el 75% de los casos correspondió a niños menores a 18 días, con una mediana de 9 días, edad en la cual, normalmente, el nivel de TSH ya está por debajo del punto de corte.
El abordaje diagnóstico para determinar la etiología de los niños y niñas afectados con HC ha sido aún insuficiente, ya que por razones económicas y con el objetivo de no demorar el inicio del tratamiento no se realizó centellografía y no fue posible la realización de otras pruebas serológicas en la muestra confirmatoria (ej. tiroglobulina sérica, anticuerpos antitiroideos) para una aproximación etiológica. Llama la atención que hasta la fecha en el 100% de los casos en los que la ecografía fue realizada, ésta reportó disgenesias, y el alto porcentaje de agenesias (47%) encontradas. En los casos de ausencia de tiroides y/o presencia de imagen ecográfica tiroidea normal está prevista la interrupción del tratamiento para una mejor investigación etiológica cuando los niños sobrepasen los 4 ó 5 años de edad (11).
En el Paraguay que por su situación geográfica de país mediterráneo presenta terrenos pobres en yodo, esta deficiencia ha sido y debe seguir siendo considerada como un grave problema de salud, como factor contribuyente al nacimiento de niños y niñas con HC (3). Más aún, si se toma en cuenta el rol que juega la tiroxina materna en etapas tempranas del desarrollo del cerebro fetal y ante el hecho de que 21,6% de las madres sean menores de 20 años de edad y por lo tanto con posibilidades de tener más hijos, la sucesión de periodos de embarazo y lactancia podrían ir agravando la situación, posiblemente sin afectación del primer hijo, pero sí de los siguientes (12-14).
Varios ajustes en diferentes niveles deberían ser llevados a cabo en pro de mejorar este programa nacional, no solo para aumentar la cobertura a nivel de la red del Ministerio, sino además para abarcar a los partos domiciliarios, que se sabe superan el 16%, sin considerar el sub-registro (2). Para reducir el número de niños sin diagnóstico debido a muestras insuficientes o con coágulos, se deberá reforzar la capacitación a los encargados de la toma de muestra. Es importante durante estas capacitaciones informar, que si bien la toma de muestra del recién nacido para el diagnostico del hipotiroidismo congénito, puede ser llevado a cabo, desde el momento mismo de su nacimiento, en sangre de cordón (15).
Debido a que el programa nacional incluye el despitaje de la fenilcetonuria, patología que precisa que el niño sea alimentado antes de la toma de muestra, la Ley 2.138 ordena la misma se realice entre los 3 y 7 días de vida. Sin olvidar los tiempos de envío de las muestras al laboratorio del programa para su análisis y por sobretodo el llenado correcto de las fichas de los recién nacidos de manera a asegurar el inicio precoz del tratamiento. Según la literatura, el coeficiente intelectual de los afectados por un HC se conserva en un 100% cuando el tratamiento es iniciado antes de los 13 días de vida, instalándose el déficit intelectual en la medida que este se retrasa (11-14). Si bien la búsqueda de los casos positivos es activa, pues se halla a cargo de los responsables de la toma de muestra y del personal del programa, esta tarea es imposible llevar a cabo si los datos no han sido llenados correctamente.
Para culminar se resalta la importancia de la implementación de un programa nacional de detección sistemático del Hipotiroidismo Congénito, especialmente en países como el nuestro, cuya población está considerada por años con predisposición a padecer los Desordenes por Deficiencia de Yodo, no solo por el trascendental beneficio directo a los afectados, sino además por ser el valor de la TSH en poblaciones de recién nacidos un importante criterio de erradicación de los DDI.
AGRADECIMIENTOS
A todas las personas encargadas de la toma de muestra y a todas las instituciones que colaboraron para que la detección neonatal sea hoy una realidad nacional en Paraguay y permita brindar a todos los niños y niñas paraguayos la posibilidad de desarrollar todo su potencial.
REFERENCIAS
1. Borrajo GJ. Newborn Screening in Latin America at the beginning of the 21st century. J Inherit Metab Dis. 2007;30:466-81. [ Links ]
2. Ministerio de Salud Pública y Bienestar Social. Departamento de Bioestadística. Certificados de Nacidos Vivos registrados, 1999-2006. Asunción: MSPyBS; 2006. [ Links ]
3. Jara-York J, Pretell E, Zaracho de Irazusta J, Goetting S, Riveros C. Prevalencia de Bocio Endémico por el Método Ecográfico, Determinación de Yoduria y Dosage de Yodo en Sal en Escolares del Paraguay. Rev Chil Nutr. 2004;31(3):287-95. [ Links ]
4. Ministerio de Salud Pública y Bienestar Social. Instituto Nacional de Alimentación y Nutrición. Informe anual del Instituto Nacional de Alimentación y Nutrición. Asunción: MSPYBS; 2006. [ Links ]
5. Ascurra M, Ayala A, Rodríguez S, Cabrera T, Covis C, Jara-Yorg J. Programa de Prevención del Retardo Mental en Caacupe. Pediatr (Asunción). 2001;28(1):33-36. [ Links ]
6. Medda E, Olivieri A, Stazi MA, Grandolfo ME, Fazzini C, Baserga M. Risk factors for congenital hypothyroidism: results of a population case-control study (1997-2003). Eur J Endocrinol. 2005;153:765-73. [ Links ]
7. Waller DK, Anderson JL, Lorey F, Cunningham GC. Risk factor for congenital hypothyroidism: An investigation of infant´s birth weight, and gender in California, 1990-1998. Teratology. 2000;62:36-41. [ Links ]
8. Abodovsky N, Vivanco X, Cuello X, Pérez P, Lobo G, Brantes J, et al. Detección precoz de hipotiroidismo congénito en Chile: resultado en 24 meses. Rev Chil Pediatr. 1995;66(3):140-44. [ Links ]
9. Simsek E, Karabay M, Kocabay K. Neonatal screening for congenital hypothyroidism in West Black Sea area, Turkey. Int J Clin Pract. 2005;59(3):336-41. [ Links ]
10. Yordam N, Calikoglu AS, Hatun S, Kandemir N, Oguz H, Tezic T, et al. Screening for congenital in Turkey. Eur J Pediatr.1995;154(8):614-16. [ Links ]
11. Bongers-Schokking JJ, Koot HM, Wiersma D, Verkerk PH, De Muinck Kelzer-Schrama SM. Influence of timing and dose of thyroid hormone replacement on development in infants with congenital hypothyroidism. J Pediatr. 2000;136(3):292-97. [ Links ]
12. Das SC, Mohamed AZ, Al-Hassan S, Otokwula AA, Isichei UP. Effect of environmental iodine deficiency (EID) on fetal growth in Nigeria. Indian J Med Res. 2006;124(5):535-44. [ Links ]
13. Glinoer D, Delange F. The Potential Repercussions of Maternal, Fetal, and Neonatal Hypothyroxinemia on the Progeny. Thyroid. 2000;10(10):871-87. [ Links ]
14. Glinnoer D. Pregnancy and Iodine. Thyroid. 2001;11(5):471-81. [ Links ]
15. Fisher DA. Management of congenital hypothyroidism clinical review 19. J Clin Endocrinol and Metabol. 1991;72:523. [ Links ]














