Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.34 no.2 Asunción 2007
CASO CLÍNICO
Osteomielitis hematógena en el contexto de una púrpura fulminante meningocócica: a propósito de un caso.
Hematogenous Osteomyelitis in the Context of eningococcal Purpura Fulminans: a case report.
Emilio Navalón Ramon1, Esperanza Martínez Ruiz2, Paloma Muñoz Jaramillo3.
1. Médico Especialista en Medicina Familiar y Comunitaria. Centro de Salud Ontinyent-II. Valencia, España.
2. Médico Especialista en Dermatología. Hospital Lluís Alcanyis. Valencia España.
3. Médico Especialista en Pediatría. Centro de Salud de la Pobla Llarga. Valencia, España.
Solicitud de Sobretiros: Emilio Navalón Ramón. Reina, 21.46800-Xativa.Valencia, España. Correo Electrónico: navalon_emi@gva.es
RESUMEN
La enfermedad meningocócica es una enfermedad contagiosa causada por la bacteria gramnegativa Neisseria meningitidis o meningococo. Los pacientes con enfermedad meningocócica invasora pueden mostrar un amplio espectro de presentaciones clínicas, entre las que se encuentra la púrpura fulminante meningocócica, con una elevada morbimortalidad.
Presentamos el caso de un niño de 13 años afecto de púrpura fulminante meningocócica que presentó una osteomielitis hematógena en el contexto del cuadro de coagulación intravascular diseminada.
Palabras claves: Enfermedad meningocócica. Meningococemia. Púrpura fulminante. Coagulación intravascular diseminada. Osteomielitis. Pediatría.
ABSTRACT
Meningococcal disease is a contagious disease caused by the Gram-negative bacteria Neisseria meningitidis, or meningococcus.Patients with invasive meningococcal disease can present a wide spectrum of clinical manifestations, among which are meningococcal purpura fulminans, which has high rates of morbidity and mortality.
We present the case of a 13 year-old child with meningococcal purpura fulminans who presented hematogenous osteomyelitis in the context of a clinical picture of disseminated intravascular coagulation.
Key Words: Meningococcal disease. Meningococcemia. Purpura fulminans. Disseminated intravascular coagulation Osteomyelitis. Pediatrics.
INTRODUCCIÓN
La enfermedad meningocócica es una enfermedad contagiosa causada por la bacteria gramnegativa Neisseria meningitidis o meningococo. Los pacientes con enfermedad meningocócica invasora (EMI), dependiendo de la secuencia de acontecimientos fisiopatológicos y de otros factores que dependen del meningococo y del huésped, pueden mostrar un amplio espectro de presentaciones clínicas: a) bacteriemia sin shock (bacteriemia aguda oculta), b) bacteriemia con shock sin meningitis (meningococemia fulminante), c) shock y meningitis, d) meningitis y e) meningococemia crónica benigna (1).
La meningococemia fulminante o púrpura fulminante meningocócica (PFM) ocasiona una elevada morbilidad y mortalidad en niños y adultos a pesar de un tratamiento antibiótico y soporte vital adecuados. Esta enfermedad ocasiona coagulación intravascular diseminada (CID) y compromiso vascular distal grave, con trombosis microvascular, hipoperfusión tisular y fracaso multiorgánico(2).
La meningococemia es menos frecuente que la meningitis, pero entre un 10 y un 30% de los pacientes con enfermedad meningocócica tienen meningococemia sin meningitis(1). La meningococemia se caracteriza por el hallazgo de hemocultivos positivos para Neisseria meningitidis junto a una respuesta inflamatoria sistémica exagerada(2).
CASO CLÍNICO
Presentamos el caso de un varón de 13 años de edad que fue ingresado tras presentar clínica de 16 horas de evolución que se inició con escalofríos intensos y malestar general, sin dolor. Más tarde apareció fiebre y dos vómitos, por lo que recibió tratamiento con paracetamol y domperidona. Continuó con fiebre y a las 15 horas de iniciado el cuadro, presentó mareo, pérdida de la conciencia durante unos segundos, encontrándolo la familia con coloración cianótica y manchas en la piel.
Sus antecedentes personales patológicos no revestían interés clínico. El embarazo fue controlado sin patología y el parto, eutócico. Pesó al nacimiento 3230 g. Recibió lactancia materna durante 8 meses y tuvo un desarrollo psicomotor normal.
En la exploración se objetivó un peso de 49,1 Kg y una talla de 155 cm. La frecuencia cardiaca era de 100 pulsaciones por minuto, la temperatura rectal de 39ºC, la tensión arterial de 82/54 mmHg y la saturación de oxígeno del 98%. Presentaba un mal estado general y estaba conciente y orientado, aunque obnubilado. Se constató cianosis periférica y púrpura en cara, cuello, tronco y extremidades (Fig. 1 y 2). La respiración se presentaba con una ligera polipnea. La auscultación cardiopulmonar y la exploración abdominal eran normales. No había edemas periféricos ni rigidez de nuca.
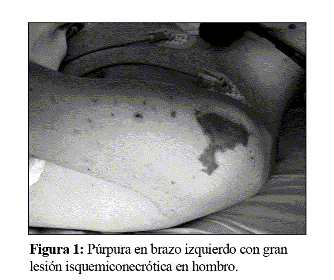
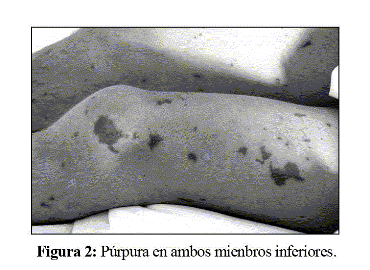
El hemograma mostró recuento de leucocitos de 3600x10^9/L, con 86% de neutrófilos y 13% de linfocitos. El recuento de plaquetas era de 115000/µL. El estudio de la coagulación mostró un índice de Quick del 21%, un dímero D de 11746 ng/mL y un fibrinógeno de 139 mg/dL. En la bioquímica básica destacaba urea de 56 mg/dL, creatinina de 2,5 mg/dL, aminotransferasa de alanina de 74 U/L y creatina cinasa de 1996 U/L, siendo el resto normal. La proteína C reactiva era de 55 mg/dL. La gasometría arterial mostró un pH de 7,21. El estudio bioquímico del líquido cefalorraquídeo (LCR) era normal, mientras que el recuento de hematíes y de leucocitos daba unas cifras de 16/mL y 22/mL (18 polimorfonucleares y 4 monocitos) respectivamente. En el hemocultivo realizado en el momento del ingreso se aisló Neisseria meningitidis (serogrupo C). El electrocardiograma, el ecocardiograma y la radiografía de tórax fueron normales.
Con el diagnóstico de púrpura fulminante por sepsis meningocócica sin meningitis clínica, pasó a la unidad de cuidados intensivos (UCI), donde se inició tratamiento con cefotaxima, teicoplanina, proteína C activada y corticoides. Durante su estancia en la UCI presentó las siguientes complicaciones: a) shock, que requirió gran cantidad de sobrecargas volumétricas y drogas vasoactivas (dopamina y noradrenalina), con lo que progresivamente fue mejorando la situación que se corrigió en 3 días; b) disfunción renal, que se corrigió rápidamente con la reposición de volumen; c) coagulopatía de consumo, que requirió la transfusión de 2 unidades de plasma, con lo que se normalizaron los tiempos de coagulación. No sufrió hemorragias; d) púrpura fulminante, que se extendió durante las primeras horas del ingreso, pero que después quedó delimitada; y e) insuficiencia respiratoria leve, probablemente en relación con un aumento de la permeabilidad vascular por la sepsis y por el importante aporte de fluidos, lo que produjo un aumento del líquido extravascular pulmonar.
A su salida de la UCI para ingresar en planta, quedaron como secuelas lesiones purpúricas necróticas en tronco y extremidades, destacando una lesión ulcerada profunda en el glúteo izquierdo y lesiones isquemiconecróticas en el extremo distal del quinto dedo de ambos pies. Fuera de la UCI mantuvo picos febriles precedidos de escalofríos sin focalidad aparente y sin respuesta a cefotaxima y teicoplanina durante los 15 días siguientes y a pesar del aislamiento, en múltiples cultivos de exudados de las lesiones cutáneas, de estafilococos coagulasa negativos y enterococos sensibles a estos antibióticos. Analíticamente destacaba una anemia con una hemoglobina de 10,5 g/dL.
Se enfocó el caso como síndrome de fiebre de origen desconocido en probable relación con sepsis nosocomial, con accesos bacteriémicos. Considerando el aislamiento del enterococo en la lesión cutánea o bien una complicación endocárdica de origen meningocócico, se realizó un ecocardiograma de control a los 15 días de evolución, sin hallazgos sugerentes de endocarditis. Se descartó un foco séptico de planos profundos en el glúteo por ecografía, así como abscesos suprarrenales o retroperitoneales en una tomografía axial computerizada (TAC) abdominopélvica. Tanto en esta TAC como en una resonancia nuclear magnética craneal y de raquis no hubo hallazgos que justificasen la fiebre. Se decidió la supresión del tratamiento con teicoplanina y cefotaxima después de 20 días de tratamiento y no hubo cambios en el patrón febril, por lo que se descartó fiebre de origen farmacológico. Se tomaron 3 hemocultivos seriados a las 48 horas de dicha supresión, con resultados negativos y se inició tratamiento empírico con imipenem, fundamentado en que con los tratamientos previamente empleados, muy probablemente no se había cubierto suficientemente algunos bacilos gramnegativos intrahospitalarios o de crecimiento insidioso (grupo HACEK), ni tampoco la flora anaerobia o microaerófila. La puerta de entrada podría hallarse en las múltiples lesiones cutáneas y el foco de acantonamiento podría ser óseo, en las lesiones necróticas de los extremos distales del quinto dedo de ambos pies (Fig. 3), en el contexto de infartos sépticos acaecidos durante la CID meningocócica.
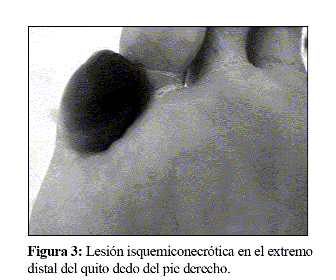
Asimismo se procedió a la cura y retirada de esfacelos de las lesiones de los dedos. La respuesta al imipenem, aunque parcial, fue significativa, observándose que los accesos bacteriémicos cesaron, aunque persistía una febrícula continua que nunca superó los 38ºC y se apreció mejoría del estado general y de la anemia. Este hecho reforzó la hipótesis antes referida. La remisión incompleta de la fiebre se atribuyó a una difusión inadecuada del imipenem al foco séptico y necrótico.
Reinterrogando al paciente recordó que, pocos días después de su salida de la UCI, sentía molestias en la región pretibial derecha, dato que corroboró enfermería, llamándole la atención las molestias a dicho nivel durante las curas, sin que existieran lesiones cutáneas en esta zona, aunque entonces fue relacionado con la convalecencia del grave cuadro infeccioso del que estaba saliendo. No obstante y ante la persistencia del cuadro febril, este dato cobró una relevancia fundamental. Considerando entonces firmemente la sospecha de osteomielitis, se solicitó una gammagrafía ósea y una radiografía de tibias (Fig. 4) y pies, con lo que se confirmaron signos de osteomielitis extensa en ambas diáfisis tibiales, en el quinto metatarsiano del pie izquierdo y necrosis de la falange distal del quinto dedo del pie derecho. Por la gammagrafía existían dudas en el hueso iliaco y en la epífisis proximal del cúbito izquierdo, sin existir focos de captación en el raquis ni en el cráneo.
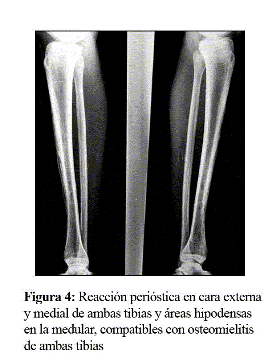
Ante el hallazgo radiológico y gammagráfico y en espera del curetaje de las lesiones, se tomó una vía central, asociando clindamicina intravenosa (IV) al tratamiento con imipenem. A las 24 horas se apreció una normalización completa de la curva de temperatura, dato que apoyó la hipótesis de que se hallaban implicados en el foco gérmenes anaerobios, posiblemente flora mixta, pues si hubiesen sido cocos grampositivos, se hubiera apreciado respuesta con el tratamiento previo con teicoplanina, que además difunde bien en el hueso.
Se procedió al curetaje de las lesiones más extensas, las tibiales, obteniéndose muestras para cultivos en medios habituales, para hongos y para micobacterias, con el procesamiento inmediato de las mismas para anaerobios, siendo negativos. Precisó una transfusión de 2 unidades de hematíes tras el procedimiento quirúrgico, asociándose ferroterapia oral, profilaxis tromboembólica y rehabilitación sin carga.
A los 8 días de terapia efectiva se hizo una nueva cura con retirada de los esfacelos de los dedos de los pies, presentando esa tarde una temperatura de 38ºC, sin escalofríos ni repercusión clínica. Se tomaron hemocultivos de las tres luces de la vía central y se programaron hemocultivos seriados en caso de reaparición de la fiebre, con procesamiento expreso para medios habituales y hongos, que resultaron negativos. Ni la radiografía de tórax ni la de tibias y pies mostró cambios. Se mantuvo el mismo tratamiento y los picos vespertinos de 38ºC sin escalofríos y con buena tolerancia se sucedieron, por lo que se realizó un nuevo curetaje y fresado de las lesiones en las tibias, procesándose nuevamente para cultivo las muestras obtenidas. Precisó otra transfusión de 2 unidades de hematíes. Una vez retirada la analgesia se observó persistencia de la febrícula.
No se apreciaron cambios significativos en las radiografías de pies, codo izquierdo y pelvis. Se retiró el imipenem tras 4 semanas de tratamiento, ante la posibilidad de fiebre por fármacos, pero manteniendo la clindamicina IV, sin remisión de la febrícula. Se realizó ecografía Doppler de miembros inferiores, descartándose trombosis venosa profunda. A los 18 días de su colocación, se retiró la vía central, cultivándose las puntas del catéter y manteniendo la clindamicina IV por vía periférica. Fue entonces cuando la febrícula remitió. Ante la evolución a mejoría y después de mantener 5 semanas de tratamiento, se dio el alta tras 58 días de hospitalización, siendo controlado en consultas externas.
DISCUSIÓN
La enfermedad meningocócica es una infección sistémica causada por el diplococo gramnegativo aerobio Neisseria meningitidis. Se conocen más de 30 serogrupos, pero sólo 6 de ellos (A, B, C, Y, W-135 y, recientemente, X) se asocian con potencial patogénico significativo(3) y, de hecho, son los responsables de más del 90% de los casos de infección meningocócica en el mundo. El único reservorio del meningococo es la nasofaringe humana y la transmisión se produce de persona a persona, a través de las secreciones respiratorias. Cuando Neisseria meningitidis alcanza a una persona, coloniza su nasofaringe y el individuo queda como portador asintomático, situación en la que puede permanecer durante varios meses.
La tasa de portadores sanos es variable (8-20%)(3). Una vez el meningococo ha colonizado las vías aéreas superiores, puede pasar a la sangre a través de la mucosa y es entonces cuando se produce la EMI. Los factores de riesgo relacionados con el paso de la bacteria a sangre y, por tanto, con la EMI que se han identificado hasta el momento son la exposición al humo del tabaco, la infección respiratoria por virus Influenza, el hacinamiento, el bajo nivel socioeconómico, defectos del sistema inmune (déficit congénito de los componentes del complemento C5 a C9, déficit de properdina, asplenia funcional o anatómica, infección por VIH) y soluciones de continuidad de la mucosa respiratoria(4,5).
Una vez la bacteria alcanza el torrente circulatorio, si su ritmo de multiplicación es bajo causa infecciones localizadas, como meningitis, artritis, pericarditis, celulitis, endoftalmitis, conjuntivitis, neumonía, sialoadenitis, anexitis, enfermedad pélvica inflamatoria(1), epiglotitis(6), peritonitis(7) o uretritis(8). Si por el contrario Neisseria meningitidis se multiplica rápidamente, causa meningococemia. De hecho, se han relacionado los niveles elevados de endotoxina circulante con la presencia de meningococemia sin meningitis( 9). Asimismo, la ausencia de signos meníngeos en un paciente con meningococemia es un signo de mal pronóstico. Se ha sugerido que ello es debido a que la bacteria se multiplica tan rápidamente en la sangre que no da tiempo a que se produzca la siembra en las meninges ni la inflamación de éstas.
La meningococemia cursa con un inicio brusco, con fiebre, escalofríos, náuseas, vómitos, sensibilidad muscular y una erupción petequial o purpúrica, todo ello acompañado de mal estado general. A menudo progresa a PFM y se asocia con un cuadro de inicio rápido consistente en hipotensión, CID, hemorragia suprarrenal aguda (síndrome de Waterhouse-Friderichsen) y fallo multiorgánico. La manifestación clínica más característica es la erupción petequial o purpúrica.
Son irregulares y en ocasiones, elevadas, algunas con el centro vesicular gris pálido. Habitualmente se localizan en el tronco y en las extremidades, pero pueden aparecer en las mucosas, las plantas de los pies, las palmas de las manos y en la cabeza.
Las petequias pueden llegar a fusionarse en bullas hemorrágicas o también, ulcerarse. Los pacientes con coagulopatía severa pueden desarrollar isquemia en las extremidades o en los dedos. Sin tratamiento, el 70-90% de los pacientes con EMI morían. El uso de antibióticos redujo la mortalidad al 9-12%, aunque ésta es superior al 40% entre los pacientes con PFM (2).
La sospecha clínica rápida por parte de la familia y del personal sanitario, el tratamiento antibiótico prehospitalario, el traslado rápido al hospital, la estabilización en una UCI y la aplicación urgente de tratamiento pueden reducir la morbilidad y la mortalidad individual. Sin embargo, la mortalidad total en países desarrollados se ha estabilizado en aproximadamente el 10% en las últimas décadas, ya que muchos pacientes fallecen por shock séptico fulminante (3). El deterioro clínico es importante y aproximadamente la mitad de los pacientes que mueren lo hacen antes de 24 horas desde el inicio de los síntomas(9).
Los signos de mal pronóstico de la meningococemia son: presencia de shock, erupción equimótica o purpúrica, recuento normal de leucocitos o leucopenia, edad superior a 60 años, coma, ausencia de meningitis, trombocitopenia, velocidad de sedimentación baja, anemia y concentraciones bajas en sangre de antitrombina o de proteínas S y C(5). Las secuelas de la meningococemia incluyen pérdida de miembros, pérdida de dedos, necrosis cutáneas, musculares (llegando en este caso incluso a insuficiencia renal aguda por la mioglobinuria(9)) y óseas.
La osteonecrosis como secuela de meningococemia y CID es una complicación conocida pero rara(10), y su aparición puede ser aguda (en el contexto del cuadro clínico) o aparecer a largo plazo. Con frecuencia es sub-diagnosticada y por lo tanto no suele considerarse a la hora de establecer tratamiento específico temprano o a la de mantener vigilancia de su aparición en protocolos de seguimiento en pacientes que han padecido una meningococemia o PFM.
En nuestro caso fue la anamnesis realizada de forma meticulosa al paciente y personal de enfermería que lo atendía, lo que hizo considerar el diagnóstico que se confirmó mediante gammagrafía ósea. La patogenia de la necrosis se considera una mezcla entre factores inflamatorios (osteomielitis aguda) e isquemia tisular secundaria a la CID. No se aisló ningún germen en los cultivos realizados en el material del curetaje probablemente por la politerapia antibiótica que estaba recibiendo el paciente, aunque la limpieza del hueso afecto determinó una buena evolución clínica del enfermo.
Consideramos que esta experiencia clínica junto con los pocos casos publicados deberían hacernos considerar sobre todo a los pediatras, médicos intensivistas u ortopedas infantiles, el diagnóstico de osteonecrosis/ osteomielitis como una complicación cuya importancia radica no sólo en el momento de la grave enfermedad, sino también como una causa que puede hacer que estos pacientes sean subsidiarios a largo plazo de seguimiento específico por parte de ortopedas y traumatólogos.
Aunque el diagnóstico definitivo de la EMI está basado en el aislamiento del germen en fluidos corporales estériles en condiciones normales, el diagnóstico rápido de la PFM y el reconocimiento del inminente deterioro clínico es crucial. Este diagnóstico temprano es extremadamente difícil y requiere un alto grado de sospecha clínica. En estadios iniciales, los síntomas y signos clínicos son muy confusos o inespecíficos y el examen de LCR, incluyendo la tinción de Gram, puede no ser concluyente. En cambio, en fases más tardías, cuando ya se han establecido las lesiones cutáneas hemorrágicas características es más sencillo reconocer la enfermedad.
El diagnóstico bacteriológico rápido en pacientes con meningococemia es posible con una tinción Gram de biopsia de las áreas afectadas de la piel o de LCR. De hecho, el tratamiento antibiótico previo, puede enmascarar la identificación de la bacteria en hemocultivos y cultivos de LCR, pero no en los de biopsias de lesiones cutáneas. Otros métodos que no están influidos por la antibioterapia previa son la detección de antígenos o el análisis mediante reacción en cadena de la polimerasa, que permite la detección específica del ácido desoxirribonucleico de los diferentes serogrupos de Neisseria meningitidis.
Como se ha dicho, la supervivencia de pacientes con PFM apenas ha aumentado en las últimas décadas a pesar de las mejorías en las UCI. La velocidad y la severidad del deterioro clínico de los pacientes con PFM obliga a una terapia intensiva. Debido a la falta de buenos estudios clínicos, gran parte de esta terapia está muy controvertida y, así, el uso de glucocorticoides, el plasma fresco congelado, el recambio plasmático y otras terapias inmunomoduladoras está sujetas a debate. Donde sí existe consenso general es en dos aspectos: i) el tratamiento nunca debe ser retrasado por procedimientos diagnósticos, y ii) los antibióticos son la piedra angular del tratamiento. De manera que, ante la sospecha clínica de EMI, debe iniciarse un tratamiento empírico con ceftriaxona o cefotaxima. Una vez hecho el diagnóstico bacteriológico, se puede cambiar a un antibiótico más específico, para lo que la penicilina G, la ampicilina, la amoxicilina, el cloranfenicol, la cefotaxima y la ceftriaxona son buenas alternativas(11). Quienes presentan una PFM necesitan tratamiento de soporte intensivo, que incluye reanimación enérgica con líquidos, ventilación y vasopresores y se pueden beneficiar de tratamiento con plasma fresco congelado, glucocorticoides y proteína C activada.
Los contactos con pacientes afectos de EMI presentan un riesgo elevado de contraer la infección. Por lo tanto, la quimioprofilaxis es necesaria para prevenir la expansión de Neisseria meningitidis, sobre todo en los primeros días de evolución de la enfermedad en el caso índice y por ello debe ser iniciada cuanto antes y siempre antes de 14 días. La droga de elección es la rifampicina (5 mg/Kg de peso cada 12 h durante 2 días en niños menores de 1 mes; 10 mg/Kg de peso cada 12 h durante 2 días en niños mayores de 1 mes; y 600 mg cada 12 h durante 2 días en adultos), pero el ciprofloxacino (500 mg en dosis única y no indicada en niños) y la ceftriaxona (125 mg por vía intramuscular (IM) en dosis única en menores de 15 años y 250 mg IM en dosis única en mayores de 15 años) son alternativas válidas (9).
Hay dos tipos de vacunas antimeningocócicas. La vacuna conjugada contra el serotipo C del meningococo está incluida en el calendario vacunal a los 2 meses de edad y sólo protege frente a este serotipo. La vacuna tetravalente de polisacáridos del meningococo inmuniza contra los serogrupos A, C, W-135 e Y pero no contra el B.
Se recomienda su administración de rutina a niños de 11 a 12 años y a adolescentes de 15 años que no la hayan recibido antes de iniciar la educación secundaria. También está indicada en personas con riesgo aumentado de EMI: estudiantes universitarios de primer curso que convivan en dormitorios, reclutas, microbiólogos expuestos a Neisseria meningitidis, personas con asplenia funcional o anatómica, individuos con deficiencias de los últimos factores del complemento, viajeros a países donde Neisseria meningitidis es hiperendémico o epidémico, como el África subsahariana o Arabia Saudí y pacientes con HIV(12).
AGRADECIMIENTOS
Al doctor Rafael Calabuig Nadal, por la realización y tratamiento de parte de las fotografías.
REFERENCIAS
1. Manchanda V, Gupta S, Bhalla P. Meningococcal disease: history, epidemiology, pathogenesis, clinical manifestations, diagnosis, antimicrobial susceptibility and prevention. Indian J Med Microbiol. 2006;24:7-19. [ Links ]
2. Rosenstein NE, Perkins BA, Stephens DS, Popovic T, Hughes JM. Meningococcal disease. N Engl J Med. 2003;344:1378-388. [ Links ]
3. Stephens DS. Conquering the meningococcus. FEMS Microbiol Rev. 2007;31:3-14. [ Links ]
4. Soult Rubio JA, Muñoz Sáez M. Enfermedad meningocócica invasora. An Pediatr (Barc). 2005;62:297- 303. [ Links ]
5. Johri S, Gorthi SP, Anand AC. Meningococcal meningitis. MJAFI. 2005;61:369-74. [ Links ]
6. Crausman RS, Pluss WT, Jennings CA. Acute epiglottitis in the adult caused by Neisseria meningitidis. Scand J Infect Dis. 1995;27:77-78. [ Links ]
7. Bar-Meir S, Chojki er M, Groszmann RJ, Atterbury CE, Conn HO. Spontaneous meningococcal peritonitis: a report of two cases. Am J Dig Dis 1978;23:119-22. [ Links ]
8. Kanemitsu N, Hayashi I, Satoh N, Hayakawa T, Mitsuya H, Hayase Y, et al. Acute urethritis caused by Neisseria meningitidis. Int J Urol. 2003;10:346- 47. [ Links ]
9. Van Deuren M, Brandtzaeg P, Van der Meer JW. Update on meningococcal disease with emphasis on pathogenesis and clinical management. Clin Microbiol Rev. 2000;13:144-66. [ Links ]
10. Campbell WN, Joshi M, Sileo D. Osteonecrosis following meningococcemia and disseminated intravascular coagulation in an adult: case report and review. Clin Infect Dis. 1997;24:452-55. [ Links ]
11. Almeida-González L, Franco-Paredes C, Pérez LF, Santos-Preciado JI. Enfermedad por meningococo, Neisseria meningitidis: perspectiva epidemiológica, clínica y preventiva. Salud Publica Mex. 2004;46:438-50. [ Links ]
12. Kimmel SR. Prevention of meningococcal disease. Am Fam Physician. 2005;72:2049-50. [ Links ]














