Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.34 no.1 Asunción Aug. 2007
GUÍA
Guía para uso apropiado de componentes sanguíneos en pacientes pediátricos*
Guidelines for appropriate use of blood products in pediatric patients
Elaboración: Dra. Angélica Jiménez de Samudio, Dra. Sonia Gini, Dr. Oscar Echeverría, Dra. María Ofelia Lemir de Zelada.
Consenso Sociedad Paraguaya de Pediatría. Representantes: Prof. Dr. Ramón Mir Villamayor, Dra. Norma Beatriz Bogado Gómez, Dra. Angélica Jiménez de Samudio, Dra. Isabel Antonia Mattio Areco, Dr. Ernesto Federico Weber Weiher, Dra. Sonia Viviana Pavlicich, Dra. Elvira Mendieta Peña, Dra. Natalia Elizabeth Gómez Arriola, Dra. Blanca Lizette Heinichen Manfeld, Dr. Jorge Batista
* Tomado de "Guía para uso apropiado de componentes sanguíneos en pacientes pediátricos". Ministerio de Salud Pública y Bienestar Social. Programa Nacional de Sangre. Organización Panamericana de la Salud. Asunción-Paraguay - 2007.
INTRODUCCIÓN
Se define como terapia transfusional al uso de componentes sanguíneos obtenidos a partir de donaciones para reemplazar transitoriamente deficiencias adquiridas o congénitas de los componentes de la sangre.
La transfusión en pediatría es un procedimiento terapéutico, en el cual se debe tener un conocimiento exacto de la fisiología de las diferentes etapas de madurez, especialmente la etapa neonatal ya que durante la transición de feto a Recién Nacido se efectúan una serie de cambios complejos en la fisiología de la hematopoyesis y hemostasis.
Otro punto relevante de la transfusión en pediatría es la mejora en los tratamientos y el soporte técnico de pacientes prematuros de bajo peso, los cuales han llevado a un porcentaje mayor de supervivencia en estos pacientes, convirtiéndolos en uno de los grupos más trasfundidos.
Aunque la transfusión de productos sanguíneos sigue siendo un medio importante para salvar vidas, no toda transfusión será benéfica para el paciente, existen riesgos potenciales de transmisión de Enfermedades virales post transfusión como hepatitis, SIDA, infección por CMV entre otras; por tal motivo es importante tener en cuenta ciertas consideraciones especiales cuando se decide realizar una transfusión.
MATERIAL Y MÉTODOS
Estas Guías fueron elaboradas en base a la revisión de Guías Transfusionales publicadas por grupos de expertos internacionales y en literatura de bases de datos como MEDLINE y COCHRANE, la mayoría de ellas proporcionadas por asesores técnicos que colaboraron en la facilitación de la recopilación de la información.
Se han tomado los valores o criterios de indicación transfusional que cuentan con el mayor respaldo científico en los cuales existe concordancia y consenso en los resultados de los estudios que incluyen mayor población (Meta análisis). En aquellos casos en los cuales no se han encontrado concordancia o el nivel de evidencia fue bajo, se considero las recomendaciones de los expertos y se ha tratado de adaptarlas a la realidad de nuestro país.
La mayoría de la información científica revisada en la elaboración de estas guías cuenta con una categorización según la escala de la US Agency for Health Care Policy and Research y se presenta en la siguiente tabla:
Grados de evidencia
Ia: Evidencia obtenida desde Meta-Análisis y estudios randomizados y controlados.
Ib: Evidencia obtenida de al menos UN estudio randomizado.
IIa: Evidencia obtenida de al menos UN estudio no randomizado bien diseñado.
IIb: Evidencia obtenida de al menos UN estudio bien diseñado casi experimental.
III: Evidencia obtenida a partir de estudios descriptivos no experimentales pero bien diseñados, estudios comparativos y correlación en estudios de casos.
IV: Evidencia obtenida de opinión de expertos o de reportes de experiencias clínicas de expertos en la materia.
Grados de recomendación
A: Niveles de evidencia Ia y Ib; respaldada por estudios randomizados e importante cantidad de literatura con recomendaciones específicas.
B: Niveles de evidencia IIa, IIb, III; tienen el respaldo de un estudio clínico bien conducido aunque no randomizado en la validación de la recomendación.
C: Nivel de evidencia IV; opinión de expertos en base a su experiencia que se valida en ausencia de estudios calificados.
CONSIDERACIONES GENERALES
El acto transfusional es un acto médico, es responsabilidad del médico tratante, reconociendo que la Unidad de Medicina Transfusional es un servicio de apoyo.
El Hospital deberá tener integrado el Comité de Transfusión Hospitalaria.
La causa del déficit debe ser establecida antes de la transfusión.
La cifra de Hemoglobina (Hb) de un paciente no debe ser el único factor para tomar la decisión de efectuar una transfusión de Concentrado de Glóbulos Rojos (CGR). La decisión de transfundir debe basarse en la necesidad de aliviar los signos y síntomas de hipoxia y de acuerdo a cada cuadro clínico en particular.
El médico que prescribe debe tener conciencia de los riesgos de infecciones transmisibles por transfusión y de otras complicaciones que se pueden presentar.
El médico que prescribe debe registrar claramente el motivo de la transfusión.
Una persona capacitada, preferiblemente una enfermera, debe monitorear el acto transfusional y tomar las medidas que correspondan (según su capacitación) si hay fenómenos adversos.
Pruebas Pretransfusionales Recién
Recién Nacido (RN) hasta los 4 meses de vida.
Las muestras de sangre de la madre y del Recién Nacido deben ser obtenidas y se determinarán los grupos ABO y RhD. La muestra de la madre deberá ser estudiada buscando anticuerpos irregulares. En el Recién Nacido se determinará Test de Coombs Directo. Grado de recomendación C, Nivel de evidencia IV.
Si la sangre materna no está disponible, la búsqueda de anticuerpos irregulares se hará en el Recién Nacido (Tabla 1).

El Test de Coombs Directo positivo en el RN o presencia de anticuerpos irregulares en la madre pueden reflejar la presencia de una Enfermedad Hemolítica en el RN. En estos casos se realizarán estudios inmunohematológicos específicos para seleccionar el componente sanguíneo a ser trasfundido.
Cuando el Test de Coombs Directo y los anticuerpos irregulares resultasen negativos, se podrán realizar transfusiones de pequeños volúmenes repetidos de sangre durante los primeros 4 meses de vida sin futuras pruebas inmunohematológicas. Grado de recomendación C, Nivel de evidencia IV.
Si se realizan transfusiones de grandes volúmenes de sangre de más de 5 días de colectadas, se deberá realizar tamizaje de anticuerpos irregulares en el receptor. Grado de recomendación B, Nivel de evidencia IIb. La formación de aloanticuerpos ha sido demostrada ser excepcionalmente rara en este periodo.
Después de los 4 meses de vida las pruebas pretransfusionales deberán ser realizadas según estándares de adultos (Tabla 2).

TRANSFUSIÓN DE COMPONENTES SANGUÍNEOS
La práctica transfusional pediátrica se divide en 2 etapas:
1. Desde el nacimiento hasta los 4 meses de edad (incluyendo prematuros menores de 1000-1500 gr.).
2. Individuos mayores de esta edad.
Esta división se realiza teniendo en cuenta los siguientes puntos:
El volumen sanguíneo en el recién nacido pretérmino con muy bajo peso al nacer (1000 gr.) es en promedio 100ml/Kg. en comparación con los de término que tienen un volumen de 75- 85ml/ Kg.
Una característica de esta edad es la poca capacidad de adaptación que presentan a los cambios de volumen, con una pobre respuesta tanto a la hipovolemia como a la hipervolemia.
Otro aspecto importante es el estrés al frío producido por el cambio de temperatura por la transfusión de productos sanguíneos produciendo hipotermia, aumento del metabolismo, hipoglucemia, acidosis metabólica, favoreciendo la presencia de episodios de apnea los cuales llevan a hipoxia e hipotensión.
El sistema inmunológico tanto humoral como celular de los neonatos es inmaduro y los anticuerpos presentes en ellos son de tipo IgG provenientes de la madre. Estas alteraciones en la inmunidad han sido causa de diversas entidades asociadas al empleo de sangre y sus derivados, siendo algunas de ellas mortales como la enfe medad injerto vs. huésped.
Diversos problemas metabólicos como acidosis e hipocalcemia pueden presentarse en forma secundaria a las tranfusiones en neonatos debido a su incapacidad de metabolizar el citrato favorecido por la inmadurez hepática.
La hiperkalemia es un trastorno importante que debe ser tomado en cuenta ya que un neonato que recibe transfusión de eritrocitos almacenados por 3 a 5 días estará recibiendo de 0.1mmol/L de potasio, pero si este paciente recibe transfusión masiva como sucede en la cirugía cardiaca con bomba de circulación extracorpórea o bien es transfundido en varias oportunidades, el incremento en los niveles de potasio serico será mayor.
Otra circunstancia donde se produce un incremento de potasio serico es cuando la sangre es irradiada y almacenada por tiempo prolongado; por tal razón se recomienda que la irradiación de los eritrocitos sea lo más cercana a la transfusión.
Los problemas infecciosos en los recién nacidos como la infección por citomegalovirus (CMV) son otro aspecto importante que se debe tener en cuenta. El riesgo de adquirir esta enfermedad en el neonato está relacionada en forma inversamente proporcional a la tasa de seropositividad de la comunidad, o sea que a mayor número de adultos seropositivos para CMV, menor será la tasa de infección asintomática en el RN, así mismo la tasa de infección sintomática en RN de madres seropositivas también es baja. Sin embargo el riesgo de adquirir infección postransfusional se incrementa en RN prematuros de madres seronegativas, pudiendo evitarse con la transfusión de sangre CMV negativa o bien con la utilización de filtros para desleucocitar.
Concentrado de Glóbulos Rojos (CGR)
Descripción
Los Concentrados de Glóbulos Rojos: se obtienen a partir de la donación de sangre entera de aproximadamente 400 ml. a la cual se le ha extraído el plasma mediante centrifugación y contiene una concentración de hemoglobina no menor de 45 gr. por unidad, en un volumen de 200 y 300 ml. con Hematocrito de 55 a 75%. La unidad contiene una solución anticoagulante CPD-A1 (Citrato, fosfato, dextrosa, adenina) que permite mantener viables los hematíes durante 35 días almacenados entre +2 y +6ºC en un refrigerador con alarma y registro dev temperatura, otras soluciones son SAG-Manitol (45 días) y CPD (21 días).
Función
Incrementar la capacidad de la sangre de transportar oxígeno a los tejidos elevando la concentración de Hemoglobina.
Guías para Transfusión de Concentrado de Glóbulos Rojos (CGR) RN hasta los 4 meses de edad.
Es difícil establecer criterios estrictos de transfusión basados en evidencia durante el periodo neonatal, sin embargo experiencias anteriores en centros que han adoptado guías de transfusión o protocolos transfusionales locales han logrado disminuir la cantidad neta de transfusiones y consecuentemente la exposición de los pacientes a transfusiones innecesarias. Grado A de recomendación, Nivel Ib de evidencia.
El fraccionamiento de una sola unidad de sangre en varias bolsas satélites destinadas a un paciente contribuye a minimizar la exposición a múltiples donantes.
El uso de Eritropoyetina (EPO) podría también disminuir las exposiciones a transfusiones en los RN, sin embargo las dosis, el tiempo de utilización y el soporte nutricional aún no están estandarizados y el beneficio durante las 2 primeras semanas es modesto, comparado con el beneficio de instaurar Protocolos institucionales apropiados de transfusión. (Maier et al, 1994, 1998. Shannon et al, 1995. Franz & Pohlandt, 2001). Grado B de recomendación, Nivel IIb de evidencia.
Es necesario de considerar especialmente al RN de bajo peso al nacer y al RN debajo de las 28 semanas de edad gestacional, en los que por lo menos 4 factores predisponen a la anemia como:
1. Extracciones para laboratorio.
2. Alta tasa de crecimiento.
3. Menor vida de los eritrocitos neonatales.
4. Inadecuada producción de EPO.
Indicaciones de CGR según condición clínica y Hematocrito (Hto)
Con Hematocrito entre 36 y 40%; con enfermedad cardiopulmonar grave y que presentan:
a. Oxigenoterapia Fio2 > 45% o en CPAP.
b. Ventilación (presión media en vía aérea >7 a 10 Cm H2O)
c. Sepsis grave.
d. Hemorragia profusa.
Con Hematocrito entre 31 y 35%:
a. Si está recibiendo >35% de oxígeno suplementario.
b. Si está intubado en CPAP o asistencia respiratoria mecánica con presión media de vía aérea >6-8 cm. H2O.
Con Hematocrito entre 21 y 30%:
a. Todas las anteriores.
b. Si está recibiendo < 35% de oxígeno suplementario.
c. Si está en CPAP o asistencia respiratoria mecánica con presión media de vías aéreas < 7 cm. de H2O.
d. Si aparecen episodios de apnea/bradicardia (>9 episodios en 12 horas o dos episodios en 24 horas que requieran ventilación con bolsa y máscara) estando en tratamiento con dosis terapéuticas de metilxantinas.
e. Si presenta taquicardia (>180 por minuto), o taquipnea (> 80 por minuto) persistentes durante 24 horas.
f. Si el aumento de peso es <10 gr./día durante 1 semana a pesar de recibir aporte calórico >100 Kcal./Kg./día.
g. Si debe ser intervenido quirúrgicamente.
Con Hematocrito < ó = 20%:
a. Todas las anteriores.
b. Si está asintomático, pero con reticulocitos < 1%.
MANTENER NIVEL DE HEMATOCRITO
MAYOR DE 40% DURANTE ENFERMEDAD
RESPIRATORIA SEVERA.(Alverson et al,1988)
Grado de recomendación A, Nivel de evidencia Ib.
Indicaciones de CGR según forma de presentación de la Anemia y valor de Hemoglobina (Hb) (Tabla 3).

Frecuentemente los eritrocitos son reemplazados cuando el 10% del volumen sanguíneo total ha sido removido de los RN. Durante las primeras 2 semanas de vida es posible que la enfermedad respiratoria grave predisponga a muestreos repetidos de sangre para estudios de laboratorio y por ende a transfusiones de reemplazo, sin embargo debe evaluarse cada caso en particular y tener en cuenta la clínica que acompaña a la anemia.
No transfundir:
a. Solamente para reponer sangre extraída para análisis de laboratorio.
b. Solamente por Hto o Hb bajos
Guías para Transfusión de Glóbulos Rojos (CGR) en mayores de 4 meses de Edad.
Las transfusiones de CGR están indicadas en el tratamiento de aquellas situaciones sintomáticas donde exista un déficit en la capacidad de transporte de oxígeno, sin embargo no existe consenso total sobre las indicaciones precisas y están relacionadas con las características especiales de cada paciente. Sí, existe consenso en que la Hemoglobina es un parámetro más a evaluar en la indicación de transfusión de CGR.
Indicaciones según forma de presentación de la anemia
Anemia aguda. Generalmente producida por hemorragia aguda: intervenciones quirúrgicas, traumatismos, hemorragia digestiva aguda, etc. La valoración clínica del grado de la pérdida sanguínea es más importante que el nivel de hemoglobina o hematocrito, ya que éstos pueden no reflejar el grado de pérdida sanguínea hasta pasadas unas horas o hasta que el paciente sea normovolémico.
Las pérdidas son de sangre total pero su corrección debe hacerse con diferentes componentes sanguíneos.
Aquí hay que diferenciar el mantenimiento de la volemia, del transporte de oxígeno.
a. La volemia, establecida aproximadamente en un 7% del peso corporal total, se ha de mantener siempre cerca del 100%, ya que el margen de seguridad es muy pequeño. Los fluidos de reemplazo endovenoso son la primera línea de tratamiento de la hipovolemia, es salvadora y proporciona tiempo para detener el sangrado y obtener la sangre para la transfusión si ésta fuese necesaria. No existe evidencia de que los coloides sean superiores a la solución Salina o al Ringer en la resucitación.
b. En cambio el margen de seguridad para el transporte de oxígeno a los tejidos es mucho más amplio, pues para un gasto cardíaco de 5 l/min. y una Hb de 15 g/dl., la oferta de oxígeno es de unos 1.000 ml/min., de ellos se consumen 250 ml. La cifra mínima de Hb aceptada como segura es, en muchos países, de 7 g/dl. para pacientes con buen estado general y en situación estable, por encima de esta cifra es necesario justificar la transfusión por las circunstancias de cada paciente, aumento del gasto cardíaco, patología respiratoria, riesgo de isquemia miocárdica, etc.
c. Las proteínas plasmáticas y de la coagulación tienen un margen de seguridad aún mayor, superior al 100% de la volemia. Por tanto la reposición debe hacerse siempre escalonada. El modelo presentado en la Tabla 4 puede servir de guía.
Anemia pre y peroperatoria. Hay que señalar que no existe una cifra de Hb o Hematocrito determinada, por debajo de la cual no se pueda practicar una anestesia general o regional.
Pueden servir de orientación las siguientes pautas transfusionales:
- En el enfermo quirúrgico normovolémico sin signos de descompensación cardiopulmonar, con anemia, que debe ser sometido a intervención en breve plazo, sólo se transfundirá si la cifra de Hb es inferior a 7 g/dl., preferentemente durante el acto quirúrgico o en el postoperatorio inmediato.
- Por el contrario, en los enfermos con síntomas de enfermedad cardiaca o respiratorios crónicos (que tienen afectado el transporte de oxígeno), está justificada la transfusión preoperatoria con el objeto de aumentar la cifra de Hb por encima de 8 g/dl. Es necesario recordar que los pacientes con anemia crónica (insuficiencia renal crónica, mielodisplasias, etc.) toleran bien cifras de Hb más bajas (5 - 6 g/dl.).
- Algunos pacientes con cirugía programada pueden beneficiarse de la realización de autotransfusión entre los 35 y los 7 días previos a la intervención. El empleo de sangre autóloga es una práctica transfusional mucho más segura y supone un riesgo mucho menor para el paciente, aunque tiene el inconveniente del frecuente desaprovechamiento de las bolsas extraídas (Tabla 4).

Anemia postoperatoria. En situaciones de estabilidad hemodinámica (paciente normovolémico) y sin evidencias de sangrado, es difícil justificar transfusiones de CGR con niveles de Hb superiores a 7 g/dl (Tabla 4).
Anemia crónica. Como norma general la transfusión sólo está indicada cuando la anemia es sintomática y refractaria al tratamiento etiológico.
En pacientes asintomáticos, en ausencia de factores de riesgo, la transfusión no está indicada independientemente de la cifra de Hb, como es el caso de las anemias ferropénicas de hasta 5 g/dl., en las que han de evitarse las transfusiones si no existe una repercusión cardiaca. La decisión de transfundir dependerá de criterios clínicos cuando la Concentración de Hb esté comprendida entre 5-8 g/dl., y por encima de 10 g/dl. la transfusión casi nunca está indicada.
En los pacientes con enfermedad cardiaca - pulmonar, que precisan oxígeno suplementario y Hb< 10 g/dl., está indicada la trasfusión de Concentrado de Glóbulos Rojos (Tabla 4).
Administración
1. Debe realizarse la verificación de la identidad del paciente con nombre, apellido u otro dato apropiado al mismo, corroborar con la Historia Clínica y los datos en la Unidad de CGR. Se debe verificar la concordancia de grupo sanguíneo.
2. Utilizar un equipo de infusión adecuado con filtro de 170-200 micras que debe ser cambiado antes de las 6 horas o luego de 4 transfusiones de CGR.
3. La transfusión debe iniciarse en los 30 minutos luego de retirada la sangre de la heladera.
4. Finalizar la transfusión dentro de 4 horas o menos.
5. La sangre rara vez necesita ser calentada y si es así debe realizarse con equipos especiales de lo contrario podría producirse hemólisis.
6. No agregar medicamentos o soluciones que no sean solución fisiológica normal al equipo de infusión.
7. Adjuntar a la Historia Clínica el formulario o etiqueta enviado por la Unidad de Medicina Transfusional o de lo contrario registrar en la misma los datos presentes en la Unidad de CGR; Número, grupo sanguíneo, fecha y hora.
8. El paciente debe ser monitoreado durante la transfusión por el médico o la enfermera responsable y deben ser anotados sus signos vitales. Las reacciones severas se presentan en los primeros 15 minutos.
9. Reacciones transfusionales: ver Capítulo 9.

5.2. Guías para Transfusión de Concentrado Plaquetario. (C.P.)
Generalidades
Recordando que la hemostasia se produce en 4 fases: vascular, plaquetaria, formación del coágulo de fibrina y lisis del coágulo, las plaquetas son esenciales para la formación del tapón plaquetario primario y para suministrar la superficie hemostática para la fibrina, las deficiencias en el número y/o función pueden ser impredecibles y van desde la prolongación del tiempo de sangría sin alteración clínica hasta defectos graves de la hemostasia con amenaza de vida.
Las transfusiones de plaquetas están indicadas en situaciones clínicas como trombocitopenias o alteraciones cualitativas de plaquetas.
El pediatra que prescribe transfusiones de plaquetas deberá juzgar los beneficios que puedan obtenerse y que en todos los casos deben exceder a los riesgos y la indicación debe basarse en la evidencia médica de su necesidad.
Los riesgos que pueden presentarse son:
1. Transmisión de enfermedades infecciosas,
2. Sensibilización HLA y a Ag. específicos plaquetarios que es responsable de la refractariedad plaquetaria,
3. Reacciones mediadas por citoquinas.
Las indicaciones deben estar precedidas de la evaluación criteriosa de los siguientes puntos:
Situación clínica del paciente (hemorragia activa, esplenomegalia, fiebre, anemia, etc.).
Déficit de producción, destrucción aumentada o disfuncionalidad.
Recuento plaquetario reciente (6 hs.).
Necesidad de procedimientos invasivos.
Uso de ciertos fármacos: Anfotericina B, Antiagregantes, etc.
Respuesta a transfusiones anteriores.
Otros parámetros de coagulación alterados.
En las solicitudes de transfusión de plaquetas deberán completarse todos los datos solicitados (filiación, ubicación, peso, hematocrito, recuento de plaquetas inmediato anterior es decir efectuado dentro de las últimas 6 horas) ya que ello posibilita la adecuada identificación del paciente así como un nuevo monitoreo de la indicación y del cálculo de la dosis. Todas las solicitudes de transfusión deberán ser firmadas y selladas por el médico tratante.
Descripción
Concentrado Plaquetario de donante múltiple: es uno de los componentes de la sangre que se obtiene por centrifugación de una unidad individual de sangre entera dentro de las 8 horas de extraída y habiendo sido mantenida hasta entonces a 22-24 °C. Preparadas en condiciones apropiadas cada CP contiene al menos 5.5 x 1010 plaquetas en 50-70 ml. de plasma. Se almacenan hasta 5 días a una temperatura controlada entre 22-24° C en agitación continua y suave.
Plaquetas Obtenidas Por Aféresis: se obtienen de un donante único mediante un procedimiento de aféresis en separadores celulares automatizados, durante aproximadamente 70 a 100 minutos y contiene por lo menos 3 x 1011 plaquetas en un volumen de plasma variable entre 100 y 400 ml. Deben recibir las mismas condiciones de almacenamiento que las plaquetas de donantes múltiples.
Dosis
La dosis corrientemente aceptada aquella que, de acuerdo con lo afirmado en numerosas publicaciones, eleva el recuento de plaquetas en aproximadamente 40 x 109 por litro. Basados en una recuperación in vivo del 67% de las plaquetas transfundidas, la dosis estándar adecuada es: una unidad de plaquetas: (5-7 x 1010 plaquetas por una unidad) por cada 10 Kg. de peso de un paciente. La evaluación de lo correcto o no de la dosis puede realizarse por medio del recuento de plaquetas, lo cual puede realizarse al finalizar la transfusión (el recuento post-transfusión sólo está indicado cuando se duda de la recuperación de las plaquetas).
La frecuencia de la dosis debe determinarse con la evaluación clínica diaria y/o horaria, dependiendo esto de cada paciente (un paciente al que se lo expone a una transfusión de componentes sanguíneos merece un hemograma previo). En cada caso en el que se indique más de una dosis diaria deberán justificarse los motivos de tal indicación en cada solicitud de transfusión.
La indicación estándar sólo puede prescribirse cuando el suministro de plaquetas está sometido a un estricto control de calidad en su obtención, conservación y administración.
Indicaciones
Profilácticas
a) Insuficiencia Medular (aplasia medular, enfermedades hematooncológicas, quimioterapia, Transplante de Médula Ósea TMO, etc.) Existe acuerdo general que establece el umbral de plaquetas de 10 x 109/l como nivel suficientemente seguro para mantener sin transfundir a pacientes sin factores de riesgo adicionales (convenientemente documentados) tales como: sepsis, uso concomitante de drogas; Ej.: antibióticos, otras anormalidades de la hemostasia, esplenomegalia marcada, fiebre persistente > 38°C.
Excepción: tumores de SNC con quimioterapia y/o radioterapia, en esos cuadros se mantendrá un umbral de 20 x 109/litro.

b) Destrucción Periférica de Origen Inmunológico (Púrpura Trombocitopénica Aguda, Trombocitopenias asociadas a enfermedades autoinmunes o SIDA, etc.). La transfusión de plaquetas como medida profiláctica no está indicada, debiendo ser consultado el médico hematólogo ya que esta patología es de tratamiento médico, no transfusional.
c) Consumo/Secuestro Plaquetario (Coagulación Intravascular Diseminada (CID), microangiopatías trombóticas, hiperesplenismo, síndrome de Kasabach-Merritt). La indicación transfusional y su dosis debe ser evaluada por el médico hematólogo, en base a estudios de laboratorio que precedan a la indicación. En los casos de pacientes con hiperesplenismo que serán sometidos a una intervención quirúrgica, la transfusión de plaquetas deberá efectuarse inmediatamente antes de iniciar el procedimiento.
d) Disfunción Plaquetaria (trastornos hereditarios). La indicación transfusional es profiláctica ante procedimientos invasivos.
Transfusión Profiláctica ante Procedimientos Invasivos
La estrategia a seguir para encarar procedimientos invasivos en pacientes trombocitopénicos por insuficiencia medular es la siguiente:
Procedimientos intratorácicos, intracraneanos y biopsia hepática: son de alto riesgo por lo que es razonable un recuento de plaquetas sostenido de >50 x 109/litro. La punción torácica para colocación de catéteres venosos, broncoscopía, esofagoscopía y laparotomía, que son de riesgo intermedio, requiere recuento de plaquetas (40 x 109/litro).
Las punciones lumbares pueden ser hechas con un recuento de plaquetas > 10 x 109/l en pacientes con LLA. En pacientes con LMA y otras patologías las punciones lumbares deberán ser rea-lizadas con un recuento > 25 x 109/l.
Cuando se efectúa una transfusión de plaquetas, previa al procedimiento de punción, es crítica la realización del recuento post transfusional, con el fin de verificar si se ha alcanzado el valor esperable y se está en condiciones de punzar.

En pacientes con función medular normal que serán sometidos a cirugía mayor siempre debe interrogarse si hubo tratamiento previo (10 días antes) con aspirina u otras drogas con efecto inhibidor de la función plaquetaria, ya que en ese caso el riesgo de sangrado estará incrementado.
Terapéuticas
a) Insuficiencia Medular
Cuando la trombocitopenia está asociada con sangrado activo, en particular gastrointestinal, pulmonar y del SNC se indica la transfusión de plaquetas para mantener un recuento > de 50 x 109/l.
b) Destrucción Periférica de Origen Inmunológico En las trombocitopenias severas por rápido consumo periférico por autoanticuerpos, solo está indicado transfundir en presencia de sangrado gastrointestinal, hemorragia del SNC u ocular, independientemente del resultado del recuento de plaquetas (lo cual no anula la necesidad de obtener el recuento) ésta terapia debe ser precedida del tratamiento médico agresivo adecuado, para bloquear el consumo de las plaquetas rodeadas por anticuerpo por el Sistema Reticuloendotelial y disminuir la producción del autoanticuerpo, que es el único tratamiento etiológico.
c) Consumo/Secuestro Plaquetario Se indica transfusión de plaquetas cuando el sangrado está vinculado a la trombocitopenia y no a las causas del consumo o secuestro, esta indicación debe ser discutida entre el médico tratante y el hemoterapeuta.
d) Disfunción Plaquetaria Independientemente del número de plaquetas, ante la presencia de sangrado debe indicarse la transfusión. Esta indicación debe ser monitoreada por el médico hematólogo tratante y por el hemoterapeuta.
e) Hemorragia Masiva
Los pacientes con función medular normal que presentan hemorragia masiva, (recambio de una volemia en 24 horas o requerimiento transfusional de 10 unidades de CGR) conrecuento de plaquetas < 50 x 109/litro deben ser transfundidos.
Debe tenerse en cuenta que algunas de las plaquetas que se cuentan provienen de los concentrados de glóbulos rojos transfundidos y por lo tanto son no funcionantes.
En los pacientes sometidos a cirugía mayor con bomba de circulación extracorpórea las plaquetas pueden ser disfuncionales por la activación mecánica de la bomba. Sólo debe indicarse tranfusión de plaquetas cuando se produce sangrado y el recuento es menor de 50 x 109/litro.
Es sabido que el sangrado en estos casos es producido más frecuentemente por la heparina, inadecuada corrección con protamina, fibrinólisis o problemas de cierre quirúrgico.
Indicaciones en Neonatología
Consideraciones Generales
El recuento plaquetario normal de un neonato no difiere del de los niños mayores y adultos; va de 150- 450 x 109/l. La incidencia mayor de trombocitopenia en este grupo de pacientes se produce entre los neonatos de muy bajo peso, siendo la causa principal la destrucción aumentada (20% aproximadamente debido a CID).
La decisión transfusional, también en el neonato, debe ser tomada después de tener en cuenta los riesgos y beneficios de la misma.
La trombocitopenia es común en los RN de pretérmino enfermos y está asociada a un incremento del riesgo de hemorragia periventricular severa (Andrew et al,1987). Sin embargo la administración de plaquetas en el manejo de trombocitopenias moderadas de 50 a 100 x109/l. no parece reducir la severidad del sangrado (Andrew et al, 1993) (Tabla 6).

Los RN de término es improbable que sangren si los niveles de plaquetas se encuentran por encima de 20 x 109/l., pero en los RN pequeños, de pretérmino, se recomienda generalmente un umbral mayor particularmente durante los primeros días cuando existe mayor probabilidad de hemorragia periventricular o coexiste coagulopatía. Grado de recomendación C, Nivel de evidencia IV.
Trombocitopenia aloinmune neonatal
Es ocasionada por la producción de aloanticuerpos maternos de tipo IgG contra antígenos plaquetarios fetales derivados del padre que están ausentes en las plaquetas maternas. Se trata de un proceso relativamente frecuente que afecta a uno de cada 2000 ó 5000 recién nacidos, pudiendo ocurrir tanto en el primer niño como en sucesivos embarazos. La complicación más grave es la hemorragia cerebral (10- 30% de los neonatos) que puede tener como consecuencias secuelas neurológicas irreversibles (20%) o muerte (10% de los casos comunicados).
Las inmunoglobulinas IgG por vía intravenosa, y la transfusión de plaquetas constituyen el tratamiento de elección. Debido a que la acción terapéutica de la IgG no es inmediata los pacientes con severa trombocitopenia requieren de transfusiones de plaquetas. Son de elección para la transfusión plaquetas que carezcan del antígeno al que está dirigido el anticuerpo. Ante la falta de disponibilidad de plaquetas compatibles, pueden utilizarse plaquetas maternas obtenidas por aféresis, y lavadas con el objetivo de remover el aloanticuerpo presente en el plasma. Familiares maternos podrían ser una fuente alternativa de plaquetas compatibles.
La probabilidad de recurrencia de la trombocitopenia neonatal aloinmune en las siguientes gestaciones es muy elevada, (hasta del 80-90%) si en la gestación anterior se produjo hemorragia cerebral. La administración de IgG IV a la madre es el tratamiento más efectivo conocidas.
Si se utilizan las plaquetas maternas es importante que ellas hayan sido irradiadas y los aloanticuerpos antiplaquetarios removidos del concentrado plaquetario antes de trasfundirlos. En la Trombocitopenia Neonatal Alo inmune el contaje de plaquetas no debe ser menor a 30 x 109/l. porque el anticuerpo antiplaquetario puede inducir daño en la funcionalidad plaquetaria y pueden ser necesarias plaquetas compatibles en adición a altas dosis de Inmunoglobulina IV. Grado de recomendación C, Nivel de evidencia IV. (British committee for Standards in haematology, 2003).
Selección del componente
Debe seleccionarse un concentrado plaquetario ABO idéntico o con plasma ABO compatible con grupo ABO del receptor. Los concentrados plaquetarios contienen cantidades de estroma de GR para estimular la inmunización Rh. Nivel de evidencia llb, Grado de recomendación B.
Refractariedad plaquetaria
Se denomina refractariedad a la incapacidad para lograr en un receptor, el incremento esperado en el número de plaquetas, después de 2 episodios transfusionales consecutivos con plaquetas de donantes múltiples.
Cuando el médico tratante sospecha que se encuentra ante un caso de refractariedad debe comunicarlo al servicio de Hemoterapia para que éste realice el diagnóstico de la misma, mediante la programación de una transfusión de plaquetas con un número medido de plaquetas en el componente y el seguimiento del resultado de esa transfusión.
El diagnóstico se hace relacionando: el recuento de plaquetas del paciente inmediatamente antes y después de la transfusión (entre 15 minutos a 24 horas después), el recuento de plaquetas de la unidad o unidades transfundidas y la superficie corporal del paciente, lo que da, mediante una fórmula que relaciona estos parámetros entre sí el Incremento Corregido (IC):

Se considera que un paciente es refractario cuando su IC es < 7,5 x 109/l. Las causas de la refractariedad plaquetaria pueden ser inmunológicas (aloinmunización a antígenos HLA o a antígenos plaquetarios específicos) o no inmunológicas (hiperesplenismo, fiebre, infección, uso concomitante de drogas, coagulación intravascular diseminada).
El estudio de refractariedad plaquetaria lo hará siempre el médico especialista en Hemoterapia, el que está entrenado para hacer ese cálculo. Las indicaciones que emerjan del resultado de ese estudio dependerán de la causa de la refractariedad, y en cada caso el especialista en Hemoterapia interactuará con el médico tratante.
Cuando se trata de Refractariedad Inmunológica puede deberse a anticuerpos del sistema HLA o a anticuerpos específicos contra antígenos de las plaquetas.
Las plaquetas también poseen antígenos del sistema ABO en su superficie pero no es indicación suspender una transfusión de plaquetas por no disponer de plaquetas ABO compatibles, sin embargo, frente a una refractariedad plaquetaria se debe seleccionar siempre un componente ABO compatible.
Abordaje terapéutico en pacientes refractarios:
Tratamiento de la condición clínica subyacente a la refractariedad.
Transfusión de plaquetas HLA compatibles, si se constata que se debe a una aloinmunización HLA.
Transfusión de plaquetas de donante múltiple considerando la posibilidad de aumentar la dosis de plaquetas por acto transfusional.
Uso de Plasma Fresco Congelado (PFC), Crioprecipitado y Sobrenadante de Crioprecipitado.
Descripción
Es un componente que se obtiene separándolo de la sangre entera dentro de las 6 horas de colectado y luego congelado rápidamente a una temperatura menor de - 25ºC. Contiene factores de la coagulación estables (II, VII, IX y X), factores lábiles (V y VIII) albúmina e inmunoglobulinas.
El Factor VIII está al menos en un 70% del nivel que existe en el plasma original.
El Crioprecipitado se obtiene del plasma fresco congelado utilizando la propiedad que tienen algunas proteínas de precipitar en frío. Es un componente rico en FVIII (80 a 100 UI por unidad), factor von Willenbrand, FXIII, Fibronectina y Fibrinógeno (150 a 300 mg. por unidad).
El Sobrenadante del crioprecipitado es el plasma deplecionado en FVIII y Fibrinógeno además de moléculas de alto peso (HMW).
El PFC es preparado a partir de las unidades de sangre total y de la extracción por Plasmaféresis, son equivalentes terapéuticos en términos de hemostasis y efectos colaterales (Grado A recomendación, Nivel I evidencia).
Función
Es el líquido de transporte de los glóbulos rojos y plaquetas, y en medicina transfusional se utiliza para proveer factores de la coagulación. Hace algunos años se lo indicaba para proveer volumen, aumentar la presión oncótica y aumentar inmunoglobulinas. En la actualidad esas son contraindicaciones.
Indicaciones
Deficiencia de un Factor de la coagulación:
El PFC podrá ser utilizado para el reemplazo de la deficiencia de un solo factor cuando no se disponga del mismo como producto seguro (recombinante). Generalmente ocurre con la deficiencia del Factor V.
Deficiencia de múltiples Factores de la Coagulación
El PFC está indicado cuando se constata deficiencia de múltiples factores de la coagulación asociado con sangrado severo y o CID.
El Crioprecipitado puede ser indicado cuando el nivel de Fibrinógeno plasmático esta en un nivel < 1g/l, aunque no es claro el umbral de la hipofibrinogenemia con respecto a la importancia clínica.
Púrpura Trombocitopénica Trombótica:
La Plasmaféresis terapéutica utilizando PFC o sobrenadante como reposición de una volemia diaria debe ser comenzada al inicio del cuadro (Grado A recomendación, Nivel Ib evidencia) o dentro de las 24 horas del diagnóstico (Grado C recomendación, Nivel IV evidencia) y debe continuarse como mínimo por dos días después de haber obtenido la remisión del cuadro (Grado B recomendación, Nivel IV evidencia).
Revertir los efectos de los Anticoagulantes Orales (ACO)
El PFC puede ser usado para revertir el efecto de los ACO solamente en presencia de sangrado severo (Grado B recomendación, Nivel IIa evidencia).
Deficiencia de Vitamina K en Unidad de Cuidados Intensivos
El PFC no debe ser utilizado para la corrección laboratorial del tiempo de coagulación o TP alteradas, se debe manejar con vitamina K (Grado B recomendación, Nivel IIa evidencia).
Enfermedades Hepáticas
No existe suficiente evidencia sobre la transfusión de PFC en pacientes con enfermedad hepática y TP prolongado sin evidencia de sangrado, a no ser que deba ser intervenido quirúrgicamente o ser sometido a una biopsia hepática, en estas circunstancias está indicado transfusión de PFC (Grado C recomendación, Nivel IV evidencia).
Sangrado quirúrgico y Transfusión Masiva
El PFC debe ser usado en el tratamiento de hemorragias severas tomando como guía los resultados de estudios de crasis sanguínea durante toda la evolución del paciente, no debe ser usado como reemplazo de volumen en pacientes adultos y niños (Grado B recomendación, Nivel IIb evidencia).
La transfusión de PFC en el Recién Nacido merece especial consideración, las pruebas de coagulación son prolongadas en estos pacientes y el PFC deberá ser trasfundida acordando que estas se encuentren prolongadas usando valores de referencia para la edad.
Enfermedad Hemorrágica del Recién Nacido
Está indicado Plasma Fresco Congelado en la dosis de 10 - 20 ml/kg., como así también vitamina K intravenosa.
Neonatos con coagulopatías
Con evidencias de sangrado, como así también en aquellos en los que deben realizar procedimientos invasivos, deben recibir PFC y vitamina K (Grado C recomendación, Nivel IV evidencia).
El mejoramiento o empeoramiento de la crasis sanguínea son impredecibles por lo cual debe ser monitorizado durante la evolución del cuadro por estudios laboratoriales y la clínica.
Hemorragia Periventricular
La administración rutinaria de PFC para la prevención de la hemorragia periventricular en infantes de pretérmino no está indicada (Grado A, Nivel IIb evidencia).
Policitemia de la infancia
El PFC no está indicado en la policitemia de la infancia.
Hipoalbuminemia
No está indicado para la corrección de hipoalbuminemia o como aporte nutricional.
En neonatos con T activado y baja actividad de Anti T
No hay suficiente evidencia clínica con respecto a la transfusión de PFC.

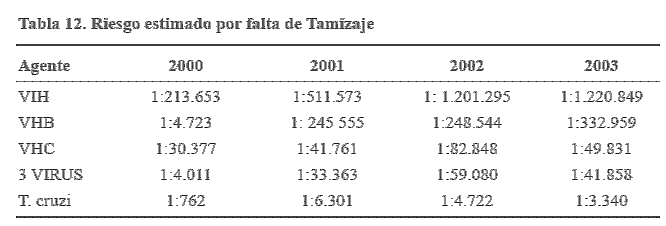
El riesgo de transmisión de patógenos es bajo y los beneficios clínicos por el uso del PFC deben ser comparados con la posible transmisión de patógenos (Grado B recomendación, Nivel II/III evidencia).
Para los pacientes con probabilidad de recibir múltiples unidades de PFC, se debe considerar la vacunación contra la hepatitis A y B (Grado C recomendación, Nivel IV evidencia).
Siempre que el paciente es candidato de recibir muchas unidades del PFC como deficiencias congénitas y recambios plasmáticos prolongados, se deben buscar alternativas de productos con menos probabilidades de transmisión de patógenos. (Grado C de recomendación, Nivel IV de evidencia).
El Uso de Plasma Fresco Congelado no está indicado para:
Reponer la volemia por pérdidas agudas.
Reponer inmunoglobulinas para restablecer la inmunocompetencia.
Tratamiento de las deficiencias de un solo factor de la coagulación, por ejemplo: Hemofilia.
Tratamiento de CID sin evidencia de sangrado, no existen evidencia que un régimen de reemplazo profiláctico previene la CID o disminuyen los requerimientos transfusionales.
Revertir anticoagulación por ACO sin evidencia de sangrado.
Prevención de la hemorragia periventricular en infantes de pretérmino.
Policitemia de la infancia.
Aporte nutricional.
Corrección de la Hipoalbuminemia.
Selección de Plasma Fresco Congelado por Grupo Sanguíneo.
Con respecto al grupo sanguíneo ABO, la primera alternativa para transfusión de PFC es la de conservar el mismo grupo sanguíneo del receptor, si no se dispone de la misma se debe utilizar grupo sanguíneo compatible (con respecto al plasma) (Tabla 8).

Se debe transfundir plasma del grupo O solamente a receptor del grupo O (Grado B recomendación, Nivel III evidencia).
En infantes y RN el plasma debe estar libre de anticuerpos irregulares.
En cuanto al factor Rh, aunque el PFC pueda contener pequeña cantidad de estroma de células rojas la sensibilización después de la administración de PFC Rh positiva es muy poco probable, debido a que el estroma celular es poco inmunogénico comparado con el glóbulo rojo intacto.
No se tiene en cuenta el factor Rh de la unidad ni del receptor para la transfusión de PFC. No se requiere administración de anti D en forma de profilaxis al paciente Rh negativo que recibió transfusión de PFC Rh positivo (Grado B recomendación, Nivel IIa evidencia).
Descongelamiento de Plasma Fresco Congelado, Crioprecipitado y Sobrenadante del Crio.
El procedimiento del descongelamiento de cualquiera de estos productos debe ser diseñado para evitar contaminación bacteriana. Se realiza a temperatura nunca superior a 37ºC.
Posterior al descongelamiento, cuando el producto no es utilizado para reponer Factor VIII y no es requerido en forma inmediata, pueden ser guardados a 4ºC antes de la administración al paciente, siempre que se transfunda dentro de las 24 horas del descongelamiento (Grado B recomendación, Nivel III evidencia).
Frecuencia y Dosis
La dosis de PFC depende de la situación clínica y de la enfermedad que causa la falla en la coagulación. Sin embargo la dosis usual para comenzar un tratamiento es de 15 ml/Kg. de peso.
Seguimiento de los pacientes: Debe monitorearse la respuesta clínica de los pacientes a la terapéutica y los resultados de laboratorio, para medir la modificación o no de los factores de la coagulación: Tiempo de Protrombina, Tiempo Parcial de Tromboplastina y Fibrinógeno.
Crioprecipitados: Indicaciones, Dosificación y Administración
El Crioprecipitado es la fracción de las proteínas plasmáticas que son insolubles en frío. Se prepara mediante la descongelación de una unidad de PFC a 4°C, tras lo cual se centrifuga para sedimentar el precipitado.
Tras eliminar el sobrenadante, el sedimento con 15 a 20 ml. de plasma se vuelve a congelar, y se conserva a temperatura inferiores a -30°C durante como máximo 1 año.
El Crioprecipitado debe contener más de 70 UI de factor VIII y 140 mg. de fibrinógeno por unidad, la actividad procoagulante (factor VIII: C) y el factor de Von Willebrand, y parte del factor XIII originalmente presente en el plasma fresco.
Indicaciones.
El Crioprecipitado puede estar indicado en el tratamiento de deficiencias congénitas y adquiridas de los factores anteriormente citados siempre y cuando no se disponga de concentrados del factor necesitado viralmente inactivados.
Dosificación
Depende del cuadro clínico del paciente. Administración El Crioprecipitado debe descongelarse a temperatura controlada de 30 a 37 ºC (baño María o calor seco). Una vez descongelado, el crioprecipitado debe mantenerse a temperatura ambiente hasta su transfusión que en el caso de que haya sido abierto el circuito debe transfundirse antes de transcurridas 6 horas desde su apertura. Componentes Especiales Componentes irradiados La presencia de linfocitos en mínimas cantidades en concentrados de hematíes y plaquetarios aumentan el riesgo de inducir una enfermedad injerto versus huésped post-transfusional (EIVH) en el receptor si este padece una inmonosupresion severa. El objetivo de la irradiación de los componentes sanguíneos es el de evitar la enfermedad injerto versus huésped post-transfusional (EIVH). Tienen indicación de recibir componentes irradiados los pacientes inmunocomprometidos (por enfermedad de base o por medicación recibida) y determinados pacientes inmunocompetentes cuando la consanguinidad o el tipo de componente aumenta el riesgo de EIVH: Indicaciones Recién Nacido con peso menor de 1500 gr. Pacientes trasplantados (TMO o trasplantes de órganos sólidos). Pacientes con síndromes de inmunodeficiencia congénita. Pacientes hemato-oncológicos (leucemias, linfomas, tumores sólidos). Donaciones dirigidas de familiares. Transfusiones intrauterinas. Exanguinotransfusión en neonatos que hubieren recibido transfusión intrauterina. Componentes celulares a utilizar durante una cirugía cardiovascular en pacientes menores de un año. Componentes leucorreducidos Los objetivos de la leucorreducción de los componentes sanguíneos son los de prevenir la transmisión de CMV, la alosensibilización a antígenos HLA y algunas reacciones post-transfusionales no hemolíticas. Deben recibir componentes leucorreducidos los siguientes grupos de pacientes: a) Pacientes candidatos a soporte hemoterapéutico prolongado: - Talasemias, - Leucemias, - Aplasias medulares. b) Pacientes candidatos a trasplante: - Insuficiencia renal crónica, - Trasplante hepático, - Trasplante de médula ósea. c) Pacientes HIV positivos. d) Pacientes de menos de 1500 gr. de peso. e) Pacientes que hayan presentado 2 o más reacciones transfusionales febriles no hemolíticas. La indicación de estas modalidades es efectuada por el médico hemoterapeuta según la patología del paciente, por lo que es imprescindible que en la solicitud de transfusión se consigne apropiadamente el diagnóstico de base y aquél por el cual se indica la transfusión. De acuerdo a los estándares para la leucorreducción de la Asociación Americana de Bancos de Sangre (AABB) y el Consenso Europeo (CE) se recomienda que todas las fracciones celulares deban de ser leucorreducidas en Recién Nacidos menores a 1200 gr., hijos de madres seronegativas para CMV o cuyo estado serológico para esta infección se desconozca. Las recomendaciones en relación a la cantidad de Leucocitos residuales que deben de tener los productos celulares son para la AABB 5 x 10(6) y para el CE 1 x 10(6). Concentrados de Hematíes Lavados Indicados en pacientes con déficit congénito de IgA y anticuerpos IgA, para evitar reacciones anafilácticas con el plasma y en pacientes con historia documentada de reacciones transfusionales severas a las proteínas plasmáticas. LA PRACTICA TRANSFUSIONAL Solicitud de transfusión. (Anexo 10.1) La solicitud de una transfusión es una prescripción facultativa que deberá contener la información necesaria para identificar al receptor fehacientemente, él o los componentes solicitados, las razones que justifican la petición y en caso de cirugía programada la fecha de dicha intervención. El médico prescriptor, que firma la solicitud, debe estar claramente identificado, así como la fecha y la hora en que la realiza. Muestra de sangre pretransfusional (Anexo 10.3) La muestra de sangre para realizar las pruebas de compatibilidad deberá estar claramente identificada, con los datos del receptor: nombre y dos apellidos, y la fecha de la extracción. Antes de proceder a la realización de las pruebas de compatibilidad, se comprobará que la información de la petición de transfusión coincida con la información de la muestra. En caso de discrepancia o duda, se tomará nueva muestra. La muestra se extraerá en tubos con anticoagulante. El procedimiento para la obtención de las muestras requiere: Identificación positiva y activa del paciente y de la solicitud. Identificación inmediata de las muestras tras la extracción. La correcta realización de este procedimiento evita la aparición de errores tanto en la identificación de la muestra como del paciente, previniendo posibles reacciones transfusionales fatales. Acto transfusional Actualmente el mayor riesgo de morbi-mortalidad asociada a la transfusión son los errores que acaban provocando una incompatibilidad de grupo ABO, se han de extremar las precauciones para asegurar que el acto transfusional se realice tras la correcta identificación del receptor y el producto asignado a él. En el acto transfusional los profesionales de enfermería juegan un papel capital, no solamente desde un punto de vista técnico, sino también en el de la atención al paciente, proporcionando información sobre la transfusión y calmando los potenciales miedos y ansiedades que el acto transfusional pueda provocar. Actuaciones previas Previamente al inicio de la transfusión de cualquier componente sanguíneo es importante tener en cuenta los siguientes puntos: Revisar las órdenes médicas para confirmar la transfusión y la forma en la que ha de realizarse: componente, cantidad, ritmo, y si se ha de administrar alguna premedicación. Establecer el acceso venoso. Si ya existe una vía periférica o central, debe verificarse su correcto funcionamiento y permeabilidad, signos de posible infección y la compatibilidad de la transfusión de componentes sanguíneos con otros fluidos. Es importante recordar que el receptor debe estar en la posición más cómoda posible antes de iniciar la transfusión pues ésta puede durar varias horas. Nunca añadir medicaciones o soluciones a través de la misma vía, la única excepción puede ser el cloruro sódico al 0,9% y nunca suministrar simultáneamente Ringer Lactato u otros productos que contengan calcio. En el caso de las vías centrales con varios accesos la transfusión puede administrarse, previa limpieza con solución salina fisiológica, por uno de ellos mientras se realiza la infusión de otros fluidos por los otros. Controlar la tensión arterial, pulso y temperatura antes de administrar cualquier componente sanguíneo. Informar al paciente de la necesidad de comunicar al personal asistencial cualquier incidencia observada en el curso de la transfusión. No es necesario restringir la ingesta oral durante la transfusión de cualquiera de los componentes sanguíneos. Administración de componentes sanguíneos Secuencia de todo acto transfusional: 1. Identificar activa e inequívocamente al receptor solicitando que proporcione su nombre y dos apellidos. Cuando no sea posible, constatar que la fuente de información sea la correcta (familiares, personal de enfermería de la planta, historia clínica del paciente). Nunca será exagerada la insistencia en este punto, ya que la mayoría de accidentes transfusionales graves se producen por el error en la identificación del receptor y/o del producto. 2. Comprobar el componente sanguíneo. Observar el aspecto (que no haya agregados o hemólisis en los concentrados de glóbulos rojos, que exista el efecto de remolino en las unidades de plaquetas, en el caso del plasma, que esté totalmente descongelado), la integridad y caducidad del producto a transfundir. 3. Verificar que el componente sanguíneo indicado va a ser administrado al receptor correcto. Para ello, revisar y comprobar que el receptor y el etiquetado del producto coinciden y son correctos. Actualmente existen en el mercado diversos métodos (identificación mediante pulseras, métodos de registro con código de barras, etc.) que intentan asegurar la correcta identificación del receptor y el producto a él asignado. 4. Una vez iniciada la transfusión, controlar al paciente para verificar que no presenta ninguna reacción. Equipos de transfusión El equipo de transfusión contiene una cámara de goteo con un filtro de 170-260 mm. y una pinza para regular el flujo. Es conveniente no llenar la cámara de goteo más de la mitad para un correcto funcionamiento y purgar posteriormente el resto del equipo. Se puede utilizar un equipo de transfusión para más de un acto transfusional pero, en cualquier caso, no se ha de utilizar durante más de 6 horas; así se reduce el riesgo de contaminación bacteriana. Existen en el mercado equipos de presión diseñados para acelerar el ritmo de infusión. En todos ellos, hay que seguir las recomendaciones dadas por el proveedor para evitar la hemólisis del producto transfundido. En ciertas situaciones es necesario calentar el producto antes de la transfusión. Para ello existen equipos diseñados expresamente para este fin que deben estar correctamente calibrados y controlados para su funcionamiento. En ningún caso, deben utilizarse estufas ni baños que no estén específicamente diseñados. En caso de ritmos de infusión lentos, es útil la ayuda de bombas de infusión con equipos específicos para la administración de componentes sanguíneos que controlen el ritmo transfusional. Así mismo en estos casos puede ser necesario proceder a dividir la unidad a transfundir con un sellador estéril para facilitar la dosificación en el tiempo necesario o permitir transfundir varias veces al receptor pediátrico de la misma unidad. Velocidad de infusión Los primeros minutos de cualquier transfusión de componentes sanguíneos deben realizarse a velocidad lenta. Sólo cuando se haya comprobado que la transfusión no provoca ninguna reacción se puede pasar a los flujos que se especifican en el apartado correspondiente de cada componente sanguíneo. A modo de recordatorio: Problemas en el ritmo de infusión: es habitual que el ritmo de la transfusión sea más lento que el deseado, esto dependerá de: El calibre del acceso utilizado. La viscosidad del componente. La diferencia de presión hidrostática entre el equipo y la presión venosa central del paciente. Un posible venoespasmo producido por la infusión rápida de CGR fríos. ENFERMEDAD HEMOLITICA RN (EHRN) La EHRN se define como el proceso hemolítico que ocurre en el período neonatal, resultado de la destrucción acelerada de los eritrocitos. La etiología puede ser clasificada en tres grupos: 1. EHRN por isoinmunización al sistema Rh, otros antígenos y por incompatibilidad a sistema ABO. 2. Defectos eritrocitarios congénitos: deficiencias enzimáticas, anormalidades de la membrana, alteraciones en la síntesis de Hb. 3. Defectos eritrocitarios adquiridos: infecciones. Enfermedad Hemolítica del RN por insoinmunización al sistema Rh En la isoinmunización por sistema Rh y otros anticuerpos, el mecanismo de destrucción de los eritrocitos fetales se genera por la existencia de un aloanticuerpo de naturaleza IgG de origen materno, dirigido contra un antígeno heredado de origen paterno presente en las células fetales y ausente en las células maternas, lo cual indica que es requisito indispensable que la madre haya tenido contacto previo con el antígeno desconocido por transfusión sanguínea previa o bien por embarazos previos (cuando la cantidad de sangre que entra a la circulación materna es de 30 cc. o más la posibilidad de sensibilización materna es casi de 100%, aunque se menciona que volúmenes tan pequeños como 0.1 cc. son capaces de producir isoinmunización) (Bol Med Hosp Infant Mex v.59 n.11 México, D.F. nov. 2002). Enfermedad Hemolítica del RN por incompatibilidad ABO La hemólisis puede desarrollarse en fetos y RN cuando existe una incompatibilidad ABO con su madre, ésta es clínicamente significativa generalmente cuando ocurre en infantes de grupo A (ocasionalmente de grupo B) cuya madre es de grupo O. La hemólisis de los GR del feto o RN es producida por IgG Anti A o Anti B materna que atraviesa la placenta, aunque en general en los casos de EHRN ABO las madres presentan niveles altos de estos anticuerpos, el grado de hemólisis no está directamente relacionado con el título de los mismos. El Test de Coombs Directo es habitualmente positivo pero no siempre por lo que se debe solicitar la realización de un Eluido para confirmar la presencia de los Ac pegados a la membrana del GR del RN, esto unido a la clínica de hemólisis y la exclusión de otras causas (presencia de Ac. Irregulares) confirman el diagnóstico. Cuando se realiza una transfusión de GR A ó B en un RN en el que el Test Coombs Directo es negativo, éste puede tornarse positivo debido a que la expresión antigénica en los GR transfundidos (por provenir de adultos) es mayor. EXSANGUINOTRANSFUSIÓN Aunque no existe consenso total entre los neonatólogos el hemocomponente recomendado para este procedimiento es Concentrado globular reducido en plasma con hematocrito de 50 a 60%. Grado de recomendación C, Nivel de evidencia IV (Tabla 9). Otra alternativa es la reconstitución que puede realizarse con Solución salina o albúmina al 4-5% hasta alcanzar el Hematocrito recomendado. La utilización de sangre total con hematocrito de entre 35 a 45% puede generar valores de hemoglobina menor a 12 gr./% post exsanguíno y anemia severa en estos RN lo que lleva al aumento de las exposiciones a otros donantes por transfusiones subsiguientes. La utilización de paquetes globulares los cuales pueden alcanzar un hematocrito de 75% produce valores de Hto inaceptables luego del procedimiento. El recambio de una volemia elimina el 75% de los GR, dos volemias puede eliminar hasta el 90% de los GR y 50% de la bilirrubina (Tabla 9 y 10). 9. REACCIONES TRANSFUSIONALES Las reacciones transfusionales o también conocidas como efectos adversos, son reacciones no deseadas, relacionadas al evento transfusional. Es imprescindible contar con un sistema para la detección, registro y análisis de la información relacionada a todos los efectos no deseados o inesperados, derivados de la transfusión de los diferentes componentes sanguíneos. (Anexo 10.2) Se las clasifica de acuerdo al momento de presentación de la reacción con respecto al inicio de la transfusión (Tabla 11). Como recomendación general ante la aparición de síntomas o signos durante o posterior a una transfusión, el personal de salud, enfermera, residentes o médicos de sala deben suspender la transfusión e informar inmediatamente a la Unidad de Medicina Transfusional con el fin de iniciar una serie de estudios y recopilación de datos para realizar una aproximación diagnóstica y posterior tratamiento. Reacción Transfusional Hemolítica aguda: Es el efecto adverso asociado a la transfusión más grave. Los hematíes transfundidos son destruidos de forma aguda por anticuerpos presentes en el plasma del receptor. La causa más frecuente es la incompatibilidad ABO debida a errores de identificación en cualquiera de las fases de la cadena transfusional. Síntomas y signos: dolor torácico o lumbar, taquicardia, disnea, escalofríos, fiebre, sangrado e incluso shock. Esta sintomatología puede acompañarse con las siguientes alteraciones analíticas: hemoglobinemia, he moglobinuria, aumento de la bilirrubina sérica, prueba de la antiglobulina humana (Test de Coombs Directo) positiva y alteración de las pruebas de coagulación. En pacientes anestesiados los primeros signos pueden ser la hipotensión y los secundarios a la instauración de una coagulación intravascular diseminada (CID). Debe distinguirse de otras hemólisis no inmunes como: infusión de líquidos hipotónicos, ciertos fármacos o medicaciones administrados en la misma vía, toxinas bacterianas por contaminación del componente, temperatura anómala de los hematíes (sobrecalentamiento o congelación). Tratamiento: Ante la sospecha de un episodio hemolítico agudo, la transfusión debe ser interrumpida inmediatamente y notificada al banco de sangre o servicio de transfusión a través de un formulario pre-impreso que debe ser llenado en su totalidad por el médico asistente (Anexo 10.2) remitiendo los equipos, la unidad y muestras de sangre solicitadas para realizar análisis, comprobando a la vez que no existen más pacientes implicados en un probable error de identificación. La gravedad de la reacción suele ser proporcional al volumen de producto incompatible transfundido. El tratamiento debe instaurarse rápidamente y de manera agresiva con líquidos que prevengan la hipotensión para intentar impedir la falla renal. La perfusión renal debe ser monitorizada con control de diuresis, que se mantendrá mínimo de 100 ml./hora las primeras 18- 24 horas. Se puede utilizar furosemida, 1-2 mg./Kg. que además de diurético mejora el flujo por la corteza renal, si no hay respuesta se puede agregar Dopamina a dosis diurética y si a la una hora no hay respuesta es probable que se haya producido necrosis tubular y se requiera diálisis. Si se desarrolla CID se tratará con los hemocomponentes necesarios para compensarla. Reacción Febril no hemolítica: Se produce por la liberación de citoquinas de los leucocitos y plaquetas durante el almacenamiento o por la presencia de anticuerpos antileucocitarios en el plasma del receptor. Síntoma y signos: elevación de más de un grado en la temperatura durante o hasta 2 horas después de finalizada la transfusión. Es un diagnóstico de exclusión y debe ser muy bien evaluado porque la fiebre puede ser el inicio de reacciones más severas. Tratamiento: Administración de antipiréticos. La leucorreducción por filtración reduce la incidencia de esta complicación y está indicada en las transfusiones siguientes a la reacción. Reacción Alérgica: Se debe a la presencia en el producto transfundido de alguna sustancia a la cual es alérgico el receptor. Síntoma y signos: se manifiesta en forma de abones o ronchas, eritema, prurito y en los casos más graves puede presentar bronco espasmo, edema de glotis y shock. Tratamiento: La mayoría son leves, no se vuelven a producir y responden bien al tratamiento con antihistamínicos. En las reacciones severas y anafilácticas, la transfusión debe interrumpirse inmediatamente e iniciarse el tratamiento de soporte cardiorrespiratorio apropiado (que puede incluir: tratamiento vasopresor con adrenalina, corticoide, intubación, etc.). La mayoría de estas reacciones graves ocurren en pacientes con deficiencia de IgA que han generado anticuerpos Anti-IgA y en ellos la clínica comienza tras la transfusión de pequeñas cantidades de cualquier componente sanguíneo que contenga plasma. Si aparece esta complicación, para transfusiones posteriores se deben utilizar componentes celulares lavados con salino, para garantizar la ausencia de plasma. Cuando se requiera la transfusión de plasma se debe contemplar la posibilidad de transfundir plasma de donantes deficitarios en IgA. Si la urgencia no lo permite y se debe transfundir plasma con IgA, se debe instaurar el tratamiento preventivo correcto (con hidrocortisona, antihistamínicos y vigilancia constante para tratamiento inmediato con adrenalina si es preciso). Lesión Pulmonar aguda asociada con transfusión (TRALI) Se trata de un edema pulmonar no cardiogénico, producido por la presencia de anticuerpos del donante en el producto transfundido que reconocen los leucocitos del receptor. También se ha sugerido que lípidos activos (tipo factor activador de las plaquetas) generados durante el almacenamiento de los componentes celulares podrían desencadenar el cuadro en pacientes susceptibles. Síntomas y signos: presentan escalofríos, fiebre, cianosis, hipotensión, insuficiencia respiratoria; después de la transfusión de un volumen de componente sanguíneo que habitualmente no produce hipervolemia. La expresividad clínica del cuadro puede ser variable: desde una caída en la saturación de oxígeno de la sangre hasta un síndrome de pulmón blanco bilateral. La causa es un incremento en la permeabilidad de la microcirculación pulmonar que provoca la salida de líquido a los espacios alveolar e intersticial. Generalmente aparece entre 2 y 4 horas después de la transfusión. Tratamiento: Requiere tratamiento en unidad de cuidados intensivos con soporte respiratorio que puede incluir la intubación endotraqueal. Ante la sospecha de su aparición, debe informarse al servicio de transfusión para el estudio de los donantes implicados y la retirada inmediata de otros productos de los donantes sospechosos para evitar que sean transfundidos. Contaminación bacteriana Se trata de una complicación poco frecuente, pero de consecuencias potencialmente mortales. Se calcula que entre el 0,002 y el 1% de los concentrados de hematíes y el 0,4 y el 4% de los concentrados de plaquetas pueden estar contaminados con bacterias. En general los gérmenes Gram negativos se asocian a la contaminación de los concentrados de hematíes, mientras que los Gram positivos suelen ser los responsables de las sepsis producidas por los concentrados de plaquetas. Síntomas y signos: fiebre alta, escalofríos, hipotensión y shock durante o inmediatamente después de la transfusión. Tratamiento: Ante la sospecha de su aparición, debe interrumpirse inmediatamente la transfusión e iniciarse el adecuado tratamiento antibiótico y de soporte cardiovascular. Simultáneamente se iniciará el estudio microbiológico en las muestras de: producto transfundido, paciente, equipo de transfusión, etc. No debe olvidarse la notificación urgente al banco de sangre o servicio de transfusión con la finalidad de retirar y/o reclamar aquellos productos procedentes de la misma unidad. Sobrecarga circulatoria Existe el riesgo de provocar una sobrecarga con velocidades de transfusión superiores a 2-4 ml/Kg./hora, sobre todo en pacientes con anemia crónica (con volumen plasmático normal o aumentado) y en pacientes con funciones cardiacas o renales comprometidas. Síntomas y signos: disnea, hipertensión, insuficiencia cardiaca congestiva, etc. Tratamiento: La interrupción inmediata de la transfusión, además de tratamiento postural junto con la administración de oxígeno y diuréticos. En las siguientes transfusiones ésta se realizará lentamente o mediante alícuotas de una unidad. Hemólisis no inmune Hemólisis mecánica por ciertas válvulas cardiacas o circulación extracorpórea, la infusión de soluciones hipotónicas o determinadas medicaciones en la vía de transfusión, el calentamiento excesivo de los hematíes, contaminación bacteriana de la unidad de sangre, etc. No hay clínica asociada a esta hemólisis, salvo en el caso de la contaminación bacteriana, la primera manifestación suele ser la emisión de orinas obscuras, (hemoglobinuria), y la presencia de hemoglobinemia, que alertan de la posible hemólisis intravascular. Posteriormente se producirá un aumento de la bilirrubina sérica. Tratamiento: Parar inmediatamente la transfusión, investigar la causa de la hemólisis. El diagnóstico diferencial con las reacciones hemolíticas agudas de origen inmune debe quedar confirmado lo antes posible para instaurar el tratamiento urgente. Reacción hemolítica retardada La transfusión de hematíes puede inducir la formación de anticuerpos contra antígenos eritrocitarios después de días (respuesta anamnésica a una inmunización previa) o semanas (inmunización primaria) de la transfusión. El riesgo de sensibilización por cada unidad transfundida a antígenos eritrocitarios (exceptuando el antígeno Rh D) es entre 1-2%. La reacción de estos anticuerpos con los hematíes recientemente transfundidos puede producir una reacción hemolítica de carácter extravascular, que rara vez compromete la vida del paciente, o precisa tratamiento de soporte. Enfermedad del Injerto contra el Huésped post transfusional Se trata de una complicación, con una alta mortalidad causada por la transfusión de linfocitos T viables a paciente inmunocomprometidos o receptores que comparten algún haplotipo con el donante (familiar en primer o segundo grado). Los linfocitos transfundidos injertan y proliferan, atacando diversos órganos (piel, hígado y especialmente médula ósea) del receptor. Síntomas y signos: se inicia unos días después de la transfusión (entre 10 y 15 días) con fiebre, diarrea, erupción cutánea, alteraciones de la funcionalidad hepática y pancitopenia. Tratamiento: los tratamientos ensayados no son efectivos, por lo que la prevención en pacientes susceptibles es imprescindible. Esta se realiza mediante la transfusión de componentes celulares sometidos a irradiación gamma, a dosis no inferiores a 25 Gy. Inmunomodulación La transfusión de componentes sanguíneos puede originar una desregulación de la inmunidad celular que está relacionada en parte por la infusión de leucocitos y sus productos. Síntomas y signos: se presenta como un estado de hiporespuesta o inmunotolerancia que puede generar recidivas tumorales y predisposición a infecciones. Tratamiento: será preventivo, se preconiza la desleucocitación de los componentes sanguíneos a ser transfundidos. Transmisión de agentes infecciosos Esta complicación es la más temida por todos los prescriptores y receptores de la transfusión de sangre y componentes. En la prevención se han realizado grandes adelantos con la implementación de pruebas para el tamizaje de nuevos agentes infecciosos, además del mejoramiento en la sensibilidad y especificidad de los estudios. Sin embargo el riesgo cero de una transfusión sanguínea no ha podido ser alcanzado. Riesgo transfusional: Existen regiones en el país que aunque aisladas, no realizan el tamizaje serológico al 100% de las unidades a transfundir, esto hace que unido a la incidencia de transmisión con unidades estudiadas que caigan por ejemplo en periodo de ventana serológica se sume la transmisión por falta de tamizaje llevando a un alto nivel de inseguridad (Tabla 11). REFERENCIAS 1. Guidelines for transfusion of erythrocytes to neonates and premature infants: Fetus and Newborn Committee, Canadian Paediatric Society. CMAJ. 1992;147(12):1781-92. 2. OShaughnessy DF, Atterbury C, Bolton Maggs P, Murphy M, Thomas D, Yates S, et al. Guidelines for the use of fresh-frozen plasma, cryoprecipitate and cryosupernatant. Br J Haematol. 2004;126(1):11- 28. 3. British Committee for Standards in Haematology, Blood Transfusion Task Force. Guidelines for the use of platelet transfusions. Br J Haematol. 2003;122(1):10-23. 4. Hospital de Pediatría Prof. Dr. J. P. Garrahan. Servicio de Hemoterapia. Comité de Transfusión. Criterios para el uso de Concentrados Plaquetarios (CP). Buenos Aires: Hospital de Pediatría Prof. Dr. J. P.Garrahan; 2006. 5. Maier RF, Sonntag JS, Walka MM, Liu G, Metze BC, Obladen M. Changing practices of red blood cell transfusions in infants with birth weights less than 1000 g. J Pediatr. 2000;136:220-24. 6. Lin Y, Foltz L. Proposed Guidelines for Platelet Transfusion. BC Medical Journal. 2005;47(5):245-48. 7. University of Washington. Department of Neonatology. Transfusion Guidelines. Washington: University of Washington; 1999. 8. LSUHSC-S Medical Library [Base de Datos en Internet]. Transfusion reference guidelines: guidelines for the transfusion of blood products; 2003. Disponible en: http://lib-sh.lsuhsc.edu/ 9. American Association of Blood Banks (AABB). Blood Transfusion Therapy: a physicians handbook.7th ed. U.S.: AABB; 2002. 10. Rebulla P. Revisitation of the clinical indications for the transfusion of platelet concentrates. Rev Clin Exp Hematol. 2001;5(3):288-310. 11. Strauss RG. Prácticas de transfusión de eritrocitos en Recién Nacidos. Clínicas de Perinatología. 1995;32:601-15. 12. Ohls RK. Uso de eritropoyetina en recién nacidos. Clínicas de Perinatología. 2000;3:687-704. 13. Meyer MP, Sharman E, Carsons M. Recombinant erythropoietin and blood transfusion in seleed preterm infants. Ach Dis Child Fetal Neonatal Ed. 2003;88:F41-F45. 14. Ohls RK, Harcum J, Schibler KR. The effect of erythropoietin on the transfusion requeriments of preterm infants weighing 750 g or less: a randomized, double-blind, placebo-controlled study. J Pediatrics. 1997;131:661-65. 15. Diez Lobo AI. Medicina Transfusional Perioperatoria, Servicio de Anestesiología y Reanimación, Hospital General de Segovia. Madrid: Ergon; 2005. 16. Organización Panamericana de la Salud. Estándares de Trabajo para Servicios de Sangre. Washington: OPS; 2005. 17. Madero L. Manual de Hematología Pediátrica. Madrid: Ergon; 2006. 18. World Health Organization. The clinical use of blood. Handbook. Ginebra: WHO; 2003.