Introducción
En búsqueda de nuevas variedades ornamentales, en ocasiones se debe incluir a la flora silvestre para introducir nuevo material genético, además de que con ello se podría evitar la extinción de especies endémicas (Pizano de Márquez, 2001). La familia Euphorbiaceae es la sexta más diversa entre las Angiospermas, dentro de toda esta gama de especies se encuentra en México Euphorbia strigosa la cual se ha identificado como una especie con potencial ornamental, por su coloración y su porte pequeño (35 cm), se considera una versión enana de la nochebuena (Pérez-Nicolás, 2020; Hernández-Villa, 2016; Valdez-Hernández et al., 2018). Para estudiar en detalle esta especie, es necesario desarrollar sistemas de propagación que hagan posible disponer de material genético homogéneo y la micropropagación ha demostrado ser una herramienta útil para esta familia (Kondamudi et al., 2009). Existe un limitado número de trabajos con esta especie (Valdez-Hernández, 2010, Pérez-Nicolás, 2020; Hernández-Villa V., 2016; Valdez-Hernández, et al., 2017, Valdez-Hernández et al., 2018.). Para la germinación Valdez-Hernández et al., (2017), señalaron que existe una correlación entre el peso-color de semilla y el porcentaje de germinación, presentando mayor viabilidad aquellas con pesos mayores a 13 mg. Por lo que este estudio buscó bajo la técnica de cultivo in vitro, identificar alguna estrategia que favorezca la obtención de mayor número de plántulas a partir de semillas con menor peso, para inmediatamente después utilizarlas para protocolos de multiplicación, ya sea para mejoramiento o conservación. Esto debido a que al ser semillas de origen silvestre se debe optimizar el recurso, puesto que en las ocasiones en que se regresó a las zonas de colecta, estas fueron modificadas por actividades antropogénicas y no se localizaba la población o había sido podada antes de producir semilla, lo que limita aún más la obtención de los materiales; existe poca información sobre la especie y aun no se encuentra en algún listado que proteja o incentive su conservación. Por ello se ha planteado como objetivo evaluar diferentes estrategias para fomentar la mayor obtención de plántulas a partir de semillas de E. strigosa con bajo peso.
Materiales y métodos
El material biológico fue colectado en el estado de Nayarit, México. Los frutos colectados se mantuvieron a temperatura ambiente (25-35°C), después de la dehiscencia (liberación de semillas) las semillas se almacenaron en recipientes desechables de plástico con tapa de 20 ml de capacidad. Las semillas del año anterior se mantuvieron a una temperatura de 20°C y las de un mes a temperatura ambiente (20-25°C). El peso de semilla que se utilizó osciló entre los 8,1 a 13,0 mg, de color claro y textura semirugosa. El experimento se estableció en el medio de MS (Murashige y Skoog, 1962) al 50 % de su concentración, con 30 g.L-1 de sacarosa, los tratamientos con reguladores con excepcion de AG3 (esterilizadas con un filtro de 0,22 µm) y antioxidantes y se ajusto el pH a 5,7±1, se agregó agar-agar 5,5 g·L-1 posteriormente se virtió 15 mL del medio en tubo de ensayo posteriormente se introdujeron en el autoclave para esterilización durante 20 minutos a una temperatura de 121 °C y una presión de 1,1 a 1,2 kg/cm2. La desinfección de semilla se realizó según la técnica de Valdez-Hernández (2010), que consistió en: triple lavado con detergente biodegradable, remojo en agua estéril desionizada con 4 mg.L-1 de azul de metileno durante cinco minutos (en la cámara de siembra), posteriormente se enjuagaron con agua estéril, repitiendo este proceso en tres ocasiones, posteriormente se remojaron en alcohol al 70 % durante cinco minutos, nuevamente triple enjuague con agua estéril, remojo con 30 % de cloro comercial, con una gota de Tween 20®, durante 10 minutos y por último enjuague cinco veces con agua estéril, y se procedió a eliminar la testa de la semilla.
El diseño experimental fue de tipo factorial: factor uno (reguladores de crecimiento): R1:1 mg L-1 Benciladenina (BA), R2: 2 mg L-1 BA + 3 mg L-1 ácido indol-3-acético (AIA), R3: 1 mg L-1 giberelinas (AG3), R4: 3 mg L-1 AG3 y R5: sin reguladores. Factor dos (antioxidantes): A1: 60 mg L-1 cisteína + 50 mg L-1 ácido ascorbico + 50 mg L-1 ácido citrico y A2: 500 mg L-1 carbon activado, es de señalar que no se utilizó un tratamiento sin antioxidantes ya que en bioensayos anteriores los autores encontraron pérdida total de ejemplares por oxidación. Factor tres (edad de semilla o colecta): C1: un año de almacenamiento y C2: recién colectada. Factor cuatro (condiciones de luz): L1: luz blanca 13 000 lumen y L2: luz roja-800 nm (Tabla 1). Todos los tratamientos fueron sometidos a un fotoperido de 16:8, a temperatura promedio de 22 °C. Se plantearon 40 tratamientos con cinco repeticiones, cada unidad experimental constituida por un tubo de ensayo con una semilla. Las variables respuesta fueron: número de semillas contaminadas (presencia de hongos o bacterias), número de semillas oxidadas (presencia ausencia de necrosamiento) y número de semillas germinadas. Las variables fueron tomadas cada tres días a partir del día de la colocación de las semillas en el medio de cultivo y durante 30 días. Los datos obtenidos se analizaron con un análisis de varianza y una prueba de medias de Tukey con una probabilidad de 0,05 con el paquete estadístico SAS (Statistical Analysis System) versión 9.0 y finalmente un análisis descriptivo.
Tabla 1. Tratamientos evaluados para promover mayor germinación in vitro en semillas de bajo peso de Euphorbia strigosa.
| TRATAMIENTOS | REGULADORES DE CRECIMIENTO | ANTIOXIDANTE | EDAD DE SEMILLA | TIPO DE LUZ | TRATAMIENTOS | REGULADORES DE CRECIMIENTO | ANTIOXIDANTE | EDAD DE SEMILLA | TIPO DE LUZ |
|---|---|---|---|---|---|---|---|---|---|
| T1 (R1A1C1L1) | R1 | A1 | C1 | L1 | T21 (R1A1C1L2) | R1 | A1 | C1 | L2 |
| T2 (R2A1C1L1) | R2 | A1 | C1 | L1 | T22 (R2A1C1L2) | R2 | A1 | C1 | L2 |
| T3 (R3A1C1L1) | R3 | A1 | C1 | L1 | T23 (R3A1C1L2) | R3 | A1 | C1 | L2 |
| T4 (R4A1C1L1) | R4 | A1 | C1 | L1 | T24 (R4A1C1L2) | R4 | A1 | C1 | L2 |
| T5 (R5A1C1L1) | R5 | A1 | C1 | L1 | T25 (R5A1C1L2) | R5 | A1 | C1 | L2 |
| T6 (R1A2C1L1) | R1 | A2 | C1 | L1 | T26 (R1A2C1L2) | R1 | A2 | C1 | L2 |
| T7 (R2A2C1L1) | R2 | A2 | C1 | L1 | T27 (R2A2C1L2) | R2 | A2 | C1 | L2 |
| T8 (R3A2C1L1) | R3 | A2 | C1 | L1 | T28 (R3A2C1L2) | R3 | A2 | C1 | L2 |
| T9 (R4A2C1L1) | R4 | A2 | C1 | L1 | T29 (R4A2C1L2) | R4 | A2 | C1 | L2 |
| T10 (R5A2C1L1) | R5 | A2 | C1 | L1 | T30 (R5A2C1L2) | R5 | A2 | C1 | L2 |
| T11 (R1A1C2L1) | R1 | A1 | C2 | L1 | T31 (R1A1C2L2) | R1 | A1 | C2 | L2 |
| T12 (R2A1C2L1) | R2 | A1 | C2 | L1 | T32 (R2A1C2L2) | R2 | A1 | C2 | L2 |
| T13 (R3A1C2L1) | R3 | A1 | C2 | L1 | T33 (R3A1C2L2) | R3 | A1 | C2 | L2 |
| T14 (R4A1C2L1) | R4 | A1 | C2 | L1 | T34 (R4A1C2L2) | R4 | A1 | C2 | L2 |
| T15 (R5A1C2L1) | R5 | A1 | C2 | L1 | T35 (R5A1C2L2) | R5 | A1 | C2 | L2 |
| T16 (R1A2C2L1) | R1 | A2 | C2 | L1 | T36 (R1A2C2L2) | R1 | A2 | C2 | L2 |
| T17 (R2A2C2L1) | R2 | A2 | C2 | L1 | T37 (R2A2C2L2) | R2 | A2 | C2 | L2 |
| T18 (R3A2C2L1) | R3 | A2 | C2 | L1 | T38 (R3A2C2L2) | R3 | A2 | C2 | L2 |
| T19 (R4A2C2L1) | R4 | A2 | C2 | L1 | T39 (R4A2C2L2) | R4 | A2 | C2 | L2 |
| T20 (R5A2C2L1) | R5 | A2 | C2 | L1 | T40 (R5A2C2L2) | R5 | A2 | C2 | L2 |
R1: 1 mg L-1 BA; R2: 2 mg L-1 BA + 3 mg L-1 AIA: R3: 1 mg L-1 AG3; R4: 3 mg L-1 AG3 y R5: sin reguladores; A1: 60 mg L-1 cisteína + 50 mg L-1 ácido ascórbico + 50 mg L-1 ácido cítrico; A2: 500 mg L-1 carbón activado; C1: un año de almacenamiento; C2: recién colectada; L1: luz blanca 13 000 lumen y L2: luz roja-800 nm.
Resultados y discusión
En el presente trabajo se evaluó el efecto de reguladores de crecimiento, antioxidantes, edad de la semilla y condiciones de luz sobre la obtención de plántulas a partir de semillas de bajo peso de E. strigosa. Se evaluó el número de semillas contaminadas, oxidadas y germinadas, mediante el análisis estadístico de los datos obtenidos al día 30 no se identificaron diferencias significativas, entre los tratamientos realizados para ningún parámetro evaluados. Los resultados se presentan de forma descriptiva (Figura 1), para resaltar algunas de las observaciones en los tratamientos más representativos. Pese a que no se observó un incremento en la obtención de plántulas comparado con lo reportado por Valdez-Hernández et al. (2017) con la germinación tradicional en turba-perlita, ya que estos autores reportaron porcentajes de germinación de 50,2 % con semillas del mismo peso, 37,7 % en las almacenadas por un año, 46,6 % en recién cosechada y 30,5 % con el mismo color. Estos resultados constituyen la base para posteriores trabajos en los cuales se aborden metodologías de multiplicación in vitro en esta especie.
Los tratamientos que mayor porcentaje de contaminación presentaron, fueron principalmente y no únicamente los que contenían giberelinas, las cuales son adicionadas una vez que el medio es esterilizado por medio de filtros, lo que convierte a los medios más susceptibles a contaminación, ya que este regulador es termosensible no se recomienda ser sometido al proceso de esterilizado tradicional en autoclave. Los tratamientos T14 (R4A1C2L1), T15 (R5A1C2L1), T34 (R4A1C2L2), T35 (R5A1C2L2) presentaron un porcentaje de contaminación del 100 %, T30 (R5A2C1L2) del 60 %, T28 (R3A2C1L2), del 40 % y T9 (R4A2C1L1), T11 (R1A1C2L1) con el 20 %. La contaminación se estableció con la presencia de hongos y/o bacterias, los cuales no fueron sometidos a identificación patológica. En cuanto a los factores antioxidantes, año de cosecha y luz, no se observó una tendencia de la contaminación, ya que se presentó indistintamente (Figura 1).
No se observó oxidación en ninguno de los tratamientos, por lo que ambos tratamientos con antioxidantes pueden ser utilizada para otros experimentos, como se mencionó anteriormente tanto los autores en bioensayos anteriores como Valdez-Hernández (2010), observaron presencia de oxidación a los pocos días de emergencia, por lo que se recomienda el uso de alguno de éstos para evitar perdida de materiales.
Las semillas germinaron en nueve de los cuarenta tratamientos, la mayor germinación, se presentó en el tratamiento T9 (R4A2C1L1) con 5 %, mientras que en T1 (R1A1C1L1), T6 (R1A2C1L1), T10 (R5A2C1L1), T11 (R1A1C2L1), T26 (R1A2C1L2), T32 (R2A1C2L2), T36 (R1A2C2L2) y T37 (R2A2C2L2) fue del 2,5 %. El agregado de AG3 a una concentración de 3 mg L-1 estimuló la germinación en semillas con un año de almacenamiento, lo cual coincide con los resultados encontrados en la literatura en los cuales se han encontrado que las giberelinas promueven la germinación en Punica granatum y Cordia elaeagnoidesSantacruz Ruvalcaba et al., 2018; Takata et al., 2014 o mejora en porcentajes de germinación en comparación con otros reguladores (Rau et al., 2021). En los tratamientos T32 y T37 con 1 mg L-1 de benciladenina germinaron a los nueve días con un 2,5 % de germinación cada uno, contrario a lo observado por Rau et al. (2021), en este trabajo la BA tuvo un efecto positivo para la germinación de Euphorbia strigosa.
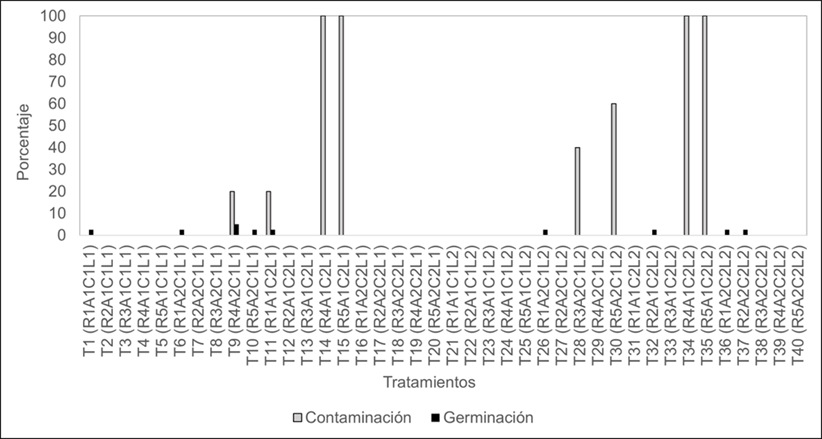
Figura 1. Porcentaje de contaminación y germinación en semillas de Euphorbia strigosa Hook and Arn, establecidas en 40 tratamientos in vitro a los 30 días.
Es de mencionar que los tratamientos con giberelinas las semillas desarrollaron hipocótilo y comenzaron a formar el epicótilo con las primeras hojas verdaderas en comparación con los tratamientos con benciladenina en donde la semilla solo emitió la radícula y abrió los cotiledones, lo cual difiere con lo reportado por (Cázarez Prado (2013) en su estudio de cultivo in vitro de E. strigosa en donde los tratamientos con benciladenina no presentaron efecto alguno. En el caso de los tratamientos sin reguladores de crecimiento no emitieron estructuras verdaderas (Figura 2). Se presentó mayor porcentaje de germinación en las semillas con un año de almacenamiento (C1) sin embargo, la diferencia fue mínima, en promedio 5 y de 2,5 % de germinación en semillas colectadas el mismo año. El bajo porcentaje de germinación puede atribuirse entre otras razones al tipo de semilla, Walters (2004) citado por Bernárdez-Mendoza (2014) menciona la clasificación de las semillas como ortodoxas y recalcitrantes, así como que hay semillas que se consideran medianamente ortodoxas mientras que otras son totalmente ortodoxas Bernárdez-Mendoza (2014) reportó que las semillas de E. strigosa no toleran almacenamientos en periodos de tiempo largos y propone que las semillas de esta especie son del tipo recalcitrantes. Por otro lado, Valdez-Hernández et al. (2017) señalan que presentan características de ortodoxas, como otras Euphorbias, ya que, aunque disminuyó el porcentaje de germinación con el tiempo, aún fue viable en las condiciones de almacenamiento a la que fue sometida y bajo las condiciones de germinación establecidas. Sin embargo, aquí la pérdida de materiales por contaminación pudo de igual manera eliminar a plantas con viabilidad, pero que al presentar contaminación fueron eliminadas, ya que lo que se buscaba era tener material inocuo. Por lo que la recomendación, seria buscar la estrategia de mejorar la técnica de lavado para garantizar la mínima perdida de material por contaminación, para garantizar evaluar el efecto de los factores que inciden en la germinación.

Figura 2. Desarrollo de plántulas de Euphorbia strigosa, 30 días después de la siembra, a) radícula de semilla puesta sin reguladores de crecimiento; b1 y b2) Plántulas desarrolladas con desorden de polaridad, puestas en 1 mg L-1 de AG3 y c) plántula con hipocótilo elongado y pigmentado en 3 mg L-1 de AG3.
En lo que respecta a las condiciones de luz, la germinación se presentó de igual en ambas condiciones, pero es de resaltar que bajo condiciones de luz roja no se desarrollaron estructuras de la planta, solo emergió la raíz y se dio la apertura de los cotiledones, contrario a las semillas que germinaron bajo luz blanca en donde se llegó a desarrollar hasta primeras hojas verdaderas. Cabe mencionar que las semillas germinaron en un menor tiempo, 5 a 7 días, en condiciones de luz blanca mientras que bajo luz roja germinaron a los 9 y 11 días después de establecidas. Aunque no fue mucha la diferencia entre condiciones de luz hubo mejor respuesta en luz blanca.
Conclusiones
Ninguno de los tratamientos favoreció el aumento en porcentaje de germinación, a pesar de que , se observó que la aplicación de giberelinas en el medio favoreció la formación de estructuras como hipocótilo y primeras hojas verdaderas, se deben mejorar los protocolos para disminuir la contaminación, para garantizar evaluar el efecto de los factores, ya que en este estudio al observarse bajos porcentajes de germinación, no se puede generalizar el efecto de éstos sobre la germinación de la especie.Tanto el carbón activado como la combinación de ácido cítrico, cisteína y ácido ascórbico demostraron ser una efectiva fuente de antioxidantes. La edad de la semilla no influyó en la germinación y condiciones de luz roja afecto negativamente en el desarrollo de las pocas plántulas obtenidas.












 uBio
uBio 


