Introducción
La soja (Glycine max (L.) Merril) es actualmente el rubro de mayor importancia del Paraguay, para la zafra 2021/2022 se registró un área de siembra de más de 3 millones de hectáreas, con una producción de más de 9 millones de toneladas (Cámara Paraguaya de Exportadores y Comercializadores de Cereales y Oleaginosas (CAPECO), 2022). En Paraguay, este cultivo genera ingresos de más de USD 3.000 millones, los cuales constituyen aproximadamente el 17 % del producto interno bruto (PIB) y 55,6 % de las exportaciones (Banco Central del Paraguay (BCP), 2022), además que una disminución del 15 % de las exportaciones del complejo soja, provocaría una caída del PIB en 1,04 %.(Carosini Ruiz Diaz et al., 2020; Morínigo Aguayo et al., 2018). En este contexto, el conocimiento de los patógenos que afectan a los campos de cultivo de soja es fundamental, ya que cualquier patógeno que afecte la producción podría tener un impacto directo en la economía del país.
Entre estos patógenos, los nematodos están clasificados como fitoparásitos muy importantes a nivel mundial, ya que pueden ocasionar pérdidas en la productividad y rentabilidad del cultivo de soja (Machado et al., 2019a). Los factores edafoclimáticos relativos a la estructura de las comunidades de nematodos como la humedad (40-80 %), la temperatura (15-30 °C) y el pH (5-7) son fundamentales para el crecimiento de las poblaciones (Griffiths et al., 2003). Los nematodos parásitos mayormente asociados a la soja son, el nematodo de la agalla (Meloidogyne spp.), Pratylenchus brachyurus, el nematodo del quiste de la soja (Heterodera glycines) y el nematodo reniforme (Rotylenchulus reniformis) (Empresa Brasileira de Pesquisa Agropecuária (EMBRAPA), 2013; Machado et al., 2019b), sin embargo, otros nematodos, como Helicotylenchus, Scutellonema y Tylenchorhynchus son considerados como potenciales patógenos para la soja (Machado, 2014). Los dos primeros han sido reportados en varias zonas productoras de maíz y pueden adaptarse a cultivos anuales en sistemas de monocultivos (Lopes, 2015; Taylor, 1960; Niblack, 1992). En los años 90 se señalaba que la soja es un huésped de Helicotylenchus y que su elevada cantidad tiene el potencial de ser dañina para otros cultivos como el maíz (Niblack, 1992). En los últimos años, la presencia de estos nematodos ha aumentado en las plantaciones de soja, convirtiéndose en posibles patógenos de la soja y otros cultivos del sistema productivo de la soja (Favoreto et al., 2019).
La presencia y abundancia de nematodos en el suelo se puede medir a través de la determinación del factor reproductivo (FR = población final (Pf) / población inicial (Pi)), resulta ser un método aplicable. Una planta huésped se considera apta para los nematodos fitoparásitos cuando el nematodo puede multiplicarse en ella, y así, la idoneidad de un huésped se determina mediante el FR, por consiguiente, permite determinar la resistencia o susceptibilidad de un hospedero específico a un nematodo específico (Anwar & McKenry, 2010). De esta manera, un FR > 1 indica que el huésped permitió la reproducción del nematodo en cuestión. Un FR < 1 indicaría que el cultivo no es un huésped adecuado o que el manejo o tratamiento implementado redujo la población del nematodo al final de la temporada.
De acuerdo con lo anteriormente expuesto, especies de nematodos que anteriormente eran de segunda importancia han aumentado su potencial de convertirse en patógenos de la soja debido al incremento de su reproducción. Esto está ligado a la falta de manejo de estos nematodos como también, debido a la poca información relacionada a la reproducción de estos nematodos en la soja. El objetivo del trabajo fue determinar la reproducción mediante el factor reproductivo de Helicotylenchus, Scutellonema y Tylenchorhynchus en el cultivo de soja.
Materiales y métodos
Muestreo de suelo
La presente investigación se realizó en parcelas de producción de soja en fincas de agricultores, parcela comercial (PC). Estas se encuentran en los distritos de Jesús (PC 1, 53 ha), Bella Vista (PC 2, 104 ha) e Itapúa Poty (PC 4, 58 ha), localidades del departamento de Itapúa, y en el distrito de Curuguaty (PC 3, 168 ha), departamento de Canindeyú. Las variedades cultivadas fueron Soja Var. DM 62R63 (Jesús), Soja Var. DM 62R63R (Bella Vista), Soja Var. Great 5R47 (Itapúa Poty) y Soja - Nidera (Curuguaty).
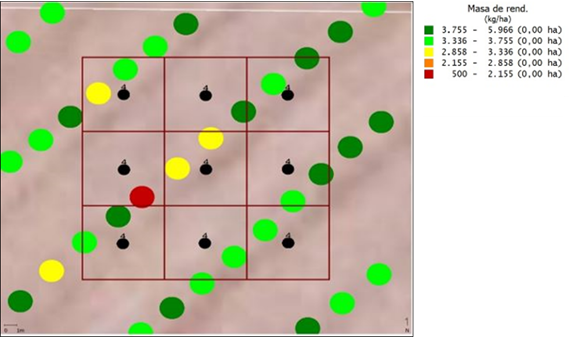
Durante el mes de octubre de 2020, al momento de la siembra, sobre los mapas de cosecha de cada PC fueron distribuidos 10 puntos de muestreo georreferenciados (Figura 1), en celdas de muestreo de 400 m2 (20 m × 20 m), cada una con 9 submuestras ubicadas en forma equidistante dentro de la celda de muestreo (Figura 2), tomadas con un calador de suelo a profundidades de 0-20 cm (López-Nicora et al., 2021), lo que resultó en la recolección de un total de 40 muestras de suelo durante la siembra (población inicial de nematodos). Durante el año 2021, al momento de la cosecha, otras 40 muestras (población final de nematodos) fueron recolectadas dentro de las mismas celdas de muestreo.
Luego, las muestras se colocaron en bolsas plásticas con las etiquetas correspondientes y se trasladaron a la Clínica Vegetal de la Universidad San Carlos, localizada en la ciudad de Asunción. Allí se almacenaron en un refrigerador a 4 °C hasta el momento de su procesamiento.

Figura 1. Zonas afectadas por nematodos PC 2 (A). Puntos de muestreo PC 1, PC 4, PC 2 (B, C, D). Muestreo con calador de suelo (E). Muestras listas para envío (F).
Extracción, identificación y cuantificación de nematodos
Para el procesamiento de las muestras, cada muestra de suelo fue homogeneizada, rompiendo manualmente los terrones de tierra aglomerados, mezclando uniformemente hasta obtener una mezcla homogénea. Posteriormente, la extracción de los nematodos fue realizada a partir de 100 cm3 de suelo por medio de la técnica de flotación-centrifugación adaptada de Jenkins (1964).
Para determinar la población inicial y final de nematodos (nematodos/cm3 de suelo), los mismos fueron identificados a nivel de género y cuantificados con un microscopio invertido (Olympus CKX53, Tokio, Japón) a 40× de magnificación.
Se determinó el factor reproductivo de los géneros Helicotylenchus, Scutellonema y Tylenchorhynchus, mediante la fórmula de Oostenbrink (1966):
Análisis de datos
La prueba de t Student de una cola con un nivel de significancia al 5 %, en donde se estableció la hipótesis, donde H ≤ 1 y Ha > 1 para determinar si existe una diferencia significativa entre las medias del FR. Para realizar la prueba de t se utilizó el software R versión 1.2.1335 (RStudio Team, 2018). Para datos del factor reproductivo, se aplicó una transformación log(x+1), para estabilizar la varianza y generar una distribución normal. A partir de todos estos datos, el software devolvió un valor P el cual fue comparado con el nivel de significancia.
Resultados
En cuanto a las poblaciones del nematodo Helicotylenchus en las diferentes zonas de cultivo de soja evaluadas, se registró tanto la población inicial (Pi) como la población final (Pf) de nematodos en cada zona. En promedio, se encontró que la Pi osciló entre 25 y 138 nematodos/cm3, mientras que la Pf osciló entre 0 y 301 nematodos/cm3. Estos resultados sugieren que las poblaciones de nematodos son altamente variables entre las diferentes zonas de cultivo analizados.
Como indica la Figura 3.A, la mayoría de las poblaciones de nematodos experimentaron un aumento significativo en su factor reproductivo, lo que indica una alta tasa de reproducción de estas poblaciones. En particular, los mayores valores de FR fueron registrados en las zonas de Bella Vista y Curuguaty, con un promedio de 4,6 y 4,1, respectivamente. Por otro lado, las poblaciones de la zona de Itapúa Poty registraron en promedio un FR más bajo de 1,8.
En Curuguaty e Itapúa Poty un aumento significativo en el FR de Helicotylenchus. El FR en las localidades de Jesús y Bella Vista no fue significativamente mayor a 1 en las poblaciones de Helicotylenchus, por lo que no se rechaza la hipótesis nula (Ho ≤ 1).
En lo referente a las poblaciones de Scutellonema en tres localidades diferentes, se observó una amplia variabilidad en las poblaciones iniciales y finales de nematodos en cada localidad, con un rango de 4 a 1250 nematodos/cm3 y de 30 a 380 nematodos/cm3, respectivamente. El promedio de la población inicial fue de 215 nematodos/cm3, mientras que el promedio de la población final fue de 763 nematodos/cm3. En cuanto a la tasa de reproducción, se registró una variabilidad significativa entre las localidades, con valores que oscilaron entre 0,85 y 14,05.
En las localidades de Jesús, Bella Vista e Itapúa Poty se observaron significativos aumentos en la tasa de reproducción (P < 0,05). Por otra parte, en Curuguaty no se identificó la presencia de Scutellonema (Figura 3.B).
Las poblaciones iniciales de Tylenchorhynchus, en Bella Vista, variaron entre 6 y 68 nematodos/cm3, con un promedio de 21 nematodos/cm3, mientras que en Curuguaty se reportaron valores de entre 4 y 602 nematodos/cm3, con una media de 129 nematodos/cm3. En cuanto a las poblaciones finales, valores máximos de 320 y 350 nematodos/cm3 fueron exhibidos en Bella Vista y Curuguaty, respectivamente. Ambas localidades registraron una población final media de 112 nematodos/cm3, en Bella Vista y 120 nematodos/cm3, en Curuguaty.
Los resultados apuntan que en ambas localidades se observó una reproducción significativa de la especie Tylenchorhynchus, con un factor de reproducción que osciló entre 5 y 38 en promedio.
En las localidades de Bella Vista y Curuguaty se observó un P < 0,05 (Figura 3.C), indicando que los nematodos se están reproduciendo en dichas localidades. No obstante, en Jesús, solo se detectó en un punto la presencia de Tylenchorhynchus y en Curuguaty no se detectó la presencia de este nematodo.
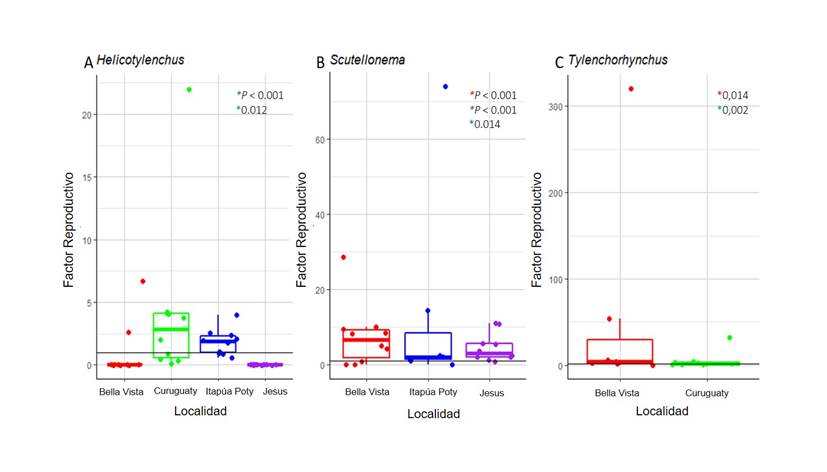
Figura 3. Factor reproductivo de nematodos fitoparásitos en parcelas comerciales de soja evaluadas en Paraguay. A. Género Helicotylenchus. B. Género Scutellonema C. Género Tylenchorhynchus. Línea (negra) horizontal representa factor reproductivo igual a uno. Las cajas representas la distribución de los datos del FR. La barra entre las cajas representa el promedio de los datos. En los asteriscos se observan los valores de P obtenidos en la prueba de t.
Discusión
Los resultados obtenidos indican la reproducción de los nematodos Helicotylenchus, Scutellonema y Tylenchorhynchus en campos de soja de las parcelas comerciales evaluadas. En áreas productoras de soja en Carolina del Sur (Estados Unidos), se observó que Helicotylenchus y Scutellonema fueron los géneros más frecuentes en el 70 % de las muestras, mientras que Tylenchorhynchus estuvo presente en el 40 % de las muestras (Lewis et al., 1993). En zonas de producción de soja de Sudáfrica, se reportó la presencia de H. dihystera y S. brachyurus en el 78 y 71 % de las muestras, respectivamente (Fourie et al., 2001). En campos de producción de soja orgánica en Minnesota, se detectó la presencia de Helicotylenchus en el 42 % de las muestras y Tylenchorhynchus en el 9 % de las muestras (Chen et al., 2012). En Mato Grosso (Brasil), se encontró la presencia de H. dihystera en el 92 % de las 3.000 muestras analizadas (Fundação Rio Verde, 2014). Además, esta especie fue detectada en el 78 % de las muestras recolectadas en campos de soja en el estado de Rio Grande do Sul, en el 47 % de las muestras recolectadas en el estado de Goiás y en el 59 % de las muestras recolectadas en el estado de Paraná. (Silva, 2007, Baida et al., 2015a, Kirsch et al., 2016).
El género Scutellonema fue reportado en diversas regiones de los estados de Paraná, Mato Grosso do Sul y Maranhão, Brasil, con densidades poblacionales superiores a 5.000 por 100 cm3 de suelo y aún mayores en 10 g de raíces (Maceda et al., 2009). Específicamente en el Estado de Paraná, Scutellonema fue identificado en el 23 % de las muestras colectadas en campos de soja (Baida et al., 2015b). Se han descubierto nuevas especies del género Tylenchorhynchus en cultivos importantes de EE.UU. y España, lo que demuestra una gran diversidad en este género. Sin embargo, la identificación precisa de estas especies es difícil (Handoo et al., 2014). Ya en la década de 1980, en campos de soja en Egipto, se registró la presencia del nematodo Tylenchorhynchus clarus y se realizaron experimentos para controlarlo químicamente (Aboul-Eid & Osman; 1981). En la década de 1990, se reportó la presencia de que Tylenchorhynchus en el 62 % de los campos de soja en Carolina del Norte, EE.UU. (Koenning & Barker, 1998). En Paraguay, el nematodo Helicotylenchus ya ha sido observado en varias fincas de producciones de soja en los departamentos de Itapúa y Canindeyú, de igual manera la presencia de Scutellonema (453 especímenes/cm3) se ha detectado en zonas productoras de soja, en el distrito de Bella Vista. (Pedrozo, 2008).
Helicotylenchus se reprodujo en las parcelas evaluadas de Curuguaty e Itapúa Poty. Esto coincide con (Norton (1977) quien realizó un experimento en invernadero y determinó la susceptibilidad de la soja a H. pseudorobustus observando que en la mayoría de los cultivares de soja hubo FR superior a 1. Yan et al., (2017) inocularon en condiciones de invernadero dos cultivares de soja, Sheyenne y Barnes, y encontraron que la densidad poblacional de nematodos, determinada vía FR, fue incrementada. Así mismo, Neto (2019) identificó a H. dihystera en suelos de cultivos de soja y comprobó que se reproducen, obteniendo un FR de 1,41 de media. Los resultados de Machado et al. (2019a) mostraron que H. dihystera se multiplica en soja cv. Potência con un FR de 2,33, similar a la hallada en el distrito de Itapuá Poty. Estos autores también observaron lesiones radiculares, considerando a este nematodo como un patógeno potencial para la soja. Por último, Gardiano-Link et al., (2022), reportaron un FR mayor a 1 en varios experimentos sobre el manejo de estos nematodos.
En el caso del género Scutellonema, se concluye que el mismo se reproduce en campos de soja en todas las parcelas comerciales donde fue identificado. Esto coincide con Machado et al. (2019a) quienes en su experimento en un invernadero comprobaron que Scutellonema se multiplicó y causó lesiones en las raíces. Además, Scutellonema es considerado como un patógeno potencial para la soja, por su propagación en las regiones productoras de soja y el incremento en las densidades de las poblaciones (Lima et al. 2009; Machado et al., 2019b). En un experimento similar, Machado et al. (2015b) evaluaron el FR de plantas de soja cv. TMG115RR, en las cuales S. brachyurus fue capaz de reproducirse tanto en el suelo como en la raíz, con un FR de 2,77 generando lesiones en las raíces, similares a las que produce P. brachyurus. Asimismo, Soares & Santos (2009) en un experimento realizado en invernadero evaluaron la resistencia de cultivares de soja convencionales y transgénicas, obteniendo un FR > 1 en cuatro cultivares, a los cuales consideró susceptibles a Scutellonema. Finalmente, Kraus & Lewis (1979) demostraron que la soja es un buen hospedero con un FR de 3,7, para el nematodo Scutellonema y Germani (1981) evidenció la patogenicidad de S. cavenessi, al demostrar que reducía el crecimiento temprano de la soja y que las raíces mostraban síntomas de necrosis.
En cuanto a Tylenchorhynchus, este se reprodujo en Bella Vista y Curuguaty. Esto coincide con Yan et al., (2018), quienes en un experimento en invernadero y en muestras de suelo que contenían 600 nematodos por kg de planta de la variedad Sheyenne, registraron un FR de 3,26, por lo que se determinó que Tylenchorhynchus es capaz de infectar a la soja. Coincidentemente el FR promedio reportado en el distrito de Curuguaty fue de 5,2. Igualmente, Venditti & Noel (1994) en un experimento en invernadero en el que inocularon 5000 nematodos a plantas de Glycine max cv. Bragg (soja), la población de T. zambiensis aumentó y lo consideraron como un buen hospedero con un FR que rondó entre 10,1 y 20.
Como se ha observado Helicotylenchus, Scutellonema y Tylenchorhynchus son nematodos que en los últimos años han tenido un incremento de sus poblaciones y frecuencias en las zonas de cultivo de soja, además de tener la capacidad de producir lesiones en la raíz. De acuerdo a Machado et al. (2019a) esto puede deberse a la plasticidad de los nematodos, ya que estos habrían desarrollado un hábito endoparásito migratorio con el objetivo de adaptarse a los sistemas de cultivo impuestos por la agricultura intensificada. La presencia tanto de Helicotylenchus, Scutellonema y Tylenchorhynchus ya se ha reportado en las mayores zonas de soja del país (Pedrozo, 2008), por lo que estos nematodos pueden representar un peligro para los campos de soja.
Es oportuno destacar que en los distritos de Jesús y Bella Vista se han utilizado la misma variedad y afrontan condiciones climáticas similares. El empleo de estas variedades ha suscitado una posible susceptibilidad frente a determinados tipos de nematodos, lo que amerita que se proceda a verificaciones adicionales en futuras investigaciones, que aborden específicamente los factores climáticos y edafoclimáticos en relación con los nematodos en los suelos de cultivo de soja, así como las pruebas de patogenicidad.
Conclusiones
Los géneros Helicotylenchus, Scutellonema y Tylenchorhynchus fueron identificados en diferentes parcelas comerciales en los departamentos de Itapúa y Canindeyú, con valores de FR que indican la capacidad de estos nematodos para reproducirse. Es necesario seguir monitoreando la presencia de nematodos en campos de soja, con la finalidad de determinar los daños que puedan ocasionar, así como también para establecer prácticas de manejo de nematodos con el objetivo de reducir su impacto en la producción de soja. De igual forma, se recomienda efectuar análisis profundos del material genético de la planta y su potencial de resistencia frente a estos organismos patógenos.












 uBio
uBio