Introducción
La salinidad del suelo es un problema mundial cada vez más grave, ya que la sal dificulta el crecimiento y desarrollo de las plantas y reduce el rendimiento de los cultivos (Lamz Piedra y González Cepero, 2013; Casierra-Posada et al., 2013). Además de la salinidad natural del suelo, ésta aumenta como resultado de las prácticas de riego y el cambio climático (Van Zelm et al., 2020; Zhu, 2001; Parihar et al., 2014). La mayoría de las especies cultivadas son sensibles a la salinidad en todas las etapas del desarrollo de la planta, siendo la germinación y el crecimiento temprano de las plántulas las más vulnerables (Liedl et al., 2013; Yurtseven et al., 2005; Hajiboland et al., 2010); debido a que se absorben iones potencialmente tóxicos, lo cual genera la disminución en la asimilación del agua, ocasionando que el proceso germinativo se retrase (Kaveh et al. 2011). A nivel de raíces, éstas alcanzan una menor longitud de modo que el volumen de suelo que pueden explorar es menor (Goykovic Cortés y Saavedra del Real, 2007). De acuerdo con cada fase de crecimiento y variedad de tomate la sensibilidad de la salinidad varía (Aini et al., 2012).
En la mayoría de los genotipos de tomate se presenta una reducción de la germinación y el crecimiento debido al estrés salino, sin embargo, algunos genotipos silvestres se desarrollan bien en esta condición (Tahir et al., 2018). Las sales en el exterior de las raíces tienen un efecto inmediato sobre el crecimiento celular y el metabolismo asociado (Munns y Tester, 2008); las plantas en general sufren estrés osmótico debido a las sales acumuladas en el exterior de las raíces y estrés iónico en el interior de las células de la planta (Horie et al., 2012).
Debido a que el NaCl es la sal más soluble y presente en los suelos, no es sorprendente que todas las plantas hayan evolucionado y desarrollado mecanismos como el ajuste osmótico y la homeostasis iónica para regular su acumulación a favor de otros minerales comúnmente presentes en bajas concentraciones, como K+ y NO3- (Lamz Piedra y González Cepero, 2013). En la mayoría de las plantas, las raíces son capaces de excluir eficazmente los iones Na+ y Cl- del agua absorbida del suelo (Munns, 2005).
Se han detectado varias especies del género Solanum con tolerancia a salinidad, incluyendo a Solanum lycopersicum L., lo que demuestra que es posible detectar germoplasma de interés en la especie cultivada. Se han identificado recursos genéticos tolerantes a salinidad en especies de tomate silvestres (Solanum chilense, S. peruvianum, S. pennellii, S. cheesmanii y S. pimpinellifolium) y en cultivares de S. lycopersicum (Foolad et al., 1999; Liedl et al., 2013). Estos resultados dan cuenta de la existencia de variabilidad genética en tomate y por tanto de la existencia de germoplasma que podría ser importante para el mejoramiento genético de tolerancia a estrés salino, especialmente en aquellas especies silvestres que presenten compatibilidad genética con los cultivares comerciales, como S. pimpinellifolium y S. pennellii (Goykovic Cortés y Saavedra del Real, 2007). Es por ello por lo que las especies silvestres son una fuente importante de genes de interés agronómico, como resistencia a factores bióticos y abióticos, base para el mejoramiento genético de la especie cultivada (Flores-Hernández et al., 2017). El aumento de la tolerancia a estrés salino requiere nuevas fuentes genéticas de esta tolerancia y técnicas más eficientes para identificar el germoplasma tolerante (Munns, 2005). El objetivo de esta investigación es el de identificar plantas tolerantes a salinidad a partir de colectas de tomate silvestres, con la finalidad de poder utilizar estas líneas en programas de mejoramiento genético.
Materiales y Métodos
La investigación se realizó en las instalaciones de la Universidad Autónoma Chapingo (UACh), México (19°29'LN, 98°53'LO y 2240 msnm). Las pruebas de tolerancia a salinidad durante la germinación se realizaron en el laboratorio de semillas del Departamento de Fitotecnia, mientras que las pruebas de tolerancia a salinidad en plántula se llevaron a cabo en el invernadero del Programa de Mejoramiento Genético de Tomate, durante 2018 y 2019.
Material vegetal
Para la obtención de líneas y material vegetal (semillas), durante 2017 se llevó a cabo un ciclo de cultivo de 120 colectas de material silvestre, 55 provienen de la colección de semillas que tiene el programa de mejoramiento genético de tomate del Instituto de Horticultura de la UACh y 65 provienen de la colección del Dr. Ricardo Lobato Ortiz del Colegio de Posgraduados, las cuales fueron cultivadas en un invernadero tipo “full vent” de nivel tecnológico medio, con cubierta de polietileno calibre 600 con transmisión de luz de 70 %, y ventilación frontal, lateral y superior protegida por malla antiáfidos, ubicado en la UACh (19°29'LN 98°53'LO; 2240 msnm); con temperatura media anual de 15,9 °C.
Pruebas de tolerancia a la salinidad durante la germinación
Para los tratamientos con sales en germinación se seleccionaron 96 líneas (Tabla 1).
Tabla 1. Líneas de tomate silvestres utilizadas en pruebas de tolerancia a salinidad en etapa de germinación. Todas pertenecientes a Solanum lycopersicum L., originarias de distintos estados de México, el origen de cada línea se refiere al indicador dado a las líneas madre en las colecciones de donde proceden.
| Línea | Origen | Línea | Origen | Línea | Origen |
|---|---|---|---|---|---|
| 1 | Cereza 4 sin acido | 24 | LOR 85 | 51 | LOR 113 |
| 2 | Totonaca 2(2016) | 25 | LOR 86 | 53 | LOR 115 |
| 6 | Arriñonado 6 sin acido | 26 | LOR 87 | 54 | LOR 116 |
| 7 | Silvestre Pancho (2016) | 27 | LOR 88 | 56 | LOR 118 |
| 8 | Claudia 2017 | 31 | LOR 92 | 57 | LOR 119 |
| 10 | Huasave, Dr. Mascorro | 32 | LOR 93 | 58 | LOR 120 |
| 11 | TomatilloMpio. Tecpan de Galiana | 33 | LOR 94 | 59 | LOR 121 |
| 12 | Ixhuatlan de Madero, Veracruz (2016) | 35 | LOR 97 | 60 | LOR 122 |
| 13 | Silvestre Oaxaca, Mercado (2016) | 36 | LOR 98 | 61 | LOR 123 |
| 15 | Arriñonado Chignahuapan, Puebla | 38 | LOR 100 | 62 | LOR 124 |
| 16 | LOR 77 | 39 | LOR 101 | 64 | LOR 128 |
| 17 | LOR 78 | 40 | LOR 102 | 65 | LOR 129 |
| 18 | LOR 79 | 41 | LOR 103 | 66 | LOR 130 |
| 19 | LOR 80 | 42 | LOR 104 | 67 | LOR 131 |
| 21 | LOR 82 | 46 | LOR 108 | 68 | LOR 132 |
| 22 | LOR 83 | 50 | LOR 112 | 69 | LOR 133 |
| 70 | LOR 134 | 96 | J106 | 113 | CM-37 |
| 71 | LOR 135 | 97 | CM-46 | 114 | C1-47 |
| 72 | LOR 136 | 98 | CM-35 | 115 | CM-19 |
| 74 | LOR 137 | 99 | CM-45 | 116 | C1-89 |
| 75 | LOR 140 | 101 | CM-31 | 117 | CM-4 |
| 76 | LOR 141 | 102 | C2-G5 | 118 | CM-83 |
| 77 | LOR 142 | 103 | CM-16 | 119 | C1-43 |
| 79 | LOR 144 | 104 | CM-44 | 120 | C2-1 |
| 80 | LOR 145 | 105 | C1-G80 | ||
| 81 | LOR 149 | 106 | CM-21 | ||
| 82 | LOR 146 | 107 | CM-34 | ||
| 83 | LOR 147 | 108 | C1-G20 | ||
| 84 | LOR 148 | 109 | C1-32 | ||
| 85 | Chichón | 110 | CM-23 | ||
| 86 | CM-1 | 111 | CM-29 | ||
| 87 | CM-5 | 112 | CM-49 |
Para determinar la tolerancia de las líneas de tomates silvestres se realizó una prueba de germinación durante 20 días en una cámara de germinación con oscuridad constante y temperatura de 27±1°C, donde fueron sembradas 25 semillas por línea en cajas Petri de 6 cm de diámetro, sobre papel filtro como sustrato, probando las semillas en condiciones salinas a una concentración de 150 mM de NaCl y sin sal, para ello el sustrato se saturó con 2 ml de agua destilada (0 mM) o con la solución salina a 150 mM. Se usó un diseño completamente al azar con tres repeticiones.
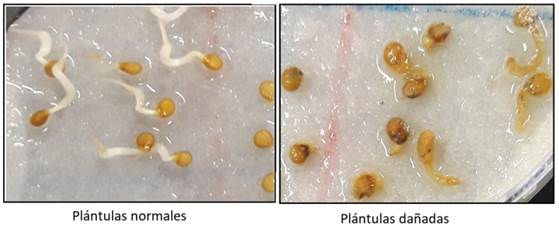
Se realizaron conteos diarios de semillas germinadas, considerando una semilla germinada cuando se presentó la protrusión de la radícula. Se evaluó el porcentaje de germinación (PG), porcentaje de plántulas normales (PN), considerando plántulas normales aquella con cambios graduales y progresivos en tamaño y estructura optimas mediante clasificación visual para diferenciar entre plantas normales y aquellas que presentan algún daño (Figura 1) e índice de velocidad de germinación (IVG) de acuerdo a la fórmula de Maguire (1962):
Pruebas de sales en plántula
Para las evaluaciones en plántula se seleccionaron 41 líneas (Tabla 2) y como testigo al híbrido comercial Cuauhtémoc:
Tabla 2. Líneas de tomate silvestre utilizadas en pruebas de tolerancia a salinidad en etapa de plántula.
| Línea | Origen | Línea | Origen |
|---|---|---|---|
| 2 | Totonaca 2(2016) | 84 | LOR 148 |
| 6 | Arriñonado 6 s in acido | 85 | Chichón |
| 10 | Huasave, Dr. Mascorro | 87 | CM-5 |
| 11 | Tomatillo Mpio. Tecpan de Galiana | 88 | CM-11 |
| 16 | LOR 77 | 90 | CM-30 |
| 17 | LOR 78 | 91 | CM-39 |
| 19 | LOR 80 | 92 | CJ46 |
| 27 | LOR 88 | 95 | CM59 |
| 55 | LOR 117 | 96 | J106 |
| 56 | LOR 118 | 102 | C2-G5 |
| 58 | LOR 120 | 107 | CM-34 |
| 60 | LOR 122 | 109 | C1-32 |
| 61 | LOR 123 | 110 | CM-23 |
| 62 | LOR 124 | 111 | CM-29 |
| 68 | LOR 132 | 113 | CM-37 |
| 72 | LOR 136 | 114 | C1-47 |
| 74 | LOR 137 | 117 | CM-4 |
| 75 | LOR 140 | 118 | CM-83 |
| 79 | LOR 144 | 119 | C1-43 |
| 81 | LOR 149 | 121 | L3 |
| 82 | LOR 146 | 122 | Cuauhtémoc |
Las semillas fueron sembradas en semilleros de germinación de polipropileno de 200 cavidades con sustrato de turba. En los primeros 10 días después de la siembra (dds) se regaron con agua destilada. Entre 10 y 20 dds se utilizó solución nutritiva de Steiner (1961) con concentración de 50%. A partir de los 21 dds se iniciaron los tratamientos con soluciones salinas mediante inmersión diaria en solución nutritiva de Steiner al 100% adicionada con 8,76 g de NaCl por litro para tener una concentración de 150 mM de NaCl. En las plantas control sin aplicación de NaCl se utilizó solución nutritiva al 100%. Los tratamientos se mantuvieron durante 45 días hasta finalizar la prueba.
La unidad experimental consistió en 10 plántulas, el diseño experimental empleado fue de bloques completos al azar con 4 repeticiones. A los 45 días después de la siembra se evaluaron el Contenido Relativo de Agua (CRA) obtenido con la formula.
Además se evaluó el peso fresco total (PFT) en mg, obtenido pesando la plántula completa; el peso de raíz (PR) en mg, obtenido separando la porción de raíz y pesando en fresco; peso seco (PS) en mg, obtenido después de secar la parte aérea de la plántula durante 5 días en una estufa a una temperatura de 70 °C; peso seco de raíz (PSR) en mg se obtuvo después de secar la raíz de la plántula en una estufa a 70°C durante 5 días; altura de planta (AP) en cm, se obtuvo midiendo la longitud de la plántula desde el inicio del tallo hasta el ápice y longitud de raíz (LR) en cm.
Análisis estadístico
Para el análisis estadístico se calcularon índices de tolerancia a sales a partir de los cocientes de los promedios de la variable obtenida en condición salina entre el promedio de la variable correspondiente la condición sin estrés. Con estos índices se realizó un análisis multivariado de agrupamiento a partir de la matriz de distancias euclidianas cuadradas. El dendrograma se construyó con el algoritmo de mínima varianza de Ward. La altura de corte con base en el criterio cubico de agrupamiento (Statistical Analysis System (SAS), 1983) y la pseudo estadística t2 (Hotelling, 1951).
El método de agrupamiento (mínima varianza de Ward) es el utilizado tanto por Marín-Montes et al. (2016) y Magallanes-López et al. (2020), ya que como indican Núñez-Colín y Escobedo-López (2011) este método es más recomendable cuando el objetivo del trabajo es conocer la variabilidad o diversidad existente en genotipos de una especie o género especifico.
Se realizó un análisis discriminante canónico a las agrupaciones que se generaron en el análisis de agrupamiento, tomando como variable clasificatoria estos mis mismos grupos que se obtuvieron en el análisis anterior. Por último, se realizaron análisis de varianza y comparaciones de medias de Tukey con α= 0.05 para describir los grupos de colectas que se identificaron.
Resultados
Análisis de agrupamiento para tolerancia a sal durante germinación
El dendrograma obtenido con el algoritmo de varianza mínima de Ward (Figura 2) permitió identificar 5 grupos, que fueron definidos a partir del criterio cúbico de agrupamiento y de la pseudo t2, con una altura de corte de 0.06 r2 semiparcial. Las diferencias en tolerancia a sales durante la germinación permitieron agrupar líneas con comportamiento similar dentro de grupos, pero con tolerancia diferente entre grupos. El grupo 1 quedó constituido por 17 líneas, el grupo 2 por 35, el 3 por 25, el 4 por 11 y el 5 por 8 líneas cada uno.
Análisis discriminante para la tolerancia a la salinidad durante la germinación
En el análisis discriminante se utilizó como variable categórica a los cinco grupos identificados en el análisis de agrupamiento, se generaron dos funciones discriminantes Variable discriminante 1 (VD1) y Variable discriminante 2 (VD2), que explicaron el 99% de la variabilidad total de los datos, con 84% y 15% respectivamente. La VD1 se asoció de manera positiva con el porcentaje de PN y PG en condiciones de estrés salino, mientras que la VD2 se asoció de manera positiva con el IVG, lo que indica que los valores altos de VD1 y VD2 corresponden a una mayor tolerancia al estrés por sales.
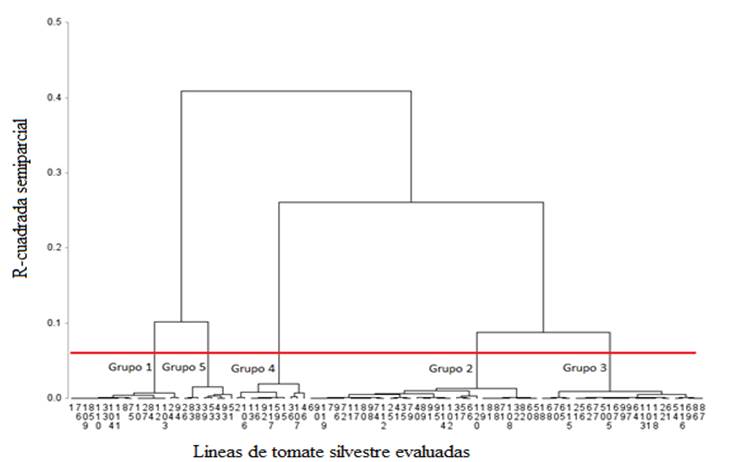
Figura 2. Dendrograma jerárquico (distancias euclidianas cuadradas y método de mínima varianza Ward) de 96 líneas de tomate silvestre evaluadas en germinación bajo condiciones salinas.
La Figura 3 muestra la representación gráfica de VD1 y VD2 de cada línea evaluada, se observa que el grupo 4 con 11 líneas, tiene un mayor porcentaje de geminación y de plantas normales, lo que lo identifica como el grupo que presenta una mayor tolerancia al estrés salino, el grupo 5 muestra valores elevados en IVG, sin embargo, su PG y PN fueron bajos.
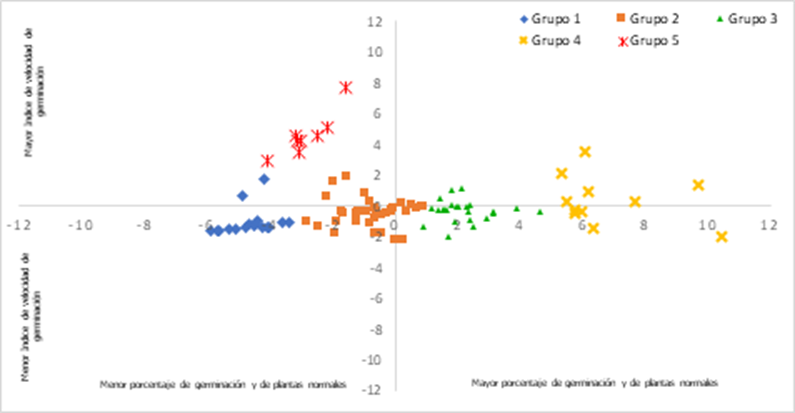
Figura 3. Representación gráfica de agrupación por variables discriminantes de 96 líneas de tomate silvestre evaluadas en germinación bajo condiciones salinas.
Los grupos 2 y 3 mostraron niveles intermedios para cada una de las variables evaluadas, mientras que el grupo 1, con 35 líneas, fue el que mostró un mayor efecto negativo al ser evaluado en condiciones salinas (Figura 3).
Análisis de varianza para la tolerancia a la salinidad durante la germinación
El análisis de varianza (Tabla 3) mostró diferencias significativas entre grupos, líneas dentro de grupos, concentraciones, interacción de grupo por concentración para cada una de las variables evaluadas; en la interacción de líneas dentro de grupo por la concentración de sales, se encontraron diferencias altamente significativas en el porcentaje de plántulas normales y en el IVG.
Los coeficientes de variación obtenidos estuvieron entre 36 y 46% en las variables evaluadas, lo que se considera como valores altos, debido principalmente al estrés al que fueron sometidas las plantas al estar en condiciones salinas, además de la variabilidad genotípica de las líneas.
Tabla 3. Análisis de varianza de caracteres evaluados en 96 líneas de tomate en germinación bajo condiciones salinas.
| FV | PG | PN | IVG |
| Grupo | ** | ** | ** |
| GEN(GRU) | ** | ** | ** |
| CON | ** | ** | ** |
| GRU*CON | ** | ** | ** |
| CON*GEN(GRU) | ns | ** | ** |
| BLO | ** | ** | ** |
| CV | 39,69 | 46,06 | 36,27 |
| MEDIAS | 40,30 | 30,91 | 2,64 |
FV= Fuentes de variación; PG= Porcentaje de germinación; PN= Porcentaje de plántulas normales; IVG= Índice de Velocidad de Germinación; GRU= Grupo; GEN(GRU)= línea; CON=Concentración; GRU*CON= Interacción grupo x concentración; CON*GEN(GRU)= Interacción de concentración x línea; BLO= bloque; CV= Coeficiente de Variación; ** Significativo con α≤ 0.01
En las comparaciones de medias para las concentraciones salinas de 0 mM de NaCl y 150 mM de NaCl se observa el efecto que tiene el estrés salino sobre las líneas evaluadas, en cada una de las variables se encontraron diferencias significativas; hubo una reducción considerable en el porcentaje de germinación, el de plantas normales y el IVG, siendo este último el que resultó más afectado ya que se redujo en un 81% (Tabla 3).
Las comparaciones de medias para grupo por concentración (Figura 4) nos indican que el grupo 1 abarca líneas que muestran valores altos para PG, PN e IVG al no estar sometidas a estrés salino sin embargo es el que más resiente la aplicación de NaCl, ya que estos valores se reducen entre 83 y 94% por tanto es el más susceptible coincidiendo con lo observado en el análisis discriminante; el grupo 5 presenta valores bajos para cada una de las variables evaluadas en ambas condiciones, este grupo incluye las 8 líneas menos tolerantes tanto por susceptibilidad al estrés salino, como por su desempeño en condiciones sin estrés; los grupos 2 y 3 mostraron una reducción considerable en cada una de las variable evaluadas al estar sometidos a condiciones de estrés por sales; el grupo 4 es el que muestra una menor reducción en su PG (1,15%) al pasar a una condición salina, mientras que el PN incluso se incrementa al estar en una concentración de 150 mM de NaCl (de 24,97 a 33,09 %) aunque su IVG se ve disminuida, este grupo incluye a las 11 líneas que muestran una mayor tolerancia a estrés por sales.
Tolerancia a la salinidad en plántulas
Análisis de agrupamiento para la tolerancia a salinidad en plántulas
Las 41 líneas evaluadas mostraron diversos niveles de tolerancia a sales en germinación y como testigo a la variedad Cuauhtémoc. El análisis de agrupamiento permitió determinar 4 grupos con una r2 semiparcial de 0,04.
El grupo 1 estuvo compuesto por 10 líneas, el grupo 2 por 13 líneas y el testigo, el grupo 3 por 12 y el 4 por 6 líneas respectivamente (Figura 5).
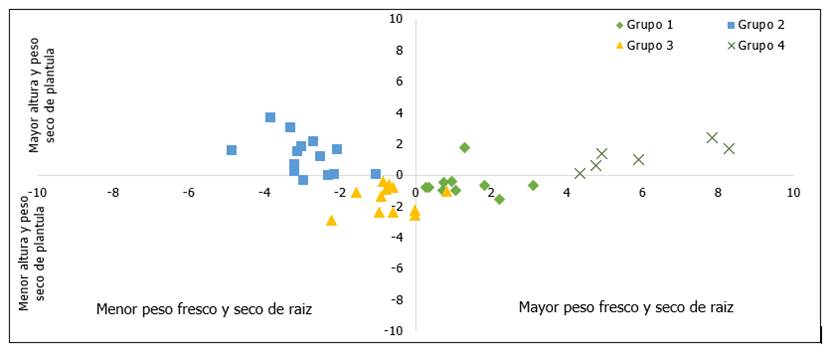
Análisis discriminante para la tolerancia a la salinidad en plántulas
El análisis discriminante canónico (Figura 6) mostró que las variables discriminantes VD1 y VD2 explicaron el 94 % de la variación total, la VD1 con 80 % se asoció positivamente con el PR y con el PSR, mientras que la VD2 con 14 % se asoció positivamente con la AP y con el PS. Esto indica que aquellas líneas con valores altos de VD1 y VD2 son las que tienen un grado mayor de tolerancia a estrés salino en etapa de plántula. Al respecto Morales et al. (2010) menciona que una de las partes más afectadas de la planta al ser sometida a estrés salino son las raíces y el daño es mayor conforme aumenta la concentración de sales; por lo tanto, un indicador de tolerancia sería una mayor cantidad de raíces.
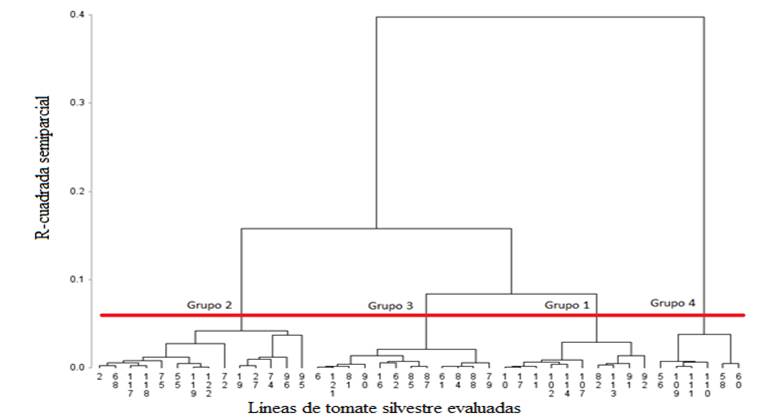
Figura 5. Dendrograma jerárquico de 41 líneas de tomate silvestre y un testigo, evaluadas en plántula bajo condiciones salinas, derivado de distancias euclidianas cuadradas y algoritmo de mínima varianza de Ward.
El grupo 4, con 6 líneas, fue el que presentó valores más altos para PR, PSR, AP y PS, por lo que es el que mostró un mayor nivel de tolerancia a salinidad; el grupo 2 tuvo valores altos en AP y PS, pero los valores de PR y PSR fueron bajos, lo que caracteriza a estas líneas entonces es que tienen una parte aérea mayor que la raíz; los grupos 1 y 3 mostraron valores medios en los caracteres evaluados.
Análisis de varianza para la tolerancia a la salinidad en plántulas
El análisis de varianza (Tabla 4) mostró diferencias significativas entre grupos para CRA, PR, PSR y AP; entre líneas se encontraron diferencias significativas en todas las variables a excepción de CRA; entre concentraciones todas las variables fueron diferentes significativamente, menos LR; en la interacción de grupo por concentración sólo el CRA no tuvo diferencias significativas; mientras que en concentración por línea el PF, PS, PSR y AP tuvieron diferencias significativas. Los coeficientes de variación fueron relativamente bajos en CRA, PF, PS, AP, y LR ya que estuvieron entre 9 y 22%; mientras que en PSR y PR tuvieron 30 y 50 % respectivamente.
Tabla 4. Análisis de varianza de caracteres evaluados en 41 líneas y testigo de tomate en plántula.
| Fuente | CRA | PF | PR | PS | PSR | AP | LR |
| GRU | ** | ns | ** | ns | ** | ** | ns |
| LIN(GRU) | ns | ** | ** | ** | ** | ** | * |
| CON | ** | ** | ** | ** | ** | ** | ns |
| GRU*CON | ns | * | ** | ** | ** | ** | ** |
| CON*LIN (GRU) | ns | ** | ns | ** | * | ** | ns |
| CV | 9,39 | 22,13 | 50,129 | 20,125 | 30,76717 | 9,49 | 14,10 |
| MEDIAS | 73,91 | 3,60 | 0,611 | 0,477 | 0,09175 | 25,89 | 7,77 |
FV=Fuentes de variación; CRA= Contenido Relativo de Agua, PF= peso fresco; PR= peso de raíz; PS= peso seco; PSR= Peso seco de raíz; AP= Altura de plántula; LR= Longitud de raíz; GRU= Grupo; LIN(GRU)= Línea; CON= Concentración; GRU*CON= Interacción de grupo por concentración; CON*LIN(GRU)= Interacción de concentración por línea; CV= Coeficiente de Variación; ** Significativo con α≤ 0.01
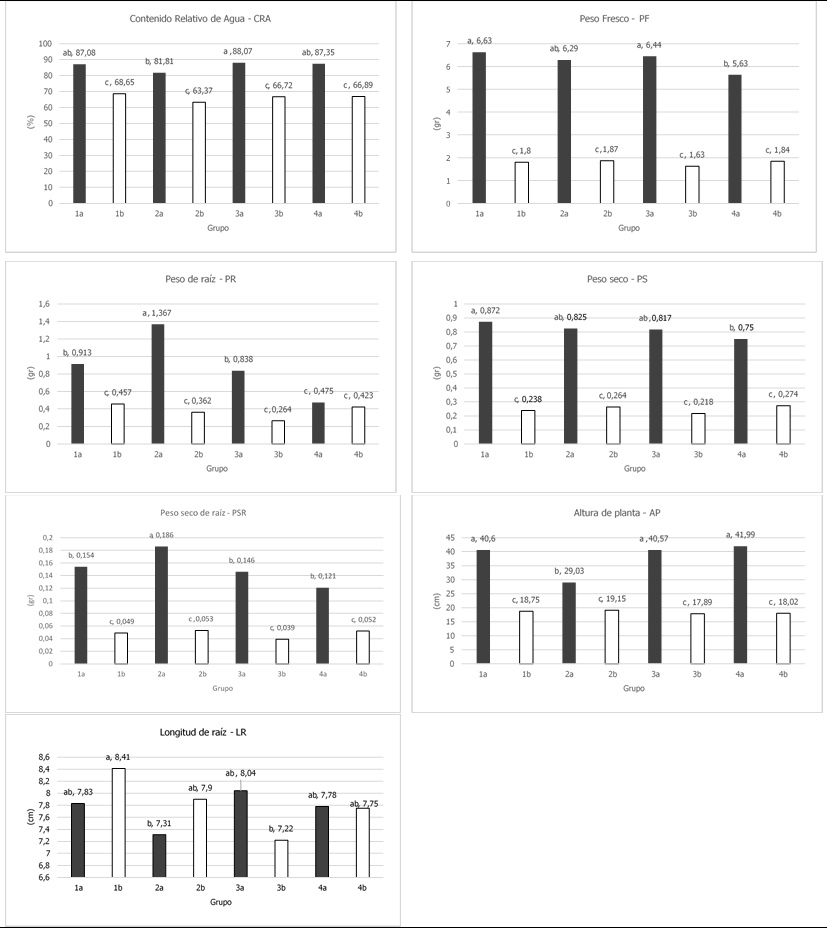
Las comparaciones de medias para concentraciones mostraron una disminución en las variables evaluadas cuando fueron sometidas a estrés por sales, a excepción de LR que mostro un ligero incremento cuando las plántulas estuvieron bajo condiciones salinas; las variables más afectadas fueron PF, PR, PS y PSR que disminuyeron entre un 60 y 70 %.
En las comparaciones de medias para grupo por concentración (Figura 7) se puede observar que los grupos presentaron valores más bajos en las variables CRA, PF, PR, PS, PSR y AP cuando estuvieron en una concentración de 150 mM de NaCl, lo que indica que se vieron afectadas por el estrés al que fueron sometidas.
La altura de planta (AP) en cada grupo se vio afectada por la concentración de sales, provocando una reducción en la misma de entre 32 y 56%, el grupo menos afectado fue el grupo 2.
El CRA también se vio reducido en cada grupo, aunque este afecto de manera similar, con reducciones de entre 21 y 24 %. La Longitud de la raíz fue la variable menos afectada, el grupo 3 presento una disminución de 10 %, mientras que los grupos 1 y 2 presentaron mayores valores en presencia de sales
Discusión
Los resultados obtenidos en el análisis discriminante para la tolerancia a la salinidad en germinación concuerdan con Cortés et al. (2014) quienes encontraron que los genotipos con mayor tolerancia a sales son aquellos que tienen porcentajes de germinación más altos y una mayor biomasa. Igualmente, Estrada-Trejo et al. (2014) mencionan que los genotipos que presentan un mayor grado de tolerancia a sales son aquellos que tienen porcentaje y velocidad de germinación más alto al ser sometidos a estrés salino.
El análisis de varianza para las pruebas de tolerancia a estrés salino confirma que existen diferencias en el nivel de tolerancia a sales tanto entre los grupos obtenidos como entre las líneas evaluadas. Tal como lo mencionan Ruiz-Espinoza et al. (2014) que indican que la salinidad afecta de forma diferenciada según el cultivar, jugando un papel importante la variabilidad genética y la etapa del desarrollo de las plantas. De la misma forma Aini et al. (2017) encontraron que la solución salina influye en la germinación de semillas dependiendo de la variedad de tomate. A su vez Chakma et al. (2019) mencionan que los diferentes niveles de las concentraciones de sal de NaCl influyen significativamente en la germinación de las semillas; observaron que la germinación de las semillas disminuía al aumentar la concentración de NaCl, la germinación máxima de semillas (68,25%) la encontraron en condiciones de control no tratadas (0 mM) seguido de 50 mM (27,08%), 100 mM (9,92%) y la germinación mínima (5,92%) fue con una concentración de sal 150 mM. Kaveh et al. (2011) encontraron una correlación negativa significativa entre la salinidad y la tasa y el porcentaje de germinación que resultó en una germinación retrasada y un porcentaje de germinación reducido en Solanum lycopersicum L.
La condición de estrés por sales afecta cada una de las variables evaluadas en cada una de las líneas bajo estudio. De manera similar Devi y Arumugam (2019), mencionan que el porcentaje de germinación del tomate estuvo muy influenciado por el estrés salino a una concentración más alta (100 mM de NaCl). Coincidiendo con Tahir et al.g (2018) que encontró que el estrés salino tuvo un efecto adverso sobre la tasa de germinación y el porcentaje de germinación. Singh et al. (2012) también observaron una reducción en la velocidad de germinación de tomate al estar sometido a salinidad coincidiendo con los resultados obtenidos en la presente investigación.
Los resultados de las pruebas de tolerancia a salinidad en plántula concuerdan con lo reportado por Devi y Arumugam (2019), ya que menciona que la longitud de plántula y la longitud de la raíz fueron significativamente diferente en todos los tratamientos (0 NaCl, 25 mM NaCl, 50mM NaCl y 100mM NaCl). De igual manera Kaveh et al. (2011) encontraron que las interacciones entre líneas x niveles de salinidad fueron significativas para el porcentaje de emergencia, la tasa de emergencia y el peso fresco y seco de la plántula.
Lara et al. (2015) reportan que la altura de planta y la producción de materia seca disminuyen al incrementar la conductividad, además que las 48 líneas nativas y de los dos testigos comerciales que evaluaron fueron afectadas negativamente por el incremento en la conductividad eléctrica. De forma similar a lo observado en la presente investigación.
En etapa de plántula las variables más afectadas fueron el PF, PR, PS y PSR ya que tuvieron una disminución de entre 50 y 70 % (Tabla 4); al respecto Hajiboland et al. (2010) mencionan que a alta salinidad reduce la producción de materia seca de las plantas en los cultivares que evaluaron, además que la influencia de la salinidad en las plantas fue altamente dependiente de los cultivares. De igual manera, Yurtseven et al., (2005) coinciden en que el rendimiento de la biomasa se ve afectado por la salinidad, ya que la disminución promedio en el rendimiento de biomasa causada por un aumento en la salinidad de 2,5 a 5,0 dS m-1 fue del 37%, y cuando la salinidad aumenta aún más a 10.0 dS m-1 se obtiene una reducción adicional del rendimiento de aproximadamente el 60%.
Ruiz Espinoza et al. (2014) encontraron que todos los órganos de la parte aérea de las plantas de tomates se alteraron con la salinidad. Mientras que Chakma et al. (2019) mencionan que la longitud de la raíz fue influenciada significativamente por los efectos de diferentes variedades de tomate, así como por la concentración de sal. De igual forma Tahir et al. (2018) mencionan que la longitud de la raíz, la longitud del brote, el peso fresco de la raíz y el peso fresco de 30 genotipos de tomate que evaluaron, el estrés salino tuvo un efecto adverso; además en todos los genotipos estudiados observaron una variación significativa en la tolerancia a la sal.
De la presente investigación se puede continuar la evaluación de los materiales ahora en etapa de planta, además de evaluar como responden en rendimiento al ser sometidas a estrés salino. En cuanto a la parte molecular se puede evaluar la presencia y expresión de genes que han sido relacionados con la tolerancia a sales.
Conclusiones
Se identificó un grupo de 11 líneas (2 ,13, 15, 16, 36, 46, 59, 92, 106, 107, 117) de tomate con tolerancia a salinidad en germinación y un grupo de 6 líneas (56, 58, 60, 109, 110, 111) con una mayor tolerancia al estrés salino en etapa de plántula. La tolerancia a la salinidad de las líneas de tomate estudiadas mostró una respuesta variable en la etapa de germinación y en la plántula. Estos resultados sugieren que la tolerancia al estrés salino depende de múltiples factores como el genotipo y el estado de desarrollo.












 uBio
uBio