INTRODUCCIÓN
La equinococosis se considera una enfermedad zoonótica desatendida, producida por el estado larvario de tenias del género Echinococcus. Se reconocen dos entidades clínicas diferenciadas: la forma quística (EQ) causada por el E. granulosus sensu lato, considerada una patología incapacitante, y la forma alveolar (EA) originada por el E. multilocularis, que puede ser fatal1. Ambas son enfermedades crónicas que tienen distinta distribución epidemiológica. La EQ, considerada incapacitante, resulta quistes únicos o múltiples que crecen en el hígado, pulmones u otras localizaciones y que ejercen un efecto de masa pudiendo afectar la función del órgano. La EA, sin embargo, simula un tumor invasivo que también prefiere al hígado, pero que puede infiltrar tejidos adyacentes y hasta producir metástasis a distancia. Un denominador común de ambas formas es la falta de datos precisos sobre el número de casos a nivel local y global2.
Desde el 2004, la Organización Panamericana / Organización Mundial de Salud estableció la Iniciativa Sudamericana para el Control y la Vigilancia de Equinococosis Quística /Hidatidosis, integrando a varios países. Un total de 6.268 casos de EQ en humanos se ha registrado desde el 2016 hasta el 2017 en Argentina, Chile y Perú. Paraguay se incorporó desde el 2016 y no dispone del registro de número de casos de la enfermedad según informe de marzo del 20193. Sin embargo, desde hace tiempo vienen reportándose casos aislados en resúmenes de congresos nacionales4-6.
Los perros infectados (huésped definitivo) son la principal fuente de EQ hidatídica humana, pues, alimentados con vísceras crudas de algún huésped intermediario (vacas, cabras, ovejas, caballos, cerdos) que ingirió huevos infestantes, se convierten en focos de transmisión. Los gatos y otros carnívoros también pueden ser huéspedes definitivos, aunque con peso epidemiológico marginal7. Los humanos pueden exponerse mediante transferencia “mano- boca”, esto es: acariciando o manipulando perros infectados (pelaje o heces) o al ingerir hierbas, verduras o frutas contaminadas con heces de perros. Recientemente se ha encontrado ADN de Echinococcus granulosus en 9% de las manos, 7% en el pelaje de los perros y hasta en 3% del suelo de áreas altamente endémicas para EQ8. En nuestro país es célebre el “tereré pantano”, una infusión compuesta de múltiples hierbas. Besar a las mascotas es otra ruta de exposición. Según un estudio, menos de la mitad de los dueños de mascotas se lava las manos con jabón después de interactuar y hasta las lambidas en el rostro y los besos se citan como gestos frecuentes9.
Investigando factores predisponentes para la ocurrencia de la equinococosis se ha consignado que el 90% de los canes son alimentados con vísceras, que el 95% de los perros no reciben tenicida y que existe un gran desconocimiento sobre la zoonosis en determinadas compañías del Departamento de San Pedro mediante una encuesta recientemente realizada por el Programa Nacional de Control de Zoonosis10. Asumir que esta zoonosis es de distribución exclusivamente rural, puede tener sesgos. Un estudio de tamizaje realizado en las adyacencias de mataderos clandestinos de zonas urbanas de Lima (Perú), ha encontrado que el 18% de los perros y el 9,3% de humanos de la vecindad estaban infectados11.
En este trabajo describimos las características clínicas de una serie de casos EQ humana vistos en un hospital de referencia y hacemos una revisión nominal de los reportes en la literatura médica nacional (Scielo Paraguay, Biblioteca Nacional del Paraguay, reportes de congresos y Biblioteca de Facultad de Ciencias Médicas de la Universidad Nacional de Asunción).
PRESENTACIÓN DE LOS CASOS
Caso 1. Mujer de 37 años, ama de casa, proveniente de zona urbana de la ciudad de Luque, sin comorbilidades, refiere disnea de larga data y consulta por cuadro de 3 días de tos, con expectoración purulenta, con estrías de sangre, dolor en región posteroinferior del hemitórax izquierdo y chillido de pecho. En el interrogatorio epidemiológico no refiere haber hecho viajes al exterior del país y refiere contacto cercano con dos canes que se alimentan de menudencias. Signos vitales estables. Nada remarcable al examen físico ni en analítica laboratorial básica. Test rápido para HIV: (-). Frotis (Gram y Ziehl-Neelsen) y cultivo de esputo: negativos. Radiografía (Rx) y Tomografía computarizada (TAC) tórax (Figura 1a y b). Ecografía abdominal: normal. Broncoscopía: árbol respiratorio normal. Se realiza lobectomía inferior izquierda. Histopatología denota parásito y estructuras características (Figura 1c y d). Diagnóstico: quiste hidatídico pulmonar autóctono. Recibió albendazol posterior a exéresis y al año de seguimiento se confirma cura.
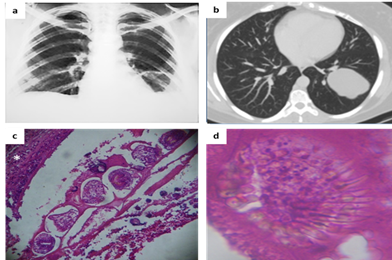
Figura 1. a) Radiografía de tórax que muestra imagen quística en campo inferior izquierdo; b) TAC de tórax que confirma la naturaleza quística de la lesión; c). Microscopía óptica y tinción (hematoxilina-eosina) de pared de quiste que muestra infiltrado peri-inflamatorio(*) y protoescólices del parasito; d) Escólex de Echinococcus con sus característicos ganchos radiados.
Caso 2. Varón de 50 años, ganadero, proveniente de Villa Oliva. Cuadro febril prolongado y tos. No refiere comorbilidades. Epidemiología: no hay suficientes datos sobre viajes al exterior. Examen físico: roncus difusos y hepatomegalia leve. TAC tórax: formación quística pulmón izquierdo (Figura 2a). Ecografía abdominal: hígado con múltiples quistes con contenido anecogénico. Fibrobroncoscopía: se observa material blanquecino emergiendo de bronquios segmentarios (Figura 2 b y c). Biopsia de material confirma membrana hidatídica. Diagnóstico: hidatidosis con compromiso multiorgánico (quiste pulmonar complicado y probable compromiso hepático). Se plantea tratamiento antiparasitario.
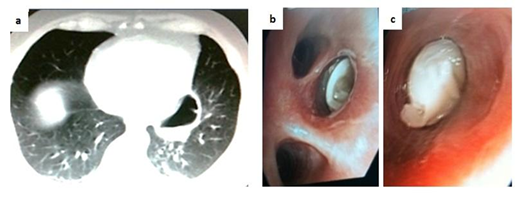
Figura 2. a) TAC de tórax que muestra quiste de contenido mixto (interfase aire-líquido) en región paracardiaca izquierda e infiltrados nodulares más lámina subpleural en región posterior; b y c) Visión endoscópica que muestra estructura membranácea gelatinosa blanca que emerge de bronquio segmentario lateral de lóbulo inferior izquierdo (“parto quístico”).
Caso 3. Mujer de 58 años, ama de casa, oriunda de zona urbana de Luque, sin antecedentes de migración, portadora de hipertensión arterial y diabetes mellitus, no fumadora que consulta por dolor en hemitorax izquierdo de larga data, ventilatorio dependiente más pérdida de peso y tos seca. Interrogatorio epidemiológico: no refiere haber viajado al exterior y tiene mascota (perro) que se alimenta de menudencias. TAC: opacidad redondeada en Figura 3a y 3b. Ecografía abdominal: normal. Broncoscopía: árbol bronquial sin peculiaridades. Antígeno hidatídico positivo por inmunocromatografía. Tratamiento: resección lobar y albendazol. Anatomía patológica: quiste hidatídico. Seguimiento al año sin secuelas clínicas aún con leve disminución del volumen pulmonar izquierdo posquirúrgico (Figura 3c).
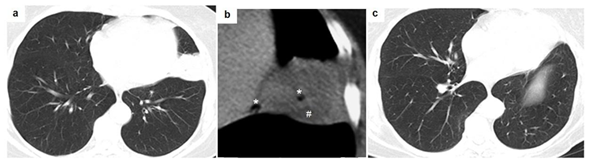
Figura 3a. TAC de tórax que denota opacidad redondeada de bordes regulares en región de língula; 3b. Imagen aumentada y en ventana mediastinal que muestra el signo de la burbuja aérea(*) y líneas de hiperatenuación serpenteantes o signo de la serpiente (#) en el interior del quiste; 3c. TAC de control al año de tratamiento que comprueba cura.
DISCUSIÓN
Mucho se ha avanzado en la comprensión de la biología del Echinococcus granulosus (EG). Una revisión sistemática de la EQ en huéspedes intermediarios y definitivos de cinco países de Sudamérica (Argentina, Brasil, Chile, Perú y Uruguay) arroja seis genotipos del parasito: G1, G2, G3, G5, G6 y G7. El E. granulosus senso strictu(G1) constituye el más frecuente en humanos (72,9%) seguidos por el E. Canadensis (G6) en 12,2% y el G7 en 9,6%. La epidemiología molecular podría ser relevante para la caracterización de la patogenicidad, del diagnóstico y tal vez hasta en la respuesta terapéutica12.
Merced a la ausencia de datos oficiales de la EC en Bolivia, Ali y cols reportan una revisión de 876 casos humanos publicados desde 1970, con tasas de hasta 4,1% de hallazgos ecográficos en zonas de alta incidencia. Relativo a huéspedes intermediarios, el recuento de antígenos positivos se dio en 24% de heces de canes, 37% en vacas, 26,9% en llamas, 2,4% en cerdos y 1,4% en ovejas13. De modo similar a estos autores, el presente trabajo ofrece una visión histórica de los casos publicados en la literatura nacional, proponiendo llenar un vacío sobre la situación local de esta zoonosis.
Posiblemente, la primera mención de hidatidosis en nuestro país se da en el campo de la literatura, pues el dramaturgo Julio Correa es quien la destaca como elemento central en su celebrado cuento “Nicolasita del Espíritu Santo”14.
Las crónicas iniciales en animales de nuestro país datan de 1969, pues Lozano y cols encuentran 76 casos en 46.800 vacunos faenados, lo cual arroja un porcentaje de 0,16%15. Un trabajo fundacional realizado en 1985 por Masi-Pallarés R. menciona que la mayoría de los quistes de vacunos eran infértiles en aquella época16.
Las descripciones en humanos comienzan en 1945 con 4 casos reportados por el Ginés A. mediante tamizaje radiográfico y prueba de Casoni (intradermorreacción con líquido hidatídico puro) en nativos del Paraguay. No existen referencias sobre datos demográficos. Este reporte es sonsacado de un trabajo de Gómez y cols. que describe el caso de una ciudadana argentina de 48 años que, visitando Puerto Sastre (Alto Paraguay), es llevada al Hospital de Clínicas por pioneumotórax súbito resultante de ruptura de quiste hidatídico pulmonar en cavidad pleural. El diagnóstico fue confirmado por examen parasitológico. En ecografía abdominal se encuentra imagen quística esplénica17.
El primer caso de quiste hidatídico pulmonar autóctono se reporta en 1990. Se trataba de una mujer de 30 años proveniente de Encarnación que vivió mucho tiempo en una granja donde faenaban animales, aunque con relatos de viaje a la Argentina. Consulta por síntomas respiratorios y nódulo pulmonar en base derecha. Se realiza lobectomía inferior derecha y el examen parasitológico e histopatológico del quiste certifica escólices de equinococus granulosus4.
Muchos años después, se percibe el aumento de reportes de casos en resúmenes de congresos de medicina de nuestro país, destacando compromiso pulmonar en una mujer de 31 años5 o afectación hepático-esplénica en adolescente de 14 años oriunda de Luque6. Relatos más detallados se pueden encontrar en publicaciones que mencionan afectación retroperitoneal en mujer de 28 años proveniente de Concepción18, o con compromiso esplénico en pacientes de sexo femenino de < 50 años19,20. Resulta también interesante el reporte de Jara y cols sobre una mujer de 55 años con antecedentes de viaje a Uruguay, portadora de quiste parapiélico derecho, hidatídico confirmado por serología e histopatología21. No se descarta que existan más casos reportados.
Una de las primeras series de casos sobre quistes hidatídicos autóctonos se reporta en el 2009 y menciona a un varón de 11 años con compromiso hepático procedente de San Pedro, a una mujer de 21 años con compromiso esplénico procedente de Dpto. Central, aun varón de 49 años con compromiso esplénico, procedente de Dpto. de Concepción y a una mujer de 17 años con compromiso pancreático, procedente de Dpto San Pedro. Todos ellos con prueba serológica (IFI) positiva22.
El inmunodiagnóstico de la infección por EG utiliza pruebas de hemaglutinación y látex (problemas con reacciones cruzadas con otras parasitosis), intradermoreacción de Casoni (presenta falsos positivos), técnica de ELISA (reacción cruzada con T. solium), la inmunofluorescencia indirecta o IFI y la técnica de inmunoBlot (Western Blot) que puede ser confirmatoria (detecta anticuerpos contra antígeno 5)23,24. El compromiso hepático conlleva diagnóstico serológico más frecuente que en caso de compromiso pulmonar25.
Baravalle y cols, describen una serie de 12 casos (83% mujeres con edad promedio 49 años) vistos durante el periodo 2006-2013 en un hospital de referencia de nuestro país. De ellos, 7 comprometían hígado y 3 a los pulmones. El ensayo hace referencia a que el 58% provenía de área metropolitana (Gran Asunción) no obstante, sin suficientes precisiones sobre viajes al exterior, lo cual no consolida el carácter autóctono de la enfermedad. Es interesante hacer notar que el motivo de consulta fue el síndrome doloroso en los casos de afección hepática y la hemoptisis en la afectación pulmonar. El 66,6% mostró eosinofilia en la analítica sanguínea y el 11,7% fue diagnosticado por serología y clínica26.
Flecha y cols, publicaron un trabajo sobre 17 casos de hidatidosis hepática consignados durante el periodo 2014-2017 en el Hospital Nacional de Itauguá. El 64,7% era del sexo femenino con un promedio de edad de 44,8 años. El 35,3% de los individuos no realizaron viajes al exterior y el dolor en hipocondrio derecho fue la causa más frecuente de consulta. El 47% de los pacientes mostró serología negativa27.
González Ayala y cols. revisaron 22 casos de afección hepática entre 2018 y 2021. La mayoría de los casos eran mujeres (edad media 57 años). Los pacientes procedían principalmente de San Pedro, Guairá, Misiones y Central, pero también hubo algunos casos de otras regiones. Las pruebas serológicas fueron positivas en el 27,3% de los casos y el diagnóstico anatómico se confirmó en el 68,2%28.
Los pulmones (después del hígado) son el segundo sitio más frecuente de diseminación hematogénica en adultos y probablemente el sitio más común en niños29. En los tres casos clínicos con compromiso pulmonar presentados en este reporte se puntualiza la procedencia y otros aspectos epidemiológicos. Es interesante resaltar las imágenes (TAC de tórax) que son orientativas al diagnóstico, así como la expresión de la visión endobronquial. Resulta fundamental saber si estamos ante la presencia de un quiste íntegro (primer y tercer caso) o de un quiste complicado (segundo caso), que clínicamente puede estar precedido por vómica30.
Los hallazgos radiológicos de las hidatidosis pulmonares no complicadas pueden variar desde imágenes quísticas con paredes regulares o con imágenes quísticas satelitales con o sin calcificación. La TAC de tórax es bastante expresiva. En el caso de quistes complicados podemos ver un doble arco, el signo de la serpiente, el signo del camalote, el signo del sol naciente, un patrón de masa cavitada, signo del aire cresciente, signo de la burbuja aérea. Pueden encontrarse hallazgos asociados como atelectasias, bronquiectasia, linfadenopatias mediastinales, espesamiento pleural y derrame pleural31. Actualmente, la ecografía, sobre todo en las localizaciones extratorácicas, es de uso muy requerido.
La broncoscopía puede ser utilizada en algunos casos. García y cols encontraron 5 indicios de compresión y 3 con inflamación endobronquial en la hidatidosis pulmonar no complicada, no habiendo otros detalles en el árbol bronquial de 22 casos. Cuando se trataba de hidatidosis pulmonar complicada, describieron 14 casos de áreas inflamadas, 14 casos de membranas endobronquiales en 44 casos32.
El tratamiento se instituye acorde a los hallazgos clínicos y ecográficos de la WHO-Informal Working Group on Echinococcosis (WHO-IWGE). El tamaño, la localización y la presencia o no de complicaciones, tanto como la disponibilidad de médicos de experiencia, tanto como de infraestructura, determinarán el enfoque. El tratamiento curativo se consigue con la remoción total, aunque podría plantearse la técnica “PAIR” (punción, aspiración, inyección y re-aspiración). Se recomienda siempre la técnica de intervención junto al tratamiento con albendazol. Se utiliza farmacoterapia sola en casos de quistes de pequeños tamaños o en casos de quistes múltiples e inoperables33.
En conclusión, presentamos una serie de casos vista en un hospital de referencia y que suma 70 casos, con los registrados en la literatura nacional (reportes de congresos y bases de datos como Scielo Paraguay y revistas de la Biblioteca Nacional y de la Biblioteca de la Facultad de Ciencias Médicas de la Universidad Nacional de Asunción). Se requieren estudios epidemiológicos sistemáticos para evaluar el grado de penetración, la distribución geográfica y las características de transmisión de esta enfermedad en nuestro país.















