1. INTRODUCCIÓN
El lapacho negro es un árbol de la familia Bignoniaceae, nativo de Centro y Sudamérica, de alto valor maderable como ornamental. Su madera es muy apreciada por su resistencia bajo agua y su estabilidad en estado seco, utilizado en la construcción, carrocerías, machimbrados y postes. En la medicina popular, es utilizada para curar llagas y heridas, y se le atribuye propiedades contra la tos al jarabe hecho de sus flores(1). Además, es una especie medicinal debido a su acción antiinflamatoria, analgésica, antibiótica y antienoplásica(2).
Fue incluido en la lista roja de plantas amenazadas de extinción en el Estado de Paraná, Brasil(3), y actualmente aparece en la lista roja del CNCFLORA (Centro Nacional de Conservação da Flora), en la categoría de LC (menos preocupante) de la Unión Internacional para la Conservación de la Naturaleza (UICN), que corresponde a las especies que no califican como amenazadas. Sin embargo, considerando que es ampliamente utilizada en las forestaciones urbanas y tiene una extensa distribución geográfica, la alta demanda de su madera puede conllevar una reducción acelerada de la población de la especie2.
Para mitigar los efectos de la reducción acelerada de la población de esta especie, las técnicas de cultivo de tejidos vegetales como la micropropagación son consideradas alternativas económicas adecuadas para especies forestales nativas por la posibilidad de propagación de árboles seleccionados, además de obtener plantas libres de fitopatógenos(4).
En este sentido, el establecimiento de un protocolo de micropropagación del lapacho negro promovería la conservación de la especie, así también incentivaría el establecimiento de plantaciones de árboles nativos.
Esta investigación contó con el patrocinio del Programa Universitario para Becas para la Investigación Andrés Borgognon y tuvo como objetivo general establecer un protocolo de micropropagación de Handroanthus heptaphyllus a partir de segmentos nodales.
2. MATERIALES Y MÉTODOS
El estudio fue ejecutado en el Laboratorio de Biotecnología del Departamento de Biología, perteneciente a la Carrera de Ingeniería Agronómica de la Facultad de Ciencias Agrarias ubicada en la ciudad de San Lorenzo en el Campus Universitario de la Universidad Nacional de Asunción, Paraguay.
El lote de individuos seleccionados como plantas madre, estuvo constituido por 72 plántulas de lapacho negro provenientes de semillas de árboles “plus”, con base a sus características fenotípicas(5), los cuales fueron seleccionados de acuerdo a la altura, diámetro a la altura del pecho (DAP), forma del fuste (rectitud y circularidad), ramificaciones, libre de plagas y enfermedades y edad de fructificación(6). Estos árboles fueron identificados por el mismo equipo de investigación.
Estas semillas fueron germinadas en almácigos cuya siembra se realizó en diciembre de 2018, y estaban localizadas en el vivero de la Carrera de Ingeniería Forestal de la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción, ciudad de San Lorenzo. A continuación, fueron repicadas en macetas de polietileno (15x22cm) dispuestos bajo media sombra (50%) por tres meses, posteriormente a sol pleno.
El sustrato en el cual se desarrollaron las plantas madre, estuvo compuesto de tierra agrícola y estiércol vacuno en relación 1:1, y el riego se llevó a cabo a partir de aspersores por 20 minutos una vez al día a tempranas horas de la mañana.
El tratamiento para el control de las manchas foliares en plantas madre consistió en una combinación de Oxicloruro de cobre (OxiCob®) y Ditiocarbamato (Mancozeb®) en proporción de 3 y 2 g/l respectivamente. La aplicación fue realizada una vez por semana.
Este lote estuvo compuesto de 1620 explantes de Handroanthus heptaphyllus (Vell.) Mattos. Los segmentos nodales; de longitudes aproximadas a 1 cm, conteniendo 1 o más nudos desprovistos de hojas; fueron extraídos de plántulas jóvenes para asegurar el vigor de los materiales.
En los ensayos previos de contaminación, los segmentos nodales fueron cultivados en 20 ml de medio de cultivo compuesto por agar y agua (T1 al T4). Posteriormente, se utilizó un medio de cultivo MS(7), adicionando 2 g/l de C.A. crecimiento (T5 al T12).
Para el control de la contaminación se aplicaron los tratamientos listados en la Tabla 1.
Tabla 1 Tratamientos de desinfección de segmentos nodales de lapacho negro.
| Tratamiento | Desinfectante | Tiempo (min) | Medio |
| T1 | C2H5OH (70%) | 3 | Agar/Agua |
| NaClO (5%) | 1 | ||
| T2 | C2H5OH (70%) | 5 | Agar/Agua |
| NaClO (5%) | 0,5 | ||
| T3 | C2H5OH (70%) | 5 | Agar/Agua |
| NaClO (4%) | 5 | ||
| T4 | C2H5OH (70%) | 3 | Agar/Agua |
| NaClO (5%) | 3 | ||
| T5 | C2H5OH (70%) | 3 | MS |
| NaClO (5%) | 3 | ||
| T6 | C2H5OH (70%) | 2 | MS |
| NaClO (5%) | 5 | ||
| T7 | C2H5OH (70%) | 2 | MS |
| NaClO (10%) | 5 | ||
| T8 | C2H5OH (70%) | 2 | MS |
| NaClO (10%) | 10 | ||
| T9 | C2H5OH (70%) | 2 | MS |
| NaClO (15%) | 10 | ||
| T10 | C2H5OH (70%) | 2 | MS |
| NaClO (15%) | 15 | ||
| T11 | C2H5OH (70%) | 2 | MS |
| NaClO (20%) | 20 | ||
| T12 | C2H5OH (70%) | 2 | MS |
| NaClO (20%) | 15 |
El tratamiento aplicado para la prevención de oxidación consistió en 2 g/l de carbón activado al medio de cultivo.
Para la evaluación de la sobrevivencia, los explantes fueron mantenidos con el medio de cultivo nutritivo de la siembra, sin subcultivos posteriores.
Se analizaron las siguientes variables: el porcentaje de control de manchas foliares en plantas madre, el porcentaje de contaminación de explantes, oxidación, sobrevivencia, brotación, formación de callos y la longitud de los brotes.
El experimento abarcó un periodo de julio de 2019 a diciembre de 2020, las siembras fueron realizadas periódicamente y su evaluación fue cada 2 días, hasta los 50 días posteriores a su establecimiento.
Los explantes sometidos a los tratamientos de control de contaminación y oxidación, que presentaban indicios de brotación pasados los 20 días después de la siembra, fueron evaluados para la variable de sobrevivencia.
Para la determinación de las variables de longitud de brotes y diferenciación foliar fueron evaluados los explantes provenientes del ensayo de sobrevivencia
Todas las variables en estudio fueron expuestas a una prueba de normalidad de Kolmogórov-Smirnov (K-S), prueba no paramétrica que determina la bondad de ajuste de dos distribuciones de probabilidad entre sí(8).
3. RESULTADOS Y DISCUSIÓN
3.1. Selección de plantas madre de sanidad controlada
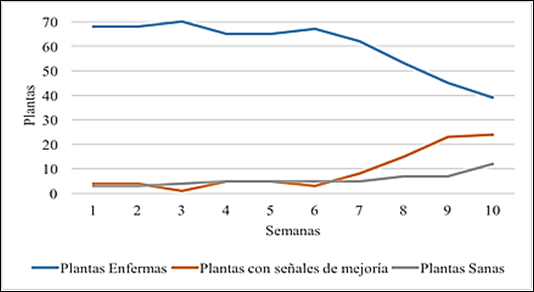
En la Figura 1 se observan los datos referentes a la evolución de las plantas madre ante la aplicación del tratamiento de control de manchas foliares (Oxicloruro de cobre 3 g/l y Ditiocarbamato 2 g/l), presentó una mejoría visible comparado con la cantidad de plantas enfermas al inicio del ensayo.
Las plántulas de Handroanthus heptaphyllus presentaron manchas necróticas dispersas de color marrón posterior a los 18 meses de su germinación.
Posterior a la décima quinta aplicación se contabilizó 100% de plantas libre de manchas foliares. En estudios realizados con Amburana cearensis (Fr. Allem.) A.C. Smith, se obtuvo un control de contaminación del 81%, luego de tratar a sus plantas donadoras de explantes con OxiCob® (3,50g/l) cada 15 días antes de retirar los segmentos de los mismos(9). Asimismo, investigaciones referidas a micropropagación de lapacho de floración blanca (Handroanthus heptaphyllus), recomendaron la utilización de fungicida “Dithane M-80” de composición Mancozeb® (ditiocarbamato) a una concentración de 3g/ l, controlando hasta el 79% en comparación a las siembras sin tratamiento a las plantas madre(10,11,12 ) .
3.2. Contaminación de explantes
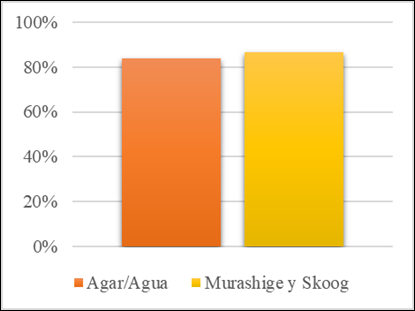
La primera fase del experimento se lleva a cabo en medio de cultivo de bajo costo (Agar/Agua), partiendo de los siguientes tratamientos: T1 (C2H5OH 70% por 3 minutos; NaClO 5% por 1 minutos), T2 (C2H5OH 70% por 5 min; NaClO 5% por 30 seg), T3 (C2H5OH 70% por 5 min; NaClO 4% por 5 min), estos tratamientos presentaron 100% de contaminación a los 5 días de la siembra. Sin embargo, el T4 (C2H5OH 70% por 3 min; NaClO 5% por 3 min) presentó un control de la contaminación del 84% y se considera el más efectivo para el control de la contaminación en medio de cultivo agar/agua.
Posterior a los 7 días de la siembra, los explantes libres de contaminantes empiezan a decrecer debido a la falta de nutrientes en el medio.
La siguiente fase del ensayo se desarrolló en medio de cultivo nutritivo (MS), con base en el tratamiento de mejor respuesta en medio Agar/Agua, se parte del tratamiento T5 (C2H5OH 70% por 3 min; NaClO 5% por 3 min), el cual presentó un 87% de explantes asépticos hasta 10 días después de su siembra y muestran signos de desarrollo meristemático.
La utilización de MS como medio de cultivo dio resultados promisorios en la micropropagación de Handroanthus heptaphyllus en tanto que ensayos realizados con segmentos nodales de Handroanthus impetiginosus sugieren la utilización de WPM (Wood Plant Medium) para el cultivo de tejidos de esta especie(13).
La concentración y tiempo de inmersión C2H5OH (70%) y NaClO (5%) por 3 min resulta efectivo para el control de la contaminación en medio Agar/Agua tanto como en medio de cultivo MS en igualdad de condiciones (Figura 2).
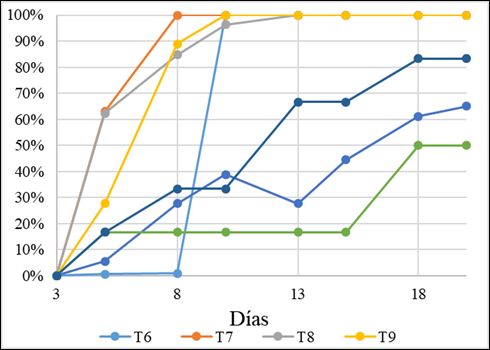
Los tratamientos T6, T7, T8 y T9 presentaron 100% de contaminación a los 10 días, por su parte, los tratamientos T10, T11 y T12 controlaron la contaminación efectivamente y fueron observados 20 días después de la siembra (Figura 3).
El tratamiento T11 resultó ser más efectivo en cuanto al control de la contaminación presentando un 50% hasta los 20 días después de la siembra. El T10 y T12 presentaron un control de 35% y 17% respectivamente.
Experimentos de micropropagación de Handroanthus heptaphyllus de floración blanca, registraron un control del 73% con la desinfestación con NaClO al 5% y 32% de contaminación de los explantes con la desinfestación con NaClO al 10% durante 10 minutos y sembrados en medio de cultivo MS(14).
Sin embargo, investigaciones relacionadas al establecimiento in vitro de H. chrysotrichus sostienen que el medio MS promovió un mayor porcentaje de contaminación (68,7%) en sus ensayos (15).
En relación a la contaminación, se observa que los medios de cultivo no aportaron diferencia significativa en la germinación de las plantas, a pesar de que la MS presenta menos del 1% de contaminación(15).
3.3. Control de la oxidación
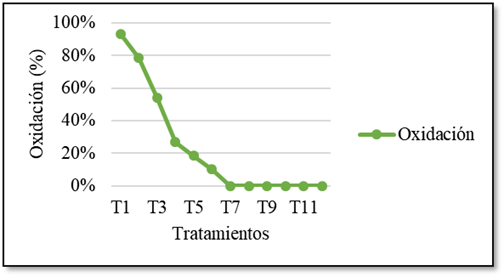
En la Figura 4 se observan los datos referentes al control de la oxidación, el tratamiento consistió en la aplicación de 2 g/l de carbón activado al medio de cultivo como método de control de la oxidación.
La determinación de la aplicación de carbón activado fue con base a los resultados de trabajos afines al cultivo de tejidos realizados por varios investigadores que proponen la adición de 2 g/l de carbón activado al medio de cultivo como método de control de la oxidación (1, 10, 16, 17, 18,19, 20, 21).
Resultó efectivo el tratamiento de prevención de oxidación 2 g/l de carbón activado al medio de cultivo controlando hasta el 100% de necrosis.
3.4. Sobrevivencia
Para la obtención del porcentaje de sobrevivencia, se tuvieron en cuenta explantes con indicios de brotación, sin presencia de contaminación o necrosis pasados los 20 días de la siembra, a los que se denominan indiferentes.
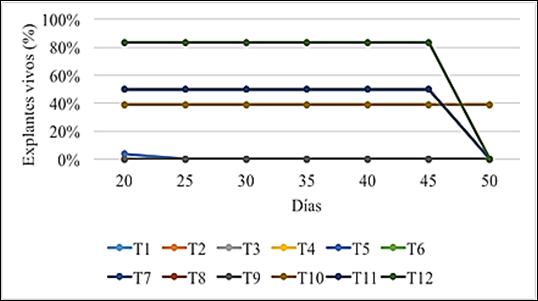
A partir de los 20 días de la siembra, solo los tratamientos T5, T10, T11 y T12 presentaron explantes para el análisis de sobrevivencia.
El tratamiento T10 presentó un 60% de sobrevivencia hasta pasados los 50 días de la siembra. El T11 y T12 presentaron explantes vivos hasta los 45 días (Figura 5).
Pasados los 40 días de incubación, los explantes no prosperaron en su crecimiento debido al empobrecimiento del medio de cultivo en los que se encontraban lo que indujo a su necrosis aunque sin presencia de contaminantes microbianos.
3.5. Diferenciación foliar y formación de callos
Fueron analizados todos los explantes que presentaron indicios de brotación y formación de callos. La brotación de los explantes de lapacho se puede ver en la Figura 6.
En la primera fase de la experimentación, con los tratamientos T1, T2, T3 y T4, cuyo medio consistió con base en agar y agua, no fueron registrados indicios de brotación en ninguno de los casos. Sin embargo, en el T5 (MS) presentó un 48,14% de explantes con indicios de brotación a los 8 días.
El T10 y T11 presentaron diferenciación foliar de 1 y 2 mm respectivamente.
El uso de BAP afectó el crecimiento de la planta (altura) y el sistema radicular (en las raíces) en el medio de cultivo MS, comprobado así con un ajuste significativo de la regresión y un coeficiente de determinación aceptable(15, 20).
4. CONCLUSIONES
Los resultados del experimento permitieron concluir que para el establecimiento del protocolo de micropropagación de Handranthus heptaphyllus resutó efectiva la aplicación de la combinación de Oxicloruro de cobre (OxiCob®) y Ditiocarbamato (Mancozeb®) e incidió favorablemente en el control de enfermedades fúngicas y posteriormente en el éxito de la siembra.
La oxidación fue controlada al 100% con la aplicación del tratamiento de prevención de necrosis celular, que consistió en la adición de 2 g/l de carbón activado.
El tratamiento T10 registró un 60% de explantes vivos hasta los 50 días con diferenciación foliar de 1,5 mm de elongación promedio.












 uBio
uBio