INTRODUCCIÓN
El Síndrome de Sjögren (SS) es una enfermedad autoinmune sistémica que afecta principalmente las glándulas exocrinas, como las lacrimales y salivales, causando síntomas principales como xerostomía y xeroftalmia(1,2). Es más común en mujeres mayores de 50 años(3). Los genes implicados en el SS están relacionados con las vías de señalización del factor nuclear Kappa B (NF-kB), interferón (IFN), linfocitos y la presentación de antígenos, destacando el papel del factor regulador del interferón 5 (IRF5) en la diferenciación de células B(4). Las características patológicas incluyen infiltrados linfocíticos en glándulas afectadas y la producción de autoanticuerpos, provocando inflamación y daño glandular(5).
Los pacientes con SS muestran signos de activación de células B, incluyendo hipergammaglobulinemia, elevación de cadenas ligeras libres, y positividad para autoanticuerpos como el factor reumatoide (FR) y los anticuerpos anti-Ro (detectado en el 60-80%) y anti-La (presente en el 30-40%)(6). El SS se clasifica en primario, y asociado a condiciones reumáticas como artritis reumatoide (AR) y lupus eritematoso sistémico (LES)(6). Los criterios de clasificación se basan en la presencia de xerostomía, xeroftalmia y un trastorno autoinmune subyacente, además de la detección de autoanticuerpos y el examen histopatológico de las glándulas salivales(7).
A pesar de los criterios existentes, el SS es una enfermedad heterogénea con una amplia variedad de presentaciones clínicas y velocidades de progresión. Los criterios actuales pueden no capturar adecuadamente las fases tempranas o las manifestaciones extraglandulares de la enfermedad, lo que sugiere la necesidad de enfoques diagnósticos más inclusivos y precisos(8,9).
Investigaciones realizadas de forma reciente han demostrado la importancia de identificar mecanismos moleculares, y biomarcadores para mejorar la comprensión y clasificación del SS(10). La identificación de biomarcadores, que son moléculas o eventos indicativos de procesos normales o patológicos, es crucial para avanzar en el diagnóstico, la estratificación de pacientes y el desarrollo de nuevas terapias(11). Además, éstos funcionan como efectores de vías moleculares que redundan en efectos biológicos o fisiopatológicos(12).
El objetivo de este estudio es identificar nuevos biomarcadores y mecanismos moleculares implicados en la fisiopatogénesis del SS, mediante la revisión y análisis de la evidencia existente para explorar las distintas vías de génesis de la enfermedad. Este estudio se enfocará en las vías moleculares descritas en la Tabla 1, con el propósito de comprender mejor la complejidad y heterogeneidad del SS.
Tabla 1. Diferentes vías moleculares implicadas génesis del Síndrome de Sjögren
| Vías de linfocitos B y CXCL13/CXC5 |
| Vía Catepsina S (CTSS)/Cistatina C (CYS C) |
| Vía Quimioquina C-X3-C Modificada de Ligando 1 (CX3CL1) / (CX3CR1) / Catepsina S (CTSS) |
| Vía quimiocina Regulada por Activación del Timo (TARC) / Receptores de Quimiocinas (CCR4 Y CCR8) |
| Vía del Factor de Activación de Células B (BAFF) |
| Vía Células T Reguladoras Foliculares (TFR) y las Células T Auxiliares Foliculares (TFH) |
| Vía Células T CD4 de Tipo TH17 + ACT1 + STAT3 |
| Vía de la Proteína Morfogenética Ósea 6 (BMP6) a través de complejos receptores de Serina / Treonina Quinasa Transmembrana (ACVR) de Tipo I y Tipo II Específicos |
| Vía de la Estimulación del Receptor de Oxitocina |
| Vía Receptor ze Zinc (ZNR) / Receptor 39 Acoplado A Proteína G (GPR39) |
| El Autoantígeno, Calponina-3 |
METODOLOGÍA
Estrategia de búsqueda de información
Para esta revisión narrativa, se identificó literatura mediante la formulación de las siguientes preguntas clave: ¿Cuáles son los biomarcadores identificados en el Síndrome de Sjögren y cuáles son los mecanismos moleculares involucrados en su fisiopatología? Se realizaron búsquedas en bases de datos como PubMed, Clinical Key, Scopus, Cochrane Library, Nature, Science Direct y Google Académico, abarcando artículos publicados desde enero de 2018. Los criterios de búsqueda se diseñaron utilizando términos del tesauro DeCs o MeSH, tales como "Sjögren AND Fisiopatología", "Sjögren AND Biomarcadores", entre otros. Además, se revisaron las referencias bibliográficas de los artículos seleccionados para obtener información adicional.
Criterios de inclusión y exclusión
Los criterios de inclusión abarcaron revisiones sistemáticas, narrativas, reportes de casos con revisión literaria, metaanálisis y ensayos aleatorizados. Se excluyeron duplicados, casos sin revisión, cartas al editor y trabajos con información incompleta o inaccesibles.
Extracción de datos y evaluación de la calidad de los artículos identificados
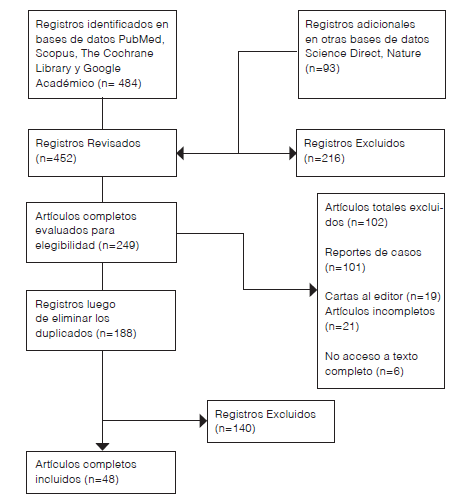
En la revisión, tras aplicar los criterios PRISMA Preferred Reporting Items for Systematic reviews and Meta-Analyses) a 452 registros iniciales, se seleccionaron inicialmente 188 artículos, finalmente se eligieron 48 artículos, organizados por temas, enfocándose en mecanismos moleculares y biomarcadores clínicamente relevantes en la fisiopatología del Síndrome de Sjögren. Se priorizaron publicaciones de alto impacto según el Journal Citation Reports (JCR) (Figura 1).
RESULTADOS Y DISCUSIÓN
Actualmente, los antígenos que inducen SS incluyen péptido Ro, péptido La, péptido M3R (receptor muscarínico 3), anhidrasa carbónica 2 (CA2) y extracto de proteína de glándula submandibular (GS)(13,14). También los desencadenantes extrínsecos y la disbiosis son factores importantes involucrados en la patogénesis del SS (37-40). Además, se ha descrito cómo la inmunización con autoantígenos específicos puede inducir la degradación de la tolerancia inmunitaria y provocar inflamación y disfunción glandular de los pacientes con SS(15).
La hiperactividad de las células B y la hiperplasia de los ganglios linfáticos son características únicas del SS; es así como las células B juegan un papel vital en la patogenia de esta enfermedad(5). Además, existe aumento de las citoquinas proinflamatorias en suero, incluidas interleuquinas (IL)-2, IL-4, IL-6, IL-17A, interferón (IFNγ) y factor de necrosis tumoral (TNF-α), que pueden afectar la función de las células B y alterar la función secretora de las glándulas salivales y oculares(16,17) (Figura 2). Pero no sólo las células B están implicadas en los mecanismos moleculares de la fisiopatogénesis en el SS. A continuación, se describen otras vías fisiopatológicas y posibles biomarcadores implicados.
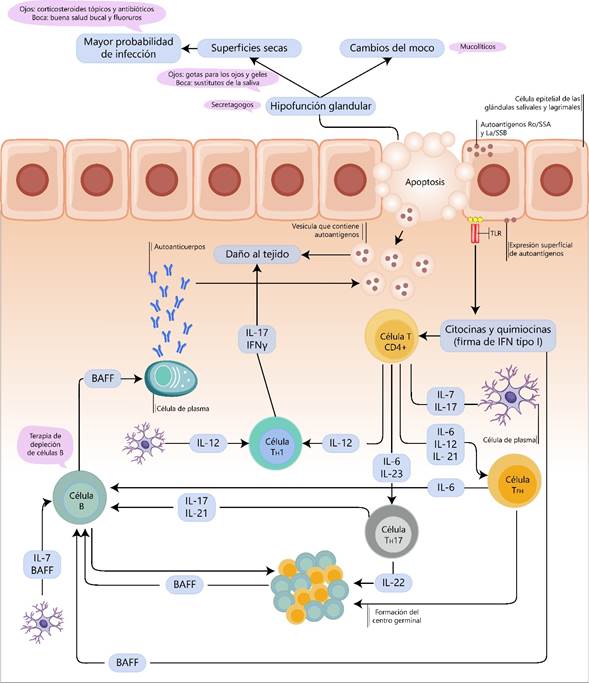
Las células epiteliales de las glándulas salivares (SGEC) expresan receptores tipo Toll(TLR). La producción de autoantígenos, la regulación positiva de moléculas inmunocompetentes (quimiocinas y citocinas), apoptosis e hipofunción epitelial, inicia debido a la activación de la señalización de TLR en el epitelio de la glándula. Estos autoantígenos pueden desligarse de las SGEC y exponerse a las células inmunitarias. Fuente: elaboración propia.
Vías de linfocitos B y CXCL13/CXC5
La interacción entre las células B y el receptor de quimiocinas CXC tipo 5 (CXCR5) juega un papel crucial en el SS a través de la quimiocina CXCL13, que media la agregación de células B en las glándulas salivales y se ve influenciada por el aumento de IFNα en pacientes con SS. Esta interacción promueve la formación de estructuras similares a centros germinales, estimulando crónicamente a las células B para la producción de autoanticuerpos(18). Además, el reclutamiento de células inductoras de tejido linfoide, dirigido por CXCL13 e IL-7, contribuye a la génesis de estas estructuras, involucrando a células que expresan CXCR5 y CD127(18). Los niveles elevados de CXCL13 en suero y saliva de pacientes con SS se asocian directamente con la actividad de la enfermedad, resaltando su relevancia en la patología y como potencial marcador de actividad(19).
Vía Catepsina S (CTSS)/Cistatina C (CYS C)
La catepsina S (CTSS) es una cisteína proteasa con funciones esenciales en procesos fisiológicos, como la degradación de la matriz extracelular, la presentación de antígenos mediante MHC II y el catabolismo de proteínas. Su papel se extiende a la activación del receptor de dolor inflamatorio y producción de citoquinas(20). Particularmente en el contexto lacrimal, la CTSS mantiene actividad en pH ácido y neutro, influyendo en la composición de las lágrimas y la superficie ocular(21). Su implicación en enfermedades autoinmunes se destaca por una actividad elevada en pacientes con SS comparada con individuos con ojo seco no asociado a SS(22). La medición de CTSS lagrimal emerge como un potencial biomarcador para SS, regulada por inhibidores como la cistatina C (Cys C), cuyos niveles alterados modulan la actividad de CTSS(20). Estudios indican una correlación entre bajos niveles lacrimales de Cys C y alta actividad de CTSS en SS, afectando la concentración de proteínas clave como lactoferrina e IgA secretora, esenciales para la defensa ocular. Esto sugiere una disminución de estas proteínas en SS, enfatizando la importancia de CTSS como marcador y agente patogénico en la enfermedad(22).
Vía Quimioquina C-X3-C Modificada de Ligando 1 (CX3CL1) / (CX3CR1) / Catepsina S (CTSS)
La quimioquina CX3CR1, presente en células inmunitarias como NK, dendríticas, linfocitos T, monocitos y macrófagos, juega un rol crucial en adhesión y quimioatracción, facilitando la transmigración leucocitaria(23). Se ha observado elevación de su ligando CX3CL1 en suero de pacientes con enfermedades autoinmunes como LES, AR y SS(23). Investigaciones destacan la interacción CX3CL1/CX3CR1 y CTSS en la patogénesis del SS, mostrando aumento de CX3CL1 en lágrimas y su inducción junto a CTSS por IFN-γ en células epiteliales corneales y glandulares, implicando su papel en la localización y activación de células inmunitarias. Esto sugiere que CX3CL1 podría servir como biomarcador predictivo en terapias contra SS que marquen a CTSS e IFN-γ, y su sistema podría ser una diana terapéutica potencial para modular la respuesta inmunitaria en SS(24).
Vía quimiocina Regulada por Activación del Timo (TARC) / Receptores de Quimiocinas (CCR4 Y CCR8)
TARC (Timo y Quimiocina Regulada por Activación), también conocida como ligando 17 de quimiocina CC Modificado (CCL17), se expresa en el timo y es producida por células dendríticas, células endoteliales, queratinocitos y fibroblastos(25). TARC tiene afinidad como ligando por los receptores de quimiocinas (CCR) CCR4 y CCR8, que se expresan predominantemente por células Th2; por tanto, TARC induce reacciones inflamatorias dominantes Th2(25). En un estudio midieron las concentraciones de TARC en pacientes con enfermedad por IgG4, SS y controles. Las concentraciones de TARC fueron significativamente más bajas en los pacientes con SS y los controles sanos(26).
Vía del Factor de Activación de Células B (BAFF)
BAFF, una citocina crucial para la supervivencia y proliferación de las células B, juega un papel significativo en la fisiopatología del Síndrome de Sjögren (SS), con niveles elevados en el suero y glándulas salivales de pacientes(27). Su concentración se correlaciona con los anticuerpos anti-Ro, anti-La y FR, implicando su contribución a la actividad autoinmune en SS(16).Además de ser producido por monocitos y macrófagos, en SS, las células T y B también secretan BAFF(28). Hay una relación entre la actividad de interferón tipo I y la secreción de BAFF, sugiriendo un rol activo de las células epiteliales salivales en la patogénesis del SS, especialmente en la promoción de ojo seco. Este conocimiento destaca la importancia de BAFF como objetivo terapéutico potencial en SS(29).
Vía Células T Reguladoras Foliculares (TFR) y las Células T Auxiliares Foliculares (TFH)
Las células T reguladoras foliculares (TFR) y las células T auxiliares foliculares (TFH) emergen como biomarcadores prometedores para la actividad linfoide ectópica en el SS(30). Un estudio en 16 pacientes con SS reveló que la proporción de TFR a TFH en sangre y la presencia de células TFH PD-1+ICOS+ podrían indicar distintas manifestaciones del SS primario. Esta relación se vincula con la neogénesis linfoide ectópica y la actividad de la enfermedad. Un cociente TFR/TFH con punto de corte de ≥0,278 y valores del cociente TFR/TFH en sangre ≥0,302, mostraron una alta precisión en la clasificación de pacientes con SS, asociándose con sialoadenitis focal(30). Estos hallazgos sugieren que la diferenciación de células TFR podría ser un proceso secundario a la activación humoral(31). Además, se sugiere que las células epiteliales salivales podrían inducir la diferenciación de células TFH a partir de células T CD4+ vírgenes, abriendo la posibilidad de que la diferenciación de células TFR también ocurra in situ, ofreciendo una nueva perspectiva en la comprensión de la patogénesis de SS(32).
Vía Células T CD4 de Tipo TH17 + ACT1 + STAT3
Las células Th17, un grupo proinflamatorio de células T CD4+, son cruciales para la homeostasis inmune y la defensa contra patógenos, pero su hiperactividad se asocia con enfermedades autoinmunes como psoriasis, LES, AR y SS(33). La señalización de IL-17, mediada por el adaptador Act1, es esencial para la transmisión de señales a través de NF-κB y STAT3 en células tisulares(34). Un estudio reveló que la ausencia de Act1 en ratones provoca una respuesta Th17 excesiva, con síntomas de enfermedades autoinmunes, indicando que Act1 regula negativamente la activación de STAT3, manteniendo así la homeostasis inmune. La interacción Act1-STAT3 modula las respuestas dependientes de IL-23 en células T y la función de células B por IL-21, controlando la autoinmunidad. Sin embargo, aún se desconocen los mecanismos específicos por los cuales la deficiencia de Act1 resulta en una respuesta hiperTh17(35).
Vía de la Proteína Morfogenética Ósea 6 (BMP6) a través de complejos receptores de Serina / Treonina Quinasa Transmembrana (ACVR) de Tipo I y Tipo II Específicos
La señalización de BMP6 juega un papel crucial en funciones biológicas como la homeostasis del hierro y el desarrollo óseo, y recientemente se ha vinculado a la patogénesis del SS(36). Estudios indican que BMP6 se encuentra sobre expresada en las glándulas salivales de pacientes con SS, correlacionándose con reducción del flujo salival y aumento del infiltrado inflamatorio(37). La señalización mediada por BMP6, a través de receptores de serina/treonina quinasa y la activación de SMADs, se integra complejamente con la ruta de interferón (IFN), sugiriendo una interacción entre ambas vías. Este fenómeno se asocia con una disminución en la expresión de las acuaporinas AQP1 y AQP5, esenciales para la hidratación de las glándulas salivales(38). IFN-γ, por ejemplo, incrementa la expresión de SMAD7, un antagonista que modula la respuesta al TGF-β. Este entrelazamiento de vías destaca un mecanismo por el cual la inflamación y la disfunción glandular se exacerban en SS(39). Investigaciones recientes sugieren que inhibir la señalización de BMP puede reducir la infiltración de células T productoras de IFN-γ en las glándulas, ofreciendo una potencial estrategia terapéutica para mitigar la inflamación y preservar la función glandular en SS(39).
Vía de la Estimulación del Receptor de Oxitocina
Las células mioepiteliales (MEC) en las glándulas lacrimales desempeñan un papel crucial, formando una red alrededor de las células acinares y ductales, y respondiendo a estímulos neuronales gracias a la expresión de receptores muscarínicos y purinérgicos. Además de sintetizar componentes de la membrana basal y secretar factores de crecimiento, estas células poseen la habilidad de contraerse, facilitando la expulsión de líquidos y proteínas(40). Sin embargo, en el SS, se observa una alteración en la producción de la membrana basal y en la matriz extracelular (α-actina del músculo liso (SMA) y calponina y marcadores como queratinas (5 y 14)(41); por parte de los MEC, así como una reducción en la expresión de proteínas contráctiles y el receptor de oxitocina, lo que compromete la función contráctil de los acinos ante inflamaciones crónicas. Esto se ve reflejado en la incapacidad de los acinos para responder adecuadamente a la estimulación con oxitocina(42). La inflamación también modula negativamente la expresión de receptores y afecta la actividad de las metaloproteasas de matriz, alterando la estructura y función glandular. Además, la proteína SMA es fundamental para que se produzca la contracción adecuada de los MEC. Además, las citocinas inflamatorias, particularmente IL-1β, disminuyen la expresión del receptor de oxitocina en músculo liso, mientras que la actividad de MMP2 aumenta en glándulas lacrimales inflamadas, implicando la necesidad de investigar más sobre su papel en el SS(42).
Vía Receptor Zinc (ZNR) / Receptor 39 Acoplado A Proteína G (GPR39)
El zinc (Zn+2) actúa como cofactor de numerosas enzimas e influye en funciones celulares al regular canales y receptores como NMDA, GABA A, y purinoceptor 5, a través del receptor de zinc ZnR/GPR39, induciendo la señalización de calcio intracelular y la formación de Inositol trifosfato IP3(43). En las glándulas exocrinas, incluidas las salivales, esta señalización es crucial para la regulación del tráfico de acuaporina y la secreción de agua(44). El calcio intracelular, junto con la acetilcolina y los receptores muscarínicos, modula la secreción salival mediante la activación de fosfoinosítido fosfolipasa C beta (PLC-β)(45). Un estudio destacó que en las glándulas submandibulares humanas, ZnR/GPR39 media la señalización de calcio y la translocación de AQP-5 de manera independiente a la señalización muscarínica e histaminérgica, sugiriendo un mecanismo específico por el cual el zinc promueve la salivación, lo cual es de particular interés para entender mejor la disfunción salival en el SS(46).
El Autoantígeno, Calponina-3
La calponina, una proteína de unión a Ca+2 en miocitos del músculo liso, regula la contracción de los miofilamentos actina F e inactiva la ATPasa de la miosina II(47). Un estudio identificó a calponina-3 como nuevo autoantígeno en SS, encontrando anticuerpos anti-calponina-3 en pacientes con SS, LES, miositis y esclerosis múltiple. En SS, estos anticuerpos fueron más comunes en pacientes con neuropatías, sugiriendo un papel en la patología neurológica asociada(48).
CONCLUSIÓN
Los avances tecnológicos han enriquecido la comprensión del SS, permitiendo análisis detallados de la genética y los mecanismos fisiopatológicos subyacentes. La medición de la metilación del ADN ofrece perspectivas sobre la patogénesis, el diagnóstico y el tratamiento de enfermedades autoinmunes. Se ha observado una interacción significativa entre células epiteliales salivales y subpoblaciones de células B y T, crucial en la activación de la autoinmunidad, la formación de autoanticuerpos, y la generación de inflamación. La búsqueda de biomarcadores no invasivos surge ante la limitación de los métodos actuales y la naturaleza invasiva de las biopsias. Este enfoque molecular promete una clasificación más precisa de los pacientes, superando los criterios clínicos convencionales, y apunta hacia estrategias terapéuticas más efectivas basadas en la biología específica de la enfermedad.