INTRODUCCIÓN
El lupus eritematoso sistémico (LES) es un trastorno reumatológico autoinmune crónico con una elevada he terogeneidad en su presentación clínica, respuesta al tratamiento y pronóstico1. Los resultados clínicos aso-ciados a esta enfermedad han mejorado, no obstante, aún se asocia a una elevada morbilidad y mortalidad, especialmente en individuos jóvenes1. Dentro del com promiso multiorgánico asociado a esta enfermedad, las manifestaciones renales gozan de un interés preponderante.
Dentro de los órganos afectados con frecuencia se encuentran los riñones, identificándose compromiso renal hasta en el 60% de los pacientes con LES2. Definiendo la nefropatía lúpica (NL) como una enfermedad autoinmune que compromete el riñón con un papel per sistente y preponderante del sistema inmunológico en la inmunopatología y los brotes de la enfermedad3. El tratamiento habitual de la NL incluye medicamentos nefroprotectores, además inmunosupresores e inmunomoduladores, la dosificación de estos fármacos varia ampliamente en las etapas iniciales de la enfermedad, con efectos variables sobre el grado de proteinuria, comportándose como factor de confusión en estudios de intervención en enfermedad renal crónica (ERC), por lo cual pueden ser excluidos como en efecto ocurrió en los grandes ensayos clínicos (ECA) con los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT-23). Por lo tanto, se esperan estudios con mayor base poblacional y centrada exclusivamente en la sub- población de estos pacientes, que nos permita dilucidar el rol que se puede asumir por estudios preclínicos. Se presenta una revisión incluyendo la información disponible a la fecha y la utilidad potencial de los iSGLT-2 en el tratamiento de NL.
NEFROPATIA LÚPICA
La nefropatía lúpica es la causa más frecuente de enfermedad renal en los pacientes con lupus eritema- toso sistémico (LES) y un factor de riesgo importante para morbilidad y mortalidad. Su fisiopatología es heterogénea con contribución de factores genéticos, inflamatorios y ambientales1-4. Se ha establecido que aproximadamente un 50 a 60% de pacientes con LES desarrollan afectación renal, en donde, la NL es una de las causas, pero no la única de disfunción renal en esta población2,4. La mortalidad asociada con LES es significativamente más alta en pacientes con NL comparada con aquellos que no presentan esta condición un ejemplo es la mortalidad atribuible a enfermedad renal en pacientes con NL proliferativa a 5 años la cual desde su inicio es de aproximadamente 5 a 25%4. Adicionalmente, 10 a 30% de los pacientes con NL pro- gresarán a falla renal y requerimiento de terapia de reemplazo renal. Pacientes con formas proliferativas de NL (Clase III, IV o III/IV + V) tienen alto riesgo de requerimiento de terapia de reemplazo renal4.
Una descripción extensa del tratamiento de la NL escapa a los objetivos de este documento, sin embargo, el manejo de la NL varía acorde a la severidad de la enfermedad y el riesgo de progresión del daño renal. En las formas no proliferativas de NL con proteinuria subnefrótica y tasa de filtrado glomerular (TFG) normal son tratados de manera conservadora, con manejo de factores de riesgo cardiovasculares como hipertensión arterial empleando bloqueo del sistema renina angiotensina aldosterona (RAS) e inmunomodulación con antimaláricos como la hidroxicloroquina4. En cuanto al papel de la inmunosupresión, tradicionalmente se ha limitado para manejo de las manifestaciones extrarenales4. Por otro lado, en las formas proliferativas de NL (Clase III, IV o III/IV + V) y clase V con síndrome nefróti co asociado pueden ser tratados con inmunosupresión sistémica asociada a uso de dosis altas de esteroides. Esta fase inicial corresponde a la fase de inducción con duración aproximada de 3 a 6 meses4. Estos pacientes han sido excluidos típicamente de los ensayos clínicos con inhibidores de SGLT-2 por su efecto confuso sobre el comportamiento de la proteinuria.
La fase de inducción se continúa con la de mantenimiento, con miras a la prevención de las recaídas, las cuales se asociaran a incremento en el riesgo de progresión de la enfermedad renal y posibilidad de requerimiento de terapia de reemplazo renal. Los propósitos de la terapia de mantenimiento tradicionalmente se han limitado a dos componentes, en primera instancia con- solidar la terapia de inducción, garantizando remisión completa evitando toxicidad asociada a terapia farma Cológica4. En segunda instancia continuar la supresión de la autoinmunidad para prevenir las recaídas y sus consecuencias. Los medicamentos tradicionalmente empleados en esta fase corresponden al micofenolato mofetilo, ciclofosfamida o azatioprina, entre otros. No obstante, los avances recientes en la comprensión de la patogenia de la NL, los avances en su tratamiento han sido limitados con persistencia una elevada tasa de mortalidad1-4.
FISIOLOGÍA DE LOS INHIBIDORES DE SGLT-2
En individuos sanos, el túbulo renal proximal es capaz de reabsorber toda la glucosa filtrada (Aproximadamente 180 g/día)5. La reabsorción renal de glucosa requiere de la eliminación basolateral activa de sodio (Na+) mediante la Na+/k+-ATPasa que genera la fu- era impulsora electroquímica favoreciendo la entrada apical de glucosa a través del cotransportador Sodio- Glucosa (SGLT) impulsado por Na+5.
Los SGLT, son miembros de la familia de transportadores de solutos 5 (SLC5), proteínas de membrana que median el movimiento de glucosa, osmolitos, vitaminas, aminoácidos además de iones6. La familia de SLC5 tiene 12 miembros responsables del cotransporte de iones Na+ acoplado a glucosa, colina, ácidos grasos de cadena corta y mioinositol6.
Específicamente, los inhibidores SGLT-2, son medicamentos que llegaron inicialmente como antidiabéticos, pero en el curso de su desarrollo, se han encontrado importantes efectos cardio y nefroprotectores aun en pacientes no diabéticos. Estos efectos nefroprotectores renales, inicialmente descritos en pacientes con nefropatía diabética son dados porque inter- vienen en los tres ejes de progresión del compromiso renal (eje hemodinámico, inflamatorio y metabólico)6-15,22-24.
Actúan inhibiendo la reabsorción tubular de glucosa en el túbulo proximal promoviendo el aumento en la excreción urinaria de glucosa o glucosuria, lo cual favore ce el control glucémico. Además, de manera indirecta bloquean el intercambiador NH3, con lo cual favorecen la natriuresis y este fenómeno de aumento de la glucosuria y aumento de la natriuresis estimulan a la macula densa para que por fenómeno de reflejo favorezcan la vasoconstricción de la arteriola aferente y de esta manera se produce disminución de la presión intraglomerular, es decir mejoría de la hiperfiltración. Este fenóme no hemodinámico es importante, porque es uno de los mecanismos que tienen de nefroprotección. También se conoce, que tienen potentes efectos antinflamatorios a nivel renal y que impactan en los efectos deletéreos dados por la glucotoxicidad intrarrenal, además son vasodilatadores renales y mejoran la hipoxia tisular renal, entre otros efectos y tienen efectos en el control metabólico, en la reducción de peso (Figura 1).
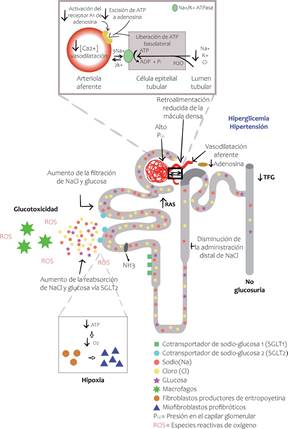
Figura 1 Compromiso renal en pacientes diabéticos. Hiperglicemia, hiperfiltración glomerular, aumento de glucosuria y natriuresis, glucotoxicidad e hipoxia renal, aumento estrés oxidativo y de los ROS. Los inhbidores SGLT-2 mejoran todos estos efectos adversos renales. Tomado y adaptado de la Rico-Fontalvo J, et al. J Clin. Nephrol 2020:4 (1): 44-4515.
En resumen, Los inhibidores SGLT-2 tienen efectos directos e indirectos que impactan beneficios renales o de nefroproteccion7) (Figura 2). Un ECA publicado en 2015, Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus patients (EMPA- REG OUTCOME), demostró que la empagliflozina reduce de manera significativa eventos cardiovasculares en pacientes con diabetes mellitus tipo 2 con enferme- dad cardiovascular preexistente8. Un análisis post hoc de los resultados renales mostró que la empagliflozina reduce la progresión de la ND9.
Por otro lado, en modelos de vasculitis y nefritis lúpica, se ha detectado presencia de SGLT-2 mediante la expresión del ARNm de SLC5A2, predominantemente localizados en el comportamiento tubulointersticial al compararse con el compartimiento glomerular10. Adicionalmente, el estudio de muestras de riñón de estos pacientes ha revelado la presencia de SGLT-2 a nivel tubulointersticial, específicamente en el borde en cepillo luminal del túbulo proximal de la corteza renal tanto en vasculitis renal como NL10.
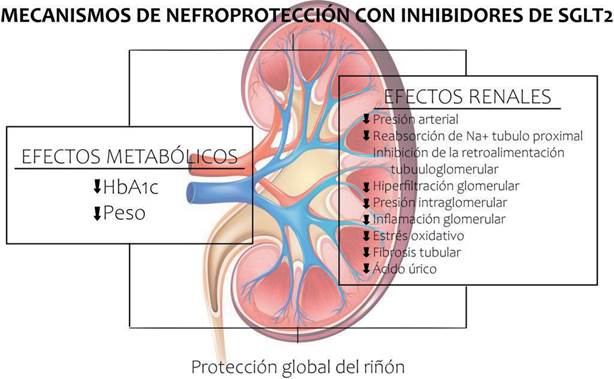
Figura 2 Mecanismos de nefroprotección.Tomado y adaptado de la Rico-Fontalvo J, et al. J Clin. Nephrol 2020:4 (1): 44-4515.
Estos estudios comparativos, basados en análisis de transcripción han evidenciado una expresión de SGLT-2 predominantemente a nivel tubulointersticial en riñones de pacientes con nefritis lúpica10. Hakroush y colaboradores, analizaron muestras de controles sanos (31 pacientes), nefropatía diabética17, nefropatía por IgA24, vasculitis renal21 y NL20, encontrando un incremento en la expresión de mARN de SLC5A2 a nivel túbulointersticial (p=<0.0001), sin identificar diferencias en sexo (p=0.7) o en la expresión glomeru lar de SLC5A2 (p=0.4)10. No obstante, en la evolución en el tiempo se evidencia una reducción en la expresión de SLC5A2, lo cual podría sugerir que durante la fase de mantenimiento o evolución de la enfermedad se reducirán los efectos favorables de la inhibición del SGLT210. Por lo tanto, esto justificaría los beneficios potenciales del tratamiento con inhibidores de SGLT-2, especialmente una vez se ha superado la fase inicial de inducción a la remisión y se alcanza estabilidad de la función renal con persistencia de proteinuria10.
INHIBIDORES DE SGLT-2 EN ENFERMEDAD RENAL CRÓNICA NO DIABÉTICA
Los efectos renoprotectores de los iSGLT-2 en pacien tes con enfermedad renal crónica no diabética han sido corroborados en grandes estudios clínicos, la evidencia al respecto viene en crecimiento y se esperan estudios que amplíen la base de pacientes con ERC con potencial utilidad para estos medicamentos11-13. Los mecanismos que median los efectos renoprotectores de los iSGLT-2 no están del todo dilucidados, sien- do los más relevantes la corrección de la hiperfiltración glomerular, la mejoría en la inflamación y la mejoría de la hipoxia renal14. Los beneficios de estos medicamentos se extienden a pacientes con ERC no diabética. Resultados derivados de ECA de fase III, incluyendo los resultados favorables derivados del Dapagliflozin in Patients with Chronic Kidney Disease (DAPA-CKD) y los futuros resultados del estudio Study of Heart and Kidney Protection with empagliflozin (EMPA-KIDNEY). Una descripción detallada de su utilidad fuera de la ERD escapa a los objetivos de esta revisión12,13.
En la evolución histórica de las investigaciones de seguridad cardiovascular de iSGLT-2, específicamente la experiencia derivada del estudio Empagliflozin Cardiovascular Outcome Event Trial in Type 2 diabetic Mellitus (EMPA-REG OUTCOME) con empagliflozina, CANagliflozin cardiovascular Assessment Study (CAN- VAS) con canagliflozina y DECLARE-TIMI 58 con dapagliflozina, mostraron que en general son cardiopro- tectores, con reducción directa de eventos adversos cardiovasculares mayores (MACE)8,15-17. Dentro de los resultados secundarios, se evidenció un importante impacto en desenlaces renales y en falla cardiaca, por lo cual, se llevaron a cabo investigaciones en pacientes no diabéticos, entre ellos, aquellos con enfermedades renales18. No obstantes, estos estudios limitaron la participación de pacientes con enfermedades autoinmunes o en uso de terapia inmunomoduladora e inmunosupresora, dado se comportarían como variable de confusión por sus efectos paralelos de reducción de proteinuria.
EL PAPEL DE INHIBIDORES DE SGLT-2 EN NEFRI- TIS LÚPICA
Los iSGLT-2 se han convertido en prometedoras opciones terapéuticas con evidencia derivada de los grandes ensayos clínicos y la creciente experiencia originada de su adición a la práctica clínica rutinaria9,12,18. Estas terapias innovadoras se encuentran en fase de adopción, siendo equiparadas al bloqueo RAS en el paciente con ERC19. No obstantes, más allá de sus beneficios teóricos en enfermedad autoinmunes con disfunción renal y proteinuria, especialmente NL, se requieren de manera prioritaria ensayos clínicos aleatorizados, controlados y prospectivos, que permitan establecer el papel de estas terapias.
Por otro lado, los pacientes con enfermedades autoinmunes fueron excluidos de los grandes ensayos clínicos en los cuales se evaluaron los efectos de iSGLT-2 en ERC no diabética, no obstante, cada vez más se discuten los efectos y potencial uso de estos medicamentos en escenarios como la vasculitis asociada a an ticuerpos anticitoplasma de neutrófilos y él LES10.
La evidencia de utilización de iSGLT-2 en NL se des- prende de pequeños estudios observacionales y series de casos. Morales y colaboradores, describen la experiencia con 5 pacientes con NL confirmada histológicamente, en tratamiento inmunosupresor y persistencia de proteinuria, con un valor medio de 2.2 gramos/día a quienes se les añadió empagliflozina 10 mg/día20. Realizaron seguimiento durante 8 semanas posterior al inicio de tratamiento, documentando una reducción de proteinuria en aproximadamente 49.9%, con cambios mínimos en la tasa de filtración glomerular20. Con respecto a este último resultado, se debe anotar que los cambios en la TFG se deben esperar y por lo tan- to medir a largo plazo, por ello se necesitan estudios orientados a evaluar estos resultados específicamente.
En los grandes ECA en los cuales se evaluaron los efectos de iSGLT-2 sobre la proteinuria y resultados cardiovasculares en enfermedad renal crónica no diabética, destacando los estudios Effects of the SGLT2 inhibitor dapagliflozin on proteinuria in nondiabetic patients with chronic kidney disease (DIAMOND) y Dapagliflozin in Patients with Chronic Kidney Disease (DA- PA-CKD), se excluyeron pacientes con NL, poliquistosis renal y vasculitis11,12. Por otro lado, un estudio en curso, un ECA a gran escala que evaluará resultados a largo plazo en ERC no diabética, empleando empagliflozina, The Study of Heart and Kidney Protection With Empagliflozin EMPAKidney (NCT03594110), no incluyo pacientes que se encontraban en tratamiento con terapia de inmunosupresión intravenosa en los últimos 3 meses; o cualquier persona que actualmente estaba recibiendo prednisolona >45 mg o equivalente. En los criterios de exclusión no dice que se excluyeron a to- dos los pacientes con NL, por lo cual probablemente incluyeron pacientes con nefritis lúpica en fase de mantenimiento de la enfermedad, estos resultados se esperan estén listos para finales de este año13,21. Por ahora la evidencia en su utilización se desprende de beneficios teóricos e informe de casos.
Por otro lado, la morbilidad y mortalidad cardiovasculares también se incrementan de manera sustancial en pacientes con LES, convirtiéndose en una causa común de mortalidad en estos pacientes, seguida por las complicaciones derivadas de las infecciones oportunistas y la severidad asociada a la actividad de la enfermedad19. Adicionalmente, las intervenciones terapéuticas involucradas en el tratamiento de LES, incluyendo las dosis acumuladas de agentes inmunosupresores se relacionan con incremento simultaneo en el riesgo cardiovascular a largo plazo19.
Por definición todos los pacientes con NL tienen enfermedad renal crónica, mostrando grados variables de albuminuria19. La albuminuria es una marcador de daño renal, un porcentaje significativo de pacientes con LES además tendrán alteraciones estructurales y funcionales, especialmente la hiperfiltración glomerular19. Dentro de la estrategia habitual recomendada por las guías de manejo de NL, se encuentra el bloqueo RAS con efectos nefroprotectores comprobados, sin embargo, se presenta persistencia de un riesgo residual en los diferentes escenarios de ERC. En consecuencia, la prevención de la progresión de la ERC y su consiguiente cargar cardiovascular adversa, podrían ser impactadas con el uso de iSGLT-2. Adicionalmente, muchas de las consecuencia sistémicas del LES como la hipertensión pulmonar, síndrome metabólico e HTA podrían encontrar algún beneficio con el uso de iSGLT-119.
CONCLUSIONES
La NL es una complicación frecuente y que marca pronostico en los pacientes con LES. Es claro que es- tos pacientes tienen un componente inflamatorio importante.
El tratamiento de pacientes con NL implica la utilización de tratamiento inmunosupresor y antiinflamatorio, así como un enfoque basado en nefroprotección y reducción de riesgo cardiovascular. Dentro de los efectos favorables de los iSGLT-2 incluyen reducción de hiperfiltración glomerular, albuminuria, lesión tubular, caída de tasa de filtrado glomerular y mejoría de la inflamación renal por múltiples vías. La evidencia actual de utilización de iSGLT-2 en NL es bastante limitada y se desprende de pequeños estudios observacionales y series de casos, en donde hay beneficios en reducción de proteinuria. Por lo anterior, los iSGLT-2 podrían tener cabida en el enfoque terapéutico de pacientes con nefropatía lúpica, como estrategia de nefro y cardioprotección, especialmente en pacientes de alto riesgo de progresión renal o albuminuria y alto riesgo cardiovascular. No obstante, se requieren estudios que permitan evaluar sus efectos a largo plazo y beneficios potenciales.















