INTRODUCCIÓN
La queratitis infecciosa es una emergencia ocular que requiere una rápida y adecuada intervención para asegurar la recuperación visual del paciente. Sin tratamiento adecuado, la infección corneal conduce a ceguera a través de cicatrices corneales y endoftalmitis. Las bacterias y los hongos se encuentran entre los agentes etiológicos frecuentes responsables de queratitis (Khokhar, Mulla, Shah, & Vaghela, 2013; Moemen, Bedir, Awad, & Ellayeh, 2015).
La queratitis micótica es una causa principal de morbilidad ocular grave y ceguera. Es de distribución mundial, pero es más común en las regiones tropicales y subtropicales, 6 a 60% de las queratitis observadas son de etiología micótica, dependiendo principalmente de la localización geográfica, en algunos países en desarrollo representa aproximadamente el 50% de todos los casos de queratitis microbiana obtenidos en cultivo (Ibrahim et al., 2011; Samudio et al., 2014). Se considera una infección oportunista asociada principalmente a trauma ocular con materiales vegetales (Laspina et al., 2004; Moemen et al., 2015; Samudio et al., 2014). En países tropicales como Paraguay, la incidencia de queratitis por hongos es relativamente alta debido a las condiciones climáticas (Laspina et al., 2004; Samudio et al., 2014).
Aunque el cultivo de patógenos microbianos se considera el método de referencia para el diagnóstico e identificación definitivos, la evaluación microscópica directa del frotis de la muestra proporciona información inmediata sobre los organismos causales. Por lo tanto, es de inmensa ayuda en el diagnóstico y tratamiento tempranos (Bharathi et al., 2006; Khokhar et al., 2013).
El cultivo de hongos, requiere tiempo e instalaciones especiales no disponibles en todos los laboratorios, lo que retrasa el tratamiento clínico. Por lo tanto, la detección microscópica directa de estructuras fúngicas en raspados corneales permite un rápido diagnóstico presuntivo (Bharathi et al., 2006; Khokhar et al., 2013; Moemen et al., 2015).
El examen microscópico es fundamental porque, además de orientar un tratamiento precoz, permite evaluar la significación clínica de los aislados y descartar microbiotacolonizante. La coloración de Gram se considera una tinción básica en la valoración inicial de muestras para análisis bacteriológico. Otras preparaciones utilizadas para la búsqueda de hongos son el examen en frescocon hidróxido de potasio (KOH), azul de lactofenol, coloraciones como Giemsa, naranja de acridina, calcofluor, metenamina de plata (tinción de Gomori-Grocott), ácido periódico de Schiff (tinción de PAS); entre éstas, algunas requieren tiempo e infraestructuras especiales y el costo de cada prueba las hace inaplicables en centros primarios, secundarios e incluso en la mayoría de los centros terciarios (Bharathi et al., 2006; Nicola, 2005)
Para minimizar la morbilidad ocular, el tratamiento antimicrobiano oportuno y específico debe iniciarse sobre la base de la evaluación clínica y microbiológica. El diagnóstico microbiológico es fundamental cuando las lesiones son inespecíficas, recurrentes o falla el tratamiento empírico, pero presenta la dificultad de que analiza muestras de pequeño volumen que contienen un bajo inóculo (Bharathi et al., 2006; Ibrahim et al., 2011; Nicola, 2005).
El presente estudio fue diseñado para establecer la utilidad diagnóstica de la coloración de Gram para bacterias y hongos en comparación con el cultivo, en pacientes con sospecha de queratitis infecciosa que asistieron a tres centros oftalmológicos de referencia.
MATERIALES Y MÉTODOS
Estudio observacional descriptivo de pruebas diagnósticas en el que se incluyeron muestras de pacientes con sospecha clínica de queratitis infecciosa que consultaron en tres centros oftalmológicos de referencia de Asunción-Paraguay entre enero 2015 a mayo 2017. Las muestras de raspado corneal fueron tomadas en los respectivos Centros por oftalmólogos con escarificador oftálmico estéril previa colocación de anestésico tópico y directamente inoculadas en placas de agar Sabouraud y otra parte colocada en lámina estéril para la evaluación microscópica posterior. Además fue realizado un hisopado de la lesión con hisopo estéril e inmediatamente inoculado en medios de agar sangre y agar chocolate estriando en forma de S rotándolo al mismo tiempo y un segundo hisopado fue colocado a un caldo tioglicolato. Posteriormente las muestras fueron transportadas al laboratorio de Microbiología del Instituto de Investigaciones en Ciencias de la Salud (IICS) para el estudio microbiológico. Una vez en el laboratorio el medio Sabouraud fue incubado a 28ºC durante 15 días, los medios sólidos para bacterias en atmósfera de CO2 del 5% a 35°C y caldo tioglicolato a 35ºC, durante 5 días. Los cultivos se consideraron relevantes en todos los casos en que se observó desarrollo del microrganismo en el sitio de inoculación. Los aislados de hongos fueron identificados en base a sus características macro y micromorfológicas y las bacterias según sus propiedades bioquímicas por métodos microbiológicos convencionales. Las muestras utilizadas fueron codificadas resguardando la identidad del paciente.
La sensibilidad, especificidad, valor predictivo positivo (VPP) y valor predictivo negativo (VPN) de la coloración de Gram fueron calculados considerando el cultivo como método de referencia.
RESULTADOS
Fueron incluidas 216 muestras, de las cuales, 136 (63,0%) fueron positivas por cultivo y 80 (37,0%) negativas para hongos o bacterias. La queratitis bacteriana por cultivo representó el 28,7% (62/216), de las cuales 47 muestras fueron positivas por coloración de Gram. La queratitis de origen micótico por cultivo representó el 34,7% (75/216), observándose 78 muestras positivas en el Gram.
El 94,8% (129/136) de los cultivos positivos fueron monomicrobianos. De los 7 cultivos polimicrobianos, en 2 muestras se aisló simultáneamente hongo y bacteria, consistente con el examen microscópico directo.
La sensibilidad global de la coloración de Gram para el diagnóstico de hongos o bacterias fue 85,3% (116/136) y la especificidad de 90% (72/80); los valores predictivos positivo (VPP) y negativo (VPN) fueron 93,5% (116/124) y 78,3% (72/92), respectivamente (Tabla 1).
Tabla 1. Utilidad de la coloración de Gram para el diagnóstico de microorganismos (hongos y bacterias)

Sensibilidad= 116/136= 85,3% (IC95%: 78,97-91,61)
Especificidad= 72/80= 90% (IC95%: 82,8-97,2)
Valor Predictivo Positivo= 116/124= 93,5% (IC95%: 88,8-98,3)
Valor Predictivo Negativo= 72/92= 78,3% (IC95%: 69,3-87,2)
El cultivo para hongos fue positivo en 75 muestras; la sensibilidad de la coloración de Gram para hongos fue 94,7% (71/75), especificidad 95,0% (134/141); VPP 91,0% (71/78) y VPN 97,1% (134/138) (Tabla 2).
Tabla 2. Utilidad de la coloración de Gram para el diagnóstico de hongos
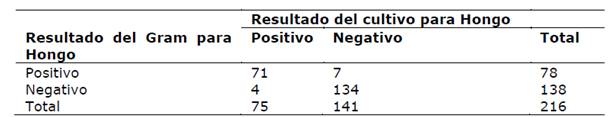
Sensibilidad= 71/75= 94,7% (IC95%: 88,91-100)
Especificidad= 134/141= 95,0% (IC95%: 91,1-98,98)
Valor Predictivo Positivo= 71/78= 91,0% (IC95%: 84,04-98,01)
Valor Predictivo Negativo= 134/138= 97,1% (IC95%: 93,94-100)
El cultivo para bacterias fue positivo en 62 muestras, la sensibilidad de la coloración de Gram fue 74,2% (46/62), especificidad 99,4% (153/154); VPP 97,9% (46/47) y VPN 90,5% (153/169) (Tabla 3).
Tabla 3. Utilidad de la coloración de Gram para el diagnóstico de bacterias

Sensibilidad= 46/62= 74,2% (IC95%: 62,5-85,89)
Especificidad= 153/154= 99,4% (IC95%: 97,76-100)
Valor Predictivo Positivo= 46/47= 97,9% (IC95%: 92,68-100)
Valor Predictivo Negativo= 153/169= 90,5% (IC95%: 85,82-95,24)
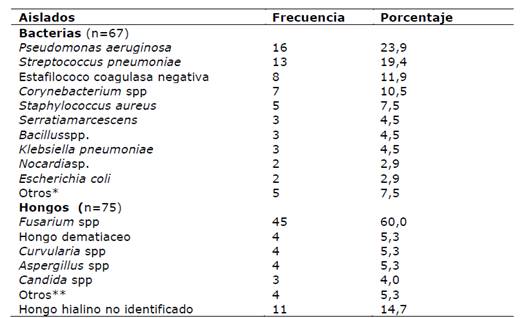
Fusarium spp. fue el hongo más frecuentemente aislado (45/75) y entre las bacterias Pseudomonas aeruginosa (16/62) y Streptococcus pneumoniae (13/62) (Tabla 4).
DISCUSIÓN
La queratitis es la principal causa de ceguera unilateral en los países en desarrollo. Se ha observado que la etiología de la queratitis varía en diferentes localizaciones geográficas y climáticas y también tienden a variar con el tiempo (Khokhar et al., 2013). En Paraguay la frecuencia de queratitis es alta, especialmente las de etiología micótica debido al clima tropical y al gran porcentaje de la población dedicada a las actividades agrícolas (Laspina et al., 2004).
Los cultivos requieren más tiempo dependiendo de los organismos (24 h a 3 semanas), el examen directo de un frotis da resultados en un corto tiempo, los métodos para la detección rápida y la confirmación del diagnóstico clínico son extremadamente importantes en la intervención de la queratitis infecciosa (Bharathi et al., 2006; Khokhar et al., 2013).
Aunque el examen en fresco con KOH para agentes fúngicos es practicado por la mayoría de los laboratorios clínicos, en nuestra situación es más factible el empleo de frotis fijados en láminas que los montajes en húmedo de raspados corneales, ya que los mismos no se recogen en el laboratorio, son remitidos de varios centros oftalmológicos en un tiempo mínimo de 2 horas luego de la toma de muestra.
La sensibilidad general de la coloración de Gram obtenida en este estudio, considerando tanto bacterias y hongos fue superior a lo reportado en la revisión de Nicola (2005) de 40-70% y por López-Cerero, Etxebarria y Mensa (2009) de 30% en las úlceras tempranas o pequeñas (<2mm) y entre 40- 60% en las úlceras más avanzadas.
Para el diagnóstico de queratitis bacteriana, la sensibilidad de la coloración de Gram fue menor a lo reportado por Bharathi et al. (2006) de 100% y mayor a lo informado por Sharma et al. (2002) en queratitis temprana 36% y en queratitis avanzada 40,9% en India. Asbell y Stenson (1982) informaron una sensibilidad de 67,0% de la tinción de Gram en la detección de bacterias en los EE.UU y Dunlop et al. (1994) 62,0% en Bangladés.
En este estudio, la sensibilidad de la coloración de Gram para el diagnóstico de hongos fue mayor a lo reportado por Gopinathan et al. (2002)y Bharathi et al. (2006) de 88.2% y 87%, respectivamente, en el último las positividades de Gram fueron mayores entre los ojos con úlceras mayores a 2 mm que entre los ojos con úlceras más pequeñas (<2 mm). Además mostró mayor sensibilidad comparada con otros estudios en donde utilizaron el examen en fresco con KOH para la observación directa de hongos, como los de Khokhar et al. (2013)y Moemen et al. (2015)quienes reportaron una sensibilidad de 83% y 84,62%, respectivamente.
Los microorganismos fúngicos fueron los patógenos más aislados en el 34,7% de las muestras de raspado corneal, con predominio de los hongos filamentosos como Fusarium spp. seguido de Aspergillus spp. y Curvulariaspp. igual a lo reportado en otros estudios (Gopinathan et al., 2002; Hernandez-Camarena et al., 2012; Hernández-Camarena et al., 2013; Moemen et al., 2015). La queratitis fúngica es una entidad de peor pronóstico que una infección bacteriana y requiere de un diagnóstico precoz para evitar consecuencias irreversibles (Samudio et al., 2014).
Entre los agentes de etiología bacteriana, coincidente con otros estudios, el microorganismo Gram negativo más aislado fue Pseudomona saeruginosa (Hernandez-Camarena et al., 2012; Hernández-Camarena et al., 2013; Laspina et al., 2009; Nentwich et al., 2015). El organismo Gram positivo más aislado fue Streptococcus pneumoniae seguido de Staphylococcus coagulasa negativo a diferencia de lo reportado en otros estudios donde predominaron especies de Staphylococcus coagulasa negativo como Staphylococcus epidermidis (Hernandez-Camarena et al., 2012; Hernández-Camarena et al., 2013).
Tanto la coloración de Gram como el cultivo poseen sus limitaciones, lo que explicaría los valores muy variables obtenidos en la literatura. La coloración Gram no tiñe eficientemente quistes o trofozoitos de amebas, que pueden pasar inadvertidos o ser confundidos con leucocitos o restos celulares, en el presente estudio no fue detectado ningún quiste o trofozoito compatible con Acantamoeba sp. La calidad del frotis es variable, la distribución correcta de la muestra sobre la lámina es muy importante, de manera a lograr un extendido fino y homogéneo. Si el frotis es grueso, las hifas se intercalan a través del tejido necrótico y su identificación puede ser difícil o imposible. Coincidimos con Bharathi et al. (2006) y López-Cerero et al. (2009) quienes consideran muy importante la experiencia del observador y la exhaustiva búsqueda de microorganismos por todo el extendido.
En cuanto a las limitaciones del cultivo, es un método que consume mucho tiempo y la identificación de especies no está disponible en todos los laboratorios de diagnóstico de rutina. Uno de los factores que puede incidir en labaja tasa de positividad es el tratamiento previo con antibióticos y el uso de anestésicos con efectos bacteriostáticos, por lo que se recomienda el uso de anestésicos sin preservadores y la toma de muestra previa al tratamiento para mejorar la recuperación de microorganismos (Hernandez-Camarena et al., 2012; Hernández-Camarena et al., 2013).
Otras veces el tamaño de la ulcera no permite obtener suficiente material para la búsqueda de todos los probables agentes etiológicos, por lo que el criterio clínico es muy útil para priorizar los estudios. Las úlceras corneales con tamaños grandes proporcionarán suficiente material para la investigación microbiológica, tanto para frotis como para cultivos, la preparación de frotis adicionales y la inoculación de más de un medio de cultivo (Bharathi et al., 2006).
Aunque el examen en fresco con KOH para la visualización de agentes fúngicos es practicada por los laboratorios clínicos, y con muy buena sensibilidad, en este estudio fue evaluado el frotis fijado en lámina, de modo a facilitar el transporte desde los centros oftalmológicos hasta el laboratorio, habiendo obtenido resultados comparables para el diagnóstico de hongos, y permitiendo la detección simultánea de bacterias. Los métodos para la detección rápida y la confirmación del diagnóstico clínico son extremadamente importantes en la intervención de la queratitis infecciosa (Bharathi et al., 2006; Khokhar et al., 2013).
En conclusión, la coloración de Gram tuvo buen desempeño diagnóstico para las queratitis micóticas, constituyéndose en una herramienta sencilla y rápida disponible en cualquier laboratorio de microbiología. Sin embargo, la sensibilidad para bacterias fue más baja, esto puede deberse en algunos casos al escaso material ya sea por la técnica de raspado o la cantidad de material raspado que también depende del tamaño de la úlcera, bajo inóculo bacteriano e inadecuada distribución de la muestra en el frotis dificultando la observación. Según los hallazgos de este estudio la coloración de Gram puede recomendarse para el diagnóstico e inicio precoz del tratamiento de queratitis infecciosa. Sin embargo, no reemplaza al cultivo que es necesario para la identificación definitiva de especies como método confirmatorio.