La leucemia linfoblástica aguda es una neoplasia causada por la proliferación clonal de precursores linfoides con infiltración de la médula ósea y capaz de producir pancitopenia en forma variable. Afecta diferentes órganos y sistemas y es potencialmente mortal por sangrados o infecciones1,2.
El género Leuconostoc pertenece a la familia Streptococcaceae. Son cocobacilos gram positivos con reacción catalasa negativo e intrínsecamente resistente a glucopéptidos. Son fácilmente confundidas con Enterococcus o Streptococcus y son de difícil aislamaniento por las grandes exigencias nutricionales. Se utilizan en la industria alimentaria, dadas sus propiedades fermentadoras y su capacidad para generar compuestos odoríferos. Originalmente no consideradas patógenos hasta inicios de siglo donde se reportaron los primeros casos de bacteriemia en pacientes inmunocomprometidos3.
Se presenta un caso de choque séptico secundario a una bacteriemia por Leuconostoc mesenteroides, asociada al uso de nutrición parenteral en paciente con íleo paralítico secundario a alteración hidroelectrolítica y leucemia linfoide aguda.
Mujer de 28 años de edad consulta con cuadro de 1 mes de evolución de astenia, debilidad generalizada, sensación febril intermitente y pérdida de peso de 5 kilogramos. No tenía antecedentes patológicos de interés.
Al examen físico del ingreso se constató en boca lesiones ampollosas y placas blanquecinas. El laboratorio mostró leucocitosis de 27000 /mm3 con 90% de blastos en el hemograma. Se realizó el diagnóstico de leucemia linfoblástica aguda CD 20+ mediante punción aspirativa de la médula ósea. Se realizó quimioterapia con doxorrubucina, citarabina, metotrexate y prednisona.
Al ingreso recibió también aciclovir y fluconazol por lesiones bucales. Posteriormente presentó mala evolución clínica con aplasia medular secundaria a quimioterapia y fiebre a repetición por lo que se inició cobertura antibiótica empírica con piperacilina tazobactan y vancomicina. Los hemocultivos resultaron negativos y a las 3 semanas de internación presentó diarrea profusa con deshidratación y alteración electrolítica (Potasio <2,2 mEq/L). Se aisló en hisopado anal Enterococcus faecium resistente a vancomicna (EVR); la muestra fue incubada en agar y bilis. Luego de identificadas las colonias de enterococo, se realizó una prueba para aislar las cepas de ERV. El primer paso de esta prueba consistió en la dilución de la cepa problema en 10 μL de caldo hasta lograr una turbidez de 0,5 McFarland. Luego, esta dilución fue inoculada en un agar de infusión de cerebro-corazón que contenía 6 μg/mL de vancomicina y se incubó por 24 h. La paciente ya estaba tratada con meropenen más tigeciclina. Concomitantemente presentó abombamiento abdominal y detención de heces y gases, alteración de la función hepática (bilirrlubina total >4,5 mg/dL). La ecografía abdominal y tomografía abdominal con contraste no mostraron causa aparente del cuadro abdominal. Se diagnosticó hígado de sepsis e íleo paralítico secundario a alteración electrolítica. Debido a intolerancia oral y débito bilioso por sonda nasogástrica se inició nutrición parenteral mediante catéter venoso central.
Con el correr de los días presentó buena evolución clínica completando antibióticos por 14 días y supera aplasia medular. En su 5° semana de internación presentó choque séptico con requerimientos de inotrópicos (noradrenalina) y se inicia empíricamente tigeciclina y meropenen ante sospecha de EVR y toma de hemocultivos. El hemocultivo informa parcialmente cocos gram (+). A pesar de terapia antibiótica no mejora el choque llegando a requerir noradrenalina a 2 mgr/hora. Al 4° día se indentifica Leuconostoc mesenteroides en hemocultivos que se procesaron en una máquina automática de cultivo BACTEC (Becton Dickinson, Franklin Lakes, EE. UU.) con resultado positivo ( 1 de 2 ). Las colonias se colocaron sobre agar de sangre de oveja al 5% y agar Mc. Conkey. La identificación se realizó utilizando el sistema VITEK®2 (bioMérieux, Marcy L'Etoile, Francia).
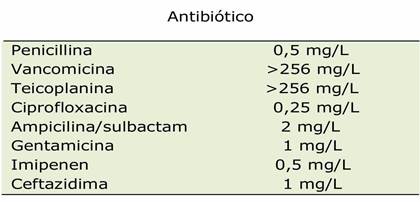
Se realizó antibiograma (tabla 1) y ante retorno de cultivo se suspendió tigecilina y meropenen y se inició ciprofloxacina y gentamicina, que completó 14 días y es externada en buenas condiciones generales
Leuconostoc mesenteroides es habitualmente no reconocido por los laboratorios de bioquímica, en general no forman parte de la rutina de investigación de los mismos y su reconocimiento no es sencillo. Son cocos gram (+) hemolíticos o alfa-hemolíticos (-) que crecen sobre agar de sangre de oveja y se confunden generalmente con Enterococcus o Streptococcus. En este caso en particular se pensó en una nueva infección por EVR posterior al choque séptico4,5.
Se distribuye ampliamente en la naturaleza. A nivel industrial se utiliza en la producción de vinos, productos lácteos, azúcar y, en ocasiones, se aisla en muestras vaginales y de heces humanas3,5,6.
Se consideran factores de riesgo para bacteriemia a Leuconostoc mesenteroides: catéter venoso central, administración de nutrición parenteral, cirugía gastrointestinal, tratamiento previo con vancomicina y diarrea crónica. Se acepta como principal probable puerta de entrada la gastrointestinal pero también se plantea la piel como puerta de entrada4,5. El presente caso cumple con varios factores de riesgo.
Cada vez son más reconocidos como patógenos importantes en pacientes neutropénicos, probablemente debido a la inmunosupresión. La infección conLeuconostocpuede causar fiebre, sepsis relacionada con catéter intravenoso, bacteriemia, dolor abdominal, gastroenteritis y meningitis5.
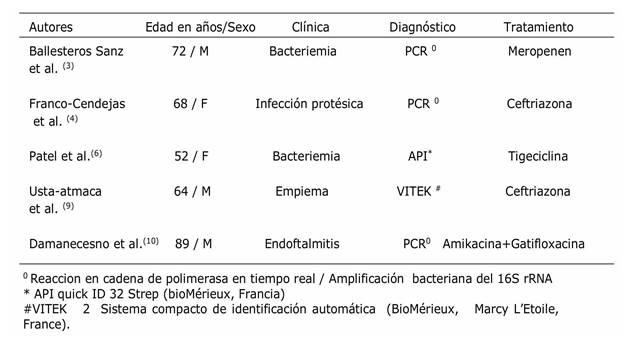
Los principales reportes de casos fueron en niños a finales de los 90 y comienzo del siglo7,8. Las guías sobre tratamiento son inexistentes y dependen del antibiograma. En la tabla 2 se muestra la terapia antibiótica de casos adultos reportados de Leuconostoc mesenteroides en los últimos 10 años 2,3,5,7,8 y llama la atención la falta de una terapia unificada.
En conclusión, se demostró la presencia Leuconostoc y como a pesar de no existir reportes se puede asociar con choque séptico. La principal característica es su espectro de sensibilidad ya que son intrinsecamente resistentes a los glucopéptidos. Además de su facilidad de confusión con otros gérmenes, se debe incluir este género en el diagnóstico diferencial de procesos infecciosos en pacientes con factores y condiciones clínicas predisponentes.