El síndrome de Bartter es una enfermedad poco usual denominada también enfermedad del asa perdedora de sal. Se caracteriza por hipopotasemia, hipocloremia, hipomagnesemia, hipocalcemia, alcalosis metabólica, presión arterial normal con excreción de cloro en orina aumentada, concentraciones elevadas de renina y aldosterona, siendo un defecto primario en la reabsorción de cloro en la porción ascendente del asa de Henle1-2.
Hay una amplia variedad de enfermedades del asa perdedoras de sal adquiridas cuyo mecanismo etiopatogénico no son bien conocidos, exceptuando aquellos cuya relación puede ser mediada genéticamente. Aquellas producidas por diversas drogas o patologías subyacentes son denominadas síndrome pseudo Bartter (PB) o síndrome Bartter-like2, pudiendo estar asociado a la fibrosis quística, diarrea hipoclorémica, mal rotación intestinal, anorexia con vómitos excesivos, diabetes insípida o la administración de furosemida y laxantes de uso crónico, cisplatino, prostaglandinas, antibióticos como los aminoglucósidos y la colistina3-6.
La colistina es un bactericida tipo polimixina (polimixina E), eficaz contra bacilos gramnegativos, principalmente útil contra gérmenes multirresistentes7. Existen pocas referencias sobre los efectos adversos medicamentosos asociados, pero los estudios más recientes destacan dos sistemas afectados más frecuentes: la neuro y la nefrotoxicidad8,9. La nefrotoxicidad inducida por colistina, aunque no muy bien definida, parece ser influenciada por el perfil renal alterado previo, patologías subyacentes e hipoflujo renal. La explicación probablemente se postula como un defecto tubular a nivel del asa ascendente de Henle secundaria a una condición de enfermedad primaria renal, mediada por prostaglandinas6,8,10.
Los cuadros clínicos manifiestos en estos pacientes son atribuidos estrictamente a la depleción de electrolitos ya citados como los calambres, parestesias, temblores, alteraciones del sensorio que van desde la agitación psicomotriz a la obnubilación, tetania y la más temible de las afecciones del aparato cardiovascular: las arritmias malignas y subsecuente paro cardiaco.
Considerando que la lesión tubular del síndrome PB está mediada por el exceso de prostaglandinas, renina y la depleción de varios electrolitos, la terapéutica específica contempla la suplementación de los déficits hallados: potasio, magnesio, calcio. Además, la correcta hidratación y el uso de antiinflamatorios no esteroideos para inhibir la génesis de prostaglandinas, considerándose también efectivo el uso de espironolactona, ya que, contrarresta la hiperaldosteronismo y la pérdida renal de potasio1.
Caso 1
Paciente de sexo femenino de 73 años, normotensa con presión arterial al ingreso 140/70 mmHg, procedente de área urbana. Con antecedente de posoperatorio de amputación supracondílea del miembro inferior derecho de seis meses de evolución, con infección del muñón de amputación con varios gérmenes aislados de manera sucesiva y tratadas. En el último cultivo se aísla A. baumanii por lo que recibió varios esquemas de antibióticos y toilettes quirúrgicos sin mejoría clínica ni laboratorial. Se inicia tratamiento con colistina en forma parenteral dirigido. Al inicio del tratamiento presentó urea y creatinina elevados 102 mg/dL y 2,3mg/dL respectivamente por lo que se disminuye dosis de colistina . Ya en nuestro centro se halla con electrolitos en rango, hipoalbuminemia 2,6 g/dL. Por persistencia de la fiebre y leucocitosis 18000/mm3 y neutrófilos 90% se inicia tratamiento con colistina en infusión continua, con buena hidratación nefroprotectora y suplementos de potasio. En el día 18 de tratamiento, el control laboratorial revela alcalosis metabólica pH 7,58, HCO3 60 mEq/L, hipopotasemia 2,2 mEq/L, hipocalcemia 7,4 mEq/L, hipomagnesemia 1,2 mEq/L. Los niveles de sodio y cloro dentro del rango. La funcionalidad renal persistía alterada haciendo meseta, pero con buen ritmo diurético. Se solicitó dosaje de electrolitos en orina que resultaron: sodio 100 mEq/24 hs, potasio 140 mEq/24 hs, magnesio 182 mEq/24 hs, calcio 420 mEq/24 hs, cloro 270 mEq/24 hs, confirmando la pérdida de potasio, magnesio, calcio y cloro. Se realizan correcciones rápidas de electrolitos y suplementos. Se decide suspender tratamiento con colistina por culminar los días estimados al caso, normalizando el disbalance al segundo día de la suspensión con la simple suspensión del fármaco. No presentando síntomas asociados al caso. Paciente externada sin disbalances.
Caso 2
Paciente de sexo femenino de 88 años procedente de área rural, con diagnóstico de arteriopatía obstructiva crónica, hipertensa con presión arterial de 150/90 mmHg, sometida a tratamiento médico y quirúrgico de revascularización del miembro inferior izquierdo, con posterior complicación pseudoaneurismática e infección del sitio quirúrgico. Se aísla K. pneumoniae productora de carbapenemasas y se inicia tratamiento con colistina parenteral. Previo al inicio del tratamiento, urea y creatinina dentro de parámetros normales: 30 mg/dL y 0,9 mg/dL respectivamente, con diuresis espontánea y buen ritmo diurético. Electrolitos en rango, hipoalbuminemia 2,9 g/dL. Al sexto día de tratamiento, los controles laboratoriales revelan alcalosis metabólica pH 7,54, HCO3 48 mEq/L, hipopotasemia 2,2 mEq/L, hipocalcemia 7,3 mEq/L, hipomagnesemia 1,0 mEq/L. Los niveles de sodio y cloro eran normales y la funcionalidad renal, basada en los niveles de urea y creatinina, eran normales, con buen ritmo diurético. Se dosaron electrolitos en orina que resultan sodio 45 mEq/24 hs, potasio 155 mEq/24 hs, magnesio 145 mEq/24 hs, calcio 430 mEq/24 hs, cloro 255 mEq/24 hs por lo que se evidencia la pérdida de electrolitos en orina. Presenta además encefalopatía metabólica, por lo que se decide suspender tratamiento con colistina y tratar los disbalances hidrolectrolíticos con correcciones rápidas más suplementos agregándose espironolactona a 200 mg/día e ibuprofeno 400 mg cada 6 hs por la sospecha de síndrome PB a colistina. Los trastornos se corrigen paulatinamente al décimo día de suspensión del antibiótico con mejoría del cuadro encefalopático de manera total. Paciente fue externada sin disbalances.
Caso 3
Paciente de sexo femenino, procedente de área urbana de 39 años, que ingresa remitida de Unidad de cuidados críticos, normotensa con presión arterial 110/70 mmHg, portadora de síndrome de Guillan Barré post influenza A. Ingresa con cuadro de neumonía a A. baumanii en tratamiento con colistina parenteral, ya en su quinto día, con hipopotasemia 2,5 mEq/L, leucocitos 13.000/mm3. Perfil renal y hepático normales, calcio, magnesio y gases normales, albúmina 3,6 g/dL. El dosaje de electrolitos en orina evidenció la pérdida de potasio, cloro, magnesio y calcio: sodio 200 mEq/24 hs, potasio 165 mEq/24 hs, magnesio 170 mEq/24 hs, calcio 460 mEq/24 hs, cloro 334 mEq/24 hs. aún contando con suplemento de potasio. En su séptimo día de antibioticoterapia, paciente presenta hipopotasemia 1,8 mEq/L persistente a correcciones iniciales, hipomagnesemia 0,9 mEq/L, hipocalcemia 6,1 mEq/L, alcalosis metabólica pH 7,61, HCO3 56 mEq/L. Se procede a la corrección de los mismos durante dos días consecutivos sin llegar a la normalidad, con clínica de trismus desde el segundo día de haberse constatado las diselectrolitemias, alteraciones electrocardiográficas compatibles con las alteraciones subyacentes. Se continua la suplementación, se inicia de tratamiento con espironolactona a 200 mg/día, ibuprofeno 400 mg cada 6 hs. Tras 48 horas de tratamiento los electrolitos llegan a la normalidad, pero la hipopotasemia normaliza recién al quinto día de tratamiento. Paciente recibe 14 días de colistina y ya sin clínica infecciosa se suspende antibiótico, manteniendo medidas de reposición por 3 días más hasta que fue externada con cuadro resuelto.
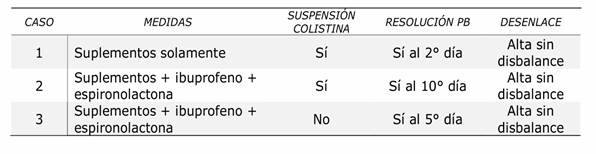
Se presentan dos tablas con el resumen comparativo de los datos demográficos, laboratoriales y clínicos (Tablas 1 y 2).
Tabla 1 Resumen comparativo de casos con síndrome pseudo Bartter: filiación, antecedentes patológicos personales, laboratorios.
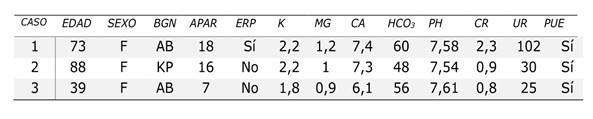
BGN: bacilos Gram negativos implicados, M: masculino, F: femenino, AB: Acinetobacter baumanii, KP: Klebsiella pneumoniae, APAR: aparición ó inicio contado en días, ERP: enfermedad renal previa, K: potasio, MG: magnesio, CA: calcio, ALB: albúmina, CR: creatinina, UR: urea, PUE: pérdida urinaria de electrolitos. NS: no solicitado.
PB: pseudo Bartter, Suplementos: correcciones con cloruro de potasio, sulfato de magnesio, gluconato de calcio. N/A: no aplica. ESPIR: espironolactona 200 mg/día, IBUPR: ibuprofeno 400 mg/6 hs.
El síndrome pseudo Bartter (PB) es una tubulopatía perdedora de sal adquirida1 cuya causa medicamentosa por el uso de colistina10 en adultos es muy rara y no contamos con publicaciones actuales, excepto en casos aislados en neonatos3,5,6. Debido a los escasos reportes en la literatura médica mundial resulta difícil describir con precisión los factores de riesgo que favorecen su incidencia. El cuadro clínico del PB está fuertemente asociado a la depleción de electrolitos (K+, Mg+, Ca+) y la alcalosis metabólica. Se presenta de manera variada con afectación multisistémica y cuyos principales blancos son el área neurológica y cardíaca con trastornos que van desde movimientos anormales a la depresión del sistema nervioso central y la aparición de arritmias ventriculares que conllevan a la arresto cardíaco y deceso del paciente10.
De un total de 3 pacientes, 2 han iniciado tratamiento con colistina parenteral dirigida a A. baumanii como única alternativa terapéutica por ser productoras de carbapenemasas y 1 paciente a K. pneumoniae también con el mismo mecanismo de resistencia. La elección de la colistina se debió a la multirresistencia observada en los bacilos gramnegativos en los hospitales11.
Todos los pacientes presentaron tras el inicio del tratamiento con colistina los disbalances metabólico-hidroelectrolíticos descritos en este síndrome: hipopotasemia, hipomagnesemia, hipocalcemia, alcalosis metabólica. Se realizó dosaje de electrolitos en orina en los 3 casos y no se realizó la determinación de la actividad de la renina plasmática, dosaje de aldosterona, que podrían ser útiles para corroborar el diagnóstico12, porque no contamos con esos estudios.
El promedio de aparición de síntomas y disturbios séricos varían desde 7 a 18 días, no encontrándose ninguna relación de los hallazgos con los factores de riesgo descritos en estudios fármaco-toxicológicos de la droga10).
Con respecto a la sintomatología solamente 2 pacientes presentaron cuadros neuro-musculares y trazados electrocardiográficos compatibles a los niveles de electrolitos bajos, aunque en promedio, todos los pacientes presentaron cifras bajas de potasio, magnesio y calcio. Esto probablemente se deba a factores individuales no caracterizables en la observación, tampoco guardan relación con los factores para la aparición tras la administración de medicamentos.
Un desenlace ominoso pudiera no estar precedido por empeoramiento clínico y tiene un papel importante la falta de reconocimiento de la noxa para su tratamiento oportuno. Viendo que las correcciones de los déficits no fueron suficientes para mantener la homeostasis, a pesar de las medidas instauradas de manera individual para cada alteración, todos los pacientes resolvieron el cuadro, 1 con la simple suspensión de la medicación, debida probablemente a que la nefrotoxicidad por colistina es potencialmente reversible10. Pero 1/3 de los casos resueltos, la simple suspensión no fue suficiente y se iniciaron tratamientos específicos con espironolactona e ibuprofeno, con buen desenlace. La instauración de éstos es debida a la toma de precauciones asociadas a diselectrolitemias y el uso de la colistina, se considera eventualmente la presencia del síndrome PB y ante el reconocimiento del ente se han podido instaurar medidas.
El periodo de resolución de los trastornos tanto laboratoriales como clínicos fue bastante diverso y no se pueden asociar entre sí13. La terapéutica parece ser efectiva ya que resuelve los trastornos que no fueron alcanzados con la simple corrección, probablemente por el tratamiento del aspecto fisiopatológico del caso.
El síndrome PB adquirido secundario al uso de colistina es una complicación bastante rara. Las características hipopotasemia, hipomagnesemia, hipocalcemia y la alcalosis metabólica son comunes. La sintomatología clínica es variable y subyacente a las alteraciones electrolíticas características. Más allá de la determinación sérica de los disturbios citados, existen otros métodos diagnósticos que ayudaría a comprobar la existencia de esta patología, como el dosaje de electrolitos en orina, actividad de la renina y aldosterona sérica, pero cuya poca asequibilidad hace imperioso pensar en este síndrome con los datos citados primeramente. El tratamiento oportuno, además de las medidas suplementarias de déficits, con la espironolactona y un antiinflamatorio no esteroideo como inhibidor de la actividad de la aldosterona y las prostaglandinas respectivamente, mejoran el cuadro.
Finalmente, recomendamos a los Internistas el uso prudente de la colistina, a pesar de las limitaciones que pudiéramos encontrar en el soporte paraclínico laboratorial, el reconocimiento precoz del síndrome PB y la instauración oportuna del tratamiento adecuado pues esta patología es potencialmente reversible pero también puede ser fatal.