Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Virtual de la Sociedad Paraguaya de Medicina Interna
On-line version ISSN 2312-3893
Rev. virtual Soc. Parag. Med. Int. vol.2 no.1 Asunción Mar. 2015
https://doi.org/10.18004/rvspmi/2312-3893/2015.02(01)31-052
ARTÍCULO ORIGINAL
Efectos de la edad sobre la morbimortalidad de la hemorragia intracerebral
Effect of age on the morbimortality of intracerebal hemorrhage
Autor: Juan S. Arce Kita1
Resumen
Introducción: los datos disponibles sobre factores de riesgo y mortalidad en sujetos jóvenes tras una hemorragia intracerebral (HIC) son muy escasos.
Objetivo: determinar los factores de riesgo en dicha población y comparar la frecuencia de mortalidad y complicaciones asociadas entre adultos menores de 50 años edad y aquellos de 50 años o más.
Material y métodos: se elaboraron dos cohortes, una de pacientes adultos menores de 50 años con HIC (cohorte 1) y otra de adultos de 50 años o más con HIC (cohorte 2), admitidos en el Hospital Nacional de Itauguá en el período 2013-2014.
Resultados: fueron incluidos 53 pacientes en la cohorte 1 y 89 en la cohorte 2. Ambas cohortes fueron similares en sus aspectos demográficos y clínicos. La mortalidad fue superior en la cohorte 2. La escala de Glasgow al egreso fue mayor en la cohorte 1. No hubo diferencias significativas entre ambas poblaciones en cuanto a incidencia de complicaciones infecciosas y neurológicas derivadas del hematoma.
Conclusión: la HIC en sujetos mayores de 50 años de edad se asocia a una mayor mortalidad.
Palabras claves: hemorragia intracerebral espontánea; edad; mortalidad; complicaciones neurológicas.
Abstract
Introduction: The available data about risk factors and mortality in young individuals after an intracerebral hemorrhage (ICH) are limited.
Objectives: To determine the risk factors in this population and then compare the mortality frequency and associated complications between adults younger than 50 years and those of 50 years old or more.
Materials and methods: Two cohorts were created, one of adult patients younger than 50 years old with ICH (cohort 1) and another of adults of 50 years and more with ICH (cohort 2), admitted into the National Hospital of Itauguá in the 2013-2014 period.
Results: Fifty three patients were included in cohort 1 and 89 in cohort 2. Both cohorts were similar in the demographic and clinical aspects. Mortality was higher in cohort 2. Glasgow scale at discharge was higher in cohort 1. There were not any significant differences between both populations in relation to the incidence of infectious and neurological complications originated in the hematoma.
Conclusion: The ICH in subjects older than 50 years old is associated with higher mortality.
Keywords: spontaneous intracerebral hemorrhage; age; mortality; neurological complications.
Introducción
El accidente vascular cerebral (ACV) es una entidad patológica caracterizada por un déficit neurológico atribuido a una lesión focal aguda del sistema nervioso central de causa vascular, en la que se incluyen al infarto cerebral, la hemorragia intracerebral (HIC) y la hemorragia subaracnoidea, consideradas en el mundo entero como las causas más importantes de discapacidad y muerte1.
La rápida instalación de signos clínicos indicativos de disfunción neurológica debido a una colección focal de sangre en el parénquima cerebral o en el sistema ventricular, no generado por un trauma, es lo que define al ACV ocasionado por una hemorragia intracerebral espontánea1.
Después del ACV isquémico, la HIC es la segunda causa más frecuente de accidentes cerebrovasculares a nivel mundial, representando alrededor del 10 a 20% del total, con una mortalidad a 30 días que ronda el 30-50%2. La mortalidad, a corto y largo plazo, parece no haber sufrido modificaciones significativas en las últimas décadas3.
El riesgo de ACV se incrementa exponencialmente con la edad. Aproximadamente, la mitad de los casos ocurre en individuos mayores de 75 años de edad. Según los datos disponibles en la literatura, en países occidentales, menos del 5% de todos los ACV ocurren en individuos menores de 45 años4. En el contexto del ACV por todas las causas ocurrido en el adulto joven, la HIC comprende el 0,7 - 40% en las diferentes series5.
En términos generales, la incidencia de la HIC ha disminuido en la última década. En países como Brasil y el Paraguay, se estima una incidencia de ACV hemorrágico de 60 a 70 casos por 100.000 habitantes cada año6.
La supervivencia a largo plazo es mayor en sujetos jóvenes que en aquellos de edad avanzada. Sin embargo, son las secuelas y la discapacidad los determinantes del gran impacto del ACV en el adulto en edad productiva para la sociedad7.
Factores de riesgo asociados a hemorragia intracerebral: la baja incidencia de eventos por HIC, sobre todo en individuos jóvenes, torna desafiante la identificación de todos los factores de riesgo implicados en su génesis8. Al igual que en sujetos de edad avanzada con HIC, en individuos menores de 50 años también la HTA resulta ser el factor de riesgo dominante, aunque la diabetes, tabaquismo, el uso excesivo de alcohol y la cafeína (en bebidas y drogas) también parecen desempeñar un papel de relevancia. Debido a que los mismos son factores modificables y relativamente comunes en el adulto joven, cierto grado de la morbilidad y mortalidad severa asociadas con la HIC, son prevenibles9. (Tabla 1)
- Hipertensión arterial. La HTA es considerada como el principal factor de riesgo de HIC en la edad media de la vida y en sujetos de edad avanzada. Existen sólo breves descripciones en lo que respecta a la HIC de etiología hipertensiva en individuos jóvenes, con una frecuencia del 11 a 64% del total de HIC, según las distintas series12. La incidencia de la hemorragia intracerebral se incrementa a medida que aumentan las cifras tensionales. Si bien la HTA se asocia a HIC de cualquier localización, el riesgo relativo es superior para hemorragias intracerebrales no-lobares (tálamo-capsular, cerebelo y tronco cerebral)13.
- Diabetes mellitus. La diabetes mellitus representa un importante factor de riesgo para los ACV tanto isquémicos como hemorrágicos14. Un meta-análisis publicado en el 2010, reunió los datos de 698.782 pacientes de 28 estudios prospectivos. El mismo determinó un hazard ratio de 1,56 (1,19-2,05) para el desarrollo de ACV hemorrágico en la población diabética15.
- Alcoholismo. El consumo de alcohol, sobre todo la ingesta de importantes cantidades de manera regular (más de 300 gramos de alcohol por semana), parece lesionar en forma temprana (incluido en sujetos jóvenes) los pequeños vasos16. El riesgo probablemente se halle incrementado por los desórdenes de la hemostasia que presentan los consumidores crónicos de alcohol con afección de la funcionalidad hepática17.
- Tabaquismo. Si bien aún existe cierto grado de controversia, ciertos estudios apoyan la posibilidad de que el tabaquismo podría ser un factor de riesgo independiente para desarrollar una hemorragia intracerebral18. Otros han relacionado dicho hábito con un mal pronóstico tras sufrir un ACV hemorrágico19.
- Niveles de colesterol. La hipercolesterolemia ha sido bien documentada como un factor de riesgo para sufrir un ACV isquémico. Por otro lado, en los últimos años, se han relacionado los bajos niveles de colesterol (hipocolesterolemia) con un riesgo aumentado de hemorragia intracerebral y hemorragia subaracnoidea. Un reciente meta-análisis, basado en 23 estudios, encontró una relación inversa estadísticamente significativa entre los niveles de colesterol (principalmente LDL) y el riesgo de ACV hemorrágico. El incremento en 1 mmol/L de colesterol total se asoció a una disminución de 15% en el riesgo de ACV hemorrágico20. Se ha relacionado también a los bajos niveles de LDL con un aumento de la mortalidad intrahospitalaria tras una hemorragia intracerebral21.
- Enfermedad renal crónica. El ACV isquémico y el hemorrágico ocurren con alta frecuencia en los sujetos con enfermedad renal crónica (ERC), sobre todo en aquellos en estadios finales de la enfermedad y sometidos a diálisis, con un riesgo relativo de 4,4-9,722. Además de ello, la HIC en pacientes con ERC moderada-severa (tasa de filtración <45 ml/min) presenta hematomas de mayor tamaño, hipertensión arterial de difícil control y un pronóstico sombrío23-25.
- Neoplasias hematológicas. Después de las infecciones, la hemorragia intracraneal representa la segunda complicación mortal más frecuente en sujetos con una neoplasia hematológica. El riesgo aumentado de HIC en este tipo de pacientes se ha atribuido a la disfunción y bajo recuento de plaquetas, deficiencias de factores de la coagulación, hiperleucocitosis, coagulación intravascular diseminada, entre otros trastornos26. Los pacientes con linfomas y leucemias mieloides agudas experimentan afección del SNC más frecuentemente que los sujetos con otros tipos de neoplasias hematológicas27,28
- Cocaína. El consumo de cocaína se ha relacionado con un amplio espectro de alteraciones en la esfera neurológica, como las debidas a complicaciones vasculares que ocasionan accidentes cerebrovasculares isquémicos y hemorrágicos, especialmente en individuos portadores de una malformación arteriovenosa o un aneurisma subyacente. Se ha propuesto que los mecanismos causales son las alteraciones de la hemostasia y vasoespasmos inducidos por la cocaína29.
- Historia de ACV previo. Un estudio prospectivo publicado en el año 2.013, realizó un seguimiento de entre 5-10 años a 961 pacientes que habían sufrido una HIC primaria. El mismo, en análisis multivariable, determinó que el ACV previo era el principal factor de riesgo independiente para la recurrencia de una hemorragia intracerebral primaria30.
- Anticoagulación. El uso de anticoagulantes orales se ha incrementado en la población mundial en las últimas décadas, especialmente de la warfarina. El principal inconveniente de los anticoagulantes antagonistas de la vitamina K es su estrecho margen terapéutico, la necesidad de controles laboratoriales periódicos y el riesgo de sangrados mayores31. En algunas series, la hemorragia intracerebral asociada a anticoagulantes representa cerca del 20% de los casos de HIC32,33.
Etiología: no existe aún una clasificación etiológica universalmente aceptada para la hemorragia intracerebral.
En el año 2012, tras una revisión retrospectiva de 1013 pacientes diagnosticados y tratados por HIC en el Hospital Central Universitario de Helsinki (Finlandia), se propuso una clasificación práctica para esta entidad. En la misma, se encasilla a la totalidad de casos en 6 grupos según la causa: malformaciones vasculares, por medicaciones (anticoagulación), angiopatía amiloide cerebral, enfermedades sistémicas, hipertensión arterial y otras etiologías indeterminadas34. (Tabla 2)
Fisiopatología: el sangrado no-traumático intracerebral es el resultado de la ruptura de las pequeñas arterias penetrantes del cerebro. Pareciera ser que, a medida que pasan los años, los vasos terminan sufriendo cambios degenerativos en sus paredes. A la edad avanzada, se suma el efecto deletéreo de la hipertensión arterial crónica y otros factores, como la diabetes10.
Cuando ocurre una hemorragia intracerebral, la mayoría de los sangrados se dan en las bifurcaciones de las arteriolas afectadas o en sus proximidades. En el caso de los hematomas lobares relacionados a la angiopatía amiloidea cerebral (AAC), el mecanismo subyacente parece ser una combinación del deterioro de la pared vascular y el depósito de amiloide a nivel capilar, arteriolar y en arterias de pequeño calibre, principalmente a nivel de la corteza cerebral. Inicialmente, el material congofílico (amiloide) se deposita entre la capa media y la adventicia de los vasos; posteriormente, el amiloide vascular se extiende a través de la media para ir reemplazando a la capa de músculo liso. En último término, dichos depósitos conducen a cambios vasculopáticos, lo que incluye la formación de microaneurismas, inflamación crónica perivascular y necrosis fibrinoide38. A continuación se mencionan efectos propios o secundarios del hematoma intraparenquimatoso que resultan determinantes en el desenlace.
Volumen del hematoma. Se ha relacionado al volumen inicial del hematoma intracerebral con un mal pronóstico39,40. No sólo parece tener implicancia en la mortalidad a corto plazo, sino también en el desenlace a 6 meses41. Se ha reportado que los hematomas pequeños (<30 ml) se asocian a un mejor pronóstico en comparación con los de mayor volumen, sobre todo si superan los 60 ml (grandes hematomas). Estos últimos ensombrecen notablemente el desenlace41-43.
Expansión del hematoma. La hemorragia intracerebral no es un evento monofásico que se detiene rápidamente. El hematoma continúa expandiéndose en las primeras 6 a 24 horas tras el evento, hasta en 40% de los individuos que sufren una HIC. El fenómeno de expansión se advierte tras la comparación del volumen del hematoma en el estudio de neuroimagen realizado al ingreso y otro efectuado 24-72 hs después. No existe definición universalmente aceptada en relación a lo que se considera un aumento significativo del hematoma (>6-12,5 ml)44. El mecanismo de producción de la expansión parece ser la ruptura de secundaria de vasos adyacentes a la lesión inicial, con episodios intermitentes de sangrado. La presencia de un sangrado activo en la angiotomografía se advierte por la extravasación del contraste en el sitio del hematoma, no teniendo conexión con vasos circundantes. Este hallazgo es un fuerte predictor de expansión del hematoma, mortalidad y pronóstico pobre12. Al igual que ocurre con la edad avanzada, el GCS al ingreso y el volumen inicial del hematoma, la expansión del hematoma es considerado un predictor de mortalidad y desenlace funcional45.
Área de penumbra perilesional. Existe cierta controversia con respecto a la existencia o no de áreas de penumbra isquémica en el tejido cerebral que rodea al hematoma. Parece ser un fenómeno advertido sólo en algunos casos y ha sido asociado a un peor pronóstico10. Por otra parte, se ha sugerido que más bien podría tratarse de un área de "penumbra metabólica" más que isquémica46.
Hemorragia intraventricular. En alrededor del 45 a 50% de los casos de HIC, el hematoma se extiende al sistema ventricular47. Este hecho incrementa la mortalidad a 50-80%48, es decir, una mortalidad unas 3 veces mayor que la de los sujetos sin hemorragia intraventricular49,50.
Aproximadamente, el 70% de las hemorragias intraventriculares son secundarias a la extensión de un hematoma intraparenquimatoso. Este sistema ventricular, de baja presión para la circulación del líquido cefalorraquídeo, es frecuentemente afectado cuando la hemorragia, a presiones cercanas a la sistólica, pasa a través de un defecto o fragilidad de la pared arterial comprometida y disecciona el tejido cerebral. Cuando dicho sangrado o hematoma se ubica en sitios profundos (hematomas profundos o ganglionares), cerca de los ventrículos laterales, tiende a volcarse en los ventrículos, con lo cual se compromete el sistema de regulación de la presión intracraneal y conduce a un aumento de dicha presión. La hipertensión endocraneana se asocia a disminución o deterioro del estado de conciencia (menor GCS al ingreso y mayor probabilidad de coma) y un riesgo mayor de muerte. Parece ser que la mortalidad es mayor cuanto mayor es el volumen de sangre al que se expone el sistema ventricular, empeorando aún más cuando ello genera hidrocefalia obstructiva, advertida en la TC51. Los valores PIC superiores a 20 mmHg se asocian no sólo a una mayor mortalidad, sino también a un pobre desenlace funcional a 3 meses52. Los factores de riesgo relacionados con esta complicación parecen ser: la edad avanzada, hematoma de gran tamaño, presión arterial media >120 mmHg y la localización primaria del sangrado53.
Hidrocefalia. La hidrocefalia obstructiva aguda es una potencial complicación de la extensión ventricular del hematoma. Ambos factores se consideran predictores independientes de pronóstico sombrío tras sufrir una hemorragia intracerebral54, al igual que la edad avanzada (70 años o más) y un GCS <855.
Convulsiones. La incidencia de convulsiones tras un ACV, en cualquiera de sus formas, varía de 2 a 14%, dependiendo de la población estudiada, el subtipo de ACV y la definición de convulsión adoptada56. La aparición de convulsiones tiene implicancias negativas en la recuperación tras el ACV y en la calidad de vida del paciente, sobre todo cuando se trata de individuos jóvenes, en los que el riesgo acumulativo a 30 años de sufrir epilepsia tras una HIC supera el 30%57.
Presentación clínica: los pacientes que sufren una HIC usualmente experimentan síntomas de disfunción neurológica, mostrando un déficit focal de instalación abrupta. Los hematomas de gran tamaño usualmente se acompañan de un incremento importante de la presión intracraneal (PIC), lo que conduce a un deterioro del nivel de conciencia. Sin embargo, es clínicamente difícil distinguir entre un evento hemorrágico y uno isquémico, aunque pareciera que la presencia de cefalea, náuseas, vómitos y la depresión del nivel de conciencia se asocian con mayor frecuencia con las hemorragias intracerebrales. Así también, se observan presiones sistólicas más elevadas en los casos de HIC que en los ACV isquémicos. En alrededor del 25% de los pacientes que se hallan inicialmente alertas, ocurre un deterioro del nivel de conciencia en las primeras 24 horas58.
La historia clínica debe registrar los síntomas de presentación y la presencia o no de factores de riesgo vasculares (HTA, diabetes, dislipidemia, enfermedad renal crónica, tabaquismo, alcoholismo y otros), si hay historia previa de ACV (isquémico o hemorrágico), trauma craneoencefálico, malformaciones vasculares pre-existentes, neoplasias diagnosticadas, uso de anticoagulantes orales y antitrombóticos, coagulopatías, consumo de drogas ilícitas y otras condiciones que predisponen al sangrado (p. ej., enfermedad hepática). El examen físico debe incluir los signos vitales, detallar la severidad del daño neurológico y el nivel de conciencia al ingreso, mediante escalas de valoración como la de Glasgow (GCS, Glasgow Coma Score).
Diagnóstico por imágenes: el abordaje inicial de un paciente que sufre un probable ACV, precisa estudios de imagen radiográficos, con el objetivo de determinar si la lesión del SNC es una isquemia, hemorragia u otro proceso no-vascular que simula un ACV. Además, define la localización, tamaño y densidad del proceso, lo cual nos da una idea de la naturaleza y severidad de la lesión vascular. La tomografía computarizada (TC) es considerada aún como el estándar de oro. En la TC, el hematoma es advertido como una imagen hiperdensa en relación al parénquima cerebral. Dicho sangrado intraparenquimatoso se hace evidente inmediatamente tras la instalación de los síntomas59.
Entre las 1 a 6 semanas, el hematoma (sub-agudo) se va tornando isodenso en relación al parénquima cerebral. A no ser que ocurra un resangrado, los hematomas más allá de las 6 semanas (crónicos) son hipodensos en la TC. Alrededor del 30% de los sobrevivientes de una HIC, no presentan anormalidades residuales en la TC10.
La TC y la resonancia magnética (RM) tienen un desempeño similar para la identificación de la HIC en fase aguda. Ambos métodos poseen una alta sensibilidad y especificidad, mostrando una concordancia del 96% uno con otro. La TC puede resultar superior para demostrar el compromiso intraventricular y subaracnoideo. Por otro lado, la RM es mejor para la detección de lesiones estructurales subyacentes (p. ej., neoplasias, microsangrados y malformaciones vasculares). El tiempo, costo, disponibilidad y tolerancia del paciente excluyen a la RM como método imagenológico inicial en la mayoría de los casos60.
La angiografía convencional mediante la introducción de un catéter tiene indicación en pacientes con HSA o una HIC de localización atípica, con calcificaciones anormales o en casos de pacientes jóvenes sin causa aparente para sufrir una HIC61.
Localización. En orden de frecuencia, la mayoría de las hemorragias intracerebrales son tálamo-capsulares (HIC subcortical profunda), lobares, cerebelares y pontinas62. La mayoría de las localizaciones, sobre todo en el caso de los hematomas tálamo-capsulares e infratentoriales, son producto de la lesión vascular ocasionada por la HTA63.Por otro lado, sólo un 60% de los casos de hematomas lobares o corticales tienen una historia de hipertensión arterial. El resto de los casos son atribuidos a angiopatía amiloide cerebral, sobre todo en sujetos mayores de 70 años. Un pequeño porcentaje de estos sangrados son atribuidos a malformaciones vasculares, más frecuentes en el joven9. Así también, la HIC asociada al uso de warfarina tiende a ocurrir con más frecuencia a nivel lobar64.
Pronóstico: la mortalidad a 30 días de la HIC es de aproximadamente 30-50%, lo que convierte a la HIC en uno de los eventos médicos agudos más mortales, similar a la HSA. Se estima que la mortalidad a 1 año es de 50%.
La mitad de las muertes toman lugar en las primeras 72 horas y se relacionan a complicaciones neurológicas (p. ej., efecto de masa, hipertensión endocraneana y/o herniación). Aquellos fallecimientos ocurridos tras el primer mes son, por lo general, el resultado de complicaciones tales como el tromboembolismo pulmonar, neumonía por aspiración, sepsis, hemorragias digestivas. Muchas de las muertes se dan también en el contexto de un presunto mal pronóstico, con la consiguiente retirada de las medidas de soporte al paciente en forma temprana.
En la fase aguda, son considerados predictores de la mortalidad a 30 días65:- Edad avanzada
- Puntuación de Glasgow al ingreso
- El tamaño del hematoma y el edema perilesional
- La expansión del hematoma y la hemorragia intraventricular asociada
Éstas y otras características clínicas han sido utilizadas para desarrollar modelos de predicción de mortalidad y desenlace funcional. Sin embargo, muchos de estas escalas tienden a otorgar un mal pronóstico en forma temprana, lo que genera la retirada de las medidas de soporte y dar órdenes de no resucitar al paciente. Es por ello, que las últimas guías de la AHA (American Heart Association) recomiendan el cuidado completo y agresivo tras las primeras horas de instalada la HIC y posponer dichas medidas de retirada por al menos 48 horas66.
Recurrencia de la HIC: en aquellos que sobreviven a una HIC espontánea, se ha estimado que el riesgo anual de recurrencia es de 2%. El riesgo de sufrir un nuevo evento vascular, de cualquier tipo, es de aproximadamente 6% y el riesgo de muerte por causa vascular en un 3%. La edad avanzada es el principal factor predictivo de estos desenlaces. El riesgo de recurrencia de la HIC depende fuertemente de la etiología subyacente. Es así que el factor de riesgo identificable más consistente con la recurrencia es la localización lobar de la hemorragia. Los sangrados lobares (mayormente causados por angiopatía amiloide) acarrean un mayor riesgo de re-sangrado en comparación con aquellos hematomas profundos o ganglionares67.Por otro lado, la HTA es el factor de riesgo modificable más importante para la prevención de las recurrencias. Tras la fase aguda, se recomienda un objetivo de presión arterial <140/90 mmHg (o <130/80 mmHg en diabéticos o con enfermedad renal crónica). A pesar de ello, el riesgo de recurrencia permanece latente68.La historia de ACV isquémico previo incrementa en 5 a 20 veces el riesgo relativo de sufrir una HIC. El hecho de haber padecido una HIC con anterioridad, es un factor de riesgo para ambos tipos de ACV, con riesgo anual de alrededor de 1.2%.
Tratamiento: el objetivo del tratamiento es el de evitar la progresión del daño neurológico, evitando la expansión del hematoma y mediante el manejo temprano de las complicaciones neurológicas. Si hay indicaciones quirúrgicas, se debe considerar el drenaje o evacuación del hematoma. En algunos casos, el tratamiento conservador es la prioridad. Todo ello depende del tamaño y la localización del sangrado. Hay evidencia indirecta que el manejo médico agresivo y especializado mejora el desenlace en pacientes con HIC. Parece ser que la mortalidad intrahospitalaria es menor para aquellos pacientes tratados en una unidad de cuidados intensivos neurológicos.
Manejo de la presión arterial. El manejo de la crisis hipertensiva en el contexto de una HIC es una emergencia médica. Sin embargo, debido a la falta de fuertes evidencias, aún existen controversias en cuanto a los objetivos específicos de presión arterial. El conflicto nace a partir de 2 teorías, una de las cuales propone la existencia de un área de "penumbra" alrededor del hematoma, la cual se encontraría en riesgo de isquemia si la presión desciende en forma precipitada10. Por otro lado, se cree que las cifras elevadas de presión arterial favorecen a la expansión del hematoma69. Si bien parece segura la disminución de la presión arterial sistólica (PAS) entre 140-110 mmHg, los últimos consensos recomiendan manejar presiones sistólicas <160 mmHg o una presión arterial media (PAM) <110 mmHg. Si la presión sistólica es >180 mmHg, o PAM >130 mmHg, y existe sospecha de una PIC incrementada, se debe monitorizar la PIC70. Las opciones terapéuticas a utilizar, incluyen el labetalol (bolo de 5-20 mg cada 15 minutos o infusión continua a 2 mg/min), nicardipina (infusión de 5-15 mg/h), hidralazina (5-10 mg cada 30 minutos o infusión a 1.5-5 µg/kg/min), nitroprusiato (infusión a 0.1-10 µg/kg/min) y nitroglicerina (infusión a 20-400 µg/min).
Manejo de la presión intracraneal. En los adultos, el volumen intracraneal es fijo debido a la rigidez de la bóveda craneana. Cualquier condición que ocasione un aumento de dicho volumen (p. ej., un hematoma intraparenquimatoso), eventualmente generará un incremento de la PIC. Además, cuando un nuevo contenido o volumen es introducido en la bóveda intracraneal (p. ej., sangre), ocurre una disminución compensantoria de uno de los otros componentes en el interior (líquido cefalorraquídeo, volumen vascular o parénquima cerebral), lo cual resulta útil hasta cierto punto. Cuando se llega al punto en el que la compensación resulta insuficiente, la PIC aumenta en forma rápida en respuesta a pequeños cambios de volumen.
La presión de perfusión cerebral (PPC) es directamente dependiente de la PIC, ya que es el resultado de la diferencia entre la PAM y la PIC (PPC = PAM - PIC). Es posible medir dicha PIC mediante la introducción de catéteres ventriculares o parenquimatosos a nivel cerebral. Los primeros permiten además el drenaje del líquido cefalorraquídeo (LCR) acumulado, si es que existe, pero se asocia a un mayor riesgo de infecciones y hemorragias, comparados con los intraparenquimatosos. Las últimas guías de la AHA recomiendan el monitoreo de la PIC y su tratamiento en aquellos pacientes con GCS <8, con hemorragia intraventricular o hidrocefalia significativas o con evidencias de herniación transtentorial66.
El tratamiento de la PIC elevada se inicia con medidas generales, como la elevación de la cabecera a 30°, analgesia y sedación. Se incluyen también terapias más agresivas, como el uso de osmoterapia (con manitol y suero salino hipertónico) para la disminución del edema cerebral, el drenaje del LCR por ventriculostomía, bloqueadores neuromusculares e hiperventilación transitoria. Estas opciones terapéuticas requieren monitoreo continuo de la PIC y la presión arterial, con el objetivo de obtener una PPC >60 mmHg)66,71.
Recomendaciones para el manejo de la presión intracraneal en la HIC70:- Se recomienda internación en una Unidad de Cuidados Intensivos para el monitoreo de la PA, PIC y la posible necesidad de ventilación mecánica o intubación.
- Pacientes con GCS <8 con evidencia clínica de herniación transtentorial, aquellos con significativa hemorragia intraventricular o hidrocefalia deben ser considerados para monitoreo de la PIC y su tratamiento.
- Resulta razonable el drenaje ventricular como tratamiento para la hidrocefalia en pacientes con el nivel de conciencia deteriorado.
- Para el control de una PIC elevada, debe considerarse un tratamiento gradual: cabecera elevada a 30°, analgesia si hay dolor y sedación en sujetos en condiciones inestables.
- Para un manejo más agresivo de la PIC, puede hacerse uso de agentes osmóticos (manitol y suero salino hipertónico), bloqueantes neuromusculares, hiperventilación o hipotermia terapéutica.
Terapia anticonvulsivante. La convulsión es una de las complicaciones neurológicas más comunes en los pacientes con HIC. Resulta más frecuente en la HIC que en pacientes con ACV isquémico. Ocurren convulsiones en forma temprana en alrededor del 4% de las HIC y en un 8% de los casos en los primeros 30 días71. Se trata de un evento relacionado con el aumento de la desviación de la línea media y con el deterioro neurológico del paciente72.
Recomendaciones para el manejo de las convulsiones en la HIC70:- La evidencia de convulsiones es indicación de tratamiento con drogas antiepilépticas.
- El monitoreo continuo con un electroencefalograma (EEG) está probablemente indicado en sujetos con HIC y un deterioro del estado mental desporporcionado para el grado de injuria cerebral.
- Deben ser tratados también aquellos pacientes con cambios en el estado mental y que tienen convulsiones electrográficas (EEG).
- No debe utilizarse medicación anticonvulsivante de manera profiláctica de manera rutinaria. La profilaxis debe individualizarse en base al riesgo de convulsiones.
Coagulopatías. La presencia de coagulopatía empeora el pronóstico de la HIC debido al aumento de incidencia de expansión y duración de la expansión del hematoma. El objetivo es revertir la coagulopatía, utilizando los antídotos específicos dependiendo del escenario clínico y suspender inmediatamente los anticoagulantes orales70,73.
Intervención neuroquirúrgica. La real utilidad de la cirugía es incierta para la mayoría de los casos de HIC. Aún resulta controversial el rol de la evacuación quirúrgica del hematoma, sobre todo para aquellos hematomas profundos o ganglionares.
Recomendaciones para el manejo quirúrgico de la HIC70:- Para la mayoría de los casos de HIC, la real utilidad de la cirugía es aún incierta.
- Si existe deterioro de la conciencia debido al efecto de masa del hematoma, debe considerarse una craneotomía temprana.
- Pacientes con hematoma cerebelar >3 cm o con compresión del tronco cerebral y/o hidrocefalia por obstrucción ventricular deben someterse a remoción del sangrado de manera urgente.
- Los hematomas lobares >30 ml ubicados a 1 cm o menos de la superficie, deben ser evacuados por craneotomía estándar, en sujetos con GCS 9-12.
- Resultan inciertas las ventajas de otros métodos como el drenaje mínimamente invasivo de los hematomas y el uso de trombolíticos intraventriculares (hemorragia intraventricular).
Derivación ventricular externa y ventriculitis. La colocación temporaria de catéteres para drenaje ventricular externo (DVE) es quizás uno de los procedimientos neuroquirúrgicos más comúnmente realizados a nivel mundial. Su instalación se lleva a cabo ante la presencia de hidrocefalia, complicación observada en la hemorragia intracerebral, sobre todo cuando se asocia a hemoventrículo, con el objetivo de dar salida por vía alternativa al líquido cefalorraquídeo y es considerada también el estándar de oro para monitorizar la PIC. Sin embargo, al tratarse de un cuerpo extraño, puede acarrear infecciones intrahospitalarias en el portador, una de ellas es la ventriculitis. Las complicaciones infecciosas relacionadas al catéter pueden aumentar significativamente la morbimortalidad del paciente74. Se han reportado incidencias de infecciones relacionadas a catéteres de 0 a 45%, según las distintas series75. Los factores que incrementan el riesgo de infección son: cateterización prolongada, pérdidas por el catéter, cambio frecuente de catéter, enfermedad de base, sepsis concurrente, entre otros76.
La evidencia con respecto a la hemorragia intracerebral en sujetos menores de 50 años es escasa, tanto a nivel mundial como en nuestro Centro hospitalario. Este evento catastrófico ocasiona un gran impacto en la población joven, por lo cual toma relevancia el determinar los factores de riesgo implicados y el desenlace de estos pacientes.
Objetivos
Comparar las características demográficas de los pacientes con hemorragia intracerebral en relación a la edad.
Determinar la frecuencia de mortalidad de la hemorragia intracerebral en relación a la edad.
Establecer la incidencia de complicaciones clínicas, laboratoriales y tiempo de hospitalización en los pacientes con hemorragia intracerebral en relación a la edad.
Describir las localizaciones de las hemorragias intracerebrales.
Material y métodos
Diseño: cohorte transversa.
Población de estudio: cohorte 1: sujetos de sexo masculino y femenino, con edad menor de 50 años, portadores de hemorragia intracerebral, que consultaron en el Hospital Nacional en los años 2.013 y 2.014. Cohorte 2: sujetos de sexo masculino y femenino, con 50 años de edad o más, portadores de hemorragia intracerebral, que consultaron en el Hospital Nacional en los años 2.013 y 2.014.
Criterios de inclusión: sujetos con déficit neurológico focal brusco y diagnóstico tomográfico de hemorragia intracerebral, con o sin anticoagulación y discrasias.
Criterios de exclusión: accidentes cerebrovascular hemorrágico de etiología traumática, hemorragia subaracnoidea de cualquier causa, transformación hemorrágica del infarto cerebral, portadores de tumores intracerebrales, malformaciones arteriovenosas conocidas.
Muestreo: no probabilístico, de casos consecutivos.
Reclutamiento: se acudió al Servicio de Estadísticas del Hospital Nacional para identificar a los sujetos del estudio. Posteriormente, se extrajeron las variables de los expedientes médicos almacenados en el Servicio de Archivo.
Variables:
Demográficas: edad y sexo.
Dependientes: escala de coma de Glasgow al ingreso, a las 24 horas y al egreso, mortalidad, complicaciones neurológicas e infecciosas, trastornos del sodio, días de hospitalización.
Predictora: edad mayor o menor a 50 años
Otras variables: hipertensión arterial, diabetes, etilismo, tabaquismo, obesidad, enfermedad renal crónica, ACV previo, uso de anticoagulantes.
Hipótesis: se consideró a la mortalidad como la principal variable dependiente:
H0: no existe diferencia estadísticamente significativa en la frecuencia de la mortalidad entre sujetos mayores y menores de 50 años.
Ha1: la frecuencia de mortalidad es estadísticamente mayor en sujetos mayores de 50 años.
Ha2: la frecuencia de mortalidad es estadísticamente mayor en sujetos menores de 50 años.
Estimación del tamaño de la muestra: Se esperó una mortalidad de 20% en la cohorte 191 y de 50% en la cohorte 22. Se calculó el tamaño de muestra con el programa Epi Info 7©. Error alpha: 5%. Error beta: 20%. IC: 95%. Se estimó así un tamaño de muestra de 45 sujetos, como mínimo, para cada cohorte.
Gestión de datos y enfoque analítico: las variables se registraron en una planilla electrónica Excel© y fueron sometidas a estadística analítica con el programa Epi Info 7©. Las variables cualitativas fueron analizadas con la prueba Chi2 para calcular el RR (IC 95%). Las variables cuantitativas se analizaron con la prueba ANOVA. Se consideró significativa toda p < 0,05.
Aspectos éticos: se respetaron los Principios de la Bioética y la Declaración de Helsinki. Se respetó la confidencialidad de los datos personales.
Resultados
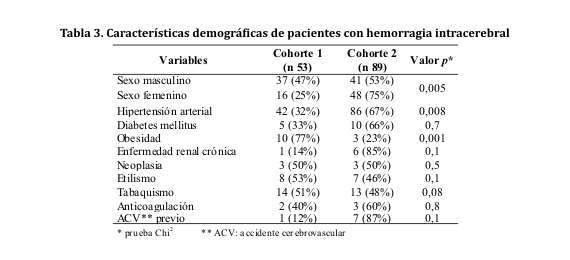
Ingresaron al estudio un total de 142 sujetos, 53 en la cohorte 1 y 89 en la cohorte 2. La edad media ± DE de la cohorte 1 fue 39 ± 9 años (rango 17-49 años) y en la cohorte 2 fue 66 ± 11 años (rango 50-94 años). Comparando variables demográficas y clínicas de las cohortes 1 y 2, se advirtió el predominio del sexo femenino e hipertensión arterial en la cohorte 2, mientras que en la cohorte 1 hubo predominio significativo de sujetos con obesidad (ver tabla 3). Sólo 28 de los 42 (66%) pacientes hipertensos de la cohorte 1, se conocían portadores de dicha entidad patológica al momento de la admisión.
En promedio, los días de internación fueron 18 ± 18 días (0-78 días) en la cohorte 1 y 12 ± 16 días en la cohorte 2 (0-70 días). La mortalidad fue estadísticamente superior en la cohorte 2 (58% vs 28%). Así también, la mortalidad precoz (primeras 48 hs) fue estadísticamente superior en la cohorte 2 (ver tabla 4).
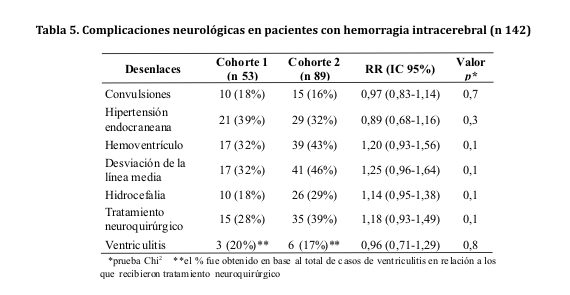
En cuanto a los desenlaces en la esfera neurológica, no hubo diferencias significativas entre ambos grupos (ver tabla 5). En ambas cohortes por igual, la presencia de hemoventrículo, desviación de la línea media e hidrocefalia estuvieron significativamente relacionados con un aumento de la mortalidad global (p <0,001).
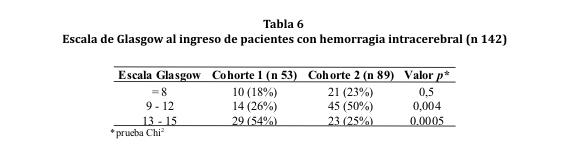
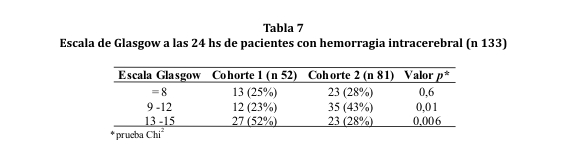
La valoración o puntaje obtenido en la escala de Glasgow al ingreso fue, en su mayoría, de 13 a 15 en la cohorte 1 y de 9 a 12 en la cohorte 2. Lo mismo se observó en la revaloración a las 24 hs pero con una población reducida debido al deceso de 9 sujetos (ver tablas 6 y 7). Por otro lado, entre los individuos que presentaron un GCS <8 al ingreso, el 70% de la cohorte 1 y el 71% de la cohorte 2, fallecieron antes de las 48 horas (p < 0,001).
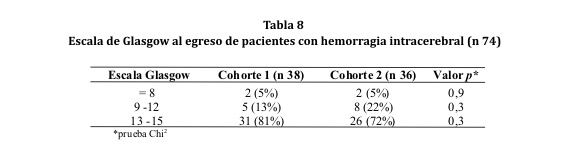
En relación al puntaje de Glasgow obtenido al egreso, la mayor parte de los casos en ambas cohortes presentaron un puntaje de 13 a 15 (ver tabla 8).
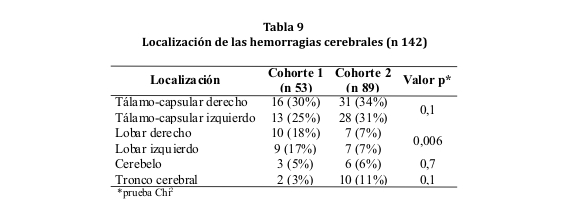
La localización más frecuente de la hemorragia fue la región tálamo-capsular (hematoma subcortical profundo) en ambas cohortes. Los segundos en frecuencia fueron los hematomas lobares, significativamente más frecuentes en la cohorte 1 en comparación con la cohorte 2 (p 0,006). No hubo predominio significativo en la incidencia de un lado sobre el otro (ver tabla 9).
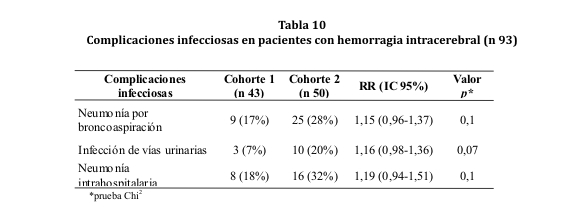
No se apreciaron diferencias significativas entre ambas cohortes en cuanto a la incidencia de complicaciones infecciosas. Para el cálculo de incidencia de infección de vías urinarias y neumonía intrahospitalaria fue utilizado un n 43 y n 50 para las cohortes 1 y 2, respectivamente, excluyéndose los casos con 72 horas o menos de estancia hospitalaria (ver tabla 10).
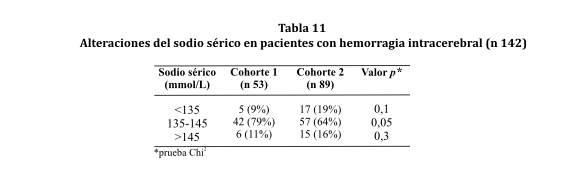
Se registraron alteraciones del sodio sérico en 20% de los sujetos de la cohorte 1. En la cohorte 2 se presentaron disturbios del sodio en un 35% de los casos. La hiponatremia fue un trastorno más frecuente en la cohorte 2 que en la cohorte 1, pero no fue un hecho estadísticamente significativo (ver tabla 11).
Del total de sujetos con hiponatremia al ingreso (22), 16 de ellos (72%) tuvieron un desenlace fatal (p 0,009); 11 de los óbitos ocurrieron en las primeras 48 horas (p 0,01).
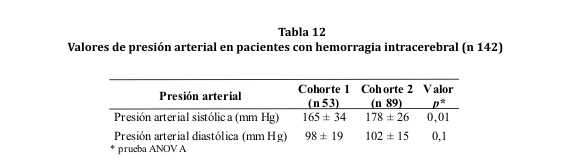
La media de las cifras tensionales sistólicas obtenidas al ingreso fueron superiores en la cohorte 2 (valor p= 0,01) (ver tabla 12).
Discusión
La hemorragia intracerebral en individuos jóvenes no está bien descripta. La mayor parte de los estudios realizados en esta población no son uniformes, presentando, en cuanto a edad, variados puntos de corte al definirla, lo cual dificulta en cierta manera la comparación de los resultados obtenidos entre los distintos estudios77-80.
De los 142 pacientes ingresados al estudio, 53 de ellos (37%) tenían menos de 50 años. En los diferentes reportes, el porcentaje de casos de HIC que ocurren en adultos jóvenes varía desde cifras cercanas al 11% hasta más de 40%. Parece ser que la significativa incidencia advertida en este estudio tiene relación con la gran prevalencia de HTA en la población de nuestro medio. Hemos notado que el 62% de los casos ocurridos en la población menor de 50 años tenía entre 40 a 49 años y el 91% de ellos eran hipertensos81,82.
En lo referente al sexo, existió un claro predominio del sexo masculino (70%) sobre el femenino (30%) en la población joven. Sólo el 25% de los pacientes de sexo femenino se hallaba en dicho grupo. Se trata de un fenómeno registrado también en varios estudios realizados con anterioridad. Parece ser que la mayor frecuencia de factores de riesgo como el alcoholismo, tabaquismo e hipertensión arterial en adultos jóvenes varones en comparación con las mujeres, explicaría la mayor incidencia de hemorragia intracerebral en ese género a edades tempranas4.
La hipertensión arterial fue el principal factor de riesgo y agente causal de los eventos hemorrágicos en este estudio (90%), en donde 42 de los 53 sujetos de la población de adultos jóvenes, es decir, el 79%, resultaron ser hipertensos, cifra superior a las informadas en otros estudios83-86. Así también, en los sujetos de 50 años o más, existió una tendencia a presentar cifras tensionales, sobre todo sistólicas, más elevadas. Se ha propuesto en los últimos años que las cifras tensionales elevadas al ingreso, estarían relacionadas con el tamaño inicial del hematoma intracerebral, la expansión del mismo y, por ende, un peor pronóstico. Además, parece tener cierta implicancia en el desenlace a largo plazo94-99.
En aquellos menores de 50 años de edad, el alcoholismo y el tabaquismo estuvieron presentes en el 15 y 26%, respectivamente. Ambos son considerados factores de riesgo para el desarrollo de HIC en el joven. Los diferentes estudios muestran un porcentaje muy variable en cuanto a presencia de dichos factores en esta población. Es probable que la prevalencia de dichos hábitos de riesgo dependa de ciertos aspectos socioculturales. Por otro lado, deberían establecerse con claridad las definiciones de ambas entidades. Para el caso específico del alcoholismo, clasificar además a los sujetos según el grado de ingesta, que parece ser un factor determinante. Con respecto al tabaquismo, resulta de importancia conocer si los individuos son fumadores actuales o exfumadores9,87.
El 77% de los individuos obesos en nuestro estudio eran menores de 50 años (10 de los 53 pacientes del grupo), un hecho que resultó estadísticamente significativo. En los últimos años se ha postulado a la obesidad como factor de riesgo de hemorragia intracerebral, sobre todo en varones que sufren HIC de localización "profunda", hecho que podría estar relacionado con las diversas comorbilidades asociadas a la obesidad (HTA y diabetes mellitus). Sin embargo, faltan estudios en la población joven que relacionen dicha condición con un riesgo aumentado de hemorragia intracerebral y más estudios en la población general para catalogar a la obesidad como factor de riesgo independiente88-90.
Las localizaciones más frecuentes de los hematomas intracerebrales fueron, en orden de frecuencia, las siguientes: tálamo-capsular, lobar, cerebelo y tronco encefálico. Estos hallazgos concuerdan con la mayoría de las casuísticas, sobre todo cuando la etiología predominante es la hipertensión arterial. Cabe destacar la significativa incidencia (35%) de sangrados lobares (superficiales) en la población menor de 50 años, ya que ciertas entidades como las malformaciones arteriovenosas, más frecuentes en este grupo etario, muestran tendencia a sangrar en dicha región. Muchas veces, el difícil acceso en nuestro medio a estudios imagenológicos como la arteriografía cerebral, nos priva de un diagnóstico etiológico más preciso, sobre todo en pacientes jóvenes que sufren una HIC en sitios poco habituales5.
La mortalidad de los casos en menores de 50 años fue de 28% (15 de los 53 pacientes), lo cual resultó notablemente inferior a la registrada en los sujetos de mayor edad (58%). Dos estudios publicados en fechas recientes, en Centros especializados de la India y Holanda, notificaron una mortalidad de 25% y 20%, respectivamente, en individuos con HIC menores de 50 años. Estos números no son mera casualidad y quizás encuentren su explicación en el hecho de que la edad avanzada per se y, fundamentalmente, un nivel de conciencia más deteriorado al ingreso, en comparación con los adultos jóvenes, podrían ser los principales predictores del desenlace final de estos pacientes mayores 5,91.
Los principales determinantes de la mortalidad global y la mortalidad precoz fueron la edad avanzada y un GCS <8 al momento de la admisión hospitalaria, lo cual concuerda con lo clásicamente descripto por la literatura en lo que a factores de mal pronóstico o predictores de mortalidad se refiere92,93.
Así también, en ambas poblaciones, las complicaciones derivadas del hematoma intracerebral (hemoventrículo, desviación de la línea media e hidrocefalia), tuvieron implicancia directa en el aumento de la mortalidad intrahospitalaria. Parece ser que todos estos procesos derivan en último término en el aumento de la presión intracraneal, fenómeno adverso, objetivo principal de los pilares terapéuticos actuales100,101.
En relación con las alteraciones laboratoriales, se registraron disturbios del sodio en un 30% (n 43) de los sujetos, advirtiéndose hiponatremia en un 15% del total de pacientes. En este estudio, la hiponatremia fue un factor predictor de mortalidad global y precoz (primeras 48 horas). Un estudio observacional publicado en fecha reciente en Alemania, que incluyó a 464 individuos con HIC, presentó una prevalencia de hiponatremia al ingreso del 15,6 % y la misma resultó también ser un predictor independiente de mortalidad intrahospitalaria. 102 Resultaría interesante para futuras investigaciones, poder determinar la etiología de la hiponatremia al ingreso y durante la hospitalización en los sujetos con HIC.
La media de los días de internación fue mayor en el grupo de pacientes con <50 años de edad (18 ± 18 días vs 12 ± 6 días). Estas cifras pueden explicarse por el hecho de que muchos de los pacientes adultos jóvenes permanecen internados por un tiempo considerable, muchas veces excesivo, mientras se gestionan estudios más exhaustivos, en busca de la etiología específica que ocasionó el evento hemorrágico.
La HIC representa sólo una pequeña proporción de casos de los accidentes cerebrovasculares, sin embargo, su verdadero impacto radica en la alta mortalidad asociada, en su efecto devastador en la calidad de vida y funcionalidad del sujeto que la padece, más aún, si éste es un individuo joven, en plena etapa productiva para la sociedad.
En los últimos años, a pesar de un mejor conocimiento de esta entidad en lo que se refiere a mecanismos de injuria y posibles blancos terapéuticos, la mortalidad de estos eventos no ha podido ser disminuida. Si bien el aumento de la morbimortalidad tiene relación directa con la edad avanzada, este factor resulta no modificable, por lo cual las futuras directrices deberían enfocarse no solamente en nuevos objetivos terapéuticos, sino también en enfatizar la importancia de una eficiente prevención primaria, controlando o modificando factores de riesgo como la hipertensión arterial, la obesidad y evitando el consumo de bebidas alcohólicas y el hábito tabáquico, sobre todo en los adultos jóvenes.
En conclusión, la hipertensión arterial fue el principal factor de riesgo de HIC, tanto en la población menor de 50 años como en la de mayor edad. Por otro lado, la obesidad se presentó como un importante factor de riesgo en sujetos jóvenes. La mortalidad global y la mortalidad precoz (en las primeras 48 horas) fueron superiores en los individuos de 50 años o más. Esta población mostró una mayor tendencia a sufrir un deterioro neurológico marcado al ingreso y a presentar cifras tensionales más elevadas que la observada en individuos menores de 50 años. No se encontraron diferencias significativas en cuanto a incidencia de complicaciones, tanto neurológicas como infecciosas, entre ambos grupos.
Referencias bibliográficas
1. Sacco RL, Kasner SE, Broderick JP, Caplan LR, Connors JJ, Culebras A, et al. An updated definition of stroke for the 21st century: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013 Jul; 44(7): 2064-89. [ Links ]
2. Sacco S, Marini C, Toni D, Olivieri L, Carolei A. Incidence and 10-year survival of intracerebral hemorrhage in a population-based registry. Stroke. 2009 Feb; 40(2): 394-9. [ Links ]
3. Zahuranec DB, Lisabeth LD, Sánchez BN, Smith MA, Brown DL, Garcia NM, et al. Intracerebral hemorrhage mortality is not changing despite declining incidence. Neurology. 2014 Jun 17; 82(24): 2180-6. [ Links ]
4. Marini C, Russo T, Felzani G. Incidence of stroke in young adults: a review. Stroke Res Treat. 2010 Dec 19; 2011: 535672. [ Links ]
5. Kalita J, Goyal G, Kumar P, Misra UK. Intracerebral hemorrhage in young patients from a tertiary neurology center in North India. J Neurol Sci. 2014 Jan 15; 336(1-2): 42-7. [ Links ]
6. Feigin VL, Forouzanfar MH, Krishnamurthi R, Mensah GA, Connor M, Bennett DA, et al. Global and regional burden of stroke during 1990-2010: Findings from the Global Burden of Disease Study 2010. Lancet. 2014 Jan 18; 383(9913): 245-54. [ Links ]
7. Rolfs A, Fazekas F, Grittner U, Dichgans M, Martus P, Holzhausen M, et al. Acute cerebrovascular disease in the young: The stroke in young fabry patients study. Stroke. 2013 Feb; 44(2): 340-9. [ Links ]
8. Howard G, Cushman M, Howard VJ, Kissela BM, Kleindorfer DO, Moy CS, et al. Risk factors for intracerebral hemorrhage: The Reasons for Geographic and Racial Differences in Stroke (REGARDS) study. Stroke. 2013 May;44(5):1282-7 [ Links ]
9. Feldmann E, Broderick JP, Kernan WN, Viscoli CM, Brass LM, Brott T, et al. Major risk factors for intracerebral hemorrhage in the young are modifiable. Stroke. 2005 Sep; 36(9): 1881-5. [ Links ]
10. Aguilar MI, Brott TG. Update in intracerebral hemorrhage. Neurohospitalist. 2011 Jul; 1(3): 148-59. [ Links ]
11. Wasay M, Khatri IA, Khealani B, Afaq M. Temporal trends in risk factors and outcome of intracerebral hemorrhage over 18 years at a tertiary care hospital in Karachi, Pakistan. J Stroke Cerebrovasc Dis. 2012 May; 21(4): 289-92. [ Links ]
12. Han JH, Lee JM, Koh EJ, Choi HY. The spot sign predicts hematoma expansion, outcome, and mortality in patients with primary intracerebral hemorrhage. J Korean Neurosurg Soc. 2014 Oct; 56(4): 303-9. [ Links ]
13. Zia E, Hedblad B, Pessah-Rasmussen H, Berglund G, Janzon L, Engström G. Blood pressure in relation to the incidence of cerebral infarction and intracerebral hemorrhage. Hypertensive hemorrhage: Debated nomenclature is still relevant. Stroke. 2007 Oct; 38(10): 2681-5. [ Links ]
14. Herzig R, Vlachová I, Mares J, Gabrys M, Sanák D, Skoloudík D, et al. Occurrence of diabetes mellitus in spontaneous intracerebral hemorrhage. Acta Diabetol. 2007 Dec; 44(4): 201-7. [ Links ]
15. Emerging Risk Factors Collaboration, Sarwar N, Gao P, Seshasai SR, Gobin R, Kaptoge S, Di Angelantonio E, et al. Diabetes mellitus, fasting blood glucose concentration, and risk of vascular disease: a collaborative meta-analysis of 102 prospective studies. Lancet. 2010 Jun 26; 375(9733): 2215-22. [ Links ]
16. Peng GS, Yin SJ, Cheng CA, Chiu SW, Lee JT, Lin WW, Lin JC, Hsu YD. Increased risk of cerebral hemorrhage in Chinese male heavy drinkers with mild liver disorder. Cerebrovasc Dis. 2007; 23(4): 309-14. [ Links ]
17. Casolla B, Dequatre-Ponchelle N, Rossi C, Hénon H, Leys D, Cordonnier C. Heavy alcohol intake and intracerebral hemorrhage: Characteristics and effect on outcome. Neurology. 2012 Sep 11; 79(11): 1109-15. [ Links ]
18. O'Donnell MJ, Xavier D, Liu L, Zhang H, Chin SL, Rao-Melacini P. Risk factors for ischaemic and intracerebral haemorrhagic stroke in 22 countries the INTERSTROKE study: A case-control study. Lancet. 2010 Jul 10; 376(9735): 112-23. [ Links ]
19. Xu L, Schooling CM, Chan WM, Lee SY, Leung GM, Lam TH. Smoking and hemorrhagic stroke mortality in a prospective cohort study of older Chinese. Stroke. 2013 Aug; 44(8): 2144-9. [ Links ]
20. Wang X, Dong Y, Qi X, Huang C, Hou L. Cholesterol levels and risk of hemorrhagic stroke: A systematic review and meta-analysis. Stroke. 2013 Jul; 44(7): 1833-9. [ Links ]
21. Mustanoja S, Strbian D, Putaala J, Meretoja A, Curtze S, Haapaniemi E, et al. Association of prestroke statin use and lipid levels with outcome of intracerebral hemorrhage. Stroke. 2013 Aug; 44(8): 2330-2. [ Links ]
22. Hirsch KG, Josephson SA. An update on neurocritical care for the patient with kidney disease. Adv Chronic Kidney Dis. 2013 Jan; 20(1): 39-44. [ Links ]
23. Molshatzki N, Orion D, Tsabari R, Schwammenthal Y, Merzeliak O, Toashi M, Tanne D. Chronic kidney disease in patients with acute intracerebral hemorrhage: Association with large hematoma volume and poor outcome. Cerebrovasc Dis. 2011; 31(3): 271-7. [ Links ]
24. Kim JK, Shin JJ, Park SK, Hwang YS, Kim TH, Shin HS. Prognostic factors and clinical outcomes of acute intracerebral hemorrhage in patients with chronic kidney disease. J Korean Neurosurg Soc. 2013 Oct; 54(4): 296-301. [ Links ]
25. Sakamoto N, Ishikawa E, Aoki K, Uemae Y, Komatsu Y, Matsumura A. Clinical outcomes of intracerebral hemorrhage in hemodialysis patients. World Neurosurg. 2014 Mar-Apr; 81(3-4): 538-42. [ Links ]
26. Chen CY, Tai CH, Cheng A, Wu HC, Tsay W, Liu JH, et al. Intracranial hemorrhage in adult patients with hematological malignancies. BMC Med. 2012 Aug 29; 10: 97. [ Links ]
27. Patil S, Nourbakhsh A, Thakur JD, Khan IS, Guthikonda B. Fatal intracranial hemorrhage as the initial presentation of acute lymphocytic leukemia: A case report. Turk Neurosurg. 2013; 23(4): 568-71. [ Links ]
28. Liu JH, Zhou F, Zhang XL, Zhang SF, Song FL, Liu YQ, et al. Clinical and pathological analysis of 41 cases of acute leukemia combined with intracranial hemorrhage. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 2013 Dec; 21(6): 1409-12. [ Links ]
29. Büttner A. Neuropathological alterations in cocaine abuse. Curr Med Chem. 2012; 19(33): 5597-600. [ Links ]
30. Huhtakangas J, Löppönen P, Tetri S, Juvela S, Saloheimo P, Bode MK, Hillbom M. Predictors for recurrent primary intracerebral hemorrhage: A retrospective population-based study. Stroke. 2013 Mar; 44(3): 585-90. [ Links ]
31. Banerjee A, Lip GY. Intracerebral hemorrhage and warfarin: perceived versus actual risk. Stroke. 2011 Sep; 42(9): 2383-4. [ Links ]
32. Flaherty ML, Kissela B, Woo D, Kleindorfer D, Alwell K, Sekar P, et al. The increasing incidence of anticoagulant-associated intracerebral hemorrhage. Neurology. 2007 Jan 9; 68(2): 116-21. [ Links ]
33. Huhtakangas J, Tetri S, Juvela S, Saloheimo P, Bode MK, Hillbom M. Effect of increased warfarin use on warfarin-related cerebral hemorrhage: A longitudinal population-based study. Stroke. 2011 Sep; 42(9): 2431-5. [ Links ]
34. Meretoja A, Strbian D, Putaala J, Curtze S, Haapaniemi E, Mustanoja S, et al. SMASH-U: A proposal for etiologic classification of intracerebral hemorrhage. Stroke. 2012 Oct; 43(10): 2592-7. [ Links ]
35. van Asch CJ, Velthuis BK, Greving JP, van Laar PJ, Rinkel GJ, Algra A, Klijn CJ. External validation of the secondary intracerebral hemorrhage score in The Netherlands. Stroke. 2013 Oct; 44(10): 2904-6. [ Links ]
36. Delgado Almandoz JE, Schaefer PW, Goldstein JN, Rosand J, Lev MH, González RG, Romero JM. Practical scoring system for the identification of patients with intracerebral hemorrhage at highest risk of harboring an underlying vascular etiology: The secondary intracerebral hemorrhage score. AJNR Am J Neuroradiol. 2010 Oct; 31(9): 1653-60. [ Links ]
37. Beslow LA, Licht DJ, Smith SE, Storm PB, Heuer GG, Zimmerman RA, et al. Predictors of outcome in childhood intracerebral hemorrhage: A prospective consecutive cohort study. Stroke. 2010 Feb; 41(2): 313-8. [ Links ]
38. Mehndiratta P, Manjila S, Ostergard T, Eisele S, Cohen ML, Sila C, Selman WR. Cerebral amyloid angiopathy-associated intracerebral hemorrhage: Pathology and management. Neurosurg Focus. 2012 Apr; 32(4): E7. [ Links ]
39. Narayan SK, Sivaprasad P, Sushma S, Sahoo RK, Dutta TK. Etiology and outcome determinants of intracerebral hemorrhage in a south Indian population, A hospital-based study. Ann Indian Acad Neurol. 2012 Oct; 15(4): 263-6. [ Links ]
40. Gupta M, Verma R, Parihar A, Garg RK, Singh MK, Malhotra HS. Perihematomal edema as predictor of outcome in spontaneous intracerebral hemorrhage. J Neurosci Rural Pract. 2014 Jan; 5(1): 48-54. [ Links ]
41. Salihović D, Smajlović D, Ibrahimagić OĆ. Does the volume and localization of intracerebral hematoma affect short-term prognosis of patients with intracerebral hemorrhage?. ISRN Neurosci. 2013 May 8; 2013: 327968. [ Links ]
42. Rathor MY, Rani MF, Jamalludin AR, Amran M, Shahrin TC, Shah A. Prediction of functional outcome in patients with primary intracerebral hemorrhage by clinical-computed tomographic correlations. J Res Med Sci. 2012 Nov; 17(11): 1056-62. [ Links ]
43. Elliott J, Smith M. The acute management of intracerebral hemorrhage: A clinical review. Anesth Analg. 2010 May 1; 110(5): 1419-27. [ Links ]
44. Ovesen C, Havsteen I, Rosenbaum S, Christensen H. Prediction and observation of post-admission hematoma expansion in patients with intracerebral hemorrhage. Front Neurol. 2014 Sep 29; 5: 186. [ Links ]
45. Davis SM, Broderick J, Hennerici M, Brun NC, Diringer MN, Mayer SA, et al. Hematoma growth is a determinant of mortality and poor outcome after intracerebral hemorrhage. Neurology. 2006 Apr 25; 66(8): 1175-81. [ Links ]
46. Vespa PM. Metabolic penumbra in intracerebral hemorrhage. Stroke. 2009 May;40(5):1547-8. [ Links ]
47. AlShardan MM, Mubasher M, Orz Y, AlYamany M. Factors that predict hydrocephalus following intraventricular hemorrhage. Br J Neurosurg. 2014 Sep 25: 1-4. [ Links ]
48. Steiner T, Diringer MN, Schneider D, Mayer SA, Begtrup K, Broderick J, Skolnick BE, Davis SM. Dynamics of intraventricular hemorrhage in patients with spontaneous intracerebral hemorrhage: Risk factors, clinical impact, and effect of hemostatic therapy with recombinant activated factor VII. Neurosurgery. 2006 Oct; 59(4): 767-73. [ Links ]
49. Hallevi H, Albright KC, Aronowski J, Barreto AD, Martin-Schild S, Khaja AM, Gonzales NR, Illoh K, Noser EA, Grotta JC. Intraventricular hemorrhage: Anatomic relationships and clinical implications. Neurology. 2008 Mar 11; 70(11): 848-52. [ Links ]
50. Rincon F, Mayer SA. Clinical review: Critical care management of spontaneous intracerebral hemorrhage. Crit Care. 2008; 12(6): 237. [ Links ]
51. Hanley DF. Intraventricular hemorrhage: Severity factor and treatment target in spontaneous intracerebral hemorrhage. Stroke. 2009 Apr; 40(4): 1533-8. [ Links ]
52. Sykora M, Steinmacher S, Steiner T, Poli S, Diedler J. Association of intracranial pressure with outcome in comatose patients with intracerebral hemorrhage. J Neurol Sci. 2014 Jul 15; 342(1-2): 141-5. [ Links ]
53. Hinson HE, Hanley DF, Ziai WC. Management of intraventricular hemorrhage. Curr Neurol Neurosci Rep. 2010 Mar;10(2):73-82. [ Links ]
54. Bhattathiri PS, Gregson B, Prasad KS, Mendelow AD. Intraventricular hemorrhage and hydrocephalus after spontaneous intracerebral hemorrhage: Results from the STICH trial. Acta Neurochir Suppl. 2006; 96: 65-8. [ Links ]
55. Stein M, Luecke M, Preuss M, Boeker DK, Joedicke A, Oertel MF. Spontaneous intracerebral hemorrhage with ventricular extension and the grading of obstructive hydrocephalus: The prediction of outcome of a special life-threatening entity. Neurosurgery. 2010 Nov; 67(5): 1243-51. [ Links ]
56. Lossius MI, Ronning OM, Slapo GD, Mowinckel P, Gjerstad L. Poststroke epilepsy: Occurrence and predictors--a long-term prospective controlled study Akershus Stroke Study. Epilepsia. 2005 Aug; 46(8): 1246-51. [ Links ]
57. Arntz R, Rutten-Jacobs L, Maaijwee N, Schoonderwaldt H, Dorresteijn L, van Dijk E, de Leeuw FE. Post-stroke epilepsy in young adults: A long-term follow-up study. PLoS One. 2013; 8(2): e55498. [ Links ]
58. Rodríguez-Yáñez M, Castellanos M, Freijo MM, López Fernández JC, Martí-Fàbregas J, Nombela F, et al. Clinical practice guidelines in intracerebral haemorrhage. Neurologia. 2013 May; 28(4): 236-49. [ Links ]
59. Ginde AA, Foianini A, Renner DM, Valley M, Camargo CA Jr. Availability and quality of computed tomography and magnetic resonance imaging equipment in U.S. emergency departments. Acad Emerg Med. 2008 Aug; 15(8): 780-3. [ Links ]
60. Goldstein JN, Gilson AJ. Critical care management of acute intracerebral hemorrhage. Curr Treat Options Neurol. 2011 Apr; 13(2): 204-16. [ Links ]
61. Oleinik A, Romero JM, Schwab K, Lev MH, Jhawar N, Delgado Almandoz JE, et al. CT angiography for intracerebral hemorrhage does not increase risk of acute nephropathy. Stroke. 2009 Jul; 40(7): 2393-7. [ Links ]
62. Keep RF, Hua Y, Xi G. Intracerebral haemorrhage: Mechanisms of injury and therapeutic targets. Lancet Neurol. 2012 Aug; 11(8): 720-31. [ Links ]
63. Acampa M, Guideri F, Di Donato I, Tassi R, Marotta G, Lo Giudice G, et al. Arterial stiffness in patients with deep and lobar intracerebral hemorrhage. J Stroke. 2014 Sep; 16(3): 184-8. [ Links ]
64. Lee SM, Park HS, Choi JH, Huh JT. Location and characteristics of warfarin associated intracranial hemorrhage. J Cerebrovasc Endovasc Neurosurg. 2014 Sep; 16(3): 184-92. [ Links ]
65. Al-Khaled M, Eggers J. Prognosis of intracerebral hemorrhage after conservative treatment. J Stroke Cerebrovasc Dis. 2014 Feb; 23(2): 230-4. [ Links ]
66. Morgenstern LB, Hemphill JC 3rd, Anderson C, Becker K, Broderick JP, Connolly ES Jr, et al. Guidelines for the management of spontaneous intracerebral hemorrhage: A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2010 Sep; 41(9): 2108-29. [ Links ]
67. Arboix A, Massons J, García-Eroles L, Comes E, Targa C, Oliveres M. Relapsing non-traumatic intracerebral hemorrhage: study of 28 patients. Med Clin (Barc). 2012 Nov 17; 139(12): 538-41. [ Links ]
68. Kim YZ, Park YH, Song YG, Kim KH. Clinical analysis of factors predisposing the recurrence of primary intracerebral hemorrhage in patients taking anti-hypertensive drugs: A prospective cohort study. Clin Neurol Neurosurg. 2013 May; 115(5): 578-86 [ Links ]
69. Jauch EC, Lindsell CJ, Adeoye O, Khoury J, Barsan W, Broderick J, Pancioli A, Brott T. Lack of evidence for an association between hemodynamic variables and hematoma growth in spontaneous intracerebral hemorrhage. Stroke. 2006 Aug; 37(8): 2061-5. [ Links ]
70. Kim JE, Ko SB, Kang HS, Seo DH, Park SQ, Sheen SH, et al. Clinical practice guidelines for the medical and surgical management of primary intracerebral hemorrhage in Korea. J Korean Neurosurg Soc. 2014 Sep; 56(3): 175-87. [ Links ]
71. Broderick J, Connolly S, Feldmann E, Hanley D, Kase C, Krieger D, et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update. Stroke. 2007 Jun; 38(6): 2001-23. [ Links ]
72. Yang TM, Lin WC, Chang WN, Ho JT, Wang HC, Tsai NW, Shih YT, Lu CH. Predictors and outcome of seizures after spontaneous intracerebral hemorrhage. Clinical article. J Neurosurg. 2009 Jul; 111(1):87-93. [ Links ]
73. Aguilar MI, Hart RG, Kase CS, Freeman WD, Hoeben BJ, García RC, et al. Treatment of warfarin-associated intracerebral hemorrhage: Literature review and expert opinion. Mayo Clin Proc. 2007 Jan; 82(1): 82-92. [ Links ]
74. Lwin S, Low SW, Choy DK, Yeo TT, Chou N. External ventricular drain infections: Successful implementation of strategies to reduce infection rate. Singapore Med J. 2012 Apr; 53(4): 255-9. [ Links ]
75. Kim JH, Desai NS, Ricci J, Stieg PE, Rosengart AJ, Härtl R, Fraser JF. Factors contributing to ventriculostomy infection. World Neurosurg. 2012 Jan; 77(1): 135-40. [ Links ]
76. Chi H, Chang KY, Chang HC, Chiu NC, Huang FY. Infections associated with indwelling ventriculostomy catheters in a teaching hospital. Int J Infect Dis. 2010 Mar; 14(3): e216-9. [ Links ]
77. Zétola VH, Nóvak EM, Camargo CH, Carraro H Jr, Coral P, Muzzio JA, Iwamoto FM, Coleta MV, Werneck LC. Stroke in young adults: Analysis of 164 patients. Arq Neuropsiquiatr. 2001 Sep; 59(3-B): 740-5. [ Links ]
78. Tancredi L, Martinelli Boneschi F, Braga M, Santilli I, Scaccabarozzi C, Lattuada P, et al. Stroke care in young patients. Stroke Res Treat. 2013; 2013: 715380. [ Links ]
79. Fazekas F, Enzinger C, Schmidt R, Dichgans M, Gaertner B, Jungehulsing GJ et al. MRI in acute cerebral ischemia of the young: the Stroke in Young Fabry Patients (sifap1) Study. Neurology. 2013 Nov 26; 81(22): 1914-21. [ Links ]
80. Ruiz-Sandoval JL, Romero-Vargas S, Chiquete E, Padilla-Martínez JJ, Villarreal-Careaga J, Cantú C, Arauz A, Barinagarrementería F. Hypertensive intracerebral hemorrhage in young people: previously unnoticed age-related clinical differences. Stroke. 2006 Dec; 37(12): 2946-50. [ Links ]
81. Doctor NM, Pandya RB, Vaghani CV, Marwadi MR. Study on Clinical Profile, risk factors and Mortality in Hypertensive Intracerebral Hemorrhage in a tertiary care hospital in Surat city. Natl J Med Res. 2013; 3(4): 381-4 [ Links ]
82. Gaist D, Wallander MA, González-Pérez A, García-Rodríguez LA. Incidence of hemorrhagic stroke in the general population: Validation of data from The Health Improvement Network. Pharmacoepidemiol Drug Saf. 2013 Feb; 22(2): 176-82. [ Links ]
83. Smajlović D, Salihović D, C Ibrahimagić O, Sinanović O, Vidović M. Analysis of risk factors, localization and 30-day prognosis of intracerebral hemorrhage. Bosn J Basic Med Sci. 2008 May; 8(2): 121-5. [ Links ]
84. Juvela S, Hillbom M, Palomäki H. Risk factors for spontaneous intracerebral hemorrhage. Stroke. 1995 Sep; 26(9): 1558-64. [ Links ]
85. Ruíz-Sandoval JL, Cantú C, Barinagarrementeria F. Intracerebral hemorrhage in young people: Analysis of risk factors, location, causes, and prognosis. Stroke. 1999 Mar; 30(3): 537-41. [ Links ]
86. Griffiths D, Sturm J. Epidemiology and etiology of young stroke. Stroke Res Treat. 2011; 2011: 209370. [ Links ]
87. Ariesen MJ, Claus SP, Rinkel GJ, Algra A. Risk factors for intracerebral hemorrhage in the general population: a systematic review. Stroke. 2003 Aug; 34(8): 2060-5. [ Links ]
88. Pezzini A, Grassi M, Paciaroni M, Zini A, Silvestrelli G, Iacoviello L, et al. Obesity and the risk of intracerebral hemorrhage: The multicenter study on cerebral hemorrhage in Italy. Stroke. 2013 Jun; 44(6): 1584-9. [ Links ]
89. Isozumi K. Obesity as a risk factor for cerebrovascular disease. Keio J Med. 2004 Mar; 53(1): 7-11. [ Links ]
90. Kim SH, Lee YS, Lee SM, Yoon BW, Park BJ. Body mass index and risk of hemorrhagic stroke in Korean adults: Case-control study. J Prev Med Public Health. 2007 Jul; 40(4): 313-20. [ Links ]
91. Rutten-Jacobs LC, Maaijwee NA, Arntz RM, Schoonderwaldt HC, Dorresteijn LD, van Dijk EJ, de Leeuw FE. Clinical characteristics and outcome of intracerebral hemorrhage in young adults. J Neurol. 2014 Nov; 261(11): 2143-9. [ Links ]
92. Li YF, Luo J, Li Q, Jing YJ, Wang RY, Li RS. A new simple model for prediction of hospital mortality in patients with intracerebral hemorrhage. CNS Neurosci Ther. 2012 Jun; 18(6): 482-6. [ Links ]
93. Samprón N, Mendia A, Azkarate B, Alberdi F, Arrazola M, Urculo E. Early mortality in spontaneous supratentorial intracerebral haemorrhage. Neurocirugia (Astur). 2010 Apr; 21(2): 93-8. [ Links ]
94. Chiquete E, Ochoa-Guzmán A, Vargas-Sánchez A, Navarro-Bonnet J, Andrade-Ramos MA, Gutiérrez-Plascencia P, Ruiz-Sandoval JL. Blood pressure at hospital admission and outcome after primary intracerebral hemorrhage. Arch Med Sci. 2013 Feb 21; 9(1): 34-9. [ Links ]
95. Zhang Y, Reilly KH, Tong W, Xu T, Chen J, Bazzano LA, Qiao D, Ju Z, Chen CS, He J. Blood pressure and clinical outcome among patients with acute stroke in Inner Mongolia, China. J Hypertens. 2008 Jul; 26(7): 1446-52. [ Links ]
96. Seo W, Oh H. Acute physiologic predictors of mortality and functional and cognitive recovery in hemorrhagic stroke: 1-, 3-, and 6-month assessments. J Stroke Cerebrovasc Dis. 2007 Mar-Apr; 16(2): 57-63. [ Links ]
97. Falcone GJ, Biffi A, Devan WJ, Brouwers HB, Anderson CD, Valant V, et al. Burden of blood pressure-related alleles is associated with larger hematoma volume and worse outcome in intracerebral hemorrhage. Stroke. 2013 Feb; 44(2): 321-6. [ Links ]
98. Rodriguez-Luna D, Muchada M, Piñeiro S, Flores A, Rubiera M, Pagola J, et al. Potential blood pressure thresholds and outcome in acute intracerebral hemorrhage. Eur Neurol. 2014; 72(3-4): 203-8. [ Links ]
99. Rodriguez-Luna D, Piñeiro S, Rubiera M, Ribo M, Coscojuela P, Pagola J, et al. Impact of blood pressure changes and course on hematoma growth in acute intracerebral hemorrhage. Eur J Neurol. 2013 Sep; 20(9): 1277-83. [ Links ]
100. Bhatia R, Singh H, Singh S, Padma MV, Prasad K, Tripathi M, Kumar G, Singh MB. A prospective study of in-hospital mortality and discharge outcome in spontaneous intracerebral hemorrhage. Neurol India. 2013 May-Jun; 61(3): 244-8. [ Links ]
101. Fan JS, Huang HH, Chen YC, Yen DH, Kao WF, Huang MS, Huang CI, Lee CH. Emergency department neurologic deterioration in patients with spontaneous intracerebral hemorrhage: Incidence, predictors, and prognostic significance. Acad Emerg Med. 2012 Feb; 19(2): 133-8. [ Links ]
102. Kuramatsu JB, Bobinger T, Volbers B, Staykov D, Lücking H, Kloska SP, Köhrmann M, Huttner HB. Hyponatremia is an independent predictor of in-hospital mortality in spontaneous intracerebral hemorrhage. Stroke. 2014 May; 45(5): 1285-91. [ Links ]
Artículo recibido: 28 diciembre 2014 Artículo aceptado: 26 enero 2015
Autor correspondiente:
Dr. Juan S. Arce Kita
Dirección: Itauguá, Paraguay
Teléfono: (595) 986 226385
Correo electrónico: drarcekita@gmail.com
1Residente de Medicina Interna. Dpto. de Medicina Interna. Hospital Nacional (Itauguá, Paraguay). Facultad de Medicina, Universidad Nacional de Itapúa