INTRODUCCIÓN
Las fibrosis derivadas de cicatrices por quemaduras siguen siendo un reto en la medicina plástica reconstructiva no sólo por el aspecto estético sino también por las contracturas finales que pueden afectar la función de algún miembro. Los estudios histológicos de injertos de grasa han documentado cambios en la textura y apariencia con signos de regeneración que se caracterizan por la neovascularización, aumento del contenido de colágeno, y la hiperplasia cutánea1-3. Esto se traduce en una mejor flexibilidad, color y textura con una mejoría en futuras contracciones.
Sin embargo, el espacio subcutáneo en una lesión por quemadura constituye un ambiente hostil para un injerto de grasa, y a menudo compromete el resultado clínico. Por lo tanto, una estrategia óptima sería introducir en el espacio subcutáneo los elementos capaces de inducir la formación de nuevos vasos sanguíneos mientras se asegura la restauración del volumen y regeneración de tejidos.
Las células madre mesenquimáticas (CMM) constituyen una población de células presentes en todos los tejidos, incluyendo la grasa, organizada en el espacio perivascular 4-7. Como parte de sus actividades tróficas8, que producen factores angiogénicos tales como el factor de crecimiento endotelial vascular(FCEV) y el factor de crecimiento de hepatocitos(FCH), postulados en la supervivencia de los injertos9,10. Hoy en día existe una variada tecnología que permite el procesamiento de la grasa con el fin de obtener la fracción del estroma vascular (FEV), que constituye el componente celular, donde se incluyen las CMM y otros tipos de células. Estas técnicas tienen, como un factor común, una digestión enzimática de tejido adiposo usando una u otra forma de la colagenasa, seguida por centrifugación.
La FEV obtenida de esta manera constituye un elemento vascular autólogo de grasa del propio paciente y, como consecuencia, podrían ser readministradas de nuevo al paciente siguiendo una lógica similar a una autotransfusión de sangre u otros hemoderivados (por ejemplo, plasma rico en plaquetas)11.
El efecto deseado de la adición de FEV a un injerto de grasa convencional es potenciar su supervivencia por medio de la inducción de nuevos vasos sanguíneos; como ejemplo de experiencia similar puede mencionarse el tratamiento de la lipodistrofia facial y de mama, la reconstrucción de glúteos y la terapia de úlceras crónicas 12-14 ya sea administrado como un injerto de grasa con FEV o como una solución de FEV per sé, el objetivo es alterar la biología del tejido receptor.
MATERIAL Y MÉTODOS
Estudio analítico, experimental tipo ensayo no controlado o estudio de intervención. La población consistió en 4 pacientes de sexo femenino con cicatrices por quemaduras que consultaron al Centro Nacional de Quemaduras y Cirugía Reconstructiva (CENQUER) en mayo de 2017. Las muestras de tejido adiposo humano fueron obtenidas de liposucciones con zonas donantes en abdomen, flanco y cara interna de los muslos, principalmente. Se obtuvo el consentimiento informado para la utilización de las muestras con propósito de investigación. La recogida del tejido adiposo se realizó mediante aspiración utilizando el dispositivo de jeringas de succión y cánulas de punta roma tipo mercedes de 4 y 3 mm de diámetro, previa infiltración de la zona donante mediante solución salina fisiológica y adrenalina.
Para el aislamiento de la FEV utilizamos un dispositivo médico cerrado (GID SVF-1) que permite la recogida directa del lipoaspirado desde la cánula de liposucción, así como el procesamiento del mismo de forma rápida y sencilla (The GID GroupInc, Colorado, EE.UU). El procedimiento empleado fue el siguiente:
Tres lavados consecutivos del tejido adiposo utilizando solución Ringer Lactato suplementada con antibióticos y heparina.
Digestión enzimática durante 40 minutos a 37 ºC en agitación utilizando el reactivo GIDzyme-2 (The GID GroupInc, Colorado, EEUU).
Inactivación de la enzima mediante albúmina humana al 2,5% y centrifugación a 800 G durante10 minutos para obtener el pellet celular (tejido comprimido) que contiene la FEV
Este pellet se resuspendió en 20 ml de Ringer Lactato mediante una aguja espinal de 14 G (Abbocath) y la suspensión celular obtenida se analizó y se inyectó en las cicatrices por quemaduras.
La selección de la muestra requirió los siguientes criterios de inclusión: pacientes de cualquier edad con cicatrices postquemadura de 3°grado con antigüedad de la lesión superior o igual a 2 años. Los criterios de exclusión fueron: pacientes embarazadas o en periodo de lactancia, antecedente de ingesta de retinoides orales de menos de 6 meses, infecciones activas o lesiones sospechosas de malignidad y pacientes que se encontraran recibiendo otro tratamiento para la remodelación de la cicatriz.
En la primera consulta se procedió a la evaluación general del paciente, registro de historia clínica y obtención del consentimiento informado. Fueron tomadas fotografías de las pacientes con cámara digital en el preoperatorio y a los 6 meses.
Para la obtención de los datos pre y postoperatorios utilizamos la Escala de Vancouver para cicatrices (Vancouver Scar Assesment /VSS)5, que categoriza las diferentes características valorables en una cicatriz tales como pigmentación, vascularización, flexibilidad y altura/grosor. Estos parámetros se expresaron sobre un total de 13 puntos. La evaluación de la pigmentación y la vascularización se realizó por observación, la flexibilidad mediante digito presión del área examinada y la altura/grosor con una regla milimétrica, en la primera visita del paciente y trascurridos 6 meses del tratamiento.
Para la percepción del paciente con respecto a sus cicatrices utilizamos la Escala del Observador y Paciente para Evaluación de Cicatrices (Patient and Observer Scar Assesment Scale/POSAS), que permite evaluar sobre una medida numérica y de manera subjetiva los síntomas relativos a dolor, picor, color, rigidez, espesor y alivio3. Dicha escala se obtuvo tras el interrogatorio al paciente con una puntuación míni ma de 1 (mejor posible) al 10 (peor posible), completándose simultáneamente la ficha escrita de cada paciente para cada parámetro.
También se tomaron muestras de tejido cicatricial antes de iniciar el tratamiento y tras 6 meses desde la inyección y fueron evaluados a la microscopía óptica.
RESULTADOS
La muestra estudiada involucró 4 cicatrices en una población de 4 pacientes. Todas fueron de sexo femenino, la edad media (media +/- desviación estándar (DP)) fue de 30,5 +/- 7,2 años, con un rango de 22 a 37 años. El índice de masa corporal (IMC) medio fue de 20 +/- 2. El promedio de antigüedad de las cicatrices fue de 22 años. Ninguna paciente presentaba infección, enfermedad o alteración endocrina concomitante. En 2 pacientes la ubicación anatómica de las cicatrices correspondió al rostro, una en la pierna y una en el brazo.
Todas mostraron mejoría en lo que respecta a las características de las cicatrices según la escala VSS del 36% y según POSAS del 20%.Tabla 1 y Tabla 2
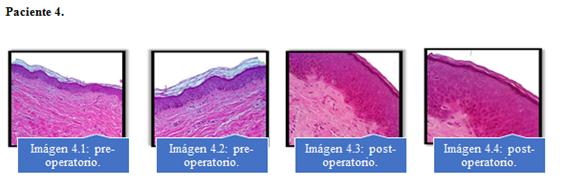
Se observó aumento de angiogénesis en las muestras analizadas a la microscopía óptica a los 6 meses en comparación a las muestras del preoperatorio. Imagen 1 al 4.
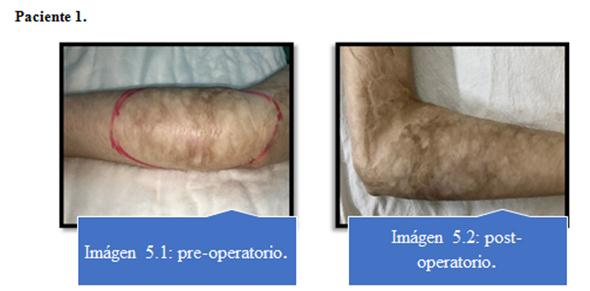
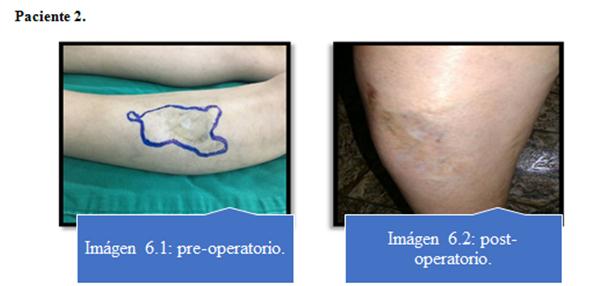
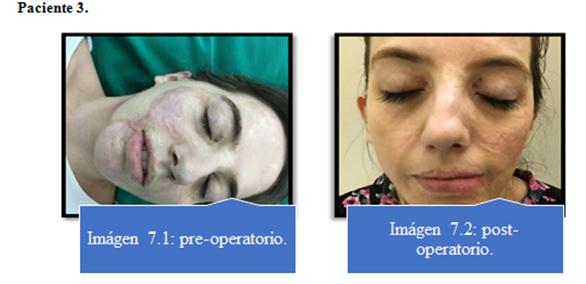
Ningún paciente presentó complicaciones con respecto al procedimiento de lipoaspiración. Imagen 5 al 8.
DISCUSIÓN
El uso de injertos de grasa para la reconstrucción subcutánea ha sido parte de la cirugía plástica hace más de 100 años. El advenimiento de la lipoaspiración en la década de 1980 facilitó la acumulación de grasa, dando impulso a los esfuerzos renovados para inyectar el tejido recogido15.
Al inicio de un procedimiento, la grasa del injerto debe adquirir su nutrición por difusión, hasta que los vasos del tejido circundante puedan infiltrarse con nuevas ramificaciones. En grandes injertos, el tejido vascular resulta insuficiente lo que provoca necrosis de la parte central del tejido y se manifiesta durante los primeros 6 meses como atrofia con pérdida de los adipocitos, fibrosis y producción de quistes16.
Para minimizar estas pérdidas de volumen, Coleman desarrolló técnicas menos traumáticas para la cosecha, el proceso, y la inyección con resultados que demostraron ser fiables y duraderos17,18. Muchos informes documentan ahora la utilidad de los injertos de grasa para restablecer el volumen subcutáneo en la cara19-22, en las mamas23-24, en defectos subcutáneos congénitos25, y en las úlceras cutáneas26. La clave para entenderlos mecanismos involucrados en este fenómeno terapéutico radica en la existencia de CMM dentro del tejido adiposo siendo los primeros en utilizar esta técnica Zuk y colab.27-30 en la Universidad de Pittsburgh.
La grasa se considera un tejido conectivo estructural, compuesto por acumulaciones de adipocitos intercalados en un marco de estroma. Este componente estromal incluye una red reticular de fibras vasculares (típicamente vasos de pequeño calibre) y sus células asociadas. Por lo tanto, después de procesar la grasa con la digestión de enzimas (ej: colagenasa), el componente celular del estroma puede ser liberado. Esta fracción vascular del estroma contiene células diferenciadas, tales como monocitos/macrófagos, leucocitos, fibroblastos, pericitos y adipocitos inmaduros, así como células indiferenciadas, tales como células progenitoras endoteliales y CMM31. Estas células no diferenciadas dentro de la FEV constituyen el componente biológicamente activo de un injerto de grasa, ya que son capaces de inducir la formación de nuevos vasos sanguíneos mientras se ejerce otros efectos tróficos8. Un número creciente de literatura documenta los efectos terapéuticos de estas células después de reconocer sitios lesionados caracterizados por la inflamación activa6,32-34.
Estos efectos están relacionados con inmunomoduladores y mecanismos tróficos, ejercidos a través de la secreción parácrina de factores de crecimiento y citocinas por las CMM, esta multi-señalización resultante promueve el establecimiento de un entorno de regeneración mediante la limitación de tejido cicatrización/fibrosis-inflamatoria mediada mientras se induce angiogénesis y la supervivencia/multiplicación de las células locales 8,35-37.
Durante la curación de heridas cutáneas, se han descrito mecanismos especiales que dan cuenta de los efectos generadores de CMM38. Ellos incluyen: modulación del fenotipo y la función de las células T y los macrófagos, la neutralización de especies reactivas de oxígeno a nivel local, la secreción de factores anti-fibróticos que modulan la producción de fibroblastos asociados de curación de heridas, mejora la función de los fibroblastos dérmicos al tiempo que reducen su conversión a miofibroblastos, la promoción de la angiogénesis y estabilidad vascular y el potencial de diferenciación directamente en las células residentes de la piel tales como queratinocitos y fibroblastos dérmicos.
Curiosamente, varios mecanismos propuestos de CMM que están activos durante situaciones agudas parecen estar también presentes en escenarios crónicos tales como secuelas de quemadura o en la cicatrización hipertrófica. Está bien establecido que las CMM expresan y secretan factores angiogénicos tales como FCEV, FCH y FCF (factor de crecimiento de fibroblastos), que mejoran la proliferación, migración y diferenciación de progenitores de células endoteliales39,40. Además de este efecto inductivo, factores CMM secretados también promueven la estabilidad vascular y vasoprotección41-43. Se ha planteado la hipótesis de que este angiogénico se ve facilitado por su origen perivascular, que se adapta durante el período de regeneración luego de la reorientación a sitios lesionados6, y cuando el proceso de remodelación vascular se lleva a cabo44,45.
Por otra parte, es bien sabido que en la cicatrización hipertrófica (es decir: fibrosis) presenta características anormales de la estructura de la matriz extracelular y de la función, incluyendo aumento de la degradación de la matriz y la formación de colágeno por lo que se ve directamente afectada la disponibilidad de fibroblastos locales a proliferar, migrar y secretar la matriz extracelular. Varios mecanismos y cascadas de señalización tienen implicaciones en este equilibrio de tejidos. Curiosamente, y como se esperaba, las CMM participan en todos estos mecanismos a través de sus actividades paracrinas. Por ejemplo, suprimen proliferación pro-fibroblastos y reducen la fibrosis de la piel a través de la secreción y la actividad de FCF46,47. En adición, las CMM afectan la migración de fibroblastosdérmicos en una manera dependiente de la dosis48.
Por otra parte, se ha demostrado que las CMM pueden prevenir la cicatrización hipertrófica a través de la secreción deTSG-6 (TNF un- estimulado gen / proteína 6) que implica apoptosis a través de la activación de caspasa-349. Este mecanismo sugiere que el efecto regulador de las MSC sobre la inflamación y el proceso de cicatrización subsiguiente implica su presencia temporal en los sitios donde se secretan TSG-6 inducida por las señales de apoptosis. Por último, se ha demostrado que los fibroblastos en la cicatrización hipertrófica tienen una actividad reducida de la metaloproteinasa de matriz 1 (MMP-1)50,51, resultando una remodelación deteriorada. Loz- Ito y colab. demostraron que las CMM de varias fuentes, incluyendo la grasa son capaces de activar exógenamente proMMP-2 y proMMP-13 en su forma degradativa52. Estas MMPs se dirigen a diversos componentes de la matriz extracelular incluyendo diferentes colágenos, la minina, fibronectina y elastina, por lo tanto promueven un estado de remodelación53.
Puede concluirse que la intervención realizada beneficia de manera notable la evolución de las lesiones, con resultados favorables según la correlación de las dos escalas de evaluación utilizadas tanto en el aspecto estético como clínica, en la capacidad funcional así como en la angiogénesis a la microscopía óptica. La remodelación de las cicatrices utilizando fracción derivadas de tejido adiposo del estroma vascular puede plantearse como una alternativa útil en el manejo conjunto o aislado de las cicatrices por quemaduras con nula morbilidad para el paciente.