INTRODUÇÃO
Espécies de Stemphylium são responsáveis por diversas doenças em plantas cultivadas como a podridão radicular em cenoura (Daucus carota L. var. sativa), causada por S. radicinum, a mancha foliar em alfafa (Medicago sativa L.), causada por S. botryosum, a mancha-de-estenfílio em aliáceas, causada por S. vesicarium e a mancha-de-estenfílio em tomate (Lycopersicon esculentum Mill.) causada por S. solani entre outras (Miller & Lacy, 1995).
Em Aliaceaes (Allium spp.), a queima-de-estenfílio, causada por S. vesicarium e em menor intensidade por S. botryosum, é considerada uma das mais importantes doenças de parte aérea nessa família em todo o mundo (Cramer, 2000). Ocorre com maior severidade em condições climáticas em que prevalecem altas temperaturas e elevada umidade relativa do ar (Suheri & Price, 2000a, b). Essa doença ocorre associada à queima púrpura das Aliaceaes, causada por Alternaria porri (Ellis) Cif., cujos sintomas destas normalmente são indistinguíveis, sendo considerado como um complexo causado por ambos patógenos (Suheri & Price, 2001).
Uma importante etapa nos estudos de fitopatógenos em condições controladas e no campo é o cultivo do microrganismo em condições assépticas para produção massal de estruturas reprodutivas (Leão, Santos, Sarmento, Reis & Chagas Júnior, 2012). A maioria dos microrganismos cultiváveis cresce em meios contendo uma fonte de carbono e nitrogênio, além de outros elementos em menor quantidade, como potássio, fósforo, enxofre, ferro, magnésio, zinco, manganês e vitaminas (Alfenas & Mafia, 2016). Contudo, a composição do meio de cultura depende do microrganismo que se deseja cultivar e dos objetos de estudo.
São poucos os meios de cultura citados na literatura para o crescimento de Stemphylium sp. Entre eles destacam-se o de Phytone-dextrose ágar para a esporulação e o Suco V-8® Ágar para o crescimento e esporulação de Stemphylium (Dhingra & Sinclair, 1995; Miller, 1955). Diante da escassez de informações sobre o crescimento do fungo Stemphylium spp. in vitro, o uso de diferentes meios de cultura constitui uma forma de se avaliar aquele que é mais propício para o seu crescimento e desenvolvimento.
Em decorrência dos problemas ocasionados pelo uso intensivo de agrotóxicos, torna-se imprescindível a busca por medidas alternativas no controle de doenças através do uso de produtos naturais, que podem se tornar eficientes e de baixo impacto ambiental. Além disso, não há fungicidas registrados para o manejo da mancha-de-estenfílio no país (Ministerio de Agricultura Pecuária e Abastecimiento, 2018).
Como medidas de manejo de doenças fúngicas, sobretudo para aquelas em que não há fungicidas registrados, os óleos essenciais, também conhecidos como óleos voláteis e óleos etéreos constituem-se como medida alternativa, visto que possuem atividade antibacteriana e antifúngica (Ramos, Andreani Junior & Kozusny - Andreani, 2016).
Podendo ser extraído de plantas aromáticas e medicinais, os óleos são obtidos de diversas partes dessas plantas, como: folhas, flores, sementes, raízes, cascas e tubérculos (Trajano & Santos, 2009). Dentre os óleos essenciais promissores para o controle de fungos fitopatogênicos destaca-se o óleo de melaleuca (Melaleuca alternifolia Maiden e Betche, Cheel - Família Myrtaceae), que possui como componente majoritário o terpinen-4-ol (entre 30 e 40%) seguido de γ-terpineno (entre 10 e 28%), α-terpineno (entre 5 e 13%), 1,8-Cineole (≤15%) (Castelo et al., 2013; Carson, Hammer & Riley, 2006).
O óleo de melaleuca possui atividade fungicida e fungistática em fungos filamentosos (Hammer, Carson & Riley, 2004), sendo seu efeito comprovado sobre Macrophomina phaseolina, Sclerotinia sclerotiorum e Alternaria alternata nas concentrações acima de 0,2%, incorporado ao meio de cultura (Santos Martins, Sagata, Araújo Santos & Juliatti, 2010), ao Colletotrichum gloeosporioides em concentração acima de 0,46% (Marinelli, Orzali, Lotti & Riccioni, 2012), ao Botrytis cinerea em folhas de repolho nas concentrações de 1,6% e 3,2% (Bishop & Reagan, 1998), bem como a eliminação da carga microbiana de C. gloeosporioides na concentração de 0,8% com tempo de exposição mínima de 40 minutos (Ramos et al., 2016).
Assim, o objetivo deste trabalho foi avaliar o crescimento micelial de Stemphylium sp. sob diferentes meios de cultura para posteriormente determinar o efeito do óleo essencial de melaleuca (Melaleuca alternifolia) no índice de velocidade de crescimento micelial in vitro desse patógeno.
MATERIAL E MÉTODOS
O experimento foi conduzido no Laboratório de Fitopatologia do Instituto Federal de Educação, Ciência e Tecnologia do Triângulo Mineiro - Campus Uberlândia, Uberlândia, Minas Gerais.
O isolado de Stemphylium sp. foi obtido de folhas de cebola var. Mercedes, híbrido de dias curtos para climas tropicais, folhagem vigorosa e resistente à raiz rosada (Pyrenochaeta terrestris). Plantas com sintomas típicos da doença foram coletadas de uma lavoura comercial situada no município de Santa Juliana, MG.
Partes infectadas das folhas foram cortadas em pequenos pedaços com ±1 cm2 cada, lavados em água destilada e esterilizadas pela imersão em hipoclorito de sódio a 0,5% por dois minutos, em seguida imersos em solução de etanol a 70% por um minuto e enxaguado três vezes em água esterilizada. Cinco fragmentos foram depositados em placas de Petri (9 cm de diâmetro) contendo 20 mL do meio batata dextrose agar (BDA) (Suheri & Price, 2000a). Três replicatas foram realizadas para cada amostra.
As placas foram incubadas em câmara climatizada (BOD) a 27oC ± 2 e fotoperíodo de 12h por 5-6 dias. Os fungos foram purificados pela inoculação em placas de Petri contendo BDA e a identificação dos isolamentos fúngicos foram realizadas com base nas características macro e microscópicas (Ellis, 1971). O isolado puro foi conservado em vidros com água destilada esterilizada seguindo-se a metodologia de Castellani (1939) para ensaios posteriores.
Ensaio 1: Meios de cultura para o crescimento de Stemphylium sp. in vitro.
Sete diferentes meios de cultura foram avaliados nesse trabalho, quais sejam: 1. Batata Dextrose Ágar (BDA); 2. Suco V-8® Ágar 5%; 3. Suco V-8® Ágar 10%; 4. Suco V-8® Ágar 20%; 5. Suco de tomate 5% (ST-5%); 6. Suco de tomate 10% (ST-10%); 7. Suco de tomate 20% (ST-20%) e 8. MEA 2% (extrato de malte - ágar). O suco V-8® utilizado é da marca Campbell’s® composto por 90% de suco de tomate e complementado por suco de cenoura, suco de beterraba, suco de salsa, suco de aipo, suco de alface, suco de agrião e suco de espinafre. O suco de tomate utilizado é da marca Superbom® composto exclusivamente por suco de tomate integral.
Todos os meios de cultura foram autoclavados a 120oC (1 atm; pressão relativa) por 20 minutos e vertidos assepticamente em placa de Petri. Para cada placa de Petri contendo 15 mL de meio foi repicado um disco de 5 mm de diâmetro, retirado das bordas de colônias desenvolvidas em meio BDA, durante seis dias, 27±2oC, no escuro.
As placas foram incubadas em BOD a 27±2 oC e fotoperíodo de 12h. Após dez e quinze dias de crescimento, as colônias foram medidas em dois sentidos perpendiculares entre si, tomando-se como valor a média. O experimento seguiu o delineamento inteiramente casualizadas (DIC) com oito tratamentos e seis repetições constituídas de uma placa de Petri. Os dados foram avaliados pelo teste de F e as médias comparadas pelo teste de Scott-Knott a 5% de probabilidade utilizando-se o programa estatístico Sisvar® (Ferreira, 2000).
Ensaio 2: Efeito do óleo essencial de melaleuca (M. alternifolia) sobre o IVCM
O óleo de melaleuca utilizado nesse estudo é puro e foi obtido comercialmente de uma empresa especializada registrada na ANVISA. O óleo foi incorporado ao meio de BDA à temperatura de 45ºC e autoclavado após diluições em série para se obter as seguintes concentrações: 0; 0,2; 0,4; 0,6 e 0,8%. Discos de 0,6 cm de diâmetro contendo colônias puras do fungo Stemphylium sp foram transferidos para o centro da placa de Petri, com os seus respectivos tratamentos e armazenadas em câmara de crescimento a 27 ±2ºC e fotoperíodo de 12 horas.
Utilizou-se o delineamento inteiramente casualizado (DIC) com cinco tratamentos e cinco repetições sendo o IVCM calculado e os dados foram submetidos à análise de variância e, quando significativos, à análise de regressão por meio do software SISVAR® (Ferreira, 2000).
A avaliação do crescimento micelial foi realizada, a cada 24 h, durante 11 dias, pela medição do diâmetro das colônias nos dois sentidos perpendiculares entre si. Utilizou-se como valor a média a partir do momento em que foi adicionado o disco de micélio com o isolado no meio de cultura. O índice de velocidade de crescimento micelial foi calculado conforme a fórmula: IVCM = ∑(D-Da)/N, onde, D = diâmetro médio atual da colônia (cm); Da = diâmetro médio da colônia do dia anterior (cm); N = número de dias após a inoculação (dias).
RESULTADOS E DISCUSSÃO
Ensaio 1: Avaliação do crescimento do Stemphylium sp. em diferentes meios de cultura.
O meio de cultura influenciou no crescimento micelial do fungo nas condições estudadas. Aos 10 dias o maior crescimento foi observado com a inoculação do fungo nos meios de cultura ST-20% (71,08 cm) e BDA (65,41 cm), enquanto o menor crescimento foi observado no tratamento V8® Ágar 5% (46,30 cm). Aos 15 dias novamente os tratamentos ST-20% e BDA acarretaram no maior crescimento micelial e, opostamente, os tratamentos V8® Ágar 5% e V8® Ágar 10% o menor crescimento. Os demais tratamentos proporcionaram resultados medianos em ambas as avaliações (Tabela 1).
Tabela 1 Média da avaliação (aos 10 e 15 dias) de diferentes meios de cultura no crescimento micelial (cm) de Stemphylium sp. isolados de cebola. IFTM, Uberlândia, 2017.
| Meios de cultura | 10 dias (cm) | 15 dias (cm) |
|---|---|---|
| ST-20% | 71,08 a | 84,10 a |
| BDA | 65,41 a | 90,02 a |
| V-8 ® Ágar 10% | 58,75 b | 73,01 b |
| V8® Ágar 20% | 57,33 b | 77,48 b |
| ST-10% | 53,50 b | 65,20 b |
| MEA | 53, 25 b | 71,41 c |
| ST-5% | 46, 30 c | 64,96 d |
| V8® Ágar 5% | 33, 50 d | 69,56 d |
| CV (%) = | 13,30 | 7,89 |
| Média geral = | 54,95 | 74,47 |
| Erro padrão médio = | 2,9831 | 2,3998 |
Médias seguidas pela mesma letra, na coluna, não diferem estatisticamente ao nível de 5% pelo teste de Scott-Knott.
Os componentes presentes nos meios de cultura enriquecidos têm a finalidade de imitar ou de se aproximar do efeito dos nutrientes químicos naturais presentes nas folhas das plantas, a fim de se obter um efeito semelhante de crescimento como naquele encontrado na natureza. Sabe-se que a composição do meio de cultura, a temperatura e luminosidade determinam a quantidade e qualidade do crescimento micelial dos fitopatógenos (Dhingra & Sinclair, 1995).
Para Dhingra e Sinclair (1995), os meios de cultura que contenham extratos e sucos de folhas e de partes vegetais normalmente estimulam o crescimento micelial e esporulação de fungos. O meio de cultura BDA é frequentemente utilizado para o crescimento micelial e esporulação de espécies de Alternaria entre outras (Ávila, Mello Ribeiro & Fontes, 2000; Teixeira, Chitarra, Arias & Machado, 2001).
Destaca-se ainda que o efeito do meio de cultura não pode ser considerado isoladamente para a determinação do crescimento micelial de fungos em geral, estando associado a outros fatores ambientais tais como a temperatura, comprimentos de onda da luz durante a incubação, tipo de injúria aplicada à colônia micelial e fotoperíodo entre outros (Dias, 2012).
Associados a esses fatores destaca-se ainda a origem do isolado, observando-se inclusive uma diferenciação de crescimento de uma mesma espécie fúngica obtido de diferentes espécies vegetais, tal como relatado por Fancelli (1991) sobre a resposta diferenciada de isolados de Alternaria solani obtidos de batateira e tomateiro, necessitando-se de injúrias para esporulação dos isolados provenientes desse último. Resultados similares foram encontrados por pesquisadores ao estudarem isolados de Verticillium obtidos de diferentes hospedeiros (Aparecido & Finatti, 2012).
O fungo Colletotrichum gloeosporioides apresentou-se sensível no controle deste com o uso do óleo essencial de melaleuca na concentração 0,8%, conforme (Ramos et al., 2016). Segundo Steffen, Maldaner, Steffen, Missio & Mezzomo (2019), o óleo essencial de melaleuca apresentou ação antifúngica sobre o crescimento in vitro de S. sclerotiorum e Fusarium spp., inibindo totalmente o desenvolvimento do micélio de ambos os fitopatógenos na concentração de 0,5%.
Ensaio 2: Efeito do óleo essencial de melaleuca (M. alternifolia) sobre o IVCM
O óleo essencial de melaleuca reduziu significativamente o crescimento micelial de Stemphylium sp. A redução do crescimento micelial medido pelo IVCM em função da concentração do óleo de melaleuca foi melhor ajustada ao modelo quadrático (Figura 1).
Segundo Martins et al. (2010), a inibição do crescimento micelial em função das concentrações do óleo de melaleuca foram melhores ajustadas ao modelo quadrático, inferindo que a concentração que melhor se ajustou no controle dos fungos fitopatogênicos foi de 0,4%, contribuindo para um menor índice de crescimento micelial dos fungos testados (Figura 2).
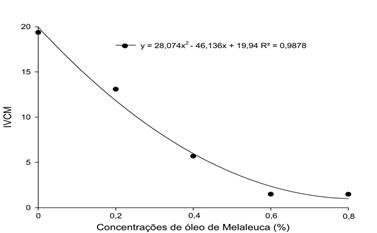
Figura 1 Índice de velocidade de crescimento micelial (IVCM) de Stemphylium sp., isolados de cebola, em função de diferentes concentrações de óleo de melaleuca. IFTM, Uberlândia, 2017.

Figura 2 Tratamentos com diferentes concentrações em BDA + óleo de melaleuca em que: a) 0,8%; b) 0,6%; c) 0,4%; d) 0,2%; e) Testemunha. IFTM, Uberlândia, 2017. (Foto de autoria própria).
A partir do IVCM foi realizado comparação de médias para melhor distinção das concentrações utilizadas do óleo de melaleuca (Tabela 2).
Tabela 2 Efeito do óleo de melaleuca (Melaleuca alternifolia) sobre a média do índice de velocidade média de crescimento (IVCM) de Stemphylium sp. isolado de cebola. IFTM, Uberlândia, 2017.
| Tratamento | IVCM (cm) | |
|---|---|---|
| Óleo de M. alternifolia (0,8%) | 1,48± | a |
| Óleo de M. alternifolia (0,6%) | 1,49± | a |
| Óleo de M. alternifolia (0,4%) | 4,56± | b |
| Óleo de M. alternifolia (0,2%) | 13,09± | c |
| Testemunha | 19,36± | d |
| CV (%) = | 17,77 | |
| Média geral = | 7,99 | |
| Erro padrão médio= | 0,6352 |
O menor IVCM foi observado nas concentrações de 0,8% e 0,6%, seguido pelas concentrações de 0,4% e 0,2%, que diferiram entre si e das maiores concentrações aplicadas. Todas as concentrações apresentaram efeito na redução do IVCM em relação à testemunha sem a adição do óleo de melaleuca ao meio de cultura.
A sensibilidade de fungos ao óleo de melaleuca a baixas concentrações já era conhecido. A. alternata, M. phaseolina e S. sclerotiorum apresentaram sensibilidade ao óleo de melaleuca na concentração de 0,2% in vitro (Martins et al., 2010). In vivo, houve o controle de B. cinerea em folhas de repolho em concentrações acima de 1,6% (Bishop & Reagan, 1998) e de Cercospora beticola a partir de 0,67% de concentração do óleo (Souza et al., 2015). Concha, Moore e Hoolloway (1998), relataram que o óleo de melaleuca no controle contra Aspergillus niger, Penicillium sp., entre outros e obtiveram uma atividade antimicrobiana significante, sugerindo que o óleo pode ser útil no tratamento de doenças fúngicas.
Outros trabalhos também apresentaram inibição do crescimento micelial de Penicillium sp. com o uso do óleo de melaleuca, a exemplo de Chidi, Bouhoudan & Khaddor (2020). Hammer et al. (2004), relataram a atividade fungistática e fungicida do óleo em dermatófitos e fungos filamentosos, enquanto que Papadopoulos, Carson, Hammer & Riley (2006) relataram atividade semelhante em Pseudomonas spp., onde a concentração mínima inibitória encontrada nos tratamentos com o óleo de Melaleuca sp. foi de 2,0%.
Quanto ao mecanismo de ação antifúngica do óleo essencial de melaleuca destaca-se a alteração na permeabilidade da membrana, afetando tanto a membrana plasmática como a mitocondrial (Carson et al., 2006) levando-se, nesse caso, à inibição da respiração mitocondrial. Segundo Cox et al., (2000) há a possiblidade do óleo essencial de Melaleuca atuar diretamente em enzimas respiratórias. Outros estudos apontam que o óleo inibe a formação do tubo germinativo, ou a conversão micelial afetando dessa forma o desenvolvimento e o crescimento do fungo (Carson et al., 2006).
A determinação da atividade biológica desses componentes presentes nos óleos essenciais, com relação ao efeito antimicrobiano, pode favorecer o desenvolvimento de novas moléculas químicas, fundamentais para o manejo de doenças de plantas, reduzindo o aparecimento de microrganismos resistentes, bem como a contaminação do meio ambiente.
Desta forma, pode-se afirmar que o óleo essencial utilizado, possui efeito fungicida no controle do Stemphylium spp. in vitro, o que pode estar relacionado à presença de componentes majoritários em sua composição química, como o terpinem 4-ol (Vieira, Barbosa, Maltha, Paula & Nascimento, 2004).
CONCLUSÕES
O meio de cultura a base de suco de tomate a 20% obteve um crescimento micelial de 71,08 cm aos 10 dias e 84,10 cm aos 15 dias, seguido do meio de cultura BDA com crescimento micelial de 65,41 cm aos 10 dias e 90,02 cm aos 15 dias.
Os tratamentos nas concentrações de 0,8% e 0,6% do óleo essencial de melaleuca apresentaram melhor eficiência no controle de Stemphylium sp. in vitro.















