INTRODUCCIÓN
En el Paraguay los cítricos se encuentran distribuidos en casi todos los Departamentos del país, fundamentalmente debido a las condiciones agroecológicas propicias para su cultivo. La producción generada en estas fincas es destinada principalmente al consumo como fruta fresca, además, en algunos casos, para el abastecimiento de industrias instaladas en algunos Departamentos como en el de Itapuá(González & Tullo, 2019).
Entre las diversas enfermedades que pueden afectar a este cultivo, el Huanglongbing (HLB) también conocida como la enfermedad de los brotes amarillos, dragón amarillo o greening, es considerada como la más devastadora de los últimos diez años a nivel mundial, provocando rápidas y severas pérdidas, tanto en el rendimiento como en la calidad del fruto, y representa una peligrosa amenaza para citricultores e industrias de jugo cítrico a nivel mundial (Bassanezi, Montesino, Gasparoto, Bergamin Filho & Amorim, 2011; Bové, 2006; Hall & Hentz, 2010; Manjunath, Halbert, Ramadugu, Webb & Lee, 2008).
La enfermedad se describió por primera vez en 1929 y se informó por primera vez en China en 1943. Como agentes causales están identificadas tres especies de α-Proteobacterias restringidas al floema, ‘CandidatusLiberibacterasiaticus’ en Asia, ‘Ca. L. africanus’ en África (Jagoueix, Bove & Garnier, 1994), y ‘Ca. L. americanus’ en Brasil, Sudamérica (Texeira et al., 2005). En el año 2007, un fitoplasma del grupo 16SrIX se asoció con síntomas de HLB en Brasil en plantas libres de Liberibacterspp (Teixeira et al., 2008). Más recientemente en el mismo país, otro fitoplasma del grupo 16SrIII fue encontrado en plantas con ausencia de 'Ca. L. asiaticus’ y ‘Ca. L. americanus’. Coinfección con 'Ca. L. asiaticus 'y 16SrIII también fueron encontradas. Secuencias del gen del ARN ribosómico 16S (ARNr) confirmaron que el fitoplasma del grupo 16SrIII está asociado con síntomas de HLB en los estados de Sao Paulo y Minas Gerais (Wulff et al., 2019)
En Paraguay se observaron los primeros síntomas de HLB en plantíos cítricos de los Departamentos de Amambay, Canindeyú, Alto Paraná, Itapúa y Cordillera, en las cuales fue detectada la especie ‘Ca.Liberibacterasiaticus’ (SENAVE, 2017). Actualmente la enfermedad se encuentra reportada en plantíos cítricos de nueve Departamentos de la Región Oriental de Paraguay (Amambay, Canindeyú, Alto Paraná, Itapúa, Caazapá, Guairá, Caaguazú, Cordillera, y San Pedro), existiendo Departamentos donde aún no fue reportado entre ellos: Misiones, Paraguarí, Central, Ñeembucú y Concepción, además de toda la Región Occidental o Chaco.
La transmisión de estas bacterias ocurre por medio de insectos psílidos como Diaphorinacitri kuwayama (Hemiptera: Psyllidae) y Triosa eritreaeerytreae (Del Guercio) (Hemiptera: Triozidae (Aidoo et al., 2019; Duan, Gottwald, Zhou & Gabriel, 2008; Hall, 2008) D.citri es considerado el vector más importante debido a su amplia distribución en el mundo(Burckhardt, Ouvrard, & others, 2012).En el Paraguay D.citrifue reportado en el año 2008 (SENAVE, 2017).
Hasta el momento no existen variedades comerciales, porta injertos resistentes o métodos de control curativos para HLB y prevenir la infección de las plantas es esencial para controlar la enfermedad. Esto se logra tentativamente plantando plántulas sanas, eliminando plantas enfermas y controlando el insecto vector (Albrecht & Bowman, 2012; Gottwald, da Graça & Bassanezi, 2007).
El rápido diagnóstico de plantas con HLB es crucial para el planeamiento de medidas de control a nivel regional. En la actualidad, el diagnóstico de HLB de rutina se realiza mediante la inspección visual para detectar los síntomas típicos de HLB, los que pueden ser confundidos con síntomas similares de otras enfermedades o deficiencias nutricionales de la planta (Bové, 2006; Sagaram, DeAngelis, Trivedi, Andersen, Lu & Wang, 2009). Métodos moleculares son utilizados para confirmación del diagnóstico de HLB, entre los cuales el método de reacción en cadena de la polimerasa es el más utilizado(Polimerase Chain Reaction; PCR) (Gopal, Gopi, Palanivel & Sreenivasulu, 2007; Li, Levy, & Hartung, 2009). Otros métodos de detección serológica de HLB son el uso de anticuerpos monoclonales (Ding, Duan, Yuan, Shao & Hartung, 2016). Estos métodos pueden ser laboriosos y requieren equipos, reactivos especiales y personal capacitado, demandan tiempo y su costo un gran número de muestras, es elevado. Entre los métodos moleculares que requieren menos equipamientos y no demandan mucho tiempo, la amplificación isotérmica mediada por Bucle(Loop-mediatediso thermal amplification; LAMP) se ha propuesto para la detección de ‘CaLiberibacterasiaticus’ y su vector D.citri (Ghosh et al., 2016).También, la tecnología de la amplificación isotérmica por polimerasa-recombinasa ha permitido la obtención de métodos rápidos de diagnóstico de fitopatógenos (Kim & Easley, 2011).
La amplificación isotérmica se realiza utilizando tres enzimas; una proteína de unión al ADN de cadena simple, una recombinasa y una polimerasa de ADN con actividad desplazante (Piepenburg, Williams, Stemple & Armes, 2006). Puede llevarse a cabo en un rango constante de temperatura (de 20°C a 45°C), evitando así el uso de equipos sofisticados como el termociclador (Zaghloul & El-shahat, 2014). Agdia Inc. ha desarrollado una plataforma de detección basada en esta tecnología y tiene disponible un kit de detección del HLB, denominado AmplifyRP® (Russell, McOwen, Bohannon, Amato & Bohannon, 2015). Este permite una rápida y fácil detección a nivel de campo. Sin embargo, todos los métodos citados pueden ser de alto costo o difícil obtención para el productor.
Entre las alternativas para un rápido y barato diagnóstico del HLB, el método de reacción almidón-iodo (RAI)ha sido propuesto por varios autores y se ha validado por el método de PCR. Sin embargo, su uso se ha limitado a actividades académicas. El método se basa en la gran acumulación de almidón en las hojas de plantas cítricas afectadas por el HLB, el cual, mediante una reacción específica del iodo con el almidón, desarrolle una coloración parda oscura muy notoria y típica que permite diferenciar aquellas plantas infectadas de las no infectadas (González, et al., 2007).
El objetivo del presente trabajo fue demostrarla eficacia del método de tinción Reacción Almidón-Iodo (RAI) en comparación con el método molecular de amplificación de la recombinasa-polimerasa (ARP) para el diagnóstico de HLB en cítricos, de forma a difundir el uso de esta técnica.
MATERIALES Y MÉTODOS
El experimento se llevó a cabo en el Laboratorio de Biología perteneciente a la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción (FCA-UNA).
Material vegetal
Fueron colectadas muestras de plantas de naranjo dulce (Citrus sinensisL.), variedad Valencia, de aproximadamente 10 años de edad, de parcelas de productores citrícolas del Departamento de Caazapá en el distrito de Higinio Morínigo. Además, muestras de hojas con síntomas correspondientes a otras enfermedades como:exocortis(CEVd),psorosis(CPsV) y tristeza de los cítricos (CTV), así mismo a efectos comparativos fueron igualmente colectadas hojas con deficiencias nutricionales (Zn, Mn, Mg) de la colección de cítricos de parcelas experimentales de la FCA-UNA localizadas en el Campus de San Lorenzo. Las muestras de hojas fueron colectadas en bolsas plásticas enumeradas y trasladadas en frío hasta el Laboratorio de Biología de la FCA/UNA para su procesamiento.
Tinción de Reacción Almidón-Iodo
Fueron seleccionadas un total de 33 plantas cítricas, de las cuales se colectaron25 hojas por planta, obteniéndose un total de 825 muestras, las cuales fueron sometidas al método RAI. Las muestras se procesaron siguiendo la metodología descrita por González et al. (2007), por lo que de cada muestra se hizo un corte transversal de una sección de la hoja, luego los cortes fueron sumergidos por dos minutos en una solución de Iodo (KI= 8,8 g.L-1, I2= 2,2 g.L-1) a temperatura ambiente y posteriormente fueron lavados en agua destilada e inmediatamente observados en microscopio óptico BOECO modelo BM 120, acoplado a una cámara MOTICAM 2300.
Amplificación por Polimerasa y Recombinasa
Muestras que presentaron la mejor tinción (más intensa y fiable) por el método RAI fueron seleccionadas como “muestras positivas” para el diagnóstico molecular. De la misma forma, muestras que no presentaron tinción fueron seleccionadas como “muestras negativas”. En total fueron analizadas 33 muestras de plantas (21 positivas y 12 negativas). Secciones de la nervadura central de 0,06 g de peso fueron cortadas y cada una analizadas por el método molecular ARP mediante el uso del kit AmplifyRP® de la marca AGDIA. Cada corte (individualmente) se introdujo en una bolsa plástica, se añadió 300 μL de tampón de extracción AMP1, y seguidamente fue macerado y homogeneizado. Posteriormente se procedió a calentarlos en bloque de calor a una temperatura de 39°C por 3 minutos, mientras que en un tubo de 200 μL se añadió: un gránulo de reacción ADN de ‘Ca.Liberibacterasiaticus’del kit, 10 μL de diluyente PD1 para disolver el gránulo de ADN, 1 μL del extracto de la muestra y luego fue incubado en el bloque de calor durante 20 minutos. Se retiró el tubo del bloque de calor y se procedió a realizar los pasos de detección colocando el tubo en la cámara de detección y de reacción específica del kit, para luego esperar 20 minutos antes de interpretar los resultados.
Análisis de los datos
Obtenidos estos datos, con independencia del método, se determinó la eficacia (sensibilidad y especificidad) del método RAI en comparación con el método ARP a través del método estadístico de concordancia Kappa de Cohen al 5% de probabilidad de error (P < 0,05).
RESULTADOS Y CONCLUSION
En los cortes transversales de las hojas infectadas con HLB (Figura 1b) se observó la tinción y coloración púrpura oscura de gránulos de almidón acumulados en las células parenquimatosas del floema, a diferencia de los cortes de hojas de control sin infección de HLB (Figura 1c).
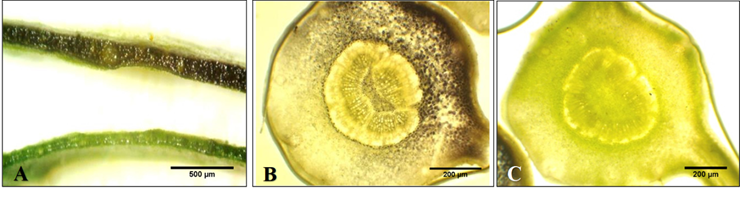
Figura 1 Comparación de tinción y coloración de cortes de hojas sanas e infectadas por HLB en cítricos A. Parte superior: corte de hoja infectada (positivo) por HLB, parte inferior: corte de hoja sana (negativo) sin HLB. B. Peciolo de hoja infectada (positivo) por HLB. C. Peciolo de hoja sana (negativo) sin HLB. FCA-UNA. San Lorenzo, Paraguay. 2017.
En la Tabla 1 podemos observar las muestras de hojas analizadas con síntomas correspondientes a otras enfermedades como exocortis(CEVd); psorosis(CPsV); tristeza de los cítricos (CTV). Ninguna de ellas presentó tinción ni coloración alguna en toda la superficie de corte, siendo visiblemente indistinguibles de las hojas sanas sin infección con HLB. Así mismo, las muestras de hojas con síntomas de deficiencias nutricionales de manganeso (Mn) y magnesio (Mg), tampoco presentaron tinción ni coloración alguna. Sin embargo, en el caso de deficiencia de zinc (Zn), se observó una leve tinción de coloración púrpura clara correspondientes a la tinción normal del almidón contenido en los casos de deficiencias de este elemento (Smith, 1975; Yelenosky & Guy, 1977; Schaffer, Liu, Goldschmidt, Boyer & Goren, 1986; Onuki, Truc, Nesumi, Hong & Kobayashi (2002); González et al. 2007). Esta leve tinción y coloración en casos de deficiencias de Zn es menos intensa comparada con las de las hojas infectadas por HLB en las que se observan la tinción y coloración purpura oscura a negra total en la superficie de corte (Figura 2).

Figura 2 Tinción de cortes de hoja. Corte superior de la hoja sana, corte medio de la hoja con deficiencia de Zn y corte inferior de hoja positiva HLB. FCA-UNA. San Lorenzo, Paraguay. 2017.
En cuanto a la comparación entre las técnicas de diagnóstico, 32 de las 33 muestras finales dieron los mismos resultados en las dos técnicas de diagnóstico; y sólo una muestra positiva por el método RAI tuvo un resultado opuesto con la técnica molecular ARP. Los resultados obtenidos y sometidos al análisis estadístico de concordancia Kappa de Cohen expresado en porcentaje proyectaron una concordancia del 93,6 % entre RAI y ARP.
El método de RAI podría permitir a los productores hacer su propio monitoreo de la enfermedad en el campo. No requiere un alto nivel de experiencia en la realización de la prueba, sin embargo, el método debe ser aplicado correctamente para garantizar la precisión de las pruebas.
Entre las limitaciones, dado el lento desarrollo de síntomas de HLB, arboles infectados que aún no demuestran síntomas pueden pasar desapercibidos para la detección de la enfermedad, estos pueden permanecer asintomáticos durante varios meses, o años, sirviendo de fuentes de inoculo. La detección temprana de la enfermedad es un desafío difícil para el control de su diseminación (Pandey & Wang, 2019)
Tabla 1 Comparación de resultados para el diagnóstico de la enfermedad HLB de los cítricos entre el método reacción almidón- iodo (RAI) y el método molecular AmplifyRP® (ARP). FCA-UNA. San Lorenzo, Paraguay. 2017.
| N° de Muestra (sobre 33 muestras) | Resultados | |
|---|---|---|
| RAI | AmplifyRP® (ARP) | |
| 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 16, 19, 20, 22, 23, 25 | Con tinción (+) | HLB (+) |
| 15, 17, 18, 21, 24, 27, 28, 29, 30, 31, 32, 33 | Sin tinción (-) | HLB (-) |
| 26 | Sin tinción (-) | HLB (-) |
| Exocortis(CEVd); psorosis(CPsV); tristeza de los cítricos (CTV) | Sin tinción (-) | No probado |
| Deficientes en manganeso (Mn) y magnesio (Mg) | Sin tinción (-) | No probado |
| Deficientes en Zinc (Zn) | Leve tinción (-) | No probado |















