INTRODUCCIÓN
La deforestación en los trópicos hoy continúa inexorablemente con graves implicaciones para la conservación de la biodiversidad, la regulación del clima y los servicios ecosistémicos. La rápida expansión de la frontera agrícola, la ganadería y la tala ilegal han convertido a los últimos remanentes de bosque tropical del mundo en parches aislados que ponen en peligro su continuidad (Da Ponte et al. 2017).
El Bosque Atlántico del Alto Paraná (BAAPA) es uno de los bosques tropicales más amenazados en el mundo, quedando en el Paraguay solo el 9% de la cobertura forestal original, en su mayoría, en un estado altamente fragmentado y degradado (WWF 2016, Da Ponte et al. 2017). Como mencionan Plací y Di Bitetti (2005), uno de los mayores impedimentos para revertir esta tendencia a la explotación no sustentable y la consecuente degradación de los bosques es que existe escasa información científica sobre el bosque y las mejores formas de manejarlo responsablemente.
A pesar de ser considerada una de las ecorregiones con mayores prioridades mundiales para conservación, existe escasa información científica disponible sobre la estructura forestal del BAAPA en el Paraguay; por tanto, se enfatiza la necesidad de estudios científicos disponibles realizados a partir de bases de datos comparables a nivel país; teniendo en cuenta que el manejo de los bienes y servicios asociados al bosque debe ir acompañado de mediciones y monitoreos de la composición, estructura y dinámica de las poblaciones vegetales, que permitan determinar la sostenibilidad del mismo.
Según De las Salas y Melo, citado por Alvis (2009), la estructura horizontal permite evaluar el comportamiento de los árboles individuales y de las especies en la superficie del bosque. Por otro lado, el análisis de la estructura vertical de un bosque puede dar un indicio del estado sucesional donde se encuentra cada especie o con qué especie se podrá componer la población futura (Schneider y Finger 2000). La evaluación de masas forestales mediante indicadores de diversidad como la abundancia, dominancia y frecuencia de las especies permiten describir la relación de las especies de una población (Hernández et al. 2013, López Hernández et al. 2017).
El objetivo de la presente investigación fue analizar la estructura horizontal y vertical de un bosque de la Ecorregión Alto Paraná, con el fin de robustecer la base de datos existente y el fundamento científico para el manejo sostenible de bosque nativo en el Paraguay.
MATERIALES Y MÉTODOS
La superficie total del bosque estudiado fue de aproximadamente 104 ha. El área de muestreo corresponde a una PPMB de 100 m x 100 m ubicada en el Centro de Formación de Técnico Superior Forestal del Departamento Alto Paraná (CEFOTESFOR-AP) con coordenadas 25°30’35,41’’ S y 54°43’15,33’’ W y una altitud de 252 msnm. Según Dinerstein et al. (1995) el sitio corresponde a la ecorregión Bosque Atlántico de Alto Paraná y de acuerdo con la clasificación de la SEAM (2013), corresponde a la Ecorregión Alto Paraná. El clima se caracteriza por lluvias frecuentes que fluctúan entre 1300 y 1800 mm por año; la temperatura puede aumentar hasta 42°C en los meses de verano (diciembre-marzo), mientras que durante el invierno (mayo-agosto) puede disminuir hasta 0°C (Da Ponte et al. 2017). De acuerdo con Spichiger et al. (1992) el bosque corresponde a la clasificación bosques con suelos bien drenados de Lauraceae, Cedrela fissilis, Chrysophyllum gonocarpum.
La parcela bajo estudio responde al diseño descripto por Contreras et al. (1999), la misma mide 100 m x 100 m totalizando 1 ha, dividida en 25 subparcelas de 20 m x 20 m (400 m2) cada una. El levantamiento de datos fue realizado por medio de un inventario de todos los individuos arbóreos con DAP ≥ 10 cm en cada subparcela. Los datos de campo en el presente análisis fueron los siguientes: (a) diámetro a la altura del pecho (DAP), tomados a 1,30 m sobre el terreno, (b) altura total, de acuerdo a estimación por observación directa, y (c) especie, identificada conforme a la base de datos del Instituto Darwinion, Flora del Cono Sur.
Los parámetros estructurales analizados fueron:
a) Composición florística: mediante listado de especies registradas en la PPMB, ordenado por familia, nombre científico, nombre común y dividido en clases: Dicotyledonae y Monocotyledonae. Los individuos reclutados se identificaron por observación directa de sus caracteres macromorfológicos, con ayuda de binoculares, descortezador y guías de campo.
b) Abundancia: mediante listado completo de las especies, indicando la cantidad de veces que se registró cada especie. La abundancia relativa de cada especie constituye el porcentaje de la abundancia en comparación del total de los árboles medidos. Se aplicaron procedimientos de Melo y Vargas (2003).
Ai = ∑ i (1)
Ai% = Ai/At × 100 (2)
Donde:
Ai = abundancia absoluta de la especie i.
Ai% = abundancia relativa de la especie i.
At = abundancia total.
∑i = cantidad de individuos de la especie.
c) Frecuencia: se obtuvo como un porcentaje del número de subparcelas en las cuales se registró la presencia de cada especie. La frecuencia relativa corresponde a la frecuencia absoluta expresada como porcentaje de la sumatoria de las frecuencias absolutas (Melo y Vargas 2003).
Fi = ∑ subparcelas con presencia de i/25 × 100 (3)
Fi = Fi/Ft × 100 (4)
Donde:
Fi = frecuencia absoluta de la especie i.
Fi% = frecuencia relativa de la especie i.
Ft = frecuencia total.
d) Dominancia: de acuerdo con Lamprecht (1990), los datos de dominancia absoluta de las especies son obtenidos sumando las áreas basales de todos los individuos por especie, la dominancia relativa es calculada como el porcentaje del área basal de cada especie respecto al total de área basal de todos los individuos en la PPMB.
Di = ∑ ABi (5)
Di% = Di/ABt × 100 (6)
AB = π/4 × d2 (7)
Donde:
Di = dominancia absoluta de la especie i.
Di% = dominancia relativa de la especie i.
AB = área basal.
ABi = área basal de la especie i.
ABt = área basal total.
d = diámetro a la altura del pecho (1,30 m sobre el terreno).
e) Índice de Valor de Importancia (IVI): mediante la sumatoria de los valores relativos de abundancia, frecuencia y dominancia de cada especie (Melo y Vargas 2003).
IVI = ∑ Ai% + Fi% + Di% (8)
Donde:
IVI = índice de valor de importancia.
Ai = abundancia relativa de la especie i.
Fi = frecuencia relativa de la especie i.
Di = dominancia relativa de la especie i.
f) Estructura vertical: considerando las directrices de Lamprecht (1990), a través de una clasificación simple de la estructura vertical, en la que se distingue: estrato superior (altura > 2/3 de la altura superior), estrato medio (< 2/3 > 1/3) y estrato inferior (< 1/3 de la altura superior).
RESULTADOS Y DISCUSIÓN
En la PPMB estudiada se registró un total de 470 individuos, pertenecientes a 24 familias botánicas, 53 géneros y 68 especies; además de 4 especies indeterminadas, de las cuales tres fueron identificadas a nivel de familia (Tabla 1).
Tabla 1 Composición florística de un bosque de la Ecorregión Alto Paraná, Paraguay.
| Clase Dicotyledoneae | |||
|---|---|---|---|
| Nº | Familia | Especie | Nombre común |
| 1 | Annonaceae | Rollinia salicifolia Schltdl. | Aratiku |
| 2 | Araliaceae | Dendropanax cuneatus (DC.) Decne. & Planch. | Ombura |
| 3 | Araliaceae | Schefflera morototoni (Aubl.) Maguirre, Steyerm. & Frodin | Amba'y guasu |
| 4 | Bignoniaceae | Handroanthus heptaphyllus (Vell.) Mattos | Lapacho |
| 5 | Bignoniaceae | Jacaranda micrantha Cham. | Karova guasu |
| 6 | Bignoniaceae | Indeterminado (liana) | Desconocido |
| 7 | Boraginaceae | Cordia americana (L.) Gottschling & J.S. Mill. | Guajayvi |
| 8 | Boraginaceae | Cordia ecalyculata Vell. | Colita |
| 9 | Boraginaceae | Cordia trichotoma (Vell.) Arráb. ex Steud. | Peterevy |
| 10 | Cannabaceae | Celtis sp. | Juasy’y |
| 11 | Cannabaceae | Trema micrantha (L.) Blume | Kurundi’y |
| 12 | Caricaceae | Carica papaya L. | Mamón |
| 13 | Caricaceae | Jacaratia spinosa (Aubl.) A. DC. | Jacarati’a |
| 14 | Euphorbiaceae | Alchornea glandulosa Poepp. | Tapi’a guasu’i |
| 15 | Euphorbiaceae | Alchornea triplinervia (Spreng.) Müll. Arg. | Chipa rupa |
| 16 | Fabaceae | Apuleia leiocarpa (Vogel) Macbr. | Yvyra pere |
| 17 | Fabaceae | Bauhinia forficata Link. ssp. pruinosa (Vogel) Fortunato & Wunderlin | Pata de buey |
| 18 | Fabaceae | Bauhinia microstachya (Raddi) F. Macbr. | Ka’i escalera |
| 19 | Fabaceae | Dahlstedtia muehlbergiana (Hassl.) M. J. Silva & A. M. Azevedo | Ka’a vusu |
| 20 | Fabaceae | Erythrina falcata Benth. | Sui’yva |
| 21 | Fabaceae | Holocalyx balansae Micheli | Yvyra pepe |
| 22 | Fabaceae | Inga uraguensis Hook. & Arn. | Inga guasu |
| 23 | Fabaceae | Muellera campestris (Mart. ex Benth.) M. J. Silva & A. M. Azevedo | Yvyra ita |
| 24 | Fabaceae | Machaerium paraguariense Hassler | Ysapy’y guasu |
| 25 | Fabaceae | Machaerium stipitatum (DC.) Vogel | Ysapy’y moroti |
| 26 | Fabaceae | Myrocarpus frondosus Allemão | Yvyra paje |
| 27 | Fabaceae | Parapiptadenia rigida (Benth.) Brenan | Kurupa’y ra |
| 28 | Fabaceae | Peltophorum dubium (Sprengel) Taub. | Yvyra pyta |
| 29 | Fabaceae | Senegalia polyphylla (DC.) Britton & Rose | Jukeri guasu |
| 30 | Lauraceae | Endlicheria paniculata (Spreng.) J. F. Macbr. | Laurel aguacate |
| 31 | Lauraceae | Nectandra lanceolata Nees & Mart. ex Nees | Aju’y moroti |
| 32 | Lauraceae | Nectandra megapotamica (Sprengel) Mez | Laurel hu |
| 33 | Lauraceae | Nectandra sp. | Laurel |
| 34 | Lauraceae | Ocotea diospyrifolia (Meissner) Mez | Aju’y sayju |
| 35 | Lauraceae | Ocotea puberula (Rich.) Nees | Laurel guaika |
| 36 | Lauraceae | Indeterminado | Laurel |
| 37 | Malvaceae | Bastardiopsis densiflora (Hook. & Arn.) Hassler | Loro blanco |
| 38 | Malvaceae | Ceiba speciosa (A. St.-Hil.) Ravena | Samu’u |
| 39 | Meliaceae | Cabralea canjerana (Vell.) Mart. | Cancharana |
| 40 | Meliaceae | Cedrela fissilis Vell. | Cedro |
| 41 | Meliaceae | Guarea kunthiana A. Juss. | Karaja bola |
| 42 | Meliaceae | Trichilia catigua A. Juss. | Katigua pyta |
| 43 | Meliaceae | Trichilia claussennii C. DC. | Katigua guasu |
| 44 | Moraceae | Ficus sp. | Guapo’y |
| 45 | Moraceae | Maclura tinctoria (L.) Steud. ssp. tinctoria | Tata jyva |
| 46 | Moraceae | Sorocea bonplandii (Baill.) W.C. Burger, Lanj. & Wess. Boer | Ñandypa mi |
| 47 | Myrtaceae | Campomanesia xanthocarpa O. Berg | Guavira pyta |
| 48 | Myrtaceae | Plinia rivularis (Cambess.) Rotman | Yvaporoity |
| 49 | Myrtaceae | Indeterminado | Desconocido |
| 50 | Nyctaginaceae | Pisonia aculeata L. | Jagua pinda |
| 51 | Nyctaginaceae | Pisonia zapallo Griseb. var. zapallo | Jukyry vusu |
| 52 | Primulaceae | Myrsine sp. 1 | Kanelon |
| 53 | Primulaceae | Myrsine sp. 2 | Kanelon pyta |
| 54 | Primulaceae | Myrsine sp. 3 | Kanelon guasu |
| 55 | Rosaceae | Prunus sp. | Yvaro |
| 56 | Rutaceae | Balfourodendron riedelianum (Engl.) Engl. | Guatambú |
| 57 | Rutaceae | Helietta apiculata Benth. | Yvyra ovi |
| 58 | Rutaceae | Zanthoxylum caribaeum Lam. | Tembetary hu |
| 59 | Rutaceae | Zanthoxylum petiolare A. St. - Hil. & Tul. | Tembetary moroti |
| 60 | Rutaceae | Zanthoxylum sp. | Tembetary |
| 61 | Salicaceae | Banara tomentosa Clos | Mbavy ra |
| 62 | Salicaceae | Casearia gossypiosperma Briq. | Mbavy guasu |
| 63 | Sapindaceae | Diatenopteryx sorbifolia Radlk. | María preta |
| 64 | Sapotaceae | Chrysophyllum gonocarpum (Mart. & Eichler) Engler | Agua’i |
| 65 | Sapotaceae | Chrysophyllum marginatum (Hook. & Arn.) Radlk. ssp. marginatum | Pykasu rembi’u |
| 66 | Simaroubaceae | Picrasma crenata (Vell.) Engl. | Pirero |
| 67 | Solanaceae | Cestrum sp. | Ka’a ne |
| 68 | Solanaceae | Solanum granuloso-leprosum Dunal | Hu’i moneha |
| 69 | Urticaceae | Cecropia pachystachya Trécul | Amba’y |
| 70 | Indeterminado | Indeterminado (liana) | Desconocido |
| Clase Monocotyledoneae | |||
| Nº | Familia | Especie | Nombre común |
| 1 | Arecaceae | Euterpe edulis Mart. | Palmito |
| 2 | Arecaceae | Syagrus romanzoffiana (Cham.) Glassman | Pindó |
El bosque bajo estudio registró un menor número de especies, en comparación con varios estudios realizados en el Bosque Atlántico del Brasil. De acuerdo con Cysneiros et al. (2015), se obtuvo 83 especies ha-1 a través del método de parcelas (DAP ≥ 10 cm) y 174 especies ha-1 con el criterio de inclusión de individuos a partir de 5 cm de DAP. França y Stehmann (2013) a través del método de cuadrantes (DAP ≥ 15 cm) han registrado 373 especies arbóreas. Por otro lado, Lima et al. (2017) han registrado 81 especies en tan solo 0,1 ha (DAP ≥ 15 cm).
Estas diferencias observadas pueden ser consecuencia de diversos procesos históricos y ecológicos, que actuaron en diferentes escalas de espacio y tiempo. La menor riqueza de especies observada en el bosque estudiado podría estar influenciada por los disturbios ocurridos en el pasado, como fue la extracción selectiva e intensa de individuos arbóreos para fines maderables.
De acuerdo con França y Stehmann (2013), la reducción de la riqueza de especies también es influenciada por la dominación de algunas pioneras en la composición florística del bosque. Cabe mencionar que algunas de las especies mejor representadas en el bosque estudiado, en términos de número de individuos, fueron Cecropia pachystachya (Amba’y) y Solanum granuloso-leprosum (Hu’i moneha), típicas de vegetación secundaria.
Las familias botánicas con mayor número de géneros y especies registradas en este estudio fueron Fabaceae (12 géneros y 14 especies), Lauraceae (3 géneros y 7 especies), Meliaceae (4 géneros y 5 especies), y Rutaceae (3 géneros y 5 especies). En conjunto, estas 4 familias fueron responsables del 43,06% del total de las especies.
En el estudio realizado por Lima et al. (2017), la familia que obtuvo mayor número de especies también fue Fabaceae. Por otro lado, Deziderio et al. (2018) encontraron que las familias mejor representadas fueron Myrtaceae (12 especies), Primulaceae (4 especies) y Asteraceae (3 especies), las cuales sumaron el 46,3% de la riqueza total del área. França y Stehmann (2013) mencionan que las familias Fabaceae (67), Lauraceae (27), Myrtaceae (26), Rubiaceae (19), Euphorbiaceae, Meliaceae y Salicaceae (16), Sapotaceae (15), Moraceae (13), Annonaceae y Malvaceae (12), Bignoniaceae, Rutaceae y Sapindaceae (10); representaron el 60% del total de especies inventariadas. Machado Lins (2017) menciona a las familias Fabaceae, Lauraceae, Sapotaceae, Euphorbiaceae, Chrysobalanaceae y Lecythidaceae como las de mayor número de especies.
Con excepción de las familias Fabaceae y Lauraceae como las mejores representadas, las diferencias cualitativas encontradas concuerdan con Cartes citado por Degen de Arrúa et al. (2017), quien menciona que en el Bosque Atlántico del Alto Paraná la composición florística es variable y se encuentra en dependencia de factores edáficos y climáticos.
Las especies más abundantes, de acuerdo con los valores de abundancia relativa, fueron Chrysophyllum gonocarpum (Agua’i), Cecropia pachystachya (Amba’y) y Cabralea canjerana (Cancharana), con 11,49%, 7,45% y 7,02%, respectivamente.
Chrysophyllum gonocarpum (Agua’i), Cabralea canjerana (Cancharana), y Jacaratia spinosa (Jacarati’a) fueron las que presentaron mayor frecuencia relativa con 7,05%, 7,05% y 5,77%, respectivamente. Ninguna de las especies presentó 100% de frecuencia absoluta, es decir, no se registraron especies que tengan presencia en todas las subparcelas.
Las especies que presentaron mayor dominancia relativa fueron Cabralea canjerana (Cancharana) con 12,21%, Chrysophyllum gonocarpum (Agua’i) con 10,29%, Jacaratia spinosa (Jacarati’a) con 6,87% y Peltophorum dubium (Yvyra pyta) con 6,47%.
Las especies que presentaron mayor peso ecológico, según los cálculos obtenidos del IVI, fueron Chrysophyllum gonocarpum (Agua’i) con 28,83%, Cabralea canjerana (Cancharana) con 26,28% y Jacaratia spinosa (Jacarati’a) con 19,45%.
Lima et al. (2017) destacaron a la especie Protium heptaphyllum con mayor valor de importancia, representando el 14,65% del total del IVI. Deziderio et al. (2018) encontraron una concentración de los valores del IVI en Podocarpus lambertii, Araucaria angustifolia y Myrceugenia bracteosa, las cuales representaron el 52,74% del total del IVI. En el estudio realizado por França y Stehmann (2013), las especies que se destacaron en cuanto a los valores del IVI fueron Joannesia princeps y Virola gardneri. Nótese que ninguna de las especies mencionadas tuvo presencia en el bosque estudiado. A pesar de que todas las áreas están localizadas en el Bosque Atlántico, ellas presentan diferencias en la altitud y orientación geográfica, además de estar sometidas a diferentes regímenes pluviométricos, que de acuerdo con Cruz et al. (2013), contituyen factores importantes para determinar la ocurrencia de especies arbóreas.
Los valores absolutos y relativos de la abundancia, frecuencia, dominancia de las especies con mayor peso ecológico de acuedo con los valores del IVI, se observan en la Tabla 2.
Tabla 2 Valores absolutos y relativos de abundancia, frecuencia, dominancia de las especies con mayor peso ecológico según los valores del IVI, de un bosque de la Ecorregión Alto Paraná, Paraguay.
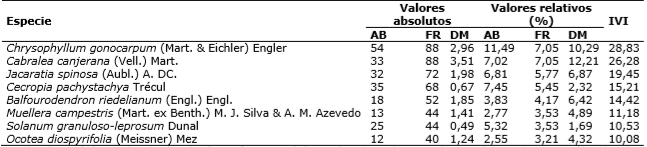
AB: abundancia (número de individuos ha-1); FR: frecuencia (número de subparcelas ocupadas en %); DM: dominancia (área basal en m2 ha-1); IVI: índice de valor de importancia (%).
La sumatoria de las áreas basales dio como resultado un valor de 28,77 m2 ha-1. En estudios realizados en el Bosque Atlántico del Brasil, Machado Lins (2017) menciona un rango de 24 a 30 m2 ha-1 de área basal (DAP ≥ 10 cm). Deziderio et al. (2018) y Cruz et al. (2013) obtuvieron mayores valores, los cuales fueron 61,65 m2 ha-1 (DAP ≥ 4,8 cm) y 62,2 m2 ha-1 (DAP ≥ 5 cm) respectivamente. França y Stehmann (2013) obtuvieron en una zona altitudinal similar al bosque estudiado (248 msnm) 20,90 m2 ha-1 (DAP ≥ 15 cm).
Estas diferencias encontradas pueden ser explicadas, en parte, debido a diferentes sucesos históricos, al impacto de la fragmentación y de la intensidad del efecto de borde (Tanus et al. 2012). Cysneiros et al. (2015) mencionan que bajos valores de área basal se han asociado con la ocurrencia de perturbaciones como la extracción selectiva de madera.
De acuerdo con la metodología mencionada, el bosque se dividió en tres estratos, en donde la altura del estrato superior fue de 20,8 a 31 m, seguido del estrato medio con una altura entre 10,3 a 20,7 m y el estrato inferior con alturas menores a 10,2 m, siendo la altura máxima del bosque 31 m.
De los 470 individuos registrados, el estrato con mayor densidad fue el inferior con 263 individuos (56%), seguido por el estrato medio con 185 individuos (39,3%), y el estrato superior con 22 individuos (4,7%) (Figura 1).
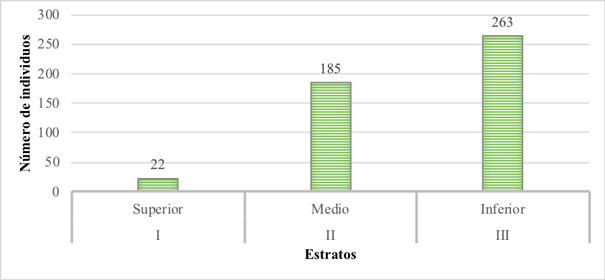
Figura 1 Distribución de los individuos según estrato arbóreo de un bosque de la Ecorregión Alto Paraná, Paraguay. I: estrato superior (20,8 a 31 m); II: estrato medio (10,3 a 20,7 m); III: estrato inferior (≤10,2 m).
El estrato superior estuvo constituido por las especies Balfourodendron riedelianum (Guatambú), Muellera campestris (Yvyra ita), Handroanthus heptaphyllus (Lapacho), Holocalyx balansae (Yvyra pepe), Alchornea triplinervia (Chipa rupa), Cabralea canjerana (Cancharana), Cordia americana (Guajayvi), Ocotea diospyrifolia (Aju’y sayju), Parapiptadenia rigida (Kurupa’y ra), Peltophorum dubium (Yvyra pyta), Pisonia aculeata (Jagua pinda) y una especie indeterminada de la familia Bignoniaceae. Cabe mencionar que las dos últimas son lianas cuyas alturas corresponden a la de los hospederos.
El estrato medio estuvo mayormente conformado por las especies Chrysophyllum gonocarpum (Agua’i), Cabralea canjerana (Cancharana), Syagrus romanzoffiana (Pindó), Balfourodendron riedelianum (Guatambú), Chrysophyllum marginatum (Pykasu rembi’u) y Ocotea diospyrifolia (Aju’y sayju).
Por otro lado, el estrato inferior estuvo mejor representado por especies pioneras como Cecropia pachystachya (Amba’y), Solanum granuloso-leprosum (Hu’i moneha) y Sorocea bonplandii (Ñandypa mi), además de las especies Jacaratia spinosa (Jacarati’a) y Chrysophyllum gonocarpum (Agua’i).
Cabe mencionar que las especies Alchornea triplinervia (Chipa rupa), Balfourodendron riedelianum (Guatambú), Cabralea canjerana (Cancharana), Handroanthus heptaphyllus (Lapacho), Holocalyx balansae (Yvyra pepe), Muellera campestris (Yvyra ita), Ocotea diospyrifolia (Aju’y sayju) y Pisonia aculeata (Jagua pinda) fueron registradas en los tres estratos. Según Schneider y Finger (2000) la presencia de una especie en los tres estratos es un indicio de su participación en la estructura del bosque, durante la fase de su desarrollo hasta llegar al clímax.
En un estudio realizado en un fragmento del Bosque Atlántico del Brasil, la altura de los individuos registrados varió de 2 a 15 m. Las especies encontradas en el estrato inferior fueron Aegiphila sp., Swartzia pickelii y Talisia esculenta. Alrededor del 50% de los individuos muestreados se encontró en el estrato inferior. En el estrato medio, la mayor representatividad se dio por los individuos Cecropia pachystachya, Byrsonima sericea y Schefflera morototoni. Entre las especies que se concentraron en el estrato superior se destacó Bowdichia virgilioides con 15 m (Freitas et al. 2018).
La altura de los árboles es un parámetro influenciado por diversos factores tales como: la intensidad luminosa y la correlación con especies dominantes; además puede indicar el estadio sucesional en que se encuentra el bosque (Silva y Carvalho 2017). De esta forma, la presencia de mayor número de individuos con alturas menores a 10,2 m (estrato inferior) y conformado principalmente por especies pioneras, sugiere que el bosque estudiado corresponde a una vegetación secundaria.
Los resultados obtenidos con relación a la composción florística y la estructura horizontal y vertical del bosque, sugieren que las diferencias encontradas pueden explicarse por lo mencionado por Machado Lins (2017): los cambios en el clima y en las condiciones del suelo, junto con las variaciones altitudinales, determinan una gran heterogeneidad en la estructura y la composición florística del Bosque Atlántico; así también, menciona que las perturbaciones humanas pasadas y presentes constituyen factores comunes e importantes que interfieren en la estructura y biomasa del Bosque Atlántico.
CONCLUSIONES
Los resultados del análisis estructural sugieren que el bosque estudiado está representado por Chrysophyllum gonocarpum (Mart. & Eichler) Engler con mayor abundancia, frecuencia e índice de valor de importancia. Además, se resalta la presencia de mayor número de individuos con alturas menores a 10,2 m (estrato inferior) y conformado principalmente por especies pioneras.
El bosque no presenta igualdades estructurales con los patrones registrados a nivel regional y, a excepción de las familias Fabaceae y Lauraceae como mejores representadas, también existen diferencias en aspectos cualitativos en comparación con la composición florística del Bosque Atlántico del Brasil; lo que sugiere que a pesar de compartir características biogeográficas, podrían existir diferencias climáticas, geológicas u otros factores ambientales y/o antrópicos que influyan en la composición y estructura del bosque.














