Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Investigación Agraria
On-line version ISSN 2305-0683
Investig. Agrar. vol.15 no.1 San Lorenzo July 2013
ARTÍCULO CIENTÍFICO
Compatibilidad in vitro de aislados nativos de Trichoderma spp. con fungicidas para el tratamiento de semillas
In vitro compatibility of native Trichoderma spp. with fungicides for seed treatment
Blas Manuel Franco Ortellado 1 y Aída Lorenza Orrego Fuente 1*
1. Departamento de Protección Vegetal de la Facultad de Ciencias Agrarias, Universidad Nacional de Asunción (FCA-UNA). San Lorenzo, Paraguay.
*Autor para correspondencia (aorrego@agr.una.py).
Recibido: 02/04/2013; Aceptado: 09/05/2013.
RESUMEN
Se realizaron dos experimentos con el objetivo de seleccionar aislados nativos del biocontrolador con mayores potenciales antagónicos y compatibles con fungicidas curasemillas. En el Experimento 1, se obtuvieron 15 aislados de Trichoderma spp. de muestras de suelo de siete departamentos del Paraguay, los cuales fueron confrontados en cultivo pareado con los fitopatógenos Macrophomina phaseolina y Phytophthora sp., el diseño experimental empleado fue completamente al azar, con arreglo factorial 15x2, con 4 repeticiones. Las variables evaluadas fueron: velocidad de crecimiento micelial y sobreposición de Trichoderma spp. En el Experimento 2, los aislados seleccionados fueron sometidos a antibiograma con los fungicidas curasemillas Carboxin + Thiram, Carbendazim + Thiram, Metiltiofanato + Thiram y Tebuconazole, en un diseño experimental completamente al azar, con arreglo factorial 6x5, con 5 repeticiones. Las variables evaluadas fueron: inhibición del crecimiento micelial y esporulación. Los resultados mostraron que de 15 aislados de Trichoderma spp., 6 presentaron mayor potencial antagónico a los fitopatógenos M. phaseolina y Phytophthora sp.; y el antibiograma reveló diferencias en la compatibilidad de los aislados de Trichoderma spp. con los fungicidas curasemillas. Se concluye que el fungicida curasemilla Carboxin+Thiram es el más compatible con el biocontrolador Trichoderma spp.
Palabras clave: Trichoderma, compatibilidad, fungicidas, Macrophomina, Phytophthora.
ABSTRACT
Two experiments were conducted with the purpose of selecting native isolates of the biocontroller with higher antagonism and compatibility with seed treatment fungicides. In Experiment 1, there was obtained 15 isolates of Trichoderma spp. of soil samples from seven departments of Paraguay, isolates were confronted in paired cultures with phytopathogens Macrophomina phaseolina and Phytophtora sp., the experimental design was completely randomized, with 15x2 factorial arrangements, with 4 replications. The variables evaluated were: mycelial growth rate and overlapping of Trichoderma spp. In the Experiment 2, the selected isolates underwent to antibiogram with seed treatment fungicides Carboxim + Thiram, Carbendazim + Thiram, Metiltiofanato + Thiram and Tebuconazole, the experimental design utilized was completely randomized with factorial arrangement 6x5, with 5 replications. The evaluated variables were: Mycelial growth inhibition and sporulation. The results show that 6 out of 15 Trichoderma spp. isolates presented greater antagonistic potential to the phytopathogens M. phaseolina and Phytophtora sp., and antibiogram revealed differences in compatibility of Trichoderma spp. isolates with seed treatment fungicides. It is concluded that the seed treatment fungicide Carboxim+Thiram is the most compatible with Trichoderma spp.
Key words: Trichoderma, compatibility, fungicides, Macrophomina, Phytophthora.
INTRODUCCIÓN
El tratamiento de semillas es una estrategia viable y económica para proteger a la semilla y a la plántula de plagas y enfermedades. Aunque durante muchos años los agricultores eligieron productos químicos como método para llevarlo a cabo, en la actualidad existe una tendencia mundial a disminuir el uso de agroquímicos y aumentar el empleo de productos alternativos como los biológicos, siendo éstos comercializados como curasemillas en países de la región entre los que se encuentran Brasil, Chile, Colombia, Costa Rica, Cuba, entre otros (Alves y López 2008).
Los hongos del género Trichoderma se encuentran entre los más empleados en el control biológico de enfermedades, especialmente para las causadas por patógenos asociados a las semillas y al suelo, su acción antagonista y su empleo como inoculante para el tratamiento de semillas han merecido un gran número de investigaciones a partir de los años 90 (Stefanova et al. 2004).
La capacidad que tienen algunos hongos de parasitar a otros se conoce como hiperparasitismo o micoparasitismo; y la exhiben los individuos del género Trichoderma hacia diferentes patógenos de plantas tales como Rhizoctonia solani, Sclerotium rolfsii y especies de los géneros Pythium, Phytophthora y Armillaria entre otros, según revela el estudio de Sandoval y López (2001); razón por la cual éste biocontrolador se utiliza como fungicida en aplicaciones foliares, tratamientos de semillas y de suelo, aunque además se lo emplea como promotor del crecimiento vegetal (Diniz et al. 2006).
La compatibilidad de Trichoderma spp. con fungicidas es objeto de estudio debido a la interrogante que surge sobre su posible inhibición por estos plaguicidas, hecho que limitaría la combinación de los métodos químicos y biológicos en el tratamiento de semillas. Esta práctica, conocida como tratamiento integrado de semillas promete ventajas, tales como reducción del uso de fungicidas, menor incidencia de patógenos, en especial los de difícil control; mayores rendimientos en los cultivos y la disminución de los riesgos que estos agroquímicos representan para la salud humana y los ecosistemas agrícolas (Roberti et al. 2006).
El estudio se basó en la premisa de que los aislados nativos del hongo Trichoderma spp. son compatibles con fungicidas curasemillas tales como: Carboxin + Thiram, Carbendazim + Thiram, Metiltiofanato + Thiram y Tebuconazole. En este contexto, el objetivo del trabajo fue evaluar la compatibilidad de aislados nativos de diversas especies de hongos del género Trichoderma con fungicidas destinados al tratamiento de semillas, midiendo el antagonismo de Trichoderma spp. sobre organismos fitopatógenos en un cultivo dual y el área de inhibición del crecimiento micelial y el efecto en la esporulación de Trichoderma spp. en un antibiograma.
METODOLOGÍA
En el laboratorio de Fitopatología del Departamento de Protección Vegetal de la FCA-UNA, situado en la ciudad de San Lorenzo, se realizaron dos experimentos, uno destinado a la selección de aislados nativos de Trichoderma spp. y el segundo para evaluar la compatibilidad de Trichoderma spp. con fungicidas curasemillas, ambos se llevaron a cabo entre enero y octubre del año 2012.
Experimento 1, Selección de aislados nativos de Trichoderma spp.: este ensayo consistió en confrontar en cultivo pareado cada una de las 15 colonias de Trichoderma spp. aisladas a partir de muestras de suelos provenientes de siete Departamentos de Paraguay, con dos fitopatógenos. Se tomaron muestras de suelo de cada uno de los siguientes departamentos, dos de Central, Alto Paraná y Canindeyú; tres de Caaguazú y cuatro de Amambay. De los departamentos de Misiones y Boquerón solo se tomó una muestra respectivamente. Los fitopatógenos empleados fueron Macrophomina phaseolina y Phytophthora sp., ambos aislados a partir de plantas enfermas de soja.
El diseño experimental empleado fue completamente al azar con arreglo factorial de 15x2, con cuatro repeticiones, donde el primer factor del arreglo corresponde a cada uno de los 15 aislados nativos de Trichoderma spp. y el segundo factor corresponde a los 2 microorganismos fitopatógenos.
El cultivo pareado se realizó acorde a la metodología descrita por Jackkish-Matsuura y Menezes (1999), según la cual se obtuvieron discos de 5 mm de diámetro del crecimiento micelial de Trichoderma spp. y de los fitopatógenos Macrophomina phaseolina y Phytophthora sp., se transfirieron a placas de Petri conteniendo medio de cultivo PDA y se llevaron a incubación a 28 ºC por 96 horas.
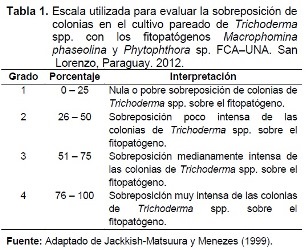
Las variables evaluadas fueron la velocidad media de crecimiento micelial y la sobreposición de colonias a las 96 horas de incubación; para la velocidad de crecimiento se midió cada colonia desde el extremo del disco opuesto al borde de la placa de Petri, hasta la barrera límite del crecimiento micelial. Para la sobreposición se calculó el porcentaje de la colonia de Trichoderma spp. sobre la colonia del fitopatógeno, las mediciones fueron realizadas sobre el eje diametral conformado por los discos. Para ambas mediciones se utilizó el software LabomedPixelPro, fotografías y una regla milimetrada para calibrar la imagen. A fin de evaluar la sobreposición, se empleó la escala modificada de Jackisch-Matsuura y Menezes (1999), detallada en la Tabla 1.
Experimento 2: Compatibilidad de Trichoderma spp. con fungicidas curasemillas, se realizaron antibiogramas, utilizando las dosis indicadas por cada 100 kg de semillas de Carboxin+Thiram (250 mL), Carbendazim + Thiram (250 mL), Metiltiofanato + Thiram (850 g) y Tebuconazole (50 mL). El diseño experimental fue Completamente al Azar con arreglo factorial de 6x5, con cinco repeticiones, donde el primer factor corresponde a los 6 aislados seleccionados de Trichoderma spp., que demostraron mayor potencial antagónico en el Experimento 1 y el segundo factor corresponde a los fungicidas curasemillas.
El antibiograma se realizó empleando el método adaptado de Brock y Madigan (1993), para lo cual 1 mL de una suspensión de conidios de Trichoderma spp. fue depositada y distribuida uniformemente en una placa de Petri con PDA y se dejó reposar durante 1 hora. Luego fueron colocados discos de papel filtro de 5 mm de diámetro, impregnados con el fungicida curasemilla en el centro de cada placa previamente inoculada. Para el tratamiento testigo, el papel filtro estuvo impregnado con agua destilada estéril. Las placas fueron incubadas a 28ºC, durante de 7 días.
Las variables evaluadas fueron área de inhibición del crecimiento micelial del hongo Trichoderma spp. y esporulación. El halo de inhibición se midió en forma diametralmente opuesta y se calculó el promedio del área, repitiendo el procedimiento cada 24 horas por 7 días a partir de la instalación del experimento, a las 48 horas de incubación se aplicó la escala utilizada por Reyes et al. (2012), detallada en la Tabla 2. Para la esporulación fueron cuantificados los conidios a los 7 días del inicio del Antibiograma, utilizando la cámara de Neubauer, fotografías y el software Photoshop CS6.
Los resultados obtenidos de ambos experimentos fueron sometidos a análisis de varianza. Las medias fueron comparadas entre sí mediante al test de Tukey al 5% de probabilidad. Para los análisis estadísticos se utilizó el paquete estadístico ESTAT.
RESULTADOS Y DISCUSIÓN
La velocidad media del crecimiento micelial, Experimento 1, a las 96 horas de incubación se observan en la Tabla 3.

El análisis de varianza indicó efectos significativos de los factores aislados de Trichoderma spp. y organismos fitopatógenos, tanto en forma separada como para la interacción de los mismos. Se verificó que los aislados presentan diferentes velocidades de crecimiento y que un mismo aislado presentó diferencias en la velocidad de crecimiento frente a cada fitopatógeno. Los aislados A-1, A-2, A-5, A-39, A-62, A-105, A-108 y A-25 fueron similares estadísticamente en la velocidad de crecimiento en cultivo pareado con Macrophomina phaseolina, presentando velocidades de entre 18,69 mm/día a 20,25 mm/día, pero éstos disminuyeron significativamente con Phytophthora sp., presentando velocidades de entre 11,87 mm/día a 13,71 mm/día.
Los aislados A-76, A-106, A-44, A-90, A-107, A-42 y A121 desarrollaron velocidades de crecimiento micelial similares en los cultivos pareados con los fitopatógenos, lo que indica que el factor interacción no tuvo efecto. Los aislados A-76 y A-106 presentaron velocidades de crecimiento estadísticamente mayores frente a ambos fitopatógenos, con 18,92 a 20,25 mm/día.
Guigón-López et al. (2010) trabajando con Trichoderma spp. registraron una velocidad de crecimiento micelial de 17,00 mm/día en cultivo pareado con M. phaseolina, mientras que Hernández-Mendoza et al. (2011) una velocidad máxima de 16,67 mm/día del antagonista en cultivo pareado con el mismo fitopatógeno. Borrero y Silva (2005) califican a la velocidad de Trichoderma spp. como una importante cualidad de antagonismo, compitiendo eficientemente por el sustrato.
Los resultados de la sobreposición de colonias de Trichoderma spp. sobre colonias de Macrophomina phaseolina y Phytophthora sp., a las 96 horas de incubación, se observan en la Tabla 4. El análisis de varianza indicó efectos significativos de los factores aislado de Trichoderma spp. y el fitopatógeno, tanto en forma separada como para la interacción de los mismos.
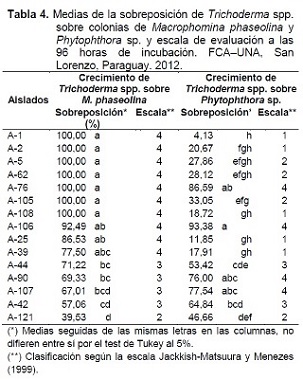
Se observa que la sobreposición de colonias de Trichoderma spp., sigue una tendencia similar al comportamiento de la velocidad de crecimiento micelial de los aislados.
Los aislados A-1, A-2, A-5, A-62, A-76, A-105 y A-108 lograron el 100% de sobreposición a M. phaseolina, aunque estos fueron similares al comportamiento de los aislados A-106, A-25 y A-39. El aislado A-121 presentó menor porcentaje de sobreposición con 39,53%, además de haber presentado menor velocidad de crecimiento micelial (Tabla 3).
Los aislados A-76 y A-106, presentaron sobreposición similar frente a M. phaseolina y Phytophthora sp., mientras que la sobreposición frente a Phytophthora sp. presentó diferencias estadísticas con los demás aislados anteriormente citados, exhibiendo rangos de entre el 4,13% al 33,05% de sobreposición, muy por debajo de la presentada frente a M. phaseolina que alcanzaba valores cercanos o iguales al 100%, dejando en evidencia la interacción entre factores y sus efectos.
Los aislados A-44, A-90, A-107, A-42 y A-121 presentaron medias de sobreposición similares frente a los hongos fitopatógenos estudiados. Los aislados A-90 y A-107 son estadísticamente similares a los aislados que alcanzaron el 100% de sobreposición.
Independientemente a la velocidad y sobreposición, todos los aislados lograron colonizar mayor superficie de medio ante los dos microorganismos fitopatógenos estudiados, resultado que concuerda con los obtenidos por Sandoval y López (2000).
La intensa sobreposición de aislados nativos de Trichoderma spp. a M. phaseolina en cultivos pareados ya fue observada por Garcete (2011). Ezziyyani et al. (2004), al confrontar T. harzianum con Phytophthora capsici observaron la capacidad de control in vitro, con intensa sobreposición. Sin embargo, la sobreposición total fue observada a partir del sexto día de iniciado el cultivo pareado y no en el cuarto día como en la presente investigación.
Fueron seleccionados para el Experimento 2, los aislados que presentaron mayor grado en la escala adaptada de Jackisch-Matsuura y Menezes (1999). De esta manera los aislados A-76 y A-106, presentaron grado 4 frente a ambos fitopatógenos en cultivo pareado, los aislados A-90 y A-107 presentan el grado 3 en cultivo pareado con M. phaseolina y 4 con Phytophthora sp. Los aislados A-5 y A-62 presentaron el grado 3 para ambos patógenos y fueron seleccionados por completar la sobreposición a M. phaseolina ya a las 72 horas de incubación.
En cuanto al Experimento 2: Compatibilidad de Trichoderma spp. con fungicidas curasemillas, en la Figura 1 se observan las medias del porcentaje de inhibición de los aislados de Trichoderma spp., a las 48 horas de incubación de las pruebas de antibiograma.
El análisis de varianza indicó efectos significativos de los factores aislado de Trichoderma spp. y fungicidas curasemillas, tanto en forma separada como para la interacción de los mismos.
Los aislados de Trichoderma spp. presentaron respuestas diferenciales al ser expuestos a los distintos fungicidas y a la vez, los fungicidas produjeron diferentes efectos sobre los aislados (Figura 1), siendo la fluctuación de los porcentajes de inhibición del crecimiento micelial del 2% al 43%.
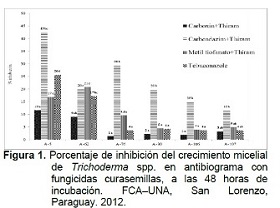
Entre los productos químicos, el Carbendazim+Thiram produjo, mayor inhibición (43%) en el aislado A-5, sin embargo, la inhibición llega a tan solo 12% en el aislado A-107. El Carboxim+Thiram, produjo inhibiciones de entre 1% a 12%, siendo menor en el A-76 y mayor en el aislado A-5. El Metiltiofanato+Thiram produjo entre 4% a 21% de inhibición, siendo menor en A-106 y mayor en el aislado A-62. En cuanto al Tebuconazole, produjo entre 4% a 26% de inhibición de crecimiento micelial, teniendo menor efecto en los aislados en el A-76, A-90, A-106 y A-107 y mayor en el A-5.
Clasificando los fungicidas según la escala propuesta por Reyes et al. (2012), para los aislados A-76, A-90, A-106 y A-107, el Carbendazim+Thiram resultó de grado 2, moderadamente compatible. Los fungicidas Carboxim+Thiram, Metiltiofanato+Thiram y Tebuconazole son compatibles con Trichoderma spp, perteneciendo al grado 1 de la mencionada escala.
Con el aislado A-5, el Carbendazim+Thiram se clasificó dentro del grado 3, no compatible, los demás fungicidas son de grado 2, moderadamente compatibles, mientras que, en el aislado A-62, se observa que el Carboxin+Thiram es de grado 1, compatible con el antagonista. Los demás curasemillas en estudio son moderadamente compatibles. Los promedios de inhibición del crecimiento micelial por factor, son presentados en la Tabla 5.
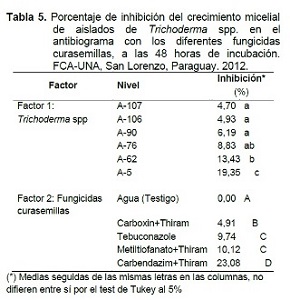
El aislado A-5 es el menos compatible con los fungicidas curasemillas empleados y los aislados A-107, A-106, A-90 y A-76 son los menos afectados en crecimiento micelial.
El fungicida que mayor inhibición de crecimiento micelial ocasionó fue el Carbendazim+Thiram, promediando 23,08% en los aislados de Trichoderma spp. El Carboxin+Thiram sólo inhibió en un promedio de 4,91%, siendo el más compatible. Los fungicidas Tebuconazole y Metiltiofanato+Thiram se comportaron de manera similar, ocasionando inhibiciones del 9,74% y 10,12%, respectivamente.
El Carboxin+Thiram es compatible con los aislados de Trichoderma spp., a excepción del aislado A-5. Estos resultados concuerdan con los obtenidos por Roberti et al. 2006, quienes encontraron que los fungicidas Carboxin y Thiram, no producían alteraciones significativas en el crecimiento micelial de cepas de Trichoderma spp. Batista et al. (2002) reportaron similar resultado para el Carboxin, mientras que, Muiño et al. (2001) difieren alegando que el Thiram ejerce una ligera toxicidad in vitro.
Batista et al. (2002) observaron que el Metiltiofanato ocasionaba la inhibición completa del crecimiento micelial del antagonista, resultado que difiere con los obtenidos en el presente estudio.
May y Kimati (2000) reportaron que el Tebuconazole produjo interferencia in vitro con el antagonista, resultado que concuerda sólo para el aislado A-5 y A-62, no así para el A-76, A-90, A-106 y A-107, donde este fungicida resultó compatible. Para todos los casos, el Carbendazim+Thiram resultó ser el fungicida con mayor efecto inhibitorio, esto concuerda con los resultados obtenidos por Cholango (2009), quien en experimentos realizados con siete aislados de Trichoderma spp., determinó que el producto más tóxico fue el Carbendazim.
Diferentes niveles de sensibilidad de los aislados de Trichoderma spp. a un mismo principio activo ya fue reportado por Ferreira et al. (1999) y Reyes et al. (2012), este fenómeno puede deberse a la capacidad que presentan los aislados de metabolizar el principio activo del fungicida, como señalan Pérez-Moreno et al. (2009).
Los aislados exhibieron una capacidad de recuperación en los antibiogramas, disminuyendo el área de inhibición de crecimiento micelial con el transcurso de los días, en ningún caso el área de inhibición aumentó con el tiempo, en promedio, el crecimiento micelial aumentó 3% en el lapso del primer al séptimo día. La disminución del área de inhibición del crecimiento micelial de Trichoderma spp. a medida que transcurren los días, también fue observada por Cholango (2009). Aunque también ocurre este fenómeno con algunos fitopatógenos, como M. phaseolina reportados por Orrego et al. (2009).
Este hecho, posiblemente se debe a que el microorganismo metaboliza los principios activos como fue señalado anteriormente.
En la Figura 2 se observan las medias del porcentaje de esporulación de los aislados de Trichoderma spp., en el antibiograma con los fungicidas curasemillas a los 7 días de incubación. El análisis de varianza indicó efectos significativos de los factores aislado de Trichoderma spp. y fungicidas curasemillas, tanto en forma separada como para la interacción de los mismos.
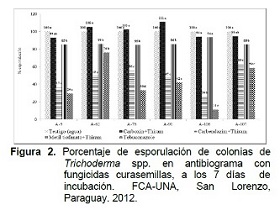
El fungicida Carboxin+Thiram presentó menor efecto inhibitorio en la esporulación de los aislados de Trichoderma spp., siendo similar al testigo en todos los casos. El A-5 alcanzó un máximo de 7% de inhibición en relación al testigo. Los aislados A-62, A-76 y A-90 mostraron un efecto promotor de la esporulación, de entre un 3% a 11%, superando al testigo.
El Metiltiofanato+Thiram no produjo efectos significativos en la esporulación del aislado A-106; mientras que en los demás aislados, produjo una reducción en el porcentaje de esporulación de carácter significativo, aproximadamente 15% menor al testigo.
El Carbendazim+Thiram mostró efectos diferenciados en la esporulación de los aislados, entre 26% al 63% en relación al testigo, lo que se traduce en inhibiciones significativas de la esporulación de entre 74% a 27%, valores para los aislados A-106 y A-107, respectivamente.
El Tebuconazole inhibió las esporulación entre 24% a 89%, exhibiendo respuesta diferenciada de los aislados al mismo principio activo. El aislado A-62 fue el menos afectado en este parámetro y el aislado más afectado fue el A-106.
Los promedios de esporulación por factor, son presentados en la Tabla 6. Para el Factor 1: Trichoderma spp., se puede observar que el menor porcentaje de esporulación lo presentó el aislado A-5 y los aislados A-62, A-107 y A-90 presentaron los mayores porcentajes de esporulación, es decir, la esporulación fue menos inhibida en estos aislados.
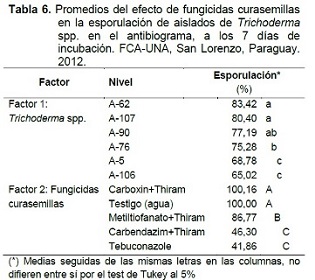
Los fungicidas Tebuconazole y Carbendazim+Thiram ejercen una notable reducción de la esporulación, en ambos casos se inhiben más del 50% en relación al testigo. En este sentido, el Carbendazim+Thiram inhibe drásticamente tanto el crecimiento micelial como la esporulación y el Tebuconazole a pesar de no inhibir considerablemente el crecimiento micelial, inhibe la esporulación.
La acción promotora de la esporulación fue reportada por Castellanos et al. (2011), en pruebas in vitro con el hongo Beauveria bassiana, el entomopatógeno expuesto a dosis bajas de Óxido cuproso y Azoxystrobin esporuló entre 11% a 22% más que el testigo, similar a lo ocurrido con el Carboxin+Thiram, para algunos aislados en la presente investigación. Respecto al Factor 2: Fungicidas curasemillas, el Carboxin+Thiram es similar al testigo, presentando un porcentaje ligeramente mayor debido al efecto promotor de la esporulación mencionado anteriormente.
En relación al fungicida curasemilla Tebuconazole, éste presentó un efecto genestático, por no interferir en el crecimiento micelial de Trichoderma spp., pero inhibió significativamente la esporulación. El mismo fenómeno fue reportado por Carrero et al. (2003), en antibiogramas con Botrytis cinerea con el fungicida Benomil, donde la esporulación del hongo fue completamente inhibida, a pesar de desarrollar abundante crecimiento micelial.
CONCLUSIONES
En las condiciones que fueron realizados los experimentos y en base a los resultados obtenidos se concluye que:
- Los aislados de Trichoderma spp. presentan velocidades de crecimiento micelial diferentes.
- De quince aislados nativos de Trichoderma spp., dos presentan mayor potencial antagónico in vitro a los organismos fitopatógenos Macrophomina phaseolina y Phytophthora sp.
- En condiciones in vitro, existe diferencias en la compatibilidad de los aislados nativos de Trichoderma spp. a fungicidas curasemillas.
- El fungicida curasemilla Carboxin+Thiram es compatible con los aislados nativos de Trichoderma spp. y el Carbendazim+Thiram es el menos compatible.
- El fungicida curasemilla Carboxin+Thiram no produce efectos negativos en la esporulación de Trichoderma spp., mientras que el Tebuconazole presenta efecto genestático.
REFERENCIAS BIBLIOGRÁFICAS
Alves, SB; Lopes, R. 2008. Controle microbiano de pragana América Latina: avanços e desafios. Piracicaba, BR, FEALQ. 414 p. [ Links ]
Batista, DC; Oliveira, SMA; Tavares, SCCH; Laranjeira, D; Neves, RAE. Silva, RLX. 2002. Efeitos de fungicidas inibindo o crescimento in vitro de Fusarium oxysporum f. sp. passiflorae e interferência com Trichoderma spp. Summa Phytopathologica. 28(4): 305-310. [ Links ]
Borrero, CA; Silva, HMR. 2005. Efectos de Trichoderma (in vitro) en los microorganismos no patógenos descomponedores de la materia orgánica de un suelo oxisol clase IV del pie de monte llanero (en línea). Orinoquia. 9(2): 6-14. Consultado 1 nov. 2012. Disponible en http://redalyc.uaemex. mx/redalyc/src/inicio/ArtPdfRed. jsp?iCve=89690202 [ Links ]
Brock, T; Madigan, M. 1993. Microbiología. 6 ed. México, MX, Prentice Hall Hispanoamericana. 956 p. [ Links ]
Carrero, C; Cedeño, L; Quintero, K; Pino, H; Rodríguez, L. 2003. Identificación y sensibilidad in vitro a fungicidas del agente causal de la podredumbre del tallo en plántulas de Eucalyptus cinerea en Mérida, Venezuela (en línea). Interciencia. 28(11): 656-659. Consultado 7 de oct. 2012. Disponible en http://redalyc.uaemex.mx/redalyc/src/inicio /ArtPdfRed.jsp?iCve=33908606 [ Links ]
Castellanos, L; Muiño, BL; Lorenzo, ME; Rodríguez, A; Gómez, A. 2011. Efecto in vitro de siete fungicidas químicos sobre Beauveria bassiana (Bals.) Vuil. (en línea). Fitosanidad: Un enfoque agroecológico. 15(1): 31-38. Consultado 23 abr. 2012. Disponible en http://scielo.sld.cu/scielo.php?pid=S156230092011000100005&scrip t=sci_arttext [ Links ]
Cholango, L. 2009. Selección de cepas de Trichoderma sp. in vitro, para el control de problemas radiculares en flores de verano (en línea). Tesis Ing. Agr. Checa, EC, Dpto. de Ciencias de la Vida, Escuela Politécnica del Ejercito. 131 p. Consultado 5 de oct. 2012. Disponible en http://repositorio.espe.edu.ec/bitstream/21000/2599/1/T-ESPE-IASA%20I-004154.pdf [ Links ]
Diniz, K; Oliveira, J; Mendes, R; Moreira, M; da Cruz, J. 2006. Incorporação de microrganismos, aminoácidos, micronutrientes e reguladores de crescimento em sementes de alface pela técnica de peliculização (en línea). Revista Brasileira de Sementes. 28(3): 37-43. Consultado 3 nov. 2011. Disponible en http://www.scielo.br/ pdf/rbs/v28n3/06.pdf [ Links ]
Ezziyyani, M; Pérez, C; Sid, A; Requena, ME; Candela, ME. 2004. Trichoderma harzianum como biofungicida para el biocontrol de Phytophthora capsici en plantas de pimiento (Capsicum annuum L.) (en línea). Anales de Biología. 26: 35-45. Consultado 5 de oct. 2012. Disponible en http://www.um.es/analesdebiologia/numeros/26/PDF/05-TRICHODERMA.pdf [ Links ]
Ferreira, A; Echeveste, C; Soares, I. 1999. Sensibilidade de isolados de Trichoderma spp. a benomil e iprodione (en línea).Ciência Rural. 29(3): 395-399. Consultado 3 nov. 2011. Disponible en http://www.scielo.br/scielo.php?script=sci_arttext&pid =S0103-84781999000300003&lang=pt [ Links ]
Garcete, JM. 2011. Efecto de aislados nativos de Trichoderma spp. en la incidencia de Macrophomina phaseolina (Tassi) Goid en sésamo (Sesamum indicum L.). Tesis Ing. Agr. San Lorenzo, PY, Dpto. de Protección Vegetal, FCA, UNA. 46 p. [ Links ]
Guigón-López, C; Guerrero-Prieto, V; Vargas-Albores, F; Carvajal-Millán, E; Ávila-Quezada, GD; Bravo-Luna, L; Ruocco, M; Lanzuise, S; Woo, S; Lorito, M. 2010. Identificación molecular de cepas nativas de Trichoderma spp. su tasa de crecimiento in vitro y antagonismo contra hongos fitopatógenos (en línea). Revista Mexicana de Fitopatología. 28(2): 87-96. Consultado 01 nov. 2012. Disponible http://www.sociedadmexicanadefitopatologia.org/archives/rmf_28_2_art_2.pdf [ Links ]
Hernández-Mendoza, JL; Sánchez-Pérez; MI; García-Olivares, JG; Mayek-Pérez, N; González-Prieto, JM; Quiroz-Velásquez JDC. 2011. Caracterización molecular y agronómica de aislados de Trichoderma spp. nativos del noreste de México (en línea). Revista Colombiana de Biotecnología. 13(2): 176-185. Consultado 01 nov. 2012. Disponible en http://www.redalyc.org/src /inicio/ArtPdfRed.jsp?iCve=77621 587017 [ Links ]
Jackkish-Matsuura, AB; Menezes, M. 1999. Efeito de Trichoderma spp. no controle de Pythium aphanidermatum em fumo (Nicotiana tabacum). Summa Phytopathologica 25(2): 161-164. [ Links ]
May, LL; Kimati, H. 2000. Controle de Phytophthora parasítica com fungicidas e efeito desses produtos no crescimento micelial de Trichoderma. Summa Phytopathologica. 26(1): 52-57. [ Links ]
Muiño, BL; Sáenz, M; Stefanova, M; Porras, A; Diaz, I. 2001. Compatibilidad de Trichoderma spp. con plaguicidas y fertilizantes en el cultivo del tabaco. Fitosanidad: Un Enfoque Actual de la Sanidad Vegetal 5(3): 3-9. [ Links ]
Orrego, A; Grabowski, C; Rodríguez, H; Soilán, L. 2009. Eficiencia de fungicidas para el control de Macrophomina phaseolina en semillas de soja, en condiciones in vitro. In Orrego, A. ed. Macrophomina phaseolina hongo causante de la pudrición carbonosa del tallo. San Lorenzo, PY, FCA/UNA. p. 27-36. [ Links ]
Pérez-Moreno, L; Villalpando-Mendiola, JJ; Castañeda-Cabrera, C; Ramírez-Malagón, R. 2009. Sensibilidad in vitro de Sclerotium rolfsii Saccardo, a los fungicidas comúnmente usados para su combate (en línea). Revista Mexicana de Fitopatología. 2(7): 11-17. Consultado 5 de oct. 2012. Disponible en http://redalyc.uaemex.mx/src/inicio/ArtPdfRed.jsp?iCve= 61211414002 [ Links ]
Reyes, Y; Infante, D; García-Borrego, J; Pozo; E del; Crua, A; Martínez, B. 2012. Compatibilidad de Trichoderma asperellum Samuels con herbicidas de mayor uso en el cultivo del arroz (en línea). Revista de Protección Vegetal. 27(1): 45-53. Consultado 1 oct. 2012. Disponible en http://scielo.sld.cu/scielo.php?pid=S1010-27522012000100008&script =sci_arttext [ Links ]
Roberti, R; Badiali, F; Pisi, A; Veronesi, A; Pancaldi, D; Cesari, A. 2006. Sensitivity of Clonostachys rosea and Trichoderma spp. as potential biocontrol agents to pesticides (en línea). Journal Of Phytopathology. 154(2): 100-109. Consultado 3 nov. 2011. Disponible en http://web. ebscohost.com/ehost/detail?sid=5bf03852-c239-411f-8e38d2efea7b1825%40sessionmgr115&vid=1&hid=108&bdata=Jmxhbmc9ZXMmc2l0ZT1laG9zdC1saXZl#db=aph&AN=19506846 [ Links ]
Sandoval, I; López, MO. 2000. Antagonismo de Trichoderma harzianum A34 hacia Macrophomina phaseolina y otros patógenos fúngicos del frijol. Fitosanidad: un Enfoque Actual de la Sanidad Vegetal. 4(3-4): 69-72. [ Links ]
Sandoval, I; López, MO. 2001. Hiperparasitismo de Trichoderma harzianum, T. viride y T. pseudokoningii sobre diferentes hongos fitopatógenos. Fitosanidad: un Enfoque Actual de la Sanidad Vegetal 5(1): 41-44. [ Links ]
Stefanova, M; Sandoval, I; Martínez, ML; Heredia, I; Ariosa, MD; Arévalo, R. 2004. Control de hongos fitopatógenos del suelo en semilleros de tabaco con Trichoderma harzianum. Fitosanidad: un Enfoque Actual de la Sanidad Vegetal 8(2): 35-38. [ Links ]














