Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Investigación Agraria
On-line version ISSN 2305-0683
Investig. Agrar. vol.14 no.2 San Lorenzo Dec. 2012
ARTÍCULO CIENTÍFICO
Inducción de resistencia en plantas de trigo (Triticum aestivum L.) a la mancha amarilla (Drechslera tritici-repentis) y marrón (Bipolaris sorokiniana)
Induction of resistance in wheat plants (Triticum aestivum L.) to the yellow spot (Drechslera tritici-repentis) and brown spot (Bipolaris sorokiniana)
Enrique Manuel Acuña Gamarra1 y Cristhian Grabowski Ocampos1*
1 Departamento de Protección Vegetal de la Facultad de Ciencias Agrarias de la Universidad Nacional de Asunción (FCA-UNA). San Lorenzo, Paraguay.
*Autor para correspondencia (cgrabowski@agr.una.py).
Recibido: 08/06/2012; Aceptado: 28/09/2012.
RESUMEN
La inducción de resistencia es la activación de mecanismos de defensas en plantas, éstos se expresan después del contacto con el patógeno o la exposición a algunas sustancias. Para determinar la inducción de resistencia a la mancha amarilla (Drechslera tritici-repentis) y mancha marrón (Bipolaris sorokiniana) en trigo, se realizaron dos experimentos en el Departamento de Protección Vegetal de la Facultad de Ciencias Agrarias, de la Universidad Nacional de Asunción, San Lorenzo, Paraguay. En el primer experimento se determinó la insensibilidad de patógenos a los productos Ka’a he’e, Acibenzolar – s – methyl (ASM), Fosetyl – Al y un producto con mezcla de oligoelementos más extractos vegetales (MOEV) en concentraciones de 0,0; 0,14; 0,28; 0,36 y 0,50%, donde la variable observada fue el crecimiento del micelio a los 12 días de incubación a 25±1°C. El segundo experimento determinó el índice de severidad en plantas tratadas con potenciales inductores, inoculadas con la suspensión de 4 x 105 esporas mL-1 de ambos patógenos. Los datos fueron sometidos a análisis de varianza y regresión lineal. El extracto de Ka’a he’e no presentó efecto directo inhibitorio sobre los patógenos yredujo en 50% el índice de severidad de manchas foliares, caracterizado como un potente inductor de resistencia en plantas de trigo, mientras que los productos MOEV y ASM presentaron un bajo efecto directo y redujeron en 48% y 33% la intensidad. Por último, con el uso de Fosetyl – Al, se redujo considerablemente el micelio de los hongos, disminuyendo en 46% el índice de severidad, por lo que estos son considerados productos de doble efecto.
Palabras clave: Bipolaris sorokiniana, Drechslera tritici-repentis, inducción de resistencia, mancha amarilla, mancha marrón.
ABSTRACT
The induction of resistance is the activation of defense mechanisms in plants; these are expressed after contact with the pathogen or exposure to some substances. To determine the induction of resistance to the yellow spot (Drechslera tritici- repentis) and the brown spot (Bipolaris sorokiniana) in wheat, experiments were conducted in the Department of Plant Protection at the Facultad de Ciencias Agrarias, Universidad Nacional de Asunción, San Lorenzo, Paraguay. Experiment 1: The first experiment determined the insensitivity of pathogens to the products Ka’a he’e, Acibenzolar – s – methyl (ASM), Fosetyl – Al and the mixture of trace elements + vegetable extracts (MOEV) at concentrations of 0.0, 0.14, 0.28, 0.36, 0.50%, where the observed variable was the mycelial growth after 12 days of incubation at 25 ± 1 °C. The second experiment determined the severity index in plants treated with potential inducers and inoculated with the suspension of 4 x 105 spore ml-1 of both pathogens. Data were subjected to analysis of variance and linear regression. The Ka'a he’e extract did not present direct inhibitory effect on the pathogens and reduced by 50% the rate of leaf spot severity, characterized as a potent inducer of resistance in wheat plants, while products MOEV and ASM presented a low direct effect and reduced in 48% and 33% the intensity. Finally, with the use of Fosetyl – Al was observed a significant reduction of fungal mycelium, decreasing 46% the severity index, these were considered as double effect products.
Key words: Bipolaris sorokiniana, Drechslera tritici- repentis, induction of resistance, yellow spot, brown spot.
INTRODUCCIÓN
El trigo (Triticum aestivum L.) es uno de los rubros agrícolas más importante durante el periodo productivo invernal. Este cultivo ha experimentado un incremento en su producción en los últimos años cubriendo las necesidades locales y dejando un excedente para la exportación (Kohli et al. 2010). Como cualquier otro cultivo presenta varios problemas fitosanitarios que aparecen en las etapas del ciclo evolutivo de la planta reduciendo el rendimiento final, siendo las pérdidas desde daños menores hasta un 100% (Reis y Casa 2005). Las enfermedades foliares constituyen uno de los factores que limitan la expresión del potencial de rendimiento del cultivo, siendo la mancha amarilla causada por Drechslera tritici-repentis y la mancha marrón causada por Bipolaris sorokiniana las de mayor intensidad, para las cuales mundialmente se han estimado pérdidas de entre el 6 y 55% debido a la presencia de estas enfermedades (Carretero 2004).
En la actualidad existen varios métodos de control de enfermedades que permiten reducir estas epidemias, pero teniendo en cuenta la problemática ambiental existente se debe buscar nuevas alternativas de manejo de enfermedades que no interfieran en su equilibrio. Así, el presente trabajo de investigación pone énfasis en alternativas no tradicionales para el manejo de manchas foliares en trigo, ya que una vez que aparecen reducen la capacidad fotosintética, ocasionando un efecto negativo en la planta, además del difícil control en estado fenológico avanzado debido a que los fungicidas ya no detienen la infección y con su uso continuo existe la tendencia de selección de cepas resistentes de patógenos.
Un método de control de enfermedades que ha generado interés en todo el mundo es la resistencia inducida, que consiste en la activación de las defensas de la planta ante el ataque de los patógenos. Según Agrios (2010), las plantas contrarrestan el ataque de patógenos mediante características estructurales que actúan como barrera física e impiden la penetración y colonización o por medio de reacciones bioquímicas que tienen lugar en sus células y tejidos, donde producen sustancias tóxicas o crean condiciones que inhiben su desarrollo. Así, mediante la aplicación de bioproductos o productos químicos sintéticos que no actúen directamente contra patógenos, sí activando los procesos fisiológicos y bioquímicos propios de la planta se evitaría o reduciría el progreso de la enfermedad (Guevara y Rodríguez 2006).
En las últimas décadas, diversos trabajos han demostrado el potencial de los extractos vegetales para el control de fitopatógenos, no solo por la acción directa como inhibidor de la germinación de esporas o desarrollo del micelio, sino por la capacidad de inducir resistencia en plantas, limitando el avance o desarrollo de la enfermedad (Riveros 2010). En la actualidad existe diversidad de agentes químicos capaces de inducir estos mecanismos de defensa, sin actividad antimicrobiana in vitro. Uno de estos compuestos es el Acibenzolar – s – methyl que actuaría como análogo estructural y funcional del ácido salicílico (Peteira et al. 2008). El producto Fosetyl-Al es eficaz contra las enfermedades foliares, del tallo y raíz causados por microorganismos del Phylum Oomycota como Phytophthora, Pythium y aquellos causantes de mildius en varios cultivos; y posee la característica de estimular las reacciones de defensa y la síntesis de fitoalexinas contra el ataque de este grupo de patógenos (Agrios 2010). Así también, productos comerciales a base de extractos y micronutrientes disponibles en el mercado se caracterizan como inductores de las autodefensas naturales de las plantas (SUNAT 2012) que están disponibles en nuestro país como fertilizantes foliares o bioestimulantes.
Con esta investigación se busca evaluar la inducción de resistencia en plantas de trigo por los potenciales inductores de resistencia como: Extracto de Ka’a he’e (Stevia rebaudiana Bertoni), Acibenzolar – s – methyl, Fosetyl – Al y el producto con mezcla de oligoelementos a base de Cu, Mn, Zn + extractos vegetales (MOEV), por medio de la determinación de la insensibilidad in vitro de los patógenos a estos productos y la eficiencia de control de las manchas foliares en plantas de trigo inoculadas, mediante la reducción de la severidad.
MATERIALES Y MÉTODOS
Los experimentos se desarrollaron en el laboratorio e invernadero de Fitopatología del Departamento de Protección Vegetal de la Facultad de Ciencias Agrarias (FCA) de la Universidad Nacional de Asunción (UNA).
Los materiales utilizados fueron: semillas de Trigo variedad BRS 208, el extracto de Ka’a he’e (Stevia rebaudiana Bertoni) como potencial inductor de resistencia biótico y los productos sintéticos potenciales inductores de resistencia Acibenzolar – s – methyl, Fosetyl – Al y el producto con mezcla de oligoelementos a base de Cu, Mn, Zn + extractos vegetales (MOEV) (Producto comercial registrado como Brotolom Total), los fungicidas Carboxin + Thiram para el tratamiento de semillas y el Tebuconazole para la aplicación foliar.
Los hongos fitopatógenos fueron aislados de semillas y hojas de trigo con signos y síntomas típicos, por el procedimiento de siembra en medio de cultivo Papa – Dextrosa – Agar (PDA) descripto por Agrios (2010), e incubadas a 25±1°C de temperatura para el desarrollo de los microorganismos. Una vez verificado el crecimiento de las colonias, se procedió al repique para la obtención del cultivo puro e identificación (Figura 1) mediante el empleo de claves taxonómicas de Carmichael et al. (1980), Menezes y Oliveira (1993) y Barnett y Hunter (1998).

Experimento 1: Efecto de los potenciales inductores de resistencia sobre el desarrollo in vitro de los hongos fitopatógenos Drechslera tritici-repentis y Bipolaris sorokiniana
Para determinar la insensibilidad de los patógenos fúngicos a los productos potenciales inductores y determinar si presentaban o no efecto directo significativo, fue utilizado el Método de Antibiograma adaptado de Brock y Madigan (1993), para lo cual un disco de 5 mm de cada patógeno con crecimiento activo fue sembrado por separado en placas de Petri con medio de cultivo PDA más la concentración correspondiente de cada producto e incubadas a 25±1°C.
El diseño experimental utilizado fue completamente al azar con arreglo factorial de 5x4, con cuatro repeticiones, donde el factor principal son los productos (extracto de Ka´a he´e, el producto con mezcla de oligoelementos a base de Cu, Mn, Zn y extractos vegetales, el producto Acibenzolar-s- metil y el producto Fosetyl-Al) y el factor secundario las concentraciones crecientes (0%; 0,14%; 0,28%; 0,36% y 0,50%) de cada producto evaluadas para los patógenos Drechslera tritici-repentis y Bipolaris sorokiniana.
La variable evaluada consistió en la medición del diámetro del crecimiento del micelio con escalimetro digital, clasificando el efecto de los tratamientos de acuerdo al radio de inhibición del crecimiento utilizando la escala adaptada de Viveros y Castaño (2006) como se observa en la Tabla 1.
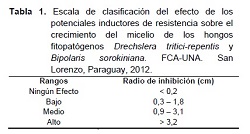
Los datos obtenidos fueron sometidos a análisis de varianza y comparación de las medias entre los tratamientos mediante el Test de Tukey al 5% de probabilidad de error. Así también fue verificada la relación causa efecto entre los productos y las concentraciones por análisis de regresión lineal simple.
Experimento 2: Control de manchas foliares con los potenciales inductores de resistencia en plantas de trigo
Para determinar la intensidad de las manchas foliares fueron tratadas plantas de trigo de la variedad BRS 208 con los potenciales inductores de resistencia e inoculados con el mix de ambos hongos fitopatógenos. Las semillas fueron sembradas en macetas plásticas de 500 cc de capacidad, que contenían sustrato esterilizado por método físico, compuesto de 50% de suelo, 25% estiércol vacuno y 25% de arena. Para el tratamiento fue utilizado la dosis comercial de cada potencial inductor aplicado mediante el tratamiento de semillas y dos pulverizaciones vía foliar a los 10 y 20 días posteriores a la emergencia.
La inoculación con la suspensión del mix de patógenos se realizó a los 5 días posteriores de la segunda aplicación de los potenciales inductores de resistencia. El inóculo fue preparado a partir de colonias puras de ambos hongos por separado, y la concentración de la suspensión determinada y ajustada con la cámara de Neubauer, donde fue obtenida una concentración mixta final de 4 x 105 esporas/cc (French y Hebert 1980).
Posterior a la inoculación, cada planta fue llevada a una cámara húmeda por un periodo de 24 h a 27°C y 80% de humedad relativa, para propiciar y garantizar la infección. Seguidamente fueron reacondicionadas nuevamente dentro del invernadero y monitoreadas diariamente en cuanto a la evolución de las manchas foliares.
La evaluación patométrica consistió en cuantificar la intensidad de la enfermedad, de 18 hojas al azar en las unidades experimentales de cada tratamiento, utilizando el diagrama de evaluación visual de manchas foliares propuesta por James (1971). Con éstos datos también se calcularon la Intensidad de daño cuya determinación fue a través de la siguiente fórmula Intensidad de Daño= (Cantidad de planta X Sub Índice de Severidad / Número de Escala) X 100. Los datos obtenidos fueron sometidos a análisis de varianza. Las medias fueron comparadas entre sí mediante el test de Tukey al 5% de probabilidad de error.
RESULTADOS Y DISCUSIÓN
En la Tabla 2 se observa el crecimiento del micelio de los hongos fitopatógenos Drechslera tritici-repentis y Bipolaris sorokiniana in vitro en concentraciones crecientes de los diferentes productos potenciales inductores incorporados al medio de cultivo correspondiente al Experimento 1.
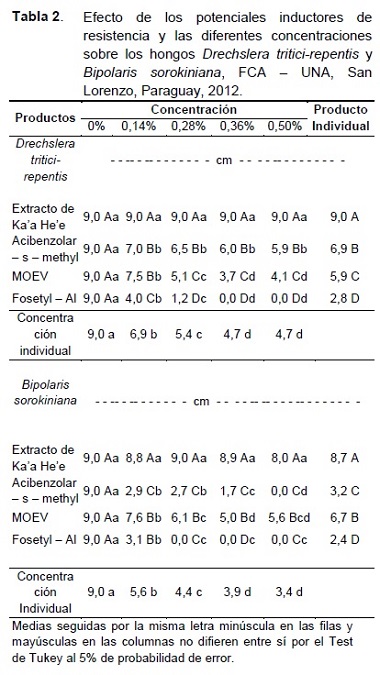
El crecimiento del micelio de D. tritici-repentis con respecto a los diferentes productos fue entre 9 cm y 2,8 cm, y en función a las concentraciones se registraron valores entre los 9 cm y 4,7 cm. Para el hongo B. sorokiniana, se observó en relación a los productos utilizados un crecimiento del micelio entre 8,7 cm y 2,4 cm y considerando el factor concentraciones variaron de 9 cm a 3,42 cm de crecimiento del micelio (Tabla 2).
El efecto de los potenciales inductores de resistencia sobre el crecimiento del micelio de D. tritici-repentis mostró diferencia significativa. Con relación a las concentraciones crecientes 0; 0,14 y 0,28% presentaron diferencias significativas entre sí, en cambio entre las dos últimas concentraciones 0,36 y 0,50% no se observaron diferencias significativas entre las mismas.
En relación a B. sorokiniana, el análisis del efecto de los potenciales inductores de resistencia sobre el crecimiento del micelio, demostró que hubo diferencia significativa entre cada producto. De igual manera para las concentraciones crecientes fue observado diferencias significativas, no obstante la mayor reducción del crecimiento del micelio se da por sobre la concentración 0,28% que corresponde a las dosis indicadas para su utilización en el manejo a campo de enfermedades. El estado actual del arte en esta ciencia alude que un inductor de resistencia deseable es aquel que ejerce efecto sobre el hospedero, alterando su relación con sus patógenos, manifestando resistencia pero que no actúe directamente contra estos por sensibilidad, causando algún efecto tóxico.
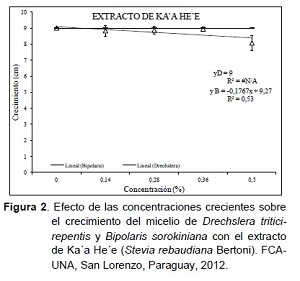
Analizando la relación causa efecto de las concentraciones crecientes sobre D. tritici-repentis y B. sorokiniana en el extracto de Ka’a he’e, se destaca en la Figura 2 la ausencia de efecto inhibitorio en relación al crecimiento del micelio de D. tritici-repentis y una reducción no significativa a partir de la concentración 0,28% en B. sorokiniana. Estos resultados coinciden con los obtenidos por Núñez (2009), donde no se encontraron ningún efecto directo o inhibitorio del extracto de Ka’a he’e sobre el desarrollo in vitro de los hongos fitopatógenos Macrophomina phaseolina y Alternaria solani.
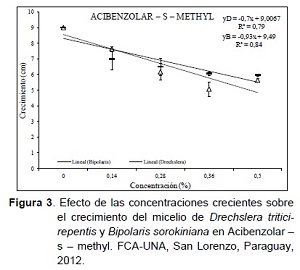
En el producto Acibenzolar – s – methyl (ASM), el crecimiento del micelio fue de 6,90 cm para D. tritici-repentis y 3,20 cm de diámetro para B. sorokiniana, evidenciándose una diferencia significativa con el extracto de Ka’a he’e, siendo así el segundo producto con menor efecto inhibitorio o directo sobre los hongos fitopatógenos (Tabla 2).
En la relación causa efecto de las concentraciones sobre el crecimiento se resalta que por cada aumento de la concentración del ASM, existe reducción significativa del crecimiento de 0,7 cm en D. tritici-repentis y 0,9 cm en B. sorokiniana por cada unidad de aumento en la concentración (Figura 3). Estos resultados coinciden con los obtenidos por Mogollón y Castaño (2011), quienes encontraron diferencia en el desarrollo del hongo Mycosphaerella fijiensis Morelet en concentraciones crecientes de 0; 0,1; 0,3 y 0,5% del Acibenzolar – s – methyl, y en otro experimento similar probando el mismo producto en concentraciones de 0; 0,2; 0,4; 0,6; 0,8 y 1% en medio de cultivo contra Thielaviopsis paradoxa, Lasiodiplodia theobromae y Pestalotiopsis sp., no se observaron efectos inhibitorios sobre el crecimiento del micelio.
En los tratamientos con el producto mezcla comercial de oligoelementos a base de Cu, Mn, Zn y extractos vegetales (MOEV) se observó un crecimiento de 5,9 cm de diámetro del micelio de D. tritici-repentis y 6,7 cm de B. sorokiniana, el cual presentó diferencia significativa con los demás productos (Tabla 2). De esta manera el MOEV siendo un producto natural semi sintético, es el tercer producto con menor efecto sobre el desarrollo de los dos hongos fitopatógenos estudiados.
Algunos productos naturales y semi sintéticos inocuos al medio ambiente son objetos de investigaciones, como el quitosano (Rodríguez et al. 2007) y el silicio (Rodrigues et al. 2005) que inducen resistencia contra Magnaporthe grisea reduciendo la severidad del bruzone, por lo que es probable que un producto como el MOEV también presente estas y otras propiedades, como producto alternativo de última generación para el manejo inteligente de enfermedades.
El comportamiento de D. tritici-repentis con respecto a las concentraciones del producto, reflejado en el análisis de regresión evidenció un efecto negativo reduciendo el crecimiento en 1,35 cm por cada unidad que se aumente la concentración. Asimismo, para el hongo B. sorokiniana se observó una reducción del crecimiento en 1,91 cm, por cada aumento de la concentración (Figura 4). Este efecto inhibitorio proporcional a la concentración puede deberse a la alta concentración de algunos elementos como Cu, Mn, Zn y extractos de varios vegetales que podrían influenciar en el crecimiento y desarrollo de patógenos, pero que al mismo tiempo podrían activar las defensas en la planta de trigo.
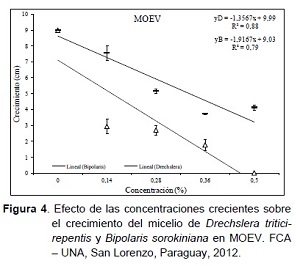
En virtud al concepto de un inductor de resistencia, el producto MOEV puede considerarse un producto que tiene un efecto tóxico no significativo, teniendo en cuenta que la indicación de aplicación foliar del mismo está entre las concentraciones de 0,2 y 0,28% del producto comercial.
El siguiente producto estudiado en cuanto a su efecto antimicrobiano es el Fosetyl–Al, donde se constató el menor crecimiento de ambos patógenos con relación a los demás productos empleados en la investigación. En el hongo D. tritici-repentis se observó un diámetro medio de 2,8 cm y en B. sorokiniana 2,4 cm (Tabla 2).
Al analizar la relación causa efecto de las concentraciones sobre el crecimiento del micelio en el producto Fosetyl – Al (Figura 5), se destaca que existe un efecto directo inhibitorio sobre los hongos Drechslera tritici-repentis y Bipolaris sorokiniana. El crecimiento del micelio en Drechslera tritici-repentis se reduce en 2,20 cm por cada unidad que se aumente la concentración del producto Fosetyl–Al. Así también en un 2,11 cm en el hongo B. sorokiniana.
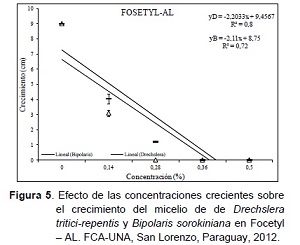
Estos resultados coinciden con los obtenidos por González y Menéndez (2007), quienes registraron una disminución del desarrollo del hongo Pythium tracheiphilum, con concentraciones crecientes de 1 a 1024 µL.mL-1 de Fosetyl – Al. En otro trabajo similar y en concordancia con los resultados obtenidos, Tremacoldi et al. (2010) en experimento in vitro encontraron que el Fosetyl – Al y otros derivados presentaron una inhibición completa del crecimiento del micelio del hongo Lasiodiplodia teobromae. Así también, evaluando inductores de resistencia en el control de Fusarium solani f. sp. piperis in vitro, Tremacoldi et al. (2009) observaron que el Fosetyl de potasio inhibió totalmente el crecimiento en las concentraciones igual o superior a 2,5 mL del producto comercial por litro.
Un producto químico es considerado inductor según Sticher et al. (1997) cuando cumple tres criterios básicos: 1) el compuesto y sus derivados no pueden exhibir actividad antimicrobiana in vitro o in vivo, 2) debe modificar la naturaleza de la interacción planta-patógeno de tal manera que se parezca a una asociación incompatible-induciendo mecanismos de defensa y por último 3) debe ser capaz de proteger plantas contra patógenos en diferentes grados dependiendo de la magnitud de las defensa que fueron activados.
A pesar de que los productos evaluados presentaron efecto inhibitorio sobre el crecimiento del micelio caracterizado como medio (Fosetyl–Al), bajo (Acibenzolar – s – methyl y MOEV) y ninguno (Extracto de Ka’a he’e) sobre los patógenos Drechslera tritici-repentis y Bipolaris sorokiniana, deben verificarse y confirmarse su posible efecto inductor de resistencia sistémica adquirida en plantas de trigo mediante la reducción de la severidad de las manchas foliares causadas por estos patógenos. Estas características corresponden a lo que se considera un inductor de resistencia ideal, no obstante en varios casos estudiados fueron encontrados productos elicitores que estimulan las defensas del hospedero y presentan efecto directo inhibitorio sobre sus patógenos (Tremacoldi et al. 2010).
La inducción de resistencia es conocida también como el lado oculto del control biológico, caso sean los elicitores bióticos. El estado actual del arte considera fundamental el estudio del trinomio patógeno-planta-elicitor como la más acertada, debido a que al mismo tiempo de ocurrir efecto directo en la planta, también ocurren modificaciones internas y externas, que pueden inducir respuestas de defensa contra patógenos (Grabowski 2012), y es por ello que a nivel mundial, en las décadas de 1990 y 2000, diversos trabajos han mostrado el uso potencial de inductores bióticos y abióticos para el control de fitopatógenos (Riveros 2010).
Comprobando el efecto inductor de los productos estudiados, en el Experimento 2 de eficiencia de control de manchas foliares en plantas de trigo, se observa en la Figura 6 el índice de severidad de la enfermedad a los 15 días posteriores a la inoculación mixta con los hongos fitopatógenos Drechslera tritici-repentis y Bipolaris sorokiniana. En el testigo absoluto se verificó la intensidad máxima de la mancha foliar con 85,5% de severidad y el tratamiento con fungicida con 40,5%, siendo el de menor intensidad.
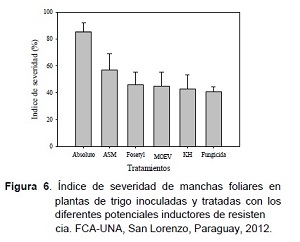
Verificando el efecto inductor, en las plantas de trigo tratadas con el Extracto de Ka’a he’e se determinó un índice de severidad de 43% sin diferencia estadística significativa con las tratadas con el fungicida (Figura 6). Asimismo, también los tratados con los productos MOEV con 45% de intensidad de la enfermedad y Fosetyl – Al con 46%, no se diferenciaron estadísticamente de las tratadas con Extracto de Ka’a he’ê y el fungicida. Por el concepto de un elicitor o moléculas activadoras, al confirmar la significativa reducción de la severidad de las manchas foliares y el bajo (MOEV) y ningún (Extracto de Ka’a he’e) efecto directo inhibitorio ejercido por estos productos sobre el crecimiento in vitro de los patógenos, se evidencia su efecto inductor de resistencia en plantas de trigo. Estas informaciones promisorias son las primeras para ambos productos y por la naturaleza orgánica natural son consideradas herramientas inteligentes para el control de enfermedades de plantas, al ser amigables al medio ambiente y permitir la reducción de la presión de plaguicidas sintéticos en la agricultura moderna.
En el caso del Fosetyl Al, siendo un compuesto orgánico natural se confirma su efecto tóxico directo sobre los patógenos, coincidiendo con Sticher et al. (1997) quienes mencionan que aún no se pudo demostrar que este compuesto llene todos los requerimientos para ser considerado inductor, debido a que en ensayos in vitro es un inhibidor débil del crecimiento fúngico, pero que también es un potente elicitor de fitoalexinas lo que lleva a especular su posible efecto inductor.
Por último, en las plantas de trigo tratadas con el Acibenzolar – s – methyl se determinó 56,7% de índice de severidad, reduciendo significativamente la intensidad de la enfermedad con relación al testigo absoluto, pero no de los anteriores productos citados y el testigo químico (Figura 6). Por tal observación también es un producto con efecto inductor de resistencia en plantas de trigo. No obstante, Pontes et al. (2010) estudiando el efecto residual del ASM en la inducción de resistencia del tomate a la mancha bacteriana destaca que son necesarias aplicaciones con intervalos de cinco días para que proporcione un control significativo de la enfermedad, lo que justifica el bajo efecto inductor de este producto en este experimento. Autores como Kunz et al. (1997) mencionan que por los mecanismos activados, estos productos comienzan a constituir una nueva clase de plaguicidas llamados fungicidas de cuarta generación.
D’ávila et al. (2011) estudiando el efecto fungitóxico de inductores de resistencia entre ellos el ASM en el crecimiento del micelio y germinación de esporas de Bipolaris oryzae dilucidaron que este producto reduce la germinación en 65%, confirmando su efecto directo sobre el patógeno.
Riveros (2010), menciona que las moléculas inductoras de resistencia, sea cual sea su naturaleza química e independientemente de su procedencia, no actúan directamente sobre el patógeno ni se convierten en agentes antimicrobianos, sino que éstas activan los mecanismos de defensa en respuesta a la presencia del patógeno.
Larqué y Mex, citado por Riveros (2010) hacen referencia acerca de investigaciones contradictorias, donde adjudican al inductor una triple función: la activación de defensa en la planta, labor anti-microbiana y la promoción del crecimiento vegetal. Éstas tres funciones fueron evidenciadas en esta investigación: en el experimento 1 para el Extracto de Ka’a he’e fue observado un efecto categorizado como ninguno, y que en el experimento 2 redujo la intensidad de las manchas foliares en la misma proporción que el fungicida. En los productos Acibenzolar – s – methyl, MOEV y Fosetyl-Al fue verificado un bajo efecto inhibitorio. La promoción de crecimiento fue observado en los tratamientos con MOEV, Fosetyl-Al y Extracto de Ka’a he’e.
Considerando lo referido, estos productos inducen resistencia en las plantas de trigo en diferentes grados y en las tres funciones mencionadas por lo que se los considera inductores de resistencia de plantas a patógenos. Con relación al Acibenzolar – s – methyl, cabe destacar que las plantas tratadas presentaron una reducción en el crecimiento, menor número y tamaño de hojas en relación a los demás tratamientos. Estos efectos podrían ser causados por fitotoxicidad, debido a que estos síntomas se intensificaron después de la segunda aplicación, lo que coinciden con lo expuesto por Romero et al. (2001), quienes pulverizando plantas de berenjena con ASM, semanalmente, para el control de Xanthomonas axonopodis pv. vesicatoria se redujo la producción de seis cultivares evaluados. De igual manera, en especies forestales Zahid et al. (2000) no observaron síntomas de fitotoxicidad, y en tabaco Cole (1999) a pesar de observar eficiencia de control de bacterias destacó que el compuesto fue moderadamente tóxico.
CONCLUSIONES
El Extracto Ka’a he’e presenta efecto inductor de resistencia en plantas de trigo por la insensibilidad in vitro de los patógenos Drechslera tritici-repentis y Bipolaris sorokiniana y la reducción del índice de severidad de las manchas foliares en un 50%.
El producto mezcla comercial de oligoelementos a base de Cu, Mn, Zn y extractos vegetales (MOEV) presenta efecto inductor de resistencia en plantas de trigo por la baja sensibilidad in vitro de los patógenos Drechslera tritici-repentis y Bipolaris sorokiniana y la reducción del índice de severidad de las manchas foliares en un 48%.
El producto Fosetyl – Al evidencia efecto inhibitorio medio in vitro sobre los patógenos Drechslera tritici-repentis y Bipolaris sorokiniana, y redujo el índice de severidad en un 46%, por lo que no es considerado un inductor de resistencia.
El producto Acibenzolar – s – methyl presenta efecto inductor de resistencia en plantas de trigo a las manchas foliares, por la baja sensibilidad de los patógenos Drechslera tritici-repentis y Bipolaris sorokiniana y la reducción índice de severidad de las manchas foliares en un 33%.
LITERATURA CITADA
Agrios, G. 2010. Fitopatología. 5 ed. México DF, MX: Limusa. 756 p. [ Links ]
Barnett, H y Hunter, B. 1998. Illustrated genera of imperfect fungi. 4 ed. Minnesota, US: APS PRESS. 218 p. [ Links ]
Brock, TM y Madigan, MT. 1993. Microbiología. 6 ed. México DF, MX, Prentice Hall Hispanoamericana. 956 p. [ Links ]
Carmichael, JW; Kendrick, WB; Connors, IL; Sigler, L. 1980. Genera of Hyphomycetes. University of Alberta Press, Edmonton, CA. v. 1, 386 p. [ Links ]
Carretero, R. 2004. Una aproximación mecanística al problema de las enfermedades foliares en el cultivo de trigo (en línea). Tesis Dr. Buenos Aires, AR. FAUBA 72 p. Consultado 24 mayo 2012. Disponible en: ri.agro.uba.ar/files/download/tesis/doctorado/2011carreteroramiro.pdf [ Links ]
Cole, DL. 1999. The efficacy of acibenzolar-S-methyl, an inducer of systemic acquired resistance, against bacterial and fungal diseases of tobacco. Crop Protection. 18(4):267-273. [ Links ]
Dávila, LS; Kuhn, OJ; Ethur, LZ. 2011. Efeito fungitóxico de indutores de resistência no crescimento micelial e germinação de esporos de Bipolaris oryzae. In: XLIV Congresso Brasileiro de Fitopatologia. Tropical Plant Pathology. Bento Gonçalves – RS, BR. vol. 36. p. 303. [ Links ]
French, E y Hebert, T. 1980. Métodos de investigación fitopatológica. San José, CR: IICA. 289 p. [ Links ]
González, AJ y Menéndez, F. 2007. Ensayo in vitro de eficacia de fungicidas frente a Pythium tracheiphilum en lechuga (en línea). Phytoma España. 167:30-35. Consultado 1 jun 2012. Disponible en: www.censa. edu.cu/index2.php?option=com_docman&task= doc_view&gid=43&Itemid=105. [ Links ]
Grabowski, C. 2012. Inducción de resistencia: El lado oculto del control biológico de enfermedades en plantas. In: Resumen Expandido. II Congreso Nacional de Ciencias Agrarias. Seminario de Energías Renovables. San Lorenzo, PY. p: 96-98. [ Links ]
Guevara, I y Rodríguez-Gálvez, E. 2006. Inductores químicos de resistencia en la supresión de la marchites del algodonero causada por Fusarium oxyisporum f. sp. vasinfectum en sistema hidropónico (en línea). Universalia. 11(1): 2-8. Consultado 13 abr 2012. Disponible en: www.dialnet.unirioja.es/servlet/fichero [ Links ]
James, C. 1971. A manual of assessment keys for plant diseases. CA: Department of Agriculture. 80 p. [ Links ]
Kohli, M; Viedma, L de; Cubilla, L. 2010. Manual del productor: guía para la producción de trigo. Asunción, PY: MAG, CAPECO, INBIO. 40 p. [ Links ]
Kunz, W; Schurter, R; Maetzke, T. 1997. The chemistry of benzothiadiazole plant activators. Pesticide Science 50(4): 275-282. [ Links ]
Menezes, M y Oliveira, S. 1993. Fungos fitopatogênicos. Recife, BR: Imprensa Universitária da UFRPE. 277 p. [ Links ]
Mogollón, AM y Castaño, J. 2011. Evaluación in vitro de inductores de resistencia sobre Mycosphaerella fijiensis Morelet (en línea). Revista Facultad Nacional de Agronomía Medellín 65(1): 6327-6336. Consultado 1 de jun 2012. Disponible en: http://www.revistas.unal.edu.co/index.php/refame/article/view/30758/30881 [ Links ]
Núñez, I. 2009. Acción fungistática de extractos vegetales sobre los hongos Macrophomina phaseolina y Alternaria solani, in vitro. Tesis Ing. Agr. San Lorenzo, PY: Departamento de Protección Vegetal, CIA, FCA, UNA. 37 p. [ Links ]
Peteira, B; Fernandez, A; Rodriguez, H; Gonzalez, E. 2008. Efecto del bion y del Fitomas como inductores de resistencia en plantas de arroz infestadas con Steneotarsonemus spinki. (en línea). Revista Protección Vegetal 23(1): 32-37. Consultado 17 abr 2012. Disponible en: www.censa. edu.cu/index2.php?option=com_docman&task=doc_view&gid=43&Itemid=105 [ Links ]
Pontes, N; Costa, F; Stock, V; Quezado-Duval, A; Oliveira, J; Maffia, L. 2010. Efeito residual do acibenzolar-S-metil na indução de resistência do tomateiro à mancha bacteriana. In: XLIII Congresso Brasileiro de Fitopatologia. Tropical Plant Pathology. Cuiabá – RS, BR. vol. 35. p. S82. [ Links ]
Reis, E y Casa, R. 2005. Doenças do trigo (Triticum aestivum). In: Kimati, H; Amorim, L; Rezende, J; Bergamin Filho, A; Camargo, L. Manual de fitopatologia. 4 ed. São Paulo, BR: Ceres. v.2, p: 631-638. [ Links ]
Riveros, A. 2010. Inducción de resistencia en plantas: interacción planta – patógeno. San José, CR: IICA. 261 p. [ Links ]
Rodrigues, FA; Jurick II, WM; Datnoff, LE; Jones, JB; Rollins, JA. 2005. Silicon influences cytological and molecular events in compatible and incompatible rice Magnaporthe grisea interactions, Physiol. Mol. Plant Pathology 66(4):144-159. [ Links ]
Rodríguez, AT; Ramírez, MA; Cárdenas, RM; Hernandez, AN; Velázquez, MG; Bautista, S. 2007. Induction of defense response of Oryza sativa L. against Pyricularia grisea (Cooke) Sacc. by treating seeds with chitosan and hydrolyzed chitosan. Pesticide Biochemistry and Physiology 89: 206-215. [ Links ]
Romero, AM; Kousik, CS; Ritchie, DF. 2001. Resistance to bacterial spot in bell pepper induced by acibenzolar-S-methyl. Plant Disease 85:189-194. [ Links ]
Sticher, L; Mauch-Mani, B; Métraux, JP. 1997. Systemic acquired resistance. Annual Review of Phytopathology 35:235-270. [ Links ]
SUNAT (Superintendencia Nacional de Aduanas y de Administración Tributaria, PE). 2012. Resolución de Intendencia Nacional. (en línea). Lima, PE. Consultado 18 May. 2012. Disponible en: http://www.sintad.com/aranceles /resointend/archivos//R-000431-2012.pdf. [ Links ]
Tremacoldi, CR; Dias, DP; Coelho, IL; Ishida, AKN. 2010. Indutor de resistência e óleos essenciais no controle da resinose do coqueiro. In: XLIII Congresso Brasileiro de Fitopatologia. Tropical Plant Pathology. Cuiabá – RS, BR. vol. 35. p. LXVIII. [ Links ]
Tremacoldi, CR; Dias, DP; Ishida, AKN; Almeida, CMB; Melo, LGL; Coelho, IL. 2009. Indutores de resistência no controle de Fusarium solani f.sp. piperis in vitro. In: XLII Congresso Brasileiro de Fitopatología. Tropical Plant Pathology. Rio de Janeiro – RJ, BR. vol. 34. p. s19. [ Links ]
Viveros, J y Castano, J. 2006. Evaluación in vitro de extractos vegetales sobre Mycosphaerella fijiensis Morelet. (en línea). Agronomía. Consultado 4 de mayo 2012. Disponible en: http://agronomia.ucaldas.edu.co/dowloads/Agronomia14-1_5.pdf [ Links ]
Zahid, A; Smith, I; Guest, D. 2000. Combinations of potassium phosphonate and Bion (acibenzolar-s-methyl) reduce root infection and dieback of Pinus radiata, Banksia integrifolia and Isopogon cuneatus caused by Phytophthora cinnamomi. Australasian Plant Pathology 29: 59-63. [ Links ]














