Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Compendio de Ciencias Veterinarias
On-line version ISSN 2226-1761
Compend. cienc. vet vol.3 no.2 San Lorenzo Dec. 2013
TRABAJO DE INVESTIGACION
ACCIÓN PROTECTORA DE LA ADVENTICIA SOBRE LA CALCIFICACIÓN VASCULAR
PROTECTIVE ACTION OF ADVENTICIOUS ON THE VASCULAR CALCIFICATION
* Montes de Oca A1, Gonzalez A2, Guerrero F1, Herencia C3, Almaden Y3, Lopez I1, Rodriguez M4, Aguilera E1
1Departamento de Medicina y Cirugía Animal, IMIBIC, Hospital Universitario Reina Sofía. Universidad de Córdoba, España.
2Departamento de Ciencias Fisiológicas, Facultad de Ciencias Veterinarias, Universidad Nacional de Asunción, Paraguay.
3Investigación, IMIBIC, Hospital Universitario Reina Sofía. Universidad de Córdoba, España.
4Nefrología, IMIBIC, Hospital Universitario Reina Sofía. Universidad de Córdoba, España.
* Resumen publicado en la Revista Nefrología de la Sociedad Española de Nefrología. España.
RESUMEN.
El rol del endotelio y de las células del músculo liso vascular de la media en la formación de calcificaciones vasculares (CV) se ha estudiado con profundidad. Sin embargo, no se ha prestado atención al papel de la adventicia en este proceso y no se ha considerado el potencial de este tejido como tal porque se asume que la adventicia es nada más que un simple «tejido conectivo laxo» que rodea los vasos sanguíneos aparentemente sin una función específica. Un trabajo publicado (1) apoya un nuevo paradigma de CV de «afuera hacia adentro», en el que la adventicia puede participar como precursora en la respuesta a una lesión vascular. El objetivo del presente estudio fue determinar el papel de la adventicia en el desarrollo de CV en un modelo in vitro. Para ello se cultivaron anillos aórticos procedentes de ratas Wistar con adventicia (c⁄adv) y sin adventicia (s⁄adv) en medios con niveles de fósforo normal (control P 0,9 mM) y elevado (P 3,3 mM). Se determinó el contenido mineral (Ca y P) de los anillos por colorimetría y mediante cortes histológicos teñidos con Von Kossa. La adición de P (3,3 Mm) al medio de cultivo resultó en un incremento en el contenido mineral de todos los anillos. Los anillos del grupo s⁄adv tratados con P (3,3 mM) presentaron mayor contenido mineral que los anillos c⁄adv cultivados bajo las mismas condiciones. No hubo diferencias en cuanto a contenido mineral en los grupos c⁄adv y s⁄adv cultivados con concentraciones normales de P (0,9 mM). En conclusión, la adventicia desempeña un papel protector de la CV en anillos de aorta expuestos a altas concentraciones de P in vitro.
Palabras clave:calcificaciones vasculares, fósforo, calcio, in vitro.
ABSTRACT.
The role of endothelium and the vascular Smooth Muscle Cells of the middle laye ron the formation of vascular calcifications (VC) has been study in deep. However, no attention was payed to the rol of adventicious in this process. Perhaps, the potential of this tissue was overlooked because the adventicious was consided hardly as a soft connective tissue, without a specific function. On the other hand, a published work (1) stresses a new paradigma VC of " From out to in”, in which the adventicious can participate as a forerunner in the answer to vascular lesion. The aim of the present study was to determine the roll of the adventicious in the development of VC in a in vitro model. For this porpose, aortic rings of wistar rats were cultured with adventicious (with⁄adv) and without (wout⁄adv) in culture media with normal levels of phosphorus (Control – P 0,9 mM) and elevated (P 3,3 mM). mineral content (Ca and P). Of the aortal rings were measured by colormetry and by mean of histological colored slide tissues by Von Kossa method. The adition of P 3,3 mM to the culture media resulted in an increase in mineral content of all the rings. The rings of the wout/adv treated with P 3,3 mM showed higher mineral content than those of w. adv group cultured under the same conditions. There were no differences in mineral content of both w. adv and wout adv groups cultured under normal concentration of P (0,9 mM). In conclusion, the adventicious play an protective roll on the VC in aortal rings exposed to high concentrations of in vitro.
Key words: vascular calcifications, phosphorus, calcium, in vitro.
INTRODUCCIÓN
La calcificación vascular (CV) hace referencia al depósito anormal de sales de calcio en los vasos sanguíneos, miocardio y válvulas cardíacas (2). Esta patología contribuye considerablemente a la mortalidad cardiovascular en pacientes con enfermedad renal terminal (3). Aproximadamente el 50% de la mortalidad en estos pacientes se atribuye a la CV (4).
La CV ha sido considerada durante mucho tiempo como un proceso pasivo y degenerativo. Sin embargo, hallazgos recientes sugieren que es un proceso activo de regulación similar a la osteogénesis (5), consistente en la transdiferenciación de las células del músculo liso vascular (CMLV) a osteoblastos, capaces de sintetizar las proteínas requeridas para la calcificación (6). Si bien, la CV ha sido reconocida hace más de 200 años, la comprensión de la patogénesis de este trastorno es todavía incompleta (7).
En el desarrollo de las CV, los depósitos de fosfato de calcio en forma de apatita se asientan en las distintas capas del vaso sanguíneo y se asocian a patologías específicas. La calcificación de la íntima se observa en las lesiones arterioscleróticas, mientras que la calcificación de la media es común en la arteriosclerosis asociada a la edad, la diabetes y la insuficiencia renal crónica (IRC) (8). En la IRC, la CV de la media ocurre en la matriz extracelular de las CMLV como resultado o producto de los desequilibrios del metabolismo mineral que sufren los enfermos renales, destacándose a la hiperfosfatemia, como principal factor de riesgo de mortalidad cardiovascular en pacientes con IRC, desempeñando un papel clave en el desarrollo de la CV (9, 10).
Diversos estudios in vitro (11, 8, 12, 4) han revelado que las elevadas concentraciones de fosfato en el medio de cultivo constituyen un potente inductor de la calcificación vascular, la cual sucede mediante una transformación de las CMLV hacia un fenotipo osteocondrogénico. Después del tratamiento con altos niveles de fósforo, las CMLV expresan proteínas marcadoras de hueso y cartílago que rigen la diferenciación osteoblástica y condrocítica tales como osteopontina, fosfatasa al calina, regulador multifuncional de la formación ósea (Runx2⁄Cbfa1), proteína morfogénica ósea 2 (BMP2), músculo liso homeobox 2 (Msx2), osterix y región determinante sexual Y-box 9 (Sox9). Además, en condiciones ricas en fósforo, las CMLV muestran una dramática disminución de las proteínas propias de su estirpe como a-actina muscular lisa (SMa-actina), calponina a-22 proteína muscular lisa (SM22a) (6, 2, 13, 14). Estos mismos cambios celulares y moleculares se han observado en pacientes hiperfosfatémicos con IRC (15, 10, 16, 17, 18). En este contexto, se resalta que la proteína matricial glutámica (MGP) contiene cinco residuos del aminoácido dependiente de vitamina K [ácido a-carboxiglutámico (Gla)] y se expresa normalmente en las túnicas adventicia y media de las arterias (más en la adventicia), aunque también se localiza en huesos, cartílagos, riñones y válvulas cardíacas. En la adventicia está asociada a la matriz extracelular, y su papel en la CV no está del todo clarificado. En otros estudios se ha demostrado que en las CMLV in vitro, la expresión de MGP se incrementa cuando los niveles de calcio extracelular aumentan, lo que sugiere que MGP participa en un mecanismo homeostático destinado a controlar y limitar la mineralización (11, 19). Por lo tanto, teniendo en cuenta la presencia de MGP en la túnica adventicia, la misma podría actuar como protector de las CV.
Los investigadores no han dimensionado el potencial de este tejido por considerarlo solo como un "tejido conectivo laxo” que circunda los vasos sanguíneos, sin ninguna función específica distinta que actuar como soporte de los grandes vasos (20). Sin embargo, un trabajo publicado (1) apoya un nuevo paradigma hipotético de "afuera hacia adentro”, en el que la adventicia podría participar como reguladora en la respuesta a una lesión o inflamación vascular.
Considerando que la enfermedad cardiovascular es la primera causa de muerte en enfermos renales y tiene una profunda influencia sobre la función cardiovascular y la salud, el desafío es saber qué mecanismos están activos y⁄o predominan en diversos estadios de la enfermedad para desarrollar estrategias terapéuticas eficaces que puedan prevenir y potencialmente revertir la calcificación vascular en la insuficiencia renal crónica. Los objetivos de la presente investigación fueron: desarrollar un modelo in vitro de explantes de aortas (EA) sin adventicia, y examinar en este nuevo modelo el papel de la misma en el desarrollo de las calcificaciones vasculares.
MATERIALES Y MÉTODOS.
El trabajo experimental de investigación, se realizó en el laboratorio del área de Nefrología del Instituto Maimónides de Investigación Biomédica de Córdoba (IMIBIC) emplazado en el Hospital Universitario Reina Sofía, conjuntamente con el departamento de Medicina y Cirugía de la Universidad de Córdoba, España. Los pasos realizados son esbozados seguidamente:
1. Cultivos in vitro.
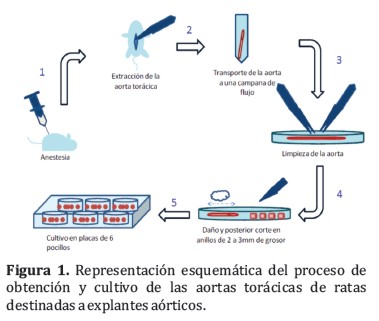
Las aortas torácicas fueron obtenidas de ratas Wistar, de 8 semanas de edad, con peso promedio comprendido entre 200 a 300 gramos. Las aortas torácicas fueron clasificadas al azar en dos grupos: uno de aortas sin adventicia y otro de aortas con adventicia. Las aortas se limpiaron cuidadosamente con suero fisiológico estéril, en una campana de flujo laminar. Finalmente, las aortas fueron seccionadas en anillos de 2 a 3 mm de grosor. Los anillos de aorta se colocaron en placas de 6 pocillos, con medio de cultivo. El medio de cultivo utilizado fue Dulbecco´s modified eagle´s medium (DMEM) suplementado con 1 mmol⁄L de piruvato sódico, 4,5 g⁄L de glutamina, 100 U⁄mL de penicilina, 100 mg⁄mL de estreptomicina y 20 mM de 4-(2-hydroxyethyl)-1 piperazineethanesulfonic acid (HEPES) un agente tampón. Los explantes se mantuvieron en una estufa a 37°C, en una atmósfera húmeda y 5% de dióxido de carbono (CO2). El medio de cultivo se renovó cada 2 días. Los pasos del procedimiento de obtención y cultivo de las aortas pueden observarse en la Figura 1.
2. Inducción de calcificación.
La inducción de calcificación de los explantes de aorta se consiguió en un medio con alto contenido en fósforo, que fue preparado con DMEM añadiendo fósforo y 3,75 U⁄mL de fosfatasa alcalina. Los explantes cultivados no sintetizan fosfatasa alcalina, de ahí la necesidad de suplementar. El medio tuvo una concentración de calcio de 1,8 mM y el fosfato fue incorporado en una proporción 2:1 de fosfato monobásico y dibásico.
3. Cuantificación de calcio.
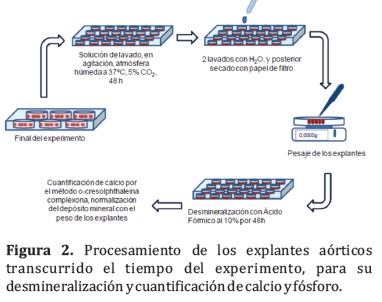
Al finalizar el tiempo del experimento, los anillos de aorta fueron colocados en placas de 24 pocillos conteniendo una solución de lavado preparada con: cloruro cálcico (CaCl2) (0,147g⁄l), HEPES (0,0476g⁄l), cloruro sódico (NaCl) (0,0876g⁄l) y nitrato sódico (NaNO3) (0,002g⁄L). Las aortas permanecieron en la solución de lavado durante 48 horas (renovando la solución a las 24 horas); durante este tiempo el tejido se mantuvo en agitación y a 37°C, en una atmósfera húmeda con 5% de CO2.
Finalizado el procedimiento anterior, los explantes fueron lavados con agua bidestilada y secados con papel de filtro. Luego, fueron pesados en una balanza de precisión y desmineralizados en ácido fórmico al 10%, durante un periodo de 48 horas. El contenido de calcio en el extracto de ácido fórmico, obtenido de la desmineralización de los explantes de aorta, se determinó colorimétricamente mediante el kit de QuantiChromTM Calcium Assay Kit. El resultado de la medición del calcio se estandarizó con el peso de las aortas, las unidades y las concentraciones expresadas en µg de calcio⁄mg de tejido. En la Figura 2 se observa un esquema del proceso completo.
4. Cuantificación de fósforo.
El contenido de fósforo en el extracto de ácido fórmico, obtenido de la desmineralización de los explantes de aorta, se determinó colorimétricamente mediante un kit de Bio Systems. El resultado de la medición de fósforo fue estandarizado con el peso de las aortas, en unidades de medida de µg de fósforo⁄mg de tejido.
5. Tinción Von Kossa
Para la detección de los depósitos minerales en los explantes, se utilizó la tinción Von Kossa, consistente en la sustitución de los iones de calcio intratisulares en forma de fosfatos o carbonatos por iones de plata, en solución acuosa sometidos a un proceso de exposición a la luz. Los depósitos iniciales de calcio se colorean de marrón-negro. Así mismo se llevó a cabo una contratinción con hematoxilina-eosina, para el estudio de la arquitectura tisular.
RESULTADOS Y DISCUSIÓN
1. Calcificación en explantes de aorta cultivados con concentraciones altas de fósforo.
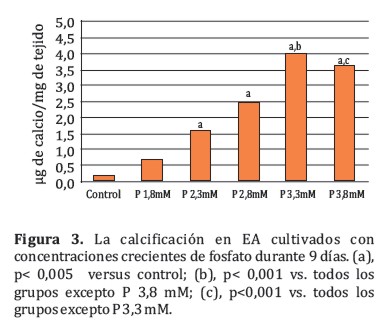
Con el propósito de determinar la concentración adecuada de fosfato para inducir calcificación se realizó una curva dosis – respuesta. Los resultados demostraron que los EA cultivados con concentraciones crecientes de fosfato durante 9 días calcificaron de una manera dosisdependiente (Figura 3). La calcificación obtenida de los EA cultivados con 2,3 mM, 2,8mM, 3,3 mM y 3,8 mM (1,59±0,15; 2,46±0,33; 4,00±0,32; 3,63±0,47 µg de calcio⁄mg de tejido, respectivamente) fue significativamente (p <0,05) más alta que la del grupo control (0,13±0,09 µg de calcio⁄mg de tejido).
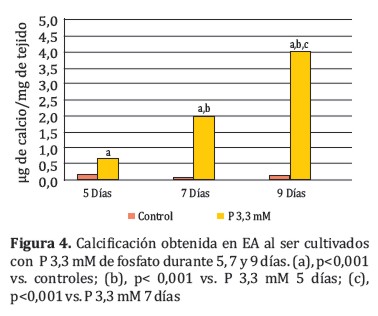
Para conocer la progresión de la calcificación a través del tiempo, se cultivaron los explantes con 3,3mM de fosfato en dinámicas de 5, 7 y 9 días (Figura 4).
La calcificación en los EA se multiplicó casi tres veces entre los días 5 (0,67±0,24 µg de calcio⁄mg de tejido) y 7 (1,93±0,22 µg de calcio⁄mg de tejido) en cultivo, y se duplicó si se comparan los valores obtenidos a los 7 y 9 días (4,01±0,32 µg de calcio⁄mg de tejido). Las diferencias entre los días 5, 7 y 9 de cultivo con P 3,3 mM fueron significativas (p <0,001).
2.Papel de la adventicia en la calcificación de EA expuestos a altas concentraciones de fósforo
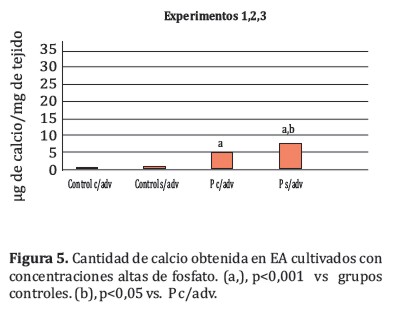
Una vez corroborada la viabilidad del modelo experimental y en base al objetivo 2 del trabajo, se investigó en este modelo el posible papel de la adventicia en el desarrollo de las CV. Para ello, se realizaron 3 ensayos experimentales independientes, en dinámica de 9 días. Se incluyeron grupos de pocillos distribuídos de la siguiente manera: pocillos control con adventicia (c⁄adv) y pocillos sin adventicia (s⁄adv); y un grupo de pocillos tratados con elevada concentración de fósforo (P 3,3 mM), nuevamente subdividido en un grupo con adventicia (P c⁄adv) y otro sin adventicia (P s⁄adv).
2.1. Análisis conjunto de los experimentos
El análisis conjunto de los tres experimentos reveló que, como se esperaba, los grupos tratados con P depositaron más calcio (Figura 5) que los grupos controles (5,16±2,24 y 7,47±4,70 µg de calcio⁄mg de tejido, P c⁄ adv y P s⁄adv respectivamente vs. 0,10±0,14; 0,30±0,44 µg de calcio⁄mg de tejido, C c⁄adv y C s⁄adv respectivamente). En cuanto a los grupos tratados con P, los EA s⁄adv registraron una mayor cantidad de calcio que el grupo P c⁄adv (7,47±4,70 vs. 5,16±2,24 µg de calcio⁄mg de tejido, respectivamente) esta diferencia fue estadísticamente significativa (p <0,05).
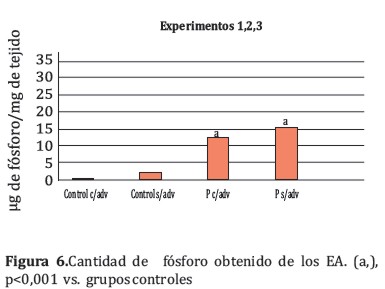
Además, el conjunto de los tres experimentos evidenció que la cantidad de fósforo acumulado (Figura 6) en los grupos tratados con P fue significativamente (p <0,001) más alta que los grupos controles (13,17±8,29 y 15,96±11,11 µg de fósforo⁄mg de tejido, P c⁄ adv y P s⁄adv respectivamente vs. 0,18±0,10; 1,95±4,86 µg de fósforo⁄mg de tejido, C c⁄adv y C s⁄adv respectivamente). Sin embargo, no se observó diferencia significativa entre los gupos tratados con P.
3.Determinación in situ de la presencia de depósitosminerales en cortes histológicos de los EA en estudio
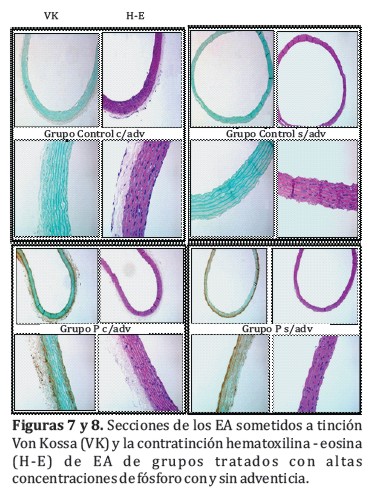
Para confirmar los datos obtenidos mediante la cuantificación de calcio y fósforo en los EA a los 9 días, se realizó la tinción Von Kossa (VK) y la contratinción hematoxilina-eosina a los 4 grupos de estudio (Figuras 7 y 8). Tal y como sucede en las determinaciones colorimétricas, en estas imágenes se aprecia una deposición mineral más extensa en el grupo P s⁄adv en comparación con el grupo P c⁄adv.
La presente investigación se centró en el desarrollo de un modelo de EA sin adventicia, objetivo llevado a cabo con éxito, logrando mantener en cultivo durante 9 días los EA en condiciones favorables. Además, los EA sin adventicia expuestos a concentraciones altas de fósforo calcificaron más que aquellos que permanecieron con todas las túnicas. Los hallazgos han revelado una aproximación importante en el conocimiento del papel de la adventicia en el desarrollo de las CV.
El desarrollo del modelo de explantes sin adventicia efectuado en este trabajo se basó en el modelo de calcificación de la media puesto a punto por un trabajo experimental anterior (21). Estos cultivos pueden realizarse a largo plazo sin necesidad de utilizar factores de crecimiento. Los EA tienen la ventaja de mantener intacta la arquitectura tisular. Además, la presencia de todas las poblaciones celulares que conforman la aorta y el contacto intercelular hacen que este modelo sea muy semejante a un organismo vivo. Numerosos estudios (22, 23, 12) han demostrado anteriormente que las CMLV expuestas a concentraciones altas de fosfato calcifican y sufren una transición fenotípica.
Los resultados obtenidos en el presente trabajo han confirmado lo que se había reportado previamente, demostrando en el modelo experimental utilizado, un aumento del depósito mineral tras cultivar con altos niveles de fósforo. Los hallazgos de este estudio están acordes con los resultados obtenidos por varios autores al demostrar que la calcificación de las CMLV expuestas a concentraciones altas de fósforo se incrementa con el paso del tiempo y que el grado de calcificación inducida es dependiente de las mismas en el medio de cultivo (12, 3, 24, 25, 26). Por lo tanto es posible afirmar que las CMLV sufren una calcificación tiempo dependiente y en correlación directa con la concentración de fosfato en el medio de cultivo. Esta investigación fue la primera enfocada en el desarrollo de un modelo in vitro para conocer el papel de la adventicia en el desarrollo de las CV.
En este trabajo de investigación se pudo observar además, que los EA sin adventicia calcificaron más que el grupo de los EA con adventicia expuestos a altas concentraciones de fósforo. La calcificación se comprobó mediante la cuantificación de calcio, fósforo y deposición mineral (Von Kossa). Los resultados obtenidos demuestran de una manera sólida que el proceso de mineralización se acentúa al retirar la adventicia de la aorta; los valores de fósforo no muestran un incremento significativo entre los grupos de estudio (P c⁄adv y P s⁄adv) pero se observa una tendencia clara a incrementar la acumulación de este mineral cuando es retirada la adventicia. Sin embargo, el incremento del depósito de calcio en los EA sin adventicia es diferente estadísticamente respecto de los EA con adventicia.
Los datos expuestos previamente sugieren que la adventicia actúa como protector de las CV, esto podría deberse a que la (MGP) presente en la pared de la arteria normal, principalmente en la adventicia, participa en un mecanismo homeostático destinado a controlar y limitar la mineralización jugando un papel fundamental en la prevención de las CV. Un posible mecanismo por el cual MGP podría inhibir la calcificación es que regule indirectamente la mineralización mediante efectos en la diferenciación osteogénica de las células mesenquimales, mediante el secuestro de BMP-2, con la cual MGP forma un complejo, previniendo la interacción de BMP-2 con sus receptores (11). Por todo esto, sería interesante en un futuro próximo evaluar la expresión génica de MGP y BMP-2 en este nuevo modelo desarrollado.
En definitiva, este estudio aporta datos importantes acerca del papel de la adventicia en el desarrollo de la calcificación vascular. También abre una nueva línea de investigación para ahondar los conocimientos de los mecanismos celulares y moleculares de la CV y de esta manera desarrollar estrategias terapéuticas eficaces que puedan prevenir y potencialmente revertir esta patología.
CONCLUSIONES.
1. Se ha conseguido desarrollar un modelo in vitro de explantes de aortas (EA) sin adventicia.
2. El presente estudio sugiere que, en este nuevo modelo, la adventicia podría actuar como protector en el desarrollo de las calcificaciones vasculares.
AGRADECIMIENTO.
Al equipo de trabajo del laboratorio del área de Nefrología del Instituto Maimónides de Investigación Biomédica de Córdoba (IMIBIC), departamento de Medicina y Cirugía Animal de la Universidad de Córdoba, España por hacer posible la realización de este trabajo de investigación.
BIBLIOGRAFÍA
1. Liu ZY, Kong W. The role of adventitia in atherosclerosis. Sheng Li Ke Xue Jin Zhan 41(3):177-82. 2010 [ Links ]
2. Speer M, Yang H, Brabb T, Leaf E, Look A, Lin W, Frutkin A, Dichek D, Giachelli C. Smooth Muscle Cells Give Rise to Osteochondrogenic Precursors and Chondrocytes in Calcifying Arteries. Circ. Res 104; 733-741. 2009 [ Links ]
3. Li X, Yang H, Giachelli C. BMP-2 promotes phosphate uptake, phenotypic modulation, and calcification of human vascular smooth muscle cells. Atherosclerosis 199:271-277. 2008 [ Links ]
4. Li X, Yang H, Giachelli C. Role of the sodium-dependent phosphate cotransporter pit-1, in vascular smooth muscle cell calcification. Circ Res 98:905-912. 2006 [ Links ]
5. Jono S, Shioi A, Ikari Y, Nishizawa Y. Vascular calcification in chronic kidney disease. J Bone Miner Metab 24:176–181. 2006 [ Links ]
6. Montes de Oca A, Madueño J, Martinez-Moreno J, Guerrero F, Muñoz-Castañeda, Rodriguez-Ortiz ME, Mendoza F, Almaden Y, López I, Rodriguez M, Aquilera-Tejero E. Hight-Phosphateinduced calcification is related to sm22a promoter methylation in vascular smooth muscle cells. J. Bone Min Res 25: 1996–2005. 2010 [ Links ]
7. Wallin R, Wajih N, Greenwood G, Sane D. Arterial calcification: a review of mechanisms, animal models, and the prospects for therapy. Med Res Rev 21:274-301. 2001 [ Links ]
8. Giachelli C. The emerging role of phosphate in vascular calcification. Kidney Int (advance online publication) doi:10.1038/ki.2008.644. 2009 [ Links ]
9. Ibels L, Alfrey A, Huffer W, Craswell P, Anderson J, Weil R. Arterial calcification and pathology in uremic patients undergoing dialysis. Am J Med 66:790-796. 1979 [ Links ]
10. Ejerblad S. The aortic content of glycosaminoglycans and hydroxyproline in experimental uraemia. Scand J Urol Nephrol 13: 171-176. 1979 11. [ Links ] Abedin M, Tintut Y, Demer L. Vascular calcification: mechanisms and clinical ramifications. Arterioscl Thromb Vasc Biol 24:1161-1170. 2004 [ Links ]
12. Jono S, Mckee M, Murry C, Shioi A, Nishizawa Y, Mori K, Morii H, Giachelli C. Phosphate regulation of vascular smooth muscle cell calcification. Circ Res 87:e10–e17. 2000 [ Links ]
13. Tintut Y, Alfonso Z, Saini T, Radcliff K, Watson K, Boström K, Demer L. Multilineage Potential of Cells from the Artery Wall. Circulation 108:2505-2510. 2003 [ Links ]
14. Wang N, Yang J, Yu X, Hu J, Xing C, Ju X, Shen X, Qian J, Zhao X, Wang X. Radial artery calcification in end-stage renal disease patients is associated with deposition of osteopontin and diminished expression of alpha-smooth muscle actin. Nephrology (Carlton) 13:367-375. 2008 [ Links ]
15. Block G, Port F. Re-evaluation of risk associated with hyperphosphatemia and hyperparathyroidism in dyalisis patients. Recommendations for a change in management. Am J Kidney Dis 35:1226-1237. 2000 [ Links ]
16. Ganesh S, Stack A, Levin N, Shearon T, Port F. Association of Elevated Serum PO4, Ca X PO4 Product, and Parathyroid Hormone with Cardiac Mortality Risk in Chronic Hemodialysis Patients. J Am Soc Nephrol 12: 2131–2138.2001 17. [ Links ] Rodriguez-Benot A, Martin-Malo A, Alvarez-Lara A,Rodriguez M, Aljama P. Mild hyperphosphatemia and mortality in hemodialysis patients. Am J Kidney Dis 46(1):68- 77. 2005 [ Links ]
18. Sakata N, Noma A, Yamatomo Y, Okamoto K, Meng J, Takebayashi S, Nagai R, Horiuchi S. Modification of elastin by pentosidine is associated with the calcification of aortic media in patients with end-stage renal disease. Nephrol Dial Transplant 18: 1601–1609. 2003 [ Links ]
19. Spronk H, Soute B, Schurgers L, Cleutjens J, Thijssen H, De Mey J, Vermeer C. Matrix Gla Protein Accumulates at the Border of Regions of Calcification and Normal Tissue in the Media of the Arterial Vessel Wall. Biochem and Bio Res Com 289: 485–490. 2001 [ Links ]
20. Wilcox J, Scott N. Potential role of the adventitia in arteritis and atherosclerosis. Int J of Card 54: 821-835. 1996 [ Links ]
21. Lomashvili K, Cobbs S, Hennigar R, Hardcastle K, O´Neill W. Phosphate induced vascular calcification: role of pyrophosphate and osteopontin. J Am Soc Nephrol 15:1392–1401. 2004 [ Links ]
22. Chen N, O´Neill K, Duan D, Moe S. Phosphorus and uremic serum upregulate osteopontin expression in vascular smooth muscle cells. Kidney Int 62:1724 –1731. 2002 [ Links ]
23. Giachelli C, Speer M, Li X, Rajachar R, Yang H. Regulation of vascular calcification: roles of phosphate and osteopontin. Circ Res 96:717-722. 2005 [ Links ]
24. Lomashvili K, Garg P, O´Neill W. Chemical and hormonal determinants of vascular calcification in vitro. Kidney Int 69:1464- 1470. 2006 [ Links ]
25. Son B, Akishita M, Iijima K, Eto M, Ouchi Y. Mechanism of Piinduced vascular calcification-regulation of Growth Arrest Specific Gene 6 (GASG6)-mediated survival pathway. J Atheroscler Thromb 15:63-68. 2008 [ Links ]
26. Steitz S, Speer M, Curinga G, Yang H, Haynes P, Aebersold R, Schinke T, Karsenty G, Giachelli C. Smooth muscle cell phenotypic transition associated with calcification: upregulation of Cbfa1 and downregulation of smooth muscle lineage markers. Circ Res 89:1147- 1154. 2001 [ Links ]
*Dirección para correspondencia: Dra. Adriana Y. González Castro. Facultad de Ciencias Veterinarias, Universidad Nacional de Asunción, Casilla de Correo N° 1061 - Ruta Mcal. Estigarribia km 10,5 - Campus Universitario - San Lorenzo - Paraguay
E-Mail:agonzalez@vet.una.py