Introducción
Las bacterias ácido láctica (BAL) constituyen un grupo heterogéneo de bacterias gram positivas, anaerobia, no esporuladoras, que pueden ser cocos o bacilos y que producen ácido láctico como principal producto durante el proceso de fermentación y poseen un gran potencial biotecnológico en la industria de alimentos (Alvarez-Sieiro et al., 2016; Sabatini, 2010). Como cualquier BAL que participe en un proceso de fermentación puede producir una variedad de compuestos inhibidores, el potencial antimicrobiano de estas bacterias está dado por la acción combinada de sus metabolitos en bacterias indeseadas (Salomskiene et al., 2019). Sin embargo, recientemente se les está dando una atención especial a las bacteriocinas, por sus posibles aplicaciones para la conservación de alimentos (Devlieghere. et al., 2004; Field et al., 2018; Gálvez et al., 2007, 2010; Woraprayote et al., 2016).
Las bacteriocinas son péptidos antimicrobianos sintetizados ribosomalmente que son activos contra otras bacterias, pueden o no poseer modificaciones postraduccionales y son secretadas al medio extra-celular (Alvarez-Sieiro et al., 2016; Cotter et al., 2005; Field et al., 2018). Sus principales ventajas en comparación con otros compuestos antimicrobianos de naturaleza peptídica son su alta tolerancia al estrés térmico, su capacidad de permanecer activas dentro de un amplio rango de pH y su efectividad incluso a bajas concentraciones (Woraprayote et al., 2016).
Si bien otras bacterias pueden producir bacteriocinas, las bacteriocinas producidas por BAL poseen la ventaja de que la mayoría de los cultivos iniciales de BAL para alimentos son considerados como seguros por la Administración de Alimentos y Medicamentos (FDA) de Estados Unidos, por lo que las bacteriocinas provenientes de estas también poseen este estatus (Alvarez-Sieiro et al.,2016; Field et al., 2018). Además, las bacteriocinas provenientes de BAL son bastante potentes contra patógenos de alimentos y microorganismos que causan el deterioro de los alimentos sin alterar las cualidades sensoriales de los mismos y no presentan toxicidad para células eucariotas (Field et al., 2018). El fin de este trabajo es identificar cepas de BAL aisladas de productos lácteos que posean potencial antimicrobiano contra L. monocytogenes, considerado como la bacteria patógena gram positiva de mayor preocupación debido a su capacidad de desarrollarse en una gran variedad de alimentos y condiciones ambientales (Gálvez et al., 2010).
Materiales y Métodos
Obtención de cepas
Se utilizaron 4 cepas previamente aisladas de BAL, pertenecientes al cepario del Departamento de Biotecnología de la FACEN-UNA las cuales fueron identificadas mediante MALDI-TOF y métodos moleculares para determinar el género y especie (Dušková et al., 2012) de las que se obtuvo las siguientes bacterias: Enterococcus faecium (M6A), Lactobacillus fermentum (M16A) y Lactobacillus plantarum (M18 y M21). Y para el patógeno se utilizó Listeria monocytogenes, donado por el Dr. Esteban Riera (Laboratorios Riera, Asunción, PY).
Prueba de inhibición en medio líquido contra
Listeria monocytogenes
Preparación de sobrenadantes y patógeno
Se cultivaron las cepas de BAL en medio MRSB por 24 h a 37 °C y L. monocytogenes en medio LB por 24 hs a 37 °C, ambas en una incubadora de CO2 serie 3 water-jacketed (Thermo Scientific™), con una atmósfera de CO2 de 0,1%. Se centrifugó el cultivo de L. monocytogenes a 4500 rpm por 10 min a 10 °C en una centrífuga refrigerada TGL- 16M (Boyn™), se desechó el sobrenadante y se resuspendió en PBS (1X). Se midió la absorbancia en el espectrofotómetro a 600 nm buscando llegar a una absorbancia equivalente a 1,5×107 UFC/mL. Luego, se hicieron dos diluciones seriadas 1:10. Por otra parte, se centrifugaron los cultivos de BAL a 6000 g (7600 rpm) por 20 minutos a 4 °C y se recuperaron los sobrenadantes. Luego se filtraron los sobrenadante con filtros de 0.22 μm (Sartorius) y se neutralizaron con hidróxido de sodio hasta un pH de 6~7 (Gellert et al., 1999; Zimina et al., 2016). Finalmente, se incubó en una placa multipocillo (×96) a 37 °C por 24 h en un Multiskan™ FC Microplate Photometer (Thermo Scientific™), acorde a los tratamientos presentados en la Tabla 1. Se midió la densidad óptica a 620 nm cada 30 min por espectrofotometría durante la incubación (Gellert et al., 1999; Zimina et al., 2016). Cada tratamiento se realizó por cuadruplicado; como control positivo se utilizó una solución estéril de nisina 0,25% y como controles negativos se utilizaron: medio LB y agua estéril (Control 1) y medio MRSB y medio LB (Control 2), ambas inoculadas con 15 μL de L. monocytogenes (1,5×105 UFC/mL).
Cálculo del porcentaje de inhibición
Para el cálculo del porcentaje de inhibición se procedió a utilizar la absorbancia a las 24 hs y se utilizó la siguiente fórmula:
Abs ? Abs
Donde: I = t c ?100
Absc
I = Porcentaje de inhibición.
Abst = Absorbancia máxima del tratamiento. Absc = Absorbancia máxima del control.
Resultados y discusión
La importancia de las pruebas de enfrentamiento radica en tener resultados sobre actividad antimicrobiana de las BAL aisladas frente a patógenos comúnmente encontrados en los alimentos y que producen su deterioro o enfermedades transmitidas por los alimentos; para los cuales deben actuar como bacteriostáticos o bactericidas.
Tabla 1. Tratamientos utilizados en la prueba de inhibición en medio líquido.
| Tratamientos | Componentes (240 μL) | |
| 1 | Medio estéril | 200 μL de medio LB + 40 μL de agua estéril |
| 2 | Control 1 | 185 μL de agua estéril + 40 μL de medio LB + 15 μL de L. monocytogenes (1,5×105 UFC/mL) |
| 3 | Control 2 | 185 μL de medio MRSB + 40 μL de medio LB + 15 μL de L. monocytogenes (1,5×105 UFC/mL) |
| 4 | Medio + Agua | 185 μL de medio MRSB + 40 μL de medio LB + 15 μL de agua estéril |
| 5 | Blanco | 40 μL de medio LB + 185 μL de sobrenadante + 15 μL de agua estéril |
| 6 | Ensayos | 40 μL de medio LB + 185 μL de sobrenadante + 15 μL de L. monocytogenes (1,5×105 UFC/mL) |
| 7 | Control + | 40 μL de medio LB + 185 μL de nisina + 15 μL de L. monocytogenes (1,5×105 UFC/mL) |
Porcentajes de inhibición
En la Tabla 2 se observan los porcentajes de inhibición obtenidos para cada cepa.
Enterococcus faecium
En la Fig. 1 se observa el crecimiento de L. monocytogenes frente al sobrenadante de E. faecium (M6A) en términos de tiempo (h) vs. absorbancia. Este organismo presentó un bajo valor de inhibición, 10,27%, siendo este el más bajo de todo el ensayo.
Algunas bacterias del género Enterococcus, incluyendo E. faecium, producen bacteriocinas denominadas enterocinas, las cuales han demostrado poseer actividades contra Listeria monocytogenes (Aymerich et al., 1996; Casaus et al., 1997; Cintas et al., 1997; Cintas et al., 1998; Khan et al., 2010). Por lo que es probable que estas cepas no sean productoras de bacteriocinas y, por lo tanto, no inhiban el crecimiento de L. monocytogenes.
Tabla 2 Porcentajes de inhibición producidos por cada cepa
| Muestra | Organismo | Porcentaje de Inhibición |
| M6A | E. faecium | -11,01% |
| M16A | L. fermentum | -56,11% |
| M18 | L. plantarum | -30,88% |
| M21 | L. plantarum | -19,90% |
| Control | L. plantarum ATCC 8014 | -78,12% |
| Nisina | N/A | -93,26% |
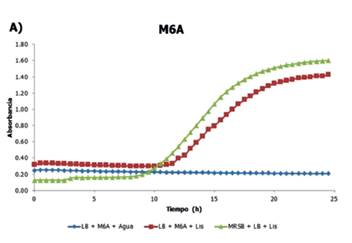
Figura 1 Cinética de crecimiento de L. monocytogenes frente al sobrenadante de E. faecium. Azul: blanco, Rojo: tratamiento y Verde: control negativo.
Lactobacillus fermentum
En la Fig. 2 se observa el crecimiento de L. monocytogenes frente al sobrenadante de L. fermentum (M16A) en términos de tiempo (h) vs. absorbancia. Nuestros resultados muestran que esta cepa produjo una inhibición superior al 50%. El valor medido fue de 56,11%. Por lo que esta cepa estudiada de L. fermentum podría ser una cepa productora de bacteriocinas con base en que posee el mayor porcentaje de inhibición del ensayo.
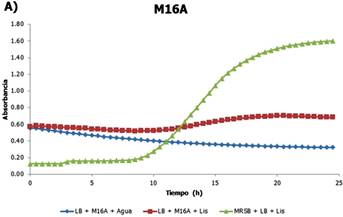
Figura 2 Cinética de crecimiento de L. monocytogenes frente al sobrenadante de L. fermentum. Azul: blanco, Rojo: tratamiento y Verde: control negativo.
La producción de bacteriocinas por L. fermentum ha sido registrada previamente, siendo estas efectivas principalmente contra bacterias gram- positivas, incluyendo L. monocytogenes(Pascualet al., 2008; Sabia et al., 2014; Yan & Lee, 1997).
Lactobacillus plantarum
En la Fig. 3 se observa el crecimiento de L. monocytogenes frente a los sobrenadante de las cepas M18 y M21 de L. plantarum en términos de tiempo (h) vs. absorbancia.
Probablemente, L. plantarum sea la especie más estudiada y mejor caracterizada para la producción de bacteriocinas. A pesar de esto, estas cepas presentaron rendimientos relativamente bajos, con porcentajes de inhibición de 30,88% (M18) y 19,90% (M21). Sería interesante realizar análisis moleculares para determinar la cepa a la que corresponde cada una y analizar la diferencia de resultados entre organismos de una misma especie. Se bien se ha reportado la producción de bacteriocinas de esta especie a partir de varias matrices de comida y se ha evaluado su actividad contra un gran número de microorganismos (Borrero et al., 2018; da Silva Sabo et al., 2014; Fernandes et al., 2017; Todorov et al., 2016; Wen et al., 2016; Zacharof & Lovitt, 2012; Zhang et al., 2018), estas cepas no presentan una gran actividad contra L. monocytogenes.
Controles positivos
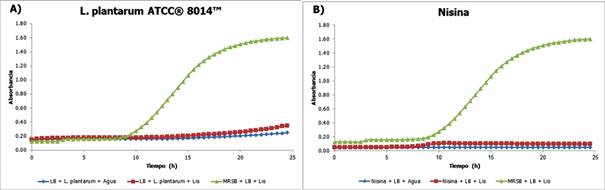
En la Fig. 4 se observa el crecimiento de L. monocytogenes frente a los sobrenadante de la cepa control L. plantarum ATCC® 8014™ y nisina, una bacteriocina bien estudiada y caracterizada, en términos de tiempo (h) vs. absorbancia.
Los resultados de los controles fueron acordes a los esperados, presentando un alto porcentaje de inhibición, 78,12% (Lactobacillus plantarum ATCC® 8014™) y 93,26% (nisina).
Se utilizó Lactobacillus plantarum ATCC® 8014™ como control, pues es una cepa en la que se ha comprobado la producción de bacteriocinas (Lash et al., 2005; Ming et al., 2015), con 78,12% de inhibición. Y la nisina, la única bacteriocina aprobada por la FDA, cuya efectividad contra Listeria ha sido comprobada anteriormente (Delves-Broughton et al., 1996), coincidiendo con nuestros resultados donde la nisina produjo una inhibición de > 90%.
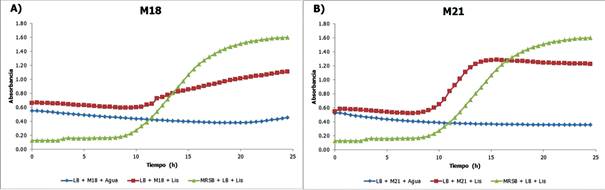
Figura 3 Cinética de crecimiento de L. monocytogenes frente a sobrenadantes de L. plantarum. Azul: blanco, Rojo: tratamiento y Verde: control negativo.
Conclusión
Se observó inhibición de crecimiento para todas los cepas aisladas a partir de leche cruda y queso Paraguay, demostrando que poseen potencial antimicrobiano contra L. monocytogenes. La cepa de E. faecium tuvo un resultado de apenas del 10%, mientras que ambas cepas de L. plantarum produjeron inhibiciones entre 20% y 30%. La cepa que presentó los mejores resultados fue L. fermentum, con porcentajes de inhibición promedio de 56,11%. No obstante, estos porcentajes fueron inferiores a las observadas en los controles positivos de L. plantarum ATCC® 8014™ (~80%) y nisina (>95%). Nuestro estudio demostró que E. faecium no posee grandes cualidades de inhibición. Mientras que las cepas con mayor actividad de inhibición corresponden a L. fermentum, por lo que es necesario estudiar estas cepas a mayor profundidad para evaluar la producción de compuestos antimicrobianos así como su capacidad como productoras de bacteriocinas.
En casi todos los estudios previos se mencionan que las BAL tienen varios compuestos con pro- piedades inhibitorias frente a bacterias patógenas y deteriorantes de alimentos. Por lo que a partir de este estudio donde se aislaron bacterias acidolácticas locales, es crucial proseguir con los ensayos de inhibición, determinando las fuentes de actividad inhibitoria como ácidos orgánicos, peróxidos de hidrógeno y bacteriófagos.
Contribución de los autores
Todos los autores contribuyeron de manera equitativa en la elaboración de este artículo.
Conflictos de interés
Los autores declaran no tener conflictos de interés
Financiamiento
El trabajo se realizó en el marco del proyecto “Evaluación de la producción de bacteriocinas a partir de Lactobacilos aisladas de productos lácteos (PINV15-681)” financiado por el CONACYT a través de su programa PROCIENCIA.












 uBio
uBio