Introducción
La resistencia bacteriana representa una preocupación significativa para nuestra salud. Su origen se atribuye tanto a nuestro uso de antimicrobianos en medicina humana como en medicina veterinaria y agricultura (Martínez, 2008; O'Neill et al., 2016). En particular, el uso indiscriminado de antibióticos en la cría intensiva de aves ha llevado al aumento de bacterias resistentes, lo que plantea un riesgo para nosotros como consumidores a través de alimentos contaminados y el contacto directo (Van Boeckel et al., 2015; Marshall & Levy, 2011). Estas bacterias resistentes pueden limitar nuestras opciones de tratamiento para enfermedades, ya que presentan resistencia a una amplia gama de antibióticos (Ventola, 2015).
La industria farmacéutica ofrece una variedad de medicamentos para tratar enfermedades infecciosas en animales destinados a nuestro consumo (Heuer et al., 2009; Hermans et al., 2011). El uso de antibióticos, ya sea en combinación o de manera individual, desempeña un papel en la selección y propagación de resistencia en las poblaciones bacterianas presentes en estos animales (Zhang et al., 2013; Zhu et al., 2017; Johnson et al., 2019).
Entre los numerosos antibióticos utilizados, la Norfloxacina (Fig. 1), perteneciente a la clase de las fluoroquinolonas, es ampliamente empleada en los seres humanos para tratar infecciones bacterianas en el tracto urinario, así como infecciones gastrointestinales y de las vías respiratorias. Es un polvo cristalino de color blanco a amarillo claro con un peso molecular de 319,331 g/mol, soluble en agua y ligeramente soluble en solventes orgánicos como etanol y cloroformo. Se mantiene estable en condiciones de almacenamiento, pero debe protegerse de la luz debido a su fotosensibilidad y de la humedad para mantener su efectividad.
En este contexto, nuestro estudio se enfoca en investigar el contenido de Norfloxacina en la carne de pollo comercializada en los supermercados de la Gran Asunción. Se ha utilizado las técnicas de cromatografía de líquido de alta resolución (HPLC) y extracción sólido-líquido para extraer el analito de la matriz. Al abordar este tema, esperamos contribuir al conocimiento sobre la presencia de Norfloxacina en este alimento que consumimos y evaluar posibles implicaciones para nuestra salud pública.
Mediante el análisis de la Norfloxacina en muestras de carne de pollo, obtenemos información relevante sobre el uso de antibióticos en la producción avícola en nuestro país y su potencial impacto en la resistencia bacteriana. Estos resultados proporcionan fundamentos científicos para adoptar medidas reguladoras y políticas que garanticen nuestra seguridad alimentaria y la eficacia de los tratamientos médicos en el contexto de nuestra salud (Varela et al., 2019).
Nuestro estudio tiene como objetivo investigar la presencia de este antibiótico en las carnes de pollo comercializadas en los supermercados de la Gran Asunción. Mediante el uso de técnicas analíticas avanzadas, ofrecemos información valiosa que contribuya a la comprensión de esta problemática y permita tomar decisiones informadas por parte de las autoridades de salud pública. De esta manera, se podrá mitigar los riesgos asociados a la resistencia bacteriana en la cadena alimentaria y en nuestra salud.
Materiales y métodos
Productos químicos y reactivos
Para nuestro estudio de investigación, hemos utilizados reactivos de grado analítico. El patrón de Norfloxacina fue suministrado por Sigma-Aldrich (St. Louis, MO). Se ha preparado una solución madre del analito una sola vez, a una concentración de 1000 µg/mL, y fue almacenado a 4 °C en frascos de vidrio oscuro. Utilizamos acetonitrilo de grado cromatográfico (Merck, Darmstadt, Alemania) y ácido fosfórico para la preparación de la fase móvil. El agua destilada se obtuvo en un equipo (QUIMIS, Brasil) y posteriormente purificada en un equipo Barnstead ™ MicroPure ™.
Instrumentación y Software
Para la extracción de la Norfloxacina de la matriz estudiada, se empleó la técnica de extracción sólido- líquido utilizando una variedad de materiales de vidriería como vasos de precipitados, embudos y varilla de vidrio, entre otros. Además, se utilizaron equipos especializados como un vortex marca LW Scientific, un baño de ultrasonido de la marca Sonorex Suoer RK 106 S y una centrífuga de mesa de la marca Presvac DCS-16 RV. Para la detección y cuantificación del analito, se utilizó un cromatógrafo líquido de alta resolución HPLC-FDL. La detección se realizó a una longitud de onda de 275 nm, y la separación cromatográfica se logró mediante el uso de una columna Zorbax Eclipse XDB-C18 (250 mm x 4,6 mm; 5 µm).
El instrumento utilizado fue controlado mediante el software LCsolution.exe (versión 1.0) así como la detección e integración de los picos. El peso de los estándares, reactivos y muestras se realizó utilizando una balanza analítica Radwag (modelo 310.R2) fabricada en Polonia (UE). Para el análisis estadístico de los datos, se utilizó el software Statgraphics Plus versión 5.0 (Manugistics, Rockville, MD, EE. UU., 2000). Además, para la elaboración y organización de los resultados, se utilizaron los paquetes de Microsoft® Office: Word®, Excel® y PowerPoint® 2010. El uso de estos materiales y equipos garantizó la precisión y reproducibilidad en la extracción, detección y cuantificación de la Norfloxacina en la matriz de estudio, lo cual es crucial para obtener resultados confiables y significativos en este contexto científico.
Optimización de las condiciones cromatográficas
HPLC
Inicialmente, se procedió a la optimización de las condiciones cromatográficas del sistema HPLC. Para lograr esto, se utilizó una solución acuosa que contenía Norfloxacina a una concentración de 75 µg/mL como muestra de estudio. Dado que el analito presenta características específicas, se decidió emplear la cromatografía en fase reversa, en la cual la fase estacionaria es menos polar que la fase móvil. En base en las propiedades fisicoquímicas de la Norfloxacina, se seleccionó una columna con relleno de tipo C18 Zorbax Eclipse XDB de dimensiones 250 mm x 4.6 mm y un tamaño de partícula de 5 µm.
Se realizaron investigaciones exhaustivas sobre las principales variables que afectan la separación cromatográfica y la intensidad de la señal. Se evaluaron diversas combinaciones de fases móviles en función de la naturaleza del analito, tales como diferentes proporciones de Acetonitrilo y Agua, como (30:70), (20:80) y (15:85). Además, se agregó 1 mL de H3PO4 al agua antes de la mezcla con el acetonitrilo para mejorar las características de la fase móvil. Adicionalmente, se estudió el impacto del caudal, la temperatura de la columna y los volúmenes de inyección en el proceso de separación cromatográfica. Se probaron velocidades de flujo en el rango de 0,5 a 1,5 mL/min, temperaturas de columna que variaron entre 30 °C y 50 °C, y volúmenes de inyección que oscilaron entre 5 y 30 µL. Mediante esta exhaustiva exploración de las condiciones cromatográficas, se logró optimizar el método para la determinación precisa de Norfloxacina. Estas etapas de optimización son cruciales para obtener resultados confiables y reproducibles en el análisis cromatográfico de este compuesto en las muestras analizadas.
Toma de muestras
La técnica de muestreo utilizada fue el no probabilística y del tipo conveniencia. Las muestras de pollos fueron obtenidas de supermercados ubicados en el área metropolitana de Asunción. Se seleccionaron tres marcas comerciales diferentes, así como dos muestras de origen casero: una adquirida en el mercado 4 de Asunción y otra criada en el interior del país. Durante la selección de las muestras, se tuvieron en cuenta diversos factores, como la disponibilidad de los productos en los establecimientos y la representatividad de las marcas en el mercado local. Se verificó que las muestras de pollo estuvieran en buen estado visual, sin signos evidentes de deterioro o contaminación. Una vez recolectadas las muestras, estas fueron trasladadas al laboratorio de manera inmediata y se les asignó un código único para su identificación. Posteriormente, se almacenaron en refrigeración a una temperatura constante de -20°C, con el fin de mantener su integridad y prevenir la proliferación microbiana hasta el momento de su análisis. Es importante destacar que se siguieron estrictas medidas de higiene y bioseguridad durante todo el proceso de muestreo, manipulación y almacenamiento de las muestras, a fin de evitar cualquier tipo de contaminación cruzada y asegurar la validez de los resultados obtenidos.
Preparación de las muestras patrones
Se preparó una disolución patrón de Norfloxacina mediante la disolución de 100 mg de la sustancia en un matraz de 100 mL utilizando una fase móvil compuesta por ACN (acetonitrilo), agua y 1 mL de H3PO4 en una proporción de 15:85. La disolución llevó a cabo en condiciones cuidadosamente controladas de temperatura y agitación para garantizar la homogeneidad de la mezcla. Como resultado, se obtuvo una concentración final de 1000 µg/mL. A partir de la mencionada disolución patrón, se prepararon seis niveles adicionales de concentración para construir una curva de calibrado precisa y confiable.
Las concentraciones seleccionadas fueron de 5, 15, 25, 50, 75 y 100 µg/mL. Para cada nivel de concentración, se tomaron volúmenes adecuados de la disolución patrón y se diluyeron cuidadosamente con la correspondiente fase móvil para obtener las concentraciones deseadas. Cabe destacar que se siguieron estrictos procedimientos de manipulación y mezcla para asegurar la precisión y la reproducibilidad en la preparación de las soluciones de concentración conocida. Además, se realizaron duplicados de cada dilución para evaluar la consistencia del método. La preparación de estas soluciones de concentración conocida es de vital importancia para la construcción de una curva de calibrado confiable, que posteriormente será utilizada para la cuantificación precisa de la Norfloxacina en las muestras analizadas.
Tratamiento de las muestras
Se pesaron 5 gramos de muestra de las diferentes marcas de pollos, incluyendo los pollos caseros obtenidos del Mercado 4 y del interior del país. Las muestras se colocaron en vasos de precipitado y se les añadió una disolución de 5 mL de la fase móvil utilizada en el método cromatográfico, compuesta por ACN (acetonitrilo), agua y 1 mL de H3PO4 en una proporción de (15:85). A continuación, se llevó a cabo la extracción de las muestras en un baño de ultrasonido durante 30 minutos, con el objetivo de obtener los componentes deseados. Una vez finalizada la extracción, los extractos se centrifugaron durante 15 minutos a una velocidad de 3220 g. El sobrenadante resultante se filtró utilizando filtros minisart de 0,45 μm y se transfirió a viales de vidrio de HPLC para su posterior análisis cromatográfico. Este procedimiento permitió obtener los extractos de las muestras listos para ser sometidos a la lectura cromatográfica, con el fin de cuantificar y analizar la presencia de Norfloxacina en las muestras de pollo.
Validación del método analítico
En este trabajo de investigación, se realizó la validación del método analítico propuesto siguiendo las directrices establecidas en la "Guía de validación para métodos bioanalíticos" proporcionada por la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés). Se evaluaron diversos parámetros de validación utilizando la curva de calibración, incluyendo la linealidad (Analytical Methods Committee, 1994), los límites de detección y cuantificación, el rango dinámico lineal, la sensibilidad analítica y la exactitud del método expresada en términos de precisión y veracidad (USP 29, 2005).
Los requisitos para la validación del método analítico se establecieron de la siguiente manera: a) Linealidad: se definió que el coeficiente de determinación (R2) debía ser igual o superior a 0,999, y la desviación residual máxima debía ser inferior al 25%. b) Precisión: se determinó la precisión como la desviación estándar relativa DER (precisión entre días), la cual debía ser ≤ 30%. c) Veracidad: se estableció que la veracidad, expresada como recuperación media, debía estar en el rango del 70% al 120%. d) Límite de cuantificación (LC): se estableció que el LC debía cumplir con los requisitos de precisión y veracidad mencionados anteriormente. Estos requisitos se alinean con la Decisión 2002/657/CE de la Comisión de la Comunidad Europea (Benítez-Villalba et al., 2013).
Para evaluar la calidad y confiabilidad del método analítico, se determinaron los parámetros fundamentales que garantizan la precisión y exactitud en la determinación del analito en la matriz estudiada. Estos parámetros son: linealidad, límite de detección (LD), límite de cuantificación (LC), rango dinámico lineal (RDL), sensibilidad analítica, exactitud y precisión del analito.
La calidad, fiabilidad y consistencia de un método analítico validado se evalúan mediante diferentes parámetros, como la sensibilidad, linealidad, límite de detección (LD), límite de cuantificación (LC), exactitud y precisión del analito en estudio (González et al., 1996). Para lograrlo, se prepararon 6 disoluciones estándar a partir de una solución madre con una concentración de 1000 µg/mL, obteniendo así disoluciones con concentraciones de 5, 15, 25, 50, 75 y 100 µg/ mL, utilizando la fase móvil como disolvente, y se detalló su preparación en el apartado de Preparación de las muestras patrones.
Cada uno de estos parámetros de validación se define de la siguiente manera: la linealidad se refiere a la capacidad de un método analítico para obtener resultados proporcionales a la concentración del analito o analitos en una muestra dentro de un rango especifico; el límite de detección (LD) corresponde a la cantidad más baja del analito en una muestra que puede ser detectada mediante una única medición, con un nivel de confianza determinado, aunque no necesariamente cuantificada con un valor exacto; el límite de cuantificación (LC) es la cantidad más baja de un analito en una muestra que puede ser determinada cuantitativamente con una precisión aceptable; el Rango Dinámico Lineal (RDL) se define como el intervalo de concentraciones que abarca desde el límite de cuantificación del método hasta el límite superior del rango de concentraciones al que se ha aplicado el método analítico (IUPAC, 1978); la sensibilidad analítica de un método mide la relación entre la señal instrumental y la concentración del analito y se expresa mediante la pendiente de la curva de calibración (González et al., 1996); la exactitud se refiere a la proxi midad del acuerdo entre el valor aceptado como verdadero o de referencia y el valor obtenido; y la precisión se refiere a la proximidad del acuerdo entre una serie de mediciones obtenidas de múltiples muestras de una muestra homogénea bajo las condiciones establecidas.
Los parámetros de validación se determinaron de la siguiente manera: Linealidad: se realizó un análisis utilizando seis concentraciones estándar en el rango de 5-100 µg/mL. Se construyó una curva de calibración trazando la señal generada por el analito en función de su concentración. La regresión lineal se calculó utilizando el método de los mínimos cuadrados. Se obtuvieron el coeficiente de correlación y el intercepto para la Norfloxacina.
Límite de detección (LD): se determinó mediante la fórmula LD = 3,3 x So, donde "So" representa la desviación estándar de la regresión, "n" es el número de puntos de calibración, y "b" es la pendiente de la curva.
Límite de cuantificación (LC): se calculó utilizando la fórmula LC = 10 x So, donde "So" se refiere a la capacidad de un método analítico determina como So= S y/x b n−2 n−1 S( y x ) desviación estándar de la regresión, b = pendiente, n = puntos de calibración (Benítez-Villalba et al., 2018).
Rango Dinámico Lineal (RDL): se estableció como el intervalo de concentraciones que abarca desde el límite de cuantificación del método hasta el límite superior del rango de concentraciones en el cual se aplicó el método.
cuantificación (LC) es la cantidad más baja de un Sensibilidad analítica (SAnalítica): se evaluó la analito en una muestra que puede ser determinada cuantitativamente con una precisión aceptable; el Rango Dinámico Lineal (RDL) se define como el intervalo de concentraciones que abarca desde el límite de cuantificación del método hasta el límite superior del rango de concentraciones al que se ha aplicado el método analítico (IUPAC, 1978); la sensibilidad analítica de un método mide la relación entre la señal instrumental y la concentración del analito y se expresa mediante la pendiente de la curva de calibración (González et al., 1996); la exactitud se refiere a la proximidad del acuerdo entre el valor aceptado como verdadero o de referencia y el valor obtenido; y la precisión se refiere a la proximidad del acuerdo entre una serie de mediciones obtenidas de múltiples muestras de una muestra homogénea bajo las condiciones establecidas.
Los parámetros de validación se determinaron relación entre la señal instrumental y la concentración del analito, expresada mediante la pendiente de la recta de calibración (González et al., 1996).
Exactitud del Método, Precisión y Veracidad: Para evaluar la exactitud del método en términos de veracidad, se realizó un estudio de recuperación utilizando tres niveles de concentración (15, 50, 75 µg/mL). Las muestras se analizaron siguiendo el procedimiento descrito en el artículo, y la concentración del analito se determinó mediante interpolación en la curva de calibración dentro del rango dinámico lineal.
La recuperación se calculó utilizando la fórmula: recuperación (%) = S1 / (S2 + S3) × 100, donde S1 es la cantidad encontrada (µg/mL) en la muestra enriquecida, S2 es la cantidad presente originalmente en la muestra no enriquecida, y S3 es la cantidad (µg/mL) de analito agregado a la muestra.
Para evaluar la exactitud del método en términos de precisión, se investigó la repetibilidad (precisión "intra-día") y la reproducibilidad (precisión "inter-día"). Se realizaron múltiples réplicas de los análisis llevados a cabo en el estudio de veracidad, tanto en un mismo día como durante tres días consecutivos. Cada muestra dopada o enriquecida se extrajo y analizó por triplicado en el mismo día para evaluar la variabilidad "intra-día".
Resultados y discusión
Condiciones cromatográficas HPLC
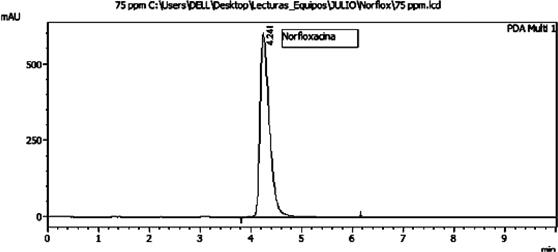
Se realizaron optimizaciones de las condiciones cromatográficas utilizando un cromatógrafo de líquidos de alta resolución HPLC. La fase móvil seleccionada fue una proporción de (15:85) Acetonitrilo: agua que mostró resultados prometedores. Se añadió 1 mL de H3PO4 al agua antes de su mezcla con el acetonitrilo, lo cual mejoró notablemente las características de la fase móvil y resultó en una señal analítica de alta calidad. La velocidad de flujo óptima se determinó en 2 mL/min, lo cual tuvo un impacto significativo en la resolución y la forma del pico cromatográfico, así como en la intensidad de respuesta y el tiempo de retención. Se encontró que una temperatura de columna de 40°C proporcionó una excelente forma del pico. En cuanto al volumen de inyección, se determinó que el valor óptimo era de 10 µL. La detección se llevó a cabo a una longitud de onda de 275 nm.
Tabla 1. Valores óptimos de las condiciones cromatográficas
| Fase estacionaria | Zorbax (C18) 250 mm x 4.5 mm x 5 µm |
| Fase móvil | ACN (acetonitrilo), agua y 1 mL de H3PO4 en una proporción de (15:85) |
| Modalidad | Isocrática |
| Flujo | 2 mL/min |
| Volumen de inyección | 10 µL |
| Temperatura de la columna | 40 oC |
| Detección | 275 nm |
Los resultados obtenidos de estas condiciones óptimas se resumen en la Tabla 1, la cual muestra los valores relevantes. Además, se adjunta en la Fig. 2 el cromatograma obtenido a partir de estas condiciones óptimas, ilustrando de manera visual los resultados obtenidos. Estas optimizaciones permitieron obtener resultados satisfactorios en el análisis cromatográfico, asegurando una separación adecuada de los componentes de interés y una detección precisa. Los valores óptimos obtenidos en este estudio proporcionan una base sólida para futuras investigaciones y aplicaciones prácticas en el ámbito científico y analítico
Validación del método analítico
En este estudio, se llevaron a cabo la validación y cuantificación de Norfloxacina en muestras de carne de pollo obtenidas de supermercados ubicados en la Gran Asunción. La extracción del analito se realizó utilizando la técnica de extracción sólido-líquido mediante el uso de un baño de ultrasonido. Posteriormente, se procedió a validar el método analítico y a detectar y cuantificar la presencia de Norfloxacina utilizando la técnica de cromatografía de líquido de alta resolución (HPLC). En la Tabla 2 se presentan los resultados obtenidos para los parámetros de calibración de la técnica analítica utilizada en este estudio. Estos parámetros incluyen el coeficiente de correlación (% R2), que indica la calidad de ajuste de la curva de calibración, el número de puntos de calibración (n), la pendiente de la curva de calibración (b) y su desviación estándar (Sb), el intercepto de la curva de calibración (a) y su desviación estándar (Sa), la desviación estándar de la regresión (Sy/x), el valor P de prueba de falta de ajuste (% plof), el límite de detección (LD), el límite de cuantificación (LC) y el rango dinámico lineal (RDL). La validación del método analítico se realizó siguiendo las recomendaciones propuestas por (Benítez Villalba et al., 2013; Mandel et al., 1954). Estos parámetros de calibración son fundamentales para asegurar la precisión y la exactitud del método analítico utilizado en la determinación de Norfloxacina en las muestras de carne de pollo.
Tabla 2. Parámetros de calibración en la técnicas analítica cromatográfico HPLC
| Linealidad | |
| Ecuación de la recta | Y=110363*X + 545230 |
| (%) R2 | 99,4 |
| n | 15 |
| b(µg/mL) | 110363 |
| Sb | 4274,02 |
| A | 545230 |
| Sa | 239091 |
| Sy/x | 1705,55 |
| %plof | 0,5722 |
| LD(µg/mL) | 0,9526 |
| LC(µg/mL) | 2,8867 |
| Sensibilidad | 0,0421 |
| RDL(µg/mL) | 2,88-100 |
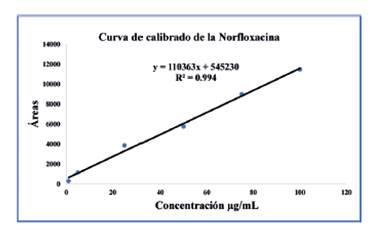
Linealidad: En esta validación del método analítico, se evaluaron dos aspectos fundamentales, el Límite de Detección (LD) y el Límite de Cuantificación (LC). Los resultados obtenidos fueron 0,9526 µg/mL y 2,8867 µg/mL respectivamente. Estos valores demuestran que el método propuesto es altamente sensible y puede utilizarse para la detección y cuantificación precisa del analito en esta matriz específica. Además, se determinó el Rango Dinámico Lineal (RDL) del analito en la curva de calibración, el cual abarcó desde 2,88 µg/mL hasta 100 µg/mL. Esto indica que el método tiene una amplia capacidad para medir concentraciones en este rango, asegurando una adecuada cobertura analítica.
El Coeficiente de Correlación (% R 2 ) obtenido para la curva de calibración fue de 99,4, lo que demuestra una excelente linealidad dentro de los intervalos estudiados. Asimismo, se evaluó la sensibilidad del método analítico, medida mediante la relación entre la señal instrumental y la concentración del analito en el rango lineal. La pendiente de la recta de calibración fue de 0,0421 µg/mL, lo que indica una alta sensibilidad del método para la detección y cuantificación precisa de la Norfloxacina. La Fig. 3 muestra el gráfico de la curva de calibración de la Norfloxacina, visualizando de manera clara la relación entre las concentraciones de la sustancia y las respuestas instrumentales.
Tabla 3 Ensayos de recuperación para la determinación de la exactitud en términos de veracidad del método utilizando la técnica de extracción sólido-líquido.
| ENSAYO Intra-día | ||||||
| Analito | Dopado µg/mL | Observado µg/mL | DE | RECUPERACIÓN % | DER % | n |
| Norfloxacina | 25 | 24,22 | 0,0704 | 96,88 | 0,2471 | 3 |
| 50 | 49,31 | 0,0458 | 98,62 | 0,1574 | 3 | |
| 75 | 74,15 | 0,0175 | 98,73 | 0,0457 | 3 | |
Exactitud del Método Analítico: En el presente estudio, se llevó a cabo una evaluación exhaustiva de la exactitud del método analítico mediante el análisis de recuperación utilizando la técnica de extracción sólido-líquido utilizando un baño de ultrasonido. Se realizaron fortificaciones de muestras de pollo casero, previamente verificadas como libres de Norfloxacina, mediante la adición de una disolución patrón en tres niveles de concentración diferentes: 25 µg/mL, 50 µg/mL y 75 µg/mL (por triplicado). Todos los cálculos y análisis se realizaron siguiendo rigurosamente la metodología descrita en la sección de validación del método analítico. En las Tablas 3 y 4 se presentan los resultados detallados de los ensayos de recuperación, los cuales permiten evaluar la exactitud en términos de veracidad del método empleando la técnica de extracción sólido-líquido.
Los resultados obtenidos revelaron una excelente precisión y exactitud del método propuesto utilizando la técnica de extracción sólido-líquido. La recuperación de Norfloxacina en esta matriz se situó en un rango comprendido entre el 96,88% y el 98,98%, tanto en los ensayos intra-día como en los ensayos inter-día. Estos valores indican que el procedimiento de extracción empleado es altamente eficiente y que el método analítico es altamente veraz y confiable. Además, la desviación estándar relativa (DER) obtenida en esta técnica analítica fue menor al 2%, lo cual cumple con los límites aceptables establecidos en la guía de validación utilizada. Según las recomendaciones de Cuadros Rodríguez et al. (1993), se considera aceptable cualquier valor de DER igual o inferior al 15% en general y al 20% en la zona próxima al límite de detección del método. En consecuencia, se puede concluir que el método propuesto, basado en la técnica de extracción sólido-líquido, cumple con los requisitos de precisión establecidos y se caracteriza por su alta veracidad, precisión y exactitud en la determinación y cuantificación de Norfloxacina en muestras de carne de pollo.
Tabla 4. Ensayos de recuperación para la determinación de la exactitud en términos de precisión del método utilizando la técnica de extracción sólido-líquido
| Ensayo Inter - día | ||||||
| Analito | Dopado µg.mL-1 | Observado µg.mL-1 | DE | Recuperación % | DER % | n |
| Norfloxacina | 25 | 24,55 | 1,279 | 98,21 | 2,037 | 3 |
| 50 | 49,49 | 1,811 | 98,98 | 1,344 | 3 | |
| 75 | 73,82 | 1,093 | 98,43 | 1,192 | 3 | |
Aplicación del método analítico
Una vez completado el desarrollo y la validación del método analítico, se procedió a la aplicación del mismo para determinar y cuantificar el contenido de Norfloxacina en las muestras de pollo. Las muestras fueron preparadas siguiendo el procedimiento descrito en la metodología, y la cuantificación se realizó utilizando la curva de calibrado establecida. Los resultados obtenidos de la extracción de este analito en las muestras de pollo se presentan en la Tabla 5.
Tabla 5. Concentración de Norfloxacina en muestras de pollo (µg/Kg). ND: no detectado (valor inferior al LD)
| Marcas | Concentración µg/Kg |
|---|---|
| Casero del Interior del país | ND |
| Casero del Mercado 4 | 1962,426 |
| Marca 1 | 2555,728 |
| Marca 2 | 888,0512 |
| Marca 3 | 7809,442 |
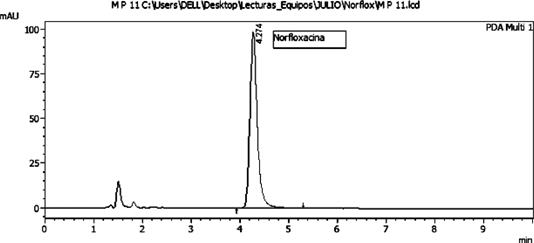
Se observa la detección y cuantificación de Norfloxacina en tres marcas comerciales de pollo, con concentraciones que variaron entre 888,0512 y 7809,442 µg/Kg, así como en la muestra de pollo casero del Mercado 4 que contiene una concentración de 1962,426 µg/Kg. Sin embargo, no se detectó la presencia de Norfloxacina en la muestra de pollo casero del interior del país. Es importante destacar que el valor "ND" indica no detectado dentro del límite de detección (LD), mientras que las concentraciones detectadas y cuantificadas se encuentran dentro del rango entre el límite de detección y el límite de cuantificación (LC). Estos resultados muestran una variabilidad en la presencia de Norfloxacina en las muestras de pollo comercializadas (Fig. 4) en los supermercados de la Gran Asunción, con concentraciones detectables en todas las marcas y ausencia solo en el pollo casero del interior del país. Esta variación puede estar relacionada con diversos factores, como el uso de este fármaco en la cría de pollos para prevenir enfermedades, así como aspectos relacionados con la alimentación y el manejo de los animales. Estos hallazgos coinciden con estudios similares realizados en Colombia, donde también se ha encontrado un alto contenido de Norfloxacina en carnes de pollo (Acevedo et al., 2015).
Esta problemática generalizada en la presencia de este compuesto en aves de corral destinadas al consumo humano destaca la importancia de abordar el uso responsable de antibióticos en la cría de aves y de implementar medidas efectivas para garantizar la seguridad alimentaria. La aplicación del método analítico desarrollado permitió detectar y cuantificar Norfloxacina en muestras de pollo, evidenciando su presencia en marcas comerciales. Estos resultados resaltan la necesidad de realizar un monitoreo continuo de los niveles de residuos de antibióticos en los alimentos, con el fin de garantizar la seguridad alimentaria y promover prácticas responsables en la industria avícola, tanto en la Gran Asunción como en otras regiones, tal como se ha demostrado en investigaciones previas realizadas en Colombia (Acevedo et al., 2015).
Conclusión
En este estudio, se desarrolló y validó un método analítico altamente sensible, preciso y exacto utilizando la técnica de extracción sólido-líquido y cromatografía de líquido de alta resolución (HPLC) para la determinación y cuantificación de Norfloxacina en muestras de carne de pollo comercializadas en supermercados de la Gran Asunción. Los resultados obtenidos demostraron que el método propuesto es altamente sensible, con un límite de detección (LD) de 0,9526 µg/mL y un límite de cuantificación (LC) de 2,8867 µg/mL. Esto indica que el método puede detectar y cuantificar Norfloxacina en concentraciones extremadamente bajas en la muestra de carne de pollo. Además, se estableció la linealidad del método mediante la construcción de una curva de calibrado utilizando diferentes concentraciones conocidas de Norfloxacina. El coeficiente de correlación (R2) de la curva de calibrado fue de 99,4%, lo que indica una relación lineal entre la concentración de Norfloxacina y la señal instrumental obtenida. Asimismo, se determinó un rango dinámico lineal (RDL) del analito de 2,88-100 µg/mL, lo que permite una amplia cobertura de concentraciones en las muestras analizadas. La aplicabilidad del método se confirmó mediante la determinación de Norfloxacina en muestras de pollo comercial.
Se observó que la presencia de Norfloxacina fue detectada y cuantificada en algunas marcas comerciales de pollo, con concentraciones que variaron entre 888,0512 y 7809,442 µg/Kg. Estas cifras superan significativamente las cantidades máximas de Norfloxacina permitidas para la carne de pollo (100 µg/Kg) según la normativa establecida por el Codex Alimentarius en su Comisión de Límites Máximos de Residuos para Medicamentos Veterinarios. Es importante resaltar que en la muestra de pollo casero del interior del país no se detectó la presencia de Norfloxacina. Estos resultados sugieren la necesidad de un monitoreo continuo de los niveles de residuos de antibióticos, como la Norfloxacina, en las muestras de carne de pollo comercial. Se observó una diferencia significativa entre los pollos criados de forma casera en el interior del país, los cuales no presentaban este antibiótico, y aquellos comercializados en el Mercado 4 de Asunción bajo la denominación de "pollo casero", los cuales mostraron altas concentraciones de Norfloxacina. Además, es fundamental implementar medidas de control y regulación para garantizar la seguridad alimentaria y promover prácticas responsables en la industria avícola. Se requiere una investigación exhaustiva para identificar las fuentes de contaminación con Norfloxacina en las cadenas de producción avícola y tomar medidas correctivas en las marcas comerciales que exceden los límites establecidos.
Contribución de los autores
Todos los autores contribuyeron de manera equitativa en la elaboración de este artículo.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
Fuente de financiamiento
Fuente de financiamiento propia.












 uBio
uBio