Introducción
Staphylococcus aureus (S. aureus) es un microorganismo ubicuo, con predilección por la piel, glándulas cutáneas y membranas mucosas de mamíferos. En el ser humano, S. aureus coloniza la piel y las mucosas de distintas localizaciones del cuerpo humano. El lugar más frecuente de colonización de S. aureus se encuentra en la parte anterior de las fosas nasales, seguidas del área perineal-ingles, de la orofaringe y de las axilas. Esta bacteria puede aislarse, además, en otros sitios como en la piel, especialmente de las manos1.
S. aureus es uno de los patógenos humanos más importantes, responsable de una amplia variedad de procesos infecciosos, tanto nosocomiales como adquiridos en la comunidad, algunos de los cuales con una mortalidad elevada. La infección suele comenzar con la colonización previa de S. aureus, principalmente en las fosas nasales. Una vez rota la barrera natural de la piel, las bacterias pueden diseminarse hacia sitios más profundos, bien por contigüidad o bien por vía hematógena2.
S. aureus es un patógeno con gran capacidad de adquirir diferentes mecanismos de resistencia a antibióticos. Este microorganismo había desarrollado la capacidad de producir B-lactamasas, que descomponen el anillo B-lactámico de la penicilina e impiden su unión con las proteínas de unión a la penicilina (PBP). Las PBPs son enzimas localizadas en la membrana bacteriana que están implicadas en la síntesis del peptidoglicano de la pared celular. Su producción está codificada por el gen mecA3.
S. aureus es capaz de producir una amplia variedad de toxinas y factores de virulencia. En relación con la emergencia de Staphylococcus aureus meticilino resistente (MRSA), el más importante es la Leucocidina de Panton-Valentine o PVL (por sus siglas en inglés)4.
La toxina PVL es una exotoxina formadora de poros, presente en algunas cepas de S. aureus tanto sensibles como resistentes a la meticilina. La presencia de PVL está asociada con mayor severidad local de las infecciones de piel y tejidos blandos, mayor respuesta inflamatoria (fiebre y otras manifestaciones sistémicas) y complicaciones en las osteomielitis; y mayor mortalidad de las neumonías. Los forúnculos y abscesos son las formas clínicas más frecuentes5.
El tratamiento de las infecciones por S. aureus depende del tipo y severidad de la infección, la prevalencia de MRSA y la sensibilidad antibiótica. También, se considera la gravedad de las infecciones atribuida a la presencia de la toxina PVL.
La emergencia de MRSA de la comunidad ha llevado al cambio de las políticas antibióticas en zonas de alta prevalencia, y a la aparición de nuevas guías de tratamiento orientadas al manejo de las infecciones por estas nuevas cepas resistentes6,7.
El objetivo de este trabajo fue determinar la portación nasal de S. aureus y su asociación con forunculosis a repetición en pacientes con o sin tratamiento con antibióticos y que concurrieron al Laboratorio Central de Salud Pública por solicitud médica para el estudio de portación, entre mayo de 2016 a mayo de 2017.
Materiales y Métodos
Diseño: estudio retrospectivo de corte transverso
Población enfocada: cepas de S. aureus aisladas de hisopados nasales y lesiones de piel o abscesos de pacientes con diagnóstico de forunculosis a repetición que estén con o sin tratamiento con antibióticos.
Población accesible: cepas de S. aureus aisladas de hisopados nasales y lesiones de piel o abscesos de pacientes con diagnóstico de forunculosis a repetición que estén con o sin tratamiento con antibióticos y que concurren en el Laboratorio Central de Salud Pública entre mayo de 2016 a mayo de 2017.
Criterios de inclusión: muestras de hisopados nasales y/o lesiones de piel o abscesos de las cuales fueron aisladas S. aureus
Criterios de exclusión: muestras de hisopados nasales y lesiones de piel o abscesos en las cuales no fueron aisladas S. aureus.
Muestreo: Se realizó un muestreo no probabilístico de casos consecutivos que presentaron los criterios de inclusión.
Variables: las variables operativas utilizadas fueron: hisopado nasal, forunculosis, fenotipo de sensibilidad, gen mecA, toxina PVL.
Instrumento de medición: Se llenó una ficha en el momento de la toma de muestra para obtener los datos mínimos del paciente requeridos para el estudio, al cual se le asignó un código numérico.
Aspectos éticos: La toma de muestra fue realizada como procedimiento de rutina, en forma única y sin requerimiento de muestras adicionales. Este trabajo empleó bacterias para la realización del estudio analítico, por lo tanto no conlleva riesgos para el paciente. Los resultados fueron entregados individualmente al paciente por escrito.
Análisis estadísticos: Todos los datos y resultados obtenidos fueron guardados en una planilla Microsoft Excel 2010, la cual fue utilizada para el análisis por el sistema Epi Info 7 ®. Para establecer la asociación de la portación nasal con forunculosis a repetición y poder evaluar diferencias estadísticas entre las variables, se utilizaron los cálculos de Chi2.
Toma de muestra y análisis microbiológicos y moleculares:
A todos los pacientes que cumplieron los criterios de inclusión se les obtuvo muestras de hisopado nasal y una aspiración por punción de la lesión o absceso, o por hisopado según el caso.
El cultivo se realizó en los medios de agar sangre de carnero al 5% y agar manitol sal con incubación a 35°C. La identificación se realizó por métodos manuales utilizando tinción de Gram y las pruebas de catalasa, coagulasa, DNAsa, PYR, urea, sensibilidad a la novobiocina 5 ug, bacitracina 10 ug y polimixina B.
El estudio de la sensibilidad a los antimicrobianos se realizó por el método de difusión en agar con discos según el método de Kirby Bauer siguiendo la interpretación de los puntos de corte establecidos por el Clinical Laboratory Standard Institute (CLSI)9.
Los antibióticos testados fueron: cefoxitina 30 μg, gentamicina 10 μg, , rifampicina 5 ug, cloranfenicol 30 μg, trimetoprimsulfametoxazol 25 ug, La caracterización fenotípica de la resistencia a macrólidos (MLSb inducible) se realizó mediante la prueba de doble disco; eritromicina 15 μg y clindamicina 2 μg. Las zonas de inhibición fueron interpretadas según su diámetro y detectando la presencia de un achatamiento en la zona de la clindamicina (D-test), indicando resistencia inducible. Si no se producía un efecto D-test, se interpretó que la cepa era sensible o resistente a clindamicina en función al diámetro de los halos de inhibición. La caracterización molecular se realizó en el área de biología molecular del LCSP. La técnica utilizada fue de la reacción en cadena de la polimerasa clásica múltiple (PCR Multiplex) siguiendo un protocolo descrito para la detección del gen mecA y PVL10,11.
La extracción del ADN se realizó con el equipo de extracción Magpurix, de este extracto se tomó 3 ul como DNA molde o templado para la reacción de amplificación.
Para la realización de esta técnica se utilizaron dos iniciadores o primers que son complementarios del gen mecA (mecA1 y mecA2) y dos iniciadores para la detección del gen luk-PV (Luk-PV1 y Luk-PV2) descritos por Lina et al10.
Para la mezcla de reacción (Mix) se utilizó por cada tubo: Desoxirribonucleotidos trifosfato (dNTPs) 2,5 mM; ClMg2 50 mM: 3 ul; Buffer PCR 10X: 5 ul; Taq DNA polimerasa 2,5 U/ul: 0,2 ul; Primers 30 pmoles/ul: 1 ul; agua grado molecular: 34,8 ul; ADN templado: 3 ul La amplificación se realizó en un termociclador siguiendo los siguientes parámetros: 95 °C, 5 minutos; 47°C, 10 min; 72°C, 6 min; 95°C, 5 min; seguidos de 35 ciclos de 30 seg a 95 °C; 30 seg. a 60°C; 1 minuto a 72 °C y un período de extensión final de 10 minutos a 72 °C.
Los fragmentos de ADN amplificados fueron separados mediante una electroforesis en gel de agarosa al 2%. El gel se preparó con 2 gr de agarosa, 100 ml de buffer TE 0,5X (50 mM Tris y 0,2 mM EDTA pH8) y 10 ul de una solución de Bromuro de Etidio (10 mg/ml). El gel fue cargado con 3,5 ul del producto amplificado con el buffer de corrida (Loading buffer) y con un control de peso molecular de 1 kb (Ladder). La corrida se realizó en buffer TE 0,5X a 100 voltios durante 45 min.
La visualización de los amplificados se realizó con un equipo transiluminador de luz ultravioleta y fotografiados con el mismo equipo que posee un fotodocumentador (BioRad) incorporado a una computadora para el posterior análisis.
Interpretación de los resultados de la PCR: las cepas que poseen el gen mecA, en el producto de PCR presentan una banda de 286 pb. Las cepas que poseen el gen luk-PV presentan una banda de 433 pb
Resultados
Portación nasal de S. aureus y su asociación con forunculosis
Se analizaron en total 168 muestras, 84 hisopados nasales y 84 lesiones de piel o abscesos.
El 45,2% (76/168) de las muestras dieron cultivo positivo para S. aureus en ambos tipos de muestras en un mismo paciente; 38 se aislaron del hisopado nasal y 38 de sus lesiones de piel.
El 23,8% (40/168) dieron cultivo negativo en ambos tipos de muestras
De los hisopados nasales que dieron cultivo positivo para S. aureus y cultivo negativo en sus lesiones fue del 9,5% (16/168).
De las lesiones de piel o abscesos que dieron cultivo positivo para S. aureus y cultivo negativo para sus hisopados nasales fue del 21,4% (36/168).
Se pudo observar un asociación altamente significativa (OR: 5,3 IC95: 1,9 - 14,2%; p = 0,0004< p=0,02; X2) entre la portación nasal de S. aureus y la formación de forúnculos a repetición.
Resistencia a meticilina
Del total de muestras se aislaron 128 cepas de S. aureus, el 66,4% (85/128) fueron resistentes a oxacilina, y el 33,6% (43/128) fueron sensibles.
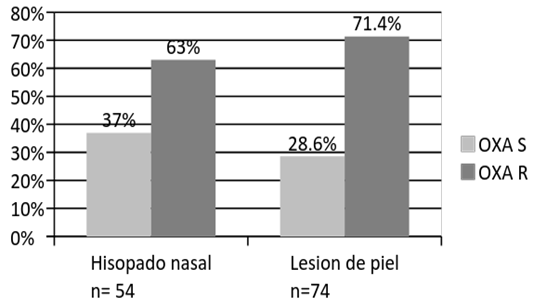
De las 128 cepas, 54 cepas se aislaron de los hisopados nasales, de los cuales el 63% (34/54) fueron oxacilina resistentes y el 37% (20/54) fueron sensibles. (Figura 1)
De las 128 cepas, 74 cepas se aislaron de las lesiones de piel, de los cuales el 71,4% (53/74) fueron oxacilina resistentes y el 28,6% (21/74) fueron sensibles.
Las 76 cepas de S. aureus aisladas de las lesiones y de sus hisopados nasales correspondientes, el 89,5% (68/76) fueron meticilino resistentes, coincidiendo la resistencia en ambos tipos de muestra.
Detección del gen mecA y PVL
Todas las 85 cepas de S. aureus que fueron resistentes a la Oxacilina por el método de difusión por discos de Cefoxitina, se confirmaron por métodos moleculares coincidiendo con la portación del gen mecA que confiere dicha resistencia por el mecanismo de producción de PBP2, evidenciados por el producto de amplificación de 288 pb (Figura 2), confirmándose así la frecuencia del 68,3% de MRSA del total de aislados.
De las 128 cepas de S. aureus, el 78,9 % (101/128) portaron el gen que codifica la PVL.
De las 54 cepas aisladas de los hisopados nasales 72,2% (39/54) portaron el gen para PVL, y de las 74 cepas aisladas de las lesiones 83,7% (62/74) portaron PVL, detectados por los productos de amplificación de 433 pb (Figura 2).
Sensibilidad a los antimicrobianos
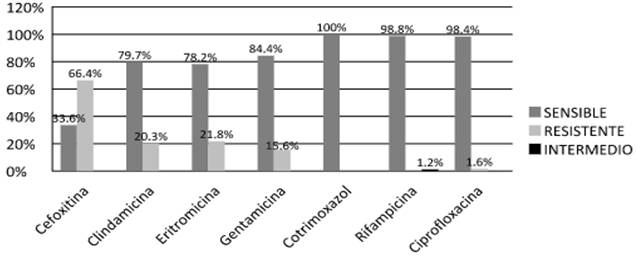
En cuanto a la sensibilidad a los antimicrobianos, de los 128 aislamientos, el 66,4% (85/128) fueron resistentes a Cefoxitina y por tanto resistentes a Oxacilina, y el 33,6% (43/128) presentaron sensibilidad a la misma.
Las 128 cepas presentaron 100% de sensibilidad a Trimetoprim sulfametoxazol. El 15,6% (20/128) fueron resistentes a Gentamicina; el 20,3% (26/128) fueron resistentes a Clindamicina, y el 21,8 % (28/128) fueron resistentes a Eritromicina. Se encontró un 1,6% (2/128) de resistencia a Ciprofloxacina y 1,2% (1/128) de sensibilidad intermedia a Rifampicina. (Figura 3).
El 10,9% (14/128) de los aislados presentaron MLSb inducible (D-Test +) (no mostrado en el gráfico).
Discusión
Este estudio fue realizado para asociar la portación nasal de S. aureus con la forunculosis a repetición, conocer la prevalencia de cepas meticilino resistentes y la portación de la toxina PVL.
El informe anual de los datos del 2015 de la Red Nacional de Laboratorios de Paraguay, enviado anualmente por el laboratorio de referencia Laboratorio Central de Salud Pública (LCSP) a la OPS/OMS, informó una prevalencia de MRSA del 71,2% de diferentes sitios de infección12.
En este estudio obtuvimos una frecuencia de MRSA del 66,4% en el total de cepas estudiadas. La meticilino resistencia de las cepas aisladas de las lesiones de piel coincidió con las aisladas de sus hisopados nasales.
Otros estudios a nivel nacional, comunicaron la frecuencia de MRSA y la presencia de PVL en diferentes sitios de infección y también en portadores nasales de trabajadores de la salud14.
La frecuencia de infecciones en general, por cepas portadoras de PVL en este estudio, fue del 78,9% del total de cepas estudiadas. Frecuencia bastante elevada en comparación con otro estudio realizado en el 2010 en Paraguay donde analizaron cepas de S. aureus adquiridos de la comunidad obtenidos a partir de muestras clínicas de secreciones de piel, partes blandas o líquidos corporales de pacientes menores de 17 años donde la portación del gen codificante de la PVL se observó en un 58% del total de los aislados15.
A pesar de la alta meticilino resistencia, se observó una alta sensibilidad a las sulfonamidas, tratamiento de elección para infecciones de piel y tejidos blandos.
En comparación con otros autores15, observamos una disminución de la sensibilidad a otros tipos de antibióticos, especialmente a la clindamicina (20,3%), alternativa de tratamiento especialmente en pediatría.
Si bien, hay otros tipos de estudios donde no encontraron una asociación significativa entre la portación nasal y las afecciones sistémicas16, en este trabajo, se pudo establecer una alta asociación de la portación nasal de S. aureus con la forunculosis a repetición (OR: 5,3 IC95: 1,9 - 14,2%; p = 0,0004< p=0,02; X2).
Conclusión
Se pudo establecer una alta asociación de la portación nasal de S. aureus con la forunculosis a repetición.
Todas las cepas meticilino resistentes portaron el gen mecA, lo que confirmó la resistencia por este mecanismo.
A través de la detección del gen Luk-PV se pudo determinar la frecuencia de portación de la toxina PVL.
Todas las cepas de S. aureus estudiadas fueron sensibles a las sulfonamidas, pero con menor sensibilidad a los macrólidos y lincosaminas, y con sensibilidades variables a otros tipos de antibióticos.