INTRODUCCION
La enfermedad renal diabética (ERD) puede presentarse en aproximadamente el 30-50% de la población con diabetes mellitus tipo 1 o 2 alrededor del mundo 1. Esta condición es influenciada por factores genéticos, ambientales, así como por cambios microvasculares y macrovasculares, incluidos cambios hemodinámicos, inflamatorios y fibrosis en los glomérulos e intersticio renal 2.
En consecuencia, esta entidad se presenta en pacientes con DM y compromiso de la función renal y puede ser explicada por varias causas 3,4. El término Nefropatía diabética (ND), se utiliza exclusivamente para señalar las lesiones renales originadas por lesión microangiopática o de los pequeños vasos. Por lo tanto, la ND es una complicación exclusiva de la DM, en la que se afecta la microcirculación renal desencadenando una serie de alteraciones funcionales y estructurales principalmente a nivel glomerular y que requiere confirmación con biopsia renal 3,5,6. El cuadro clínico de la ND se caracteriza por proteinuria persistente, hipertensión arterial y deterioro progresivo de la función renal. Hoy en día, el término más usado es el de ERD, por lo que es una definición más general que abarca los pacientes diabéticos que tengan compromiso renal y que puede asociarse a otras condiciones como obesidad, dislipidemia, hipertensión y que no requiere tener hallazgos histológicos para hacer diagnóstico.
EPIDEMIOLOGÍA Y DEFINICIONES
La diabetes mellitus (DM) es una de las enfermedades crónicas no transmisibles más frecuentes y por ende una de las emergencias sanitarias mundiales de más rápido crecimiento en las últimas décadas. Según datos recientes de la Federación internacional de diabetes (FID) para el año 2021 la prevalencia global de DM en adultos entre los 20 y 79 años fue 537 millones (10.5% de la población) y se prevé que esta cifra alcance los 643 millones para el año 2030 7. Por otro lado, habitualmente se presenta un retraso de 4 a 7 años entre el inicio de la enfermedad (DM) y su diagnóstico.
Una de las complicaciones crónicas más frecuentes que presentan los pacientes diabéticos es la enfermedad renal diabética (ERD), una patología cuya incidencia se ha duplicado en la última década debido principalmente al incremento concomitante de los pacientes con diabetes mellitus 3. Se estima que aproximadamente el 30% al 50% de los adultos con DM2 tienen compromiso renal desde el momento del diagnóstico, siendo este un marcador de pronóstico y calidad de vida 3.
Por otro lado, la DM es la principal causa de enfermedad renal crónica (ERC) y la principal causa de ingreso a diálisis. Datos recientes, sugieren que 843 millones de personas a nivel mundial presentan ERC con un incremento en la mortalidad, siendo más prevalentes en los pacientes con DM, HTA, ancianos y mujeres 8.
Tradicionalmente se ha referido el compromiso renal por diabetes con el término de “nefropatía diabética”, sin embargo, esta connotación implica hallazgos histológicos estructurales en biopsia renal, como el engrosamiento de la membrana basal glomerular, expansión difusa de la matriz mesangial y los clásicos nódulos de Kimmelstiel-Wilson, signos patognomónicos de esta entidad 2,6. La expresión clínica de la nefropatía diabética está dada por proteinuria, hipertensión arterial (HTA) y una reducción progresiva en la función renal 9.
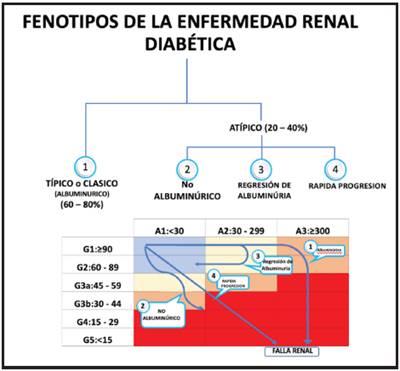
Sin embargo, hoy en día, está más aceptado usar el término de enfermedad renal diabética (ERD) para referirse al síndrome de compromiso renal en el paciente con DM, cuyo diagnóstico es clínico y se caracteriza por la presencia de albuminuria y/o disminución en la tasa de filtración glomerular (TFG) menor a 60 mL/min/1.73m2, en ausencia de signos o síntomas de otra causa de ERC 6. La definición de ERD incluye dos grandes fenotipos, el fenotipo clásico o albuminúrico y el fenotipo no clásico, del cual hay varios patrones 3. Actualmente, se mencionan que hay descritos tres principales fenotipos no clásicos 3. Esto se discutirá en mayor en detalle en relación con la historia natural de la enfermedad más adelante en este documento.
FISIOPATOLOGÍA, HISTORIA NATURAL Y FENOTIPOS.
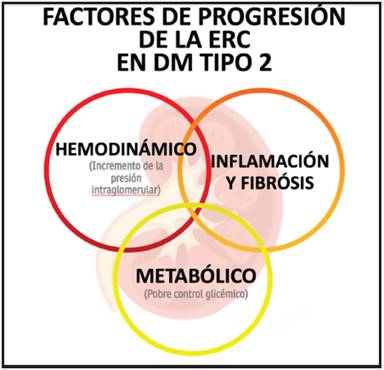
En la patogénesis y progresión de esta condición se distinguen tres ejes fundamentales el hemodinámico, metabólico e inflamatorio, este último con importancia y evidencia creciente. El compromiso renal es multifactorial involucrando distintos procesos estructurales, fisiológicos, hemodinámicos e inflamatorios que contribuyen a la reducción progresiva en la tasa de filtrado glomerular (TFG) 10. En primera instancia, los cambios por hiperfiltración glomerular conducen al desarrollo y aparición de ERD 9. La hiperglicemia se relaciona con liberación de mediadores vasoactivos, con dilatación secundaria de las arteriolas aferentes 4. Dentro de estos mediadores se encuentra el factor de crecimiento similar a la insulina 1 (IGF-1), glucagón, óxido nítrico (NO), factor de crecimiento del endotelio vascular (VEGF) y prostaglandinas 9.
Por otro lado, se producen alteraciones en la función tubular renal en etapas tempranas de la diabetes mellitus, relacionado con el grado de control glicémico 9. Debido a la alta carga filtrada de glucosa, se incrementa la reabsorción tubular de sodio y glucosa por regulación al alza del cotransportador de glucosa sodio 2 (SGLT2) en el túbulo proximal 11. Este fenómeno conlleva a una disminución en la concentración del sodio en el fluido tubular distal lo cual altera el balance tubuloglomerular cuya consecuencia es la dilatación de la arteriola aferente con aumento de las presiones intraglomerulares y por ende un estado de hiperfiltración 11. Esto representa un mecanismo paralelo a los descritos clásicamente derivado de la disregulación en el tono vascular de los capilares glomerulares.
Dentro de la comprensión de la patogenia de la ERD, los trabajos de Hostetter han permitido comprender la interacción entre los disturbios hemodinámicos y metabólicos. En estas publicaciones se corroboró que la hiperglicemia altera los mecanismos de autorregulación de los capilares glomerulares, produciendo una reducción secundaria en el tono arterial de las arteriolas glomerulares aferentes y en menor medida la eferente 11. Esta disregulación del tono vascular lleva a hipertensión glomerular y aumento inicial del filtrado glomerular, esto contribuye al daño en la estructura renal propio de la diabetes mellitus tipo 2 12.
Adicionalmente, el incremento en la producción de angiotensina 2 mediado por hiperglicemia y con activación del sistema renina angiotensina aldosterona (SRAA), juegan un papel adicional en la disregulación presente en los capilares glomerulares 11. Estos serían algunos de los mecanismos hemodinámicos fundamentales.
La exposición a la hiperglicemia crónica, presente en el curso de la diabetes mellitus, conlleva al aumento de la absorción y oxidación de ésta por parte de la célula, interfiriendo en el metabolismo energético mitocondrial 11. Los donantes de electrones impulsan un aumento desproporcionado en el gradiente de voltaje de la membrana mitocondrial que da como resultado la inhibición de la cadena de transporte de electrones a nivel del complejo III y el aumento de la síntesis de superóxido y especies reactivas de oxígeno 11.
En consecuencia, esta producción incrementada de radicales libres y especies reactivas de oxígeno lleva a la inhibición en la actividad de la enzima gliceraldehído-3-fosfato deshidrogenasa (GAPDH), enzima clave en la glicolisis 13. Esta inhibición de la glicolisis activa las vías metabólicas involucradas en la patogénesis de la ERD; estas incluyen la vía de la hexosamina, la vía implicada en la síntesis de productos finales de la glicación avanzada (AGE), la vía del sorbitol y la activación de proteína quinasa-C 11.
Dentro de los factores involucrados en los disturbios metabólicos propios de la diabetes mellitus y que llevan a la ERD se distinguen angiotensina (ANG) 2, factor de crecimiento del endotelio vascular (VEGF), angiopoyetina (ANGPT) 2, y factor de crecimiento transformante (TGF) β1 11. La participación y contribución de las ROS en la patogenia de la ERD se ha cuestionado, con resultados variables, sigue siendo un punto de interés en investigación, sin lograr establecer claramente su participación 4. Recientemente se ha incluido la participación paralela del metabolismo lípido y la contribución de la lipotoxicidad dentro del desarrollo de esta enfermedad, partiendo que los lípidos son elementos centrales dentro la progresión de la enfermedad renal 11.
Los mecanismos fisiopatológicos involucrados en el desarrollo y progresión de la ERD son complejos e incluyen diferentes vías presentes desde muchos antes del diagnóstico clínico de la enfermedad. Los procesos que llevan a estimulación de la inflamación y la fibrosis son el producto de la intervención de alteraciones metabólicas, hiperfiltración glomerular, estrés oxidativo y producción de especies reactivas de oxígeno (ROS), así como la activación de la inmunidad innata con el desarrollo secundario de inflamación y fibrosis 14. No obstante, se consideraba una enfermedad glomerular no inflamatoria, señalándose como una enfermedad inducida primariamente por cambios metabólicos y hemodinámicos, situación que se replantea a la luz de la evidencia reciente de la inflamación como tercer pilar del desarrollo de la enfermedad 4,15.
Los estudios de secuenciación de ARN del núcleo de células renales tomadas de biopsias de paciente con diabetes mellitus tipo 2, respaldan la activación de vías de señalización involucradas en la inflamación 14,16. Por otro lado, el estudio del riñón diabético muestra un aumento en la presencia de células inflamatorias, leucocitos en un orden de 7 a 8 veces con relación al riñón de sujetos sanos. Predominando algunas subpoblaciones de interés como monocitos, células B y células plasmáticas 14. La progresión en el conocimiento de la fisiopatología de la ERD orienta nuevos blancos terapéuticos e implicaciones en el manejo de esta enfermedad.
La historia natural de la ERD en pacientes con diabetes mellitus tipo 2 no difiere de la población de pacientes con diabetes mellitus tipo 1, sin embargo, existen algunos aspectos a considerar. A diferencia del curso clínico de la diabetes mellitus tipo 1, el momento exacto de diagnóstico de la DM tipo 2 es difícil de determinar, incluso se encuentran pacientes que debutan con proteinuria y al realizarse biopsia renal, ya tienen hallazgos histopatológicos conclusivos de nefropatía diabética, antes de establecerse un diagnóstico de DM tipo 2.
A pesar de que el fenotipo clásico de la ERD sigue siendo el más frecuente, la evidencia actual sugiere que los fenotipos no clásicos se están volviendo comunes. Aproximadamente del 20% al 40% de la ERD pertenecen a fenotipos no clásicos, por encima de los datos informados de estudios comentados previamente 17. Además, los estudios de cohortes han sugerido que los desenlaces renales y cardiovasculares pueden variar entre los diferentes fenotipos de ERD. Por lo tanto, es necesario clasificar y abordar a los pacientes con ERD de acuerdo con el fenotipo 17.
RIESGO CARDIOVASCULAR
La existencia de diabetes aumenta dos a cuatro veces el riesgo de desarrollar una enfermedad cardiovascular, constituyéndose en la principal causa de mortalidad entre los pacientes con diabetes, especialmente en aquellos con DM2 18.
Aproximadamente dos terceras partes de todas las muertes en pacientes con DM son atribuibles a enfermedad cardiovascular, específicamente enfermedad coronaria isquémica y falla cardiaca 19. Diferentes guías de manejo han propuesto estrategias de clasificación del riesgo cardiovascular en pacientes con DM tipo 2, pero en algunas ocasiones no resulta sencillo aplicarlos a la práctica clínica diaria 5,6.
Algunas propuestas de manejo del riesgo cardio renal en el paciente diabético, se proponen 4 grupos de riesgo cardiovascular. En general, podemos decir que no existen pacientes diabéticos de bajo riesgo cardiovascular 6. La gran mayoría de pacientes diabéticos están ubicados en la categoría de alto riesgo. Así mismo cuando el paciente diabético tiene compromiso renal, la gran mayoría también son de categoría alta o muy alto riesgo 6.
DIAGNÓSTICO
El diagnóstico de la ERD se fundamenta en los hallazgos clínicos 20. En primera instancia se debe establecer la presencia de diabetes mellitus, y segundo, demostrar la presencia de enfermedad renal definida por la presencia de albuminuria y/o disminución en tasa de filtrado glomerular (TFG) 21. Tradicionalmente se puede definir por la tasa de excreción urinaria de albúmina en 24 horas; no obstante, la albuminuria puede ser analizada con la tasa albúmina/creatinina en orina al azar 21. En general, la medición de la albuminuria se relaciona con la concentración de creatinina a través del índice albúmina/creatinina urinaria, que establece un criterio de diferenciación de la cantidad de albúmina: valores entre 30 y 300mg/g (conocidos anteriormente como microalbuminuria) y valores mayores de 300mg/g 22. La historia natural de la ND, desde los estudios de Mogensen y colaboradores, clásicamente se han establecido en 5 etapas, sobre esta base, la detección y el diagnóstico de la ND continúa basándose en la evaluación de la albuminuria 23,24.
Las guías internacionales de manejo de diabetes mellitus, recomiendan realizar pruebas de detección de ERD, en todas las personas con DM tipo 2 mediante medición de función renal y albuminuria al momento del diagnóstico y anualmente a partir de entonces. Por otro lado, en el caso de DM tipo 1, se inicia la pesquisa a partir de los 5 años de diagnóstico 6,25. No obstante, en pacientes con DM tipo 1, se puede detectar presencia de albuminuria antes de los 5 años de diagnóstico en el 18% de los pacientes, por lo cual debería hacerse cribado desde el año de diagnóstico 26. Los pacientes con micro y macroalbuminuria deben ser evaluados respecto a la presencia de comorbilidades, especialmente retinopatía y enfermedad macrovascular 24.
En pacientes con DM, la caída de TFG por debajo de 60 mL/min/1.73 m2 y/o la existencia de albuminuria (Cociente albúmina/creatinina en orina > 30 mg/g) en dos determinaciones con al menos 3 meses de diferencia es suficiente para establecer el diagnóstico de nefropatía diabética 20. Este concepto tiene una baja especificidad y una amplia variedad de lesiones histológicas, podrían explicar estos cambios, sin estar relacionadas con la DM.
El diagnóstico de ERD es clínico y se fundamenta en dos aspectos básicos: la disminución de la función renal, reducción de la TFG y la presencia de albuminuria. De estos el parámetro más frecuente es la presencia de albuminuria persistente. La ecografía renal no hace parte del diagnóstico de ERD de manera rutinaria.
La fisiopatología de la ERD es multifactorial, con varios factores fisiopatológicos involucrados en el inicio y la progresión de la enfermedad. Los estudios han demostrado que los factores genéticos contribuyen al desarrollo de la ND, pero a menudo interactúan con múltiples factores exógenos que conducen a un patrón de heredabilidad débil (27). Esto ha generado un escenario complejo en la búsqueda de optimizar las intervenciones en pacientes con ERD, principalmente el diagnóstico en las etapas tempranas y la clasificación apropiada de la ERD se ha vuelto en la actualidad un reto para la estructuración de estrategias diagnósticas y los análisis derivados de la química clínica 22. Por ello, en aras de alcanzar un enfoque basado en la medicina de precisión, distintos grupos han propuestos marcadores para la detección de ERD en sus distintas etapas. Estos incluyen marcadores diagnósticos como Col4A3, BMP7, COLEC11, DDR1, GABRR1, ELMO1 entre otros derivados de estudios genéticos; marcadores pronósticos TNFR1/TNFR2, KIM-1 y CKD273 score 27. Por último, se deben señalar los marcadores de respuesta a intervención terapéutica que acompañados de la fenotificación de los pacientes con ERD abrirán una nueva era en las intervenciones terapéuticas de esta compleja enfermedad polimorfismo de la ECA, NT-proBNP y PRE score 27.
Con relación a la biopsia renal puede no ser necesaria para el diagnóstico en casos típicos de ERD, esta estaría indicada en situaciones con curso clínico y características atípicas, que sugieren o cuestionan el diagnóstico de ERD. Estas características incluyen diabetes de corta duración, ausencia de retinopatía diabética, especialmente en diabetes mellitus tipo 1, sedimento urinario activo ejemplo: hematuria, cilindros hemáticos), síndrome nefrótico de inicio súbito o albuminuria rápidamente progresiva o reducción de TFG, así como signos y síntomas de otras enfermedades 6.
TRATAMIENTO
El conocimiento de la fisiopatología e historia natural de la ERD ha permitido reestructurar su tratamiento hacia unos ejes específicos, que incluyen: el control metabólico, reducir o enlentecer la progresión de la enfermedad renal y disminuir los desenlaces cardiovasculares 6. Muchos avances se han tenido en el abordaje y tratamiento de la ERD en los últimos años, pasamos de un enfoque netamente glucocéntrico a un enfoque holístico basado en la búsqueda y control de diferentes factores de riesgo (hiperglicemia, presión arterial, lípidos, sobrepeso, tabaquismo entre otros) y pasamos de tener medicamentos antidiabéticos que sólo buscaban un mayor control glicémico (HbA1c) a medicamentos “modificadores” de diabetes que han logrado tener impacto en el control glicémico, en otros factores de riesgo (peso, disminución de incidencia de hipoglucemias) y en los desenlaces más temidos del paciente con DM tipo 2 (desenlaces cardiovasculares y microvasculares renales) 5.
Los fármacos más antiguos y con amplio sustento en la evidencia empleados en el tratamiento de la ERD son inhibidores del RAA. En este sentido, diferentes ECA con alto rigor metodológico han demostrado sus efectos benéficos 28. Uno de los ECA iniciales, conducido por Lewis y colaboradores, en 1993, un ensayo clínico aleatorizado, controlado comparó los efectos del empleo de captopril, un inhibidor de la enzima convertidora de angiotensina (ECA) en pacientes con diabetes insulinorequiriente comparado con placebo, 202 pacientes se incluyeron 29. Encontró que el captopril protege contra el deterioro de la función renal en pacientes con ND insulinodependientes, efectos que iban más allá del control de la presión arterial 29. Por otro lado, los antagonistas del receptor de la angiotensina II (BRAs), han demostrado beneficios en mejoría de resultados renales, incluyendo trabajos como el estudio RENAAL con losartán e IDNT con Irbesartán 30,31.
Los resultados anteriores han fundamentado uno de los pilares en el tratamiento de la ERD, el control de la presión arterial. La presión arterial (PA) en el capilar glomerular es un factor de impacto en la incidencia y progresión de la ERD, el estricto control de las cifras de PA disminuye el grado de albuminuria, retarda la progresión de la ERC y disminuye la incidencia de eventos cardiovasculares 6. En la fisiopatología de la ERD se ha documentado el papel protagónico del sistema renina angiotensina aldosterona (RAAs), de allí que el uso de los inhibidores de la enzima convertidora de angiotensina (iECAs) o los bloqueadores del receptor de angiotensina (BRAs) se hayan convertido desde finales del siglo XX en una piedra angular del tratamiento de pacientes con ERD, especialmente del fenotipo proteinurico 32,33. Los beneficios de los bloqueadores del RAAs son independientes de su potencial antihipertensivo, sin embargo, siempre se debe intentar utilizar la máxima dosis tolerada por el paciente y se debe evitar el uso combinado de IECAS y BRAs ya que este doble bloqueo ha mostrado un incremento en la incidencia de hiperkalemia, hipotensión y lesión renal aguda 32,34. La meta de presión arterial puede ser menor a 140/90, sin embargo, se sugiere lograr una meta menor a 130/80 en los pacientes con albuminuria, enfermedad cardiovascular establecida o muy alto riesgo cardiovascular 6.
Los antagonistas del receptor mineralocorticoide (ARM) tienen efectos antihipertensivos suprimiendo la actividad de la aldosterona, producto final de la activación del RAA, situación que se ha relacionado con reducción de la proteinuria 28. Actualmente tenemos disponible tres medicamentos: ARM esteroideos (espironolactona y eplerenone) y un ARM no esteroideo selectivo (finerenona) 35. Los ARM bloquean directamente el receptor inactivando la acción de la aldosterona y otros ligandos como (cortisol, estrés oxidativo, RAC 1, hiperglucemia) e impidiendo la respuesta genómica y no genómica de la interacción con el receptor, disminuyendo así el grado de inflamación y remodelación en el corazón y riñón 35. El metanálisis de Hou y colaboradores, encontró que la espironolactona se asoció a reducción de albuminuria, inflamación y fibrosis en pacientes con ERC 36. También, existen datos favorables con el uso de eplerenona en reducción de albuminuria en pacientes con hipertensión arterial crónica 37. No obstante, existen restricciones con el uso de estos medicamentos en pacientes con ERC y sus potenciales eventos adversos como la hiperpotasemia, lo cual limitaría el empleo de esta medicación 28. Por ello el desarrollo de nuevos ARM no esteroideos, más selectivos para el receptor mineralocorticoide como finerenona, con potentes efectos antiinflamatorios y antifibróticos, son prometedores. En los estudios Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes (FIDELIO DKD) y Cardiovascular Events with Finerenone in Kidney Disease and Type 2 Diabetes (FIGARO DKD), han demostrado reducción en la progresión de ERC y eventos cardiovasculares 38,39.
Finerenona estaría indicado en pacientes adultos mayores de 18 años con diagnóstico de DM tipo 2 y ERD fenotipo albuminúrico clasificados de alto o muy alto riesgo cardiovascular en quienes, a pesar del uso a dosis máxima tolerable del IECA/ARAII no se logra controlar la albuminuria 35. Para el uso de finerenona hay que tener en cuenta la TFG y los niveles de potasio sérico. Se recomienda su uso con TFG mayores de 25 cc /min y con niveles de K sérico menores de 5 meq/l 35.
En cuanto a los medicamentos antidiabéticos, en el año 2008 la administración de alimentos y medicamentos de los Estados Unidos dio unas directrices a la industria farmacéutica sobre la necesidad de evaluar el riesgo cardiovascular de los nuevos antidiabéticos en sus estudios de investigación, esto llevó a realizar estudios con inhibidores dipeptil peptidasa (DPP-4i), nuevas insulinas, inhibidores del cotransportador sodio glucosa tipo 2 (iSGLT-2) y agonistas del receptor del péptido similar al glucagón tipo 1 (aGLP-1) desde una óptica de seguridad cardiovascular 40. Algunos de estos estudios realizados con iSGLT-2 y aGLP-1 mostraron unos resultados que han cambiado las guías de manejo de DM2 en el mundo 6.
A pesar de todos los avances en el tratamiento con antidiabéticos la metformina sigue siendo un medicamento de primera línea de manejo, se recomienda su uso en pacientes con TFGe mayor a 30 ml/minuto, no utilizar o descontinuar su uso en pacientes con TFGe menor a 30 ml/minuto o en pacientes hospitalizados con condición de hipotensión, deshidratación o que vayan a ser llevados a estudios con medio de contraste; para pacientes con TFGe menor a 45 ml/minuto se debe ajustar la dosis de la misma (50% aproximadamente), así mismo es importante monitorear los niveles de vitamina B12 en pacientes que lleven usando metformina por más de 3 años 6,41.
El SGLT2 es un cotransportador, que se encarga de transportar sodio y glucosa en una proporción de 1:1 empleando un gradiente de concentración de sodio mediado por Na+/K+ ATPasa en la membrana basal del túbulo proximal 28. Los inhibidores de SGLT-2 inhiben la reabsorción tubular de glucosa en el túbulo proximal promoviendo la excreción urinaria de glucosa, lo cual favorece el control glucémico. También se conoce, que tienen potentes efectos antinflamatorios a nivel renal y que impactan en los efectos deletéreos dados por la glucotoxicidad intrarenal, además son vasodilatadores renales y mejoran la hipoxia tisular renal, entre otros efectos 10. Un ECA publicado en 2015, Empagliflozin Cardiovascular Outcome Event Trial in Type 2 Diabetes Mellitus patients (EMPA-REG OUTCOME), demostró que la empagliflozina reduce manera significativa eventos cardiovasculares en pacientes con DM tipo 2 con enfermedad cardiovascular preexistente 42. Un análisis post hoc de los resultados renales mostró que la empagliflozina reduce la progresión de la ND 43.
Los resultados de los programas Canagliflozin cardiovascular Assessment Study (CANVAS) con canagliflozina y Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes (DECLARE-TIMI 58) con dapagliflozina, demostraron beneficios cardio-renovasculares en pacientes con DM2. Posteriormente, Una revisión sistemática y metanálisis de estos estudios mostraron efectos protectores cardiovasculares y renales favorables 28,44-46. Lo anterior, favorecio a que se desarrollaran estudios en pacientes con ERD. El estudio Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy (CREDENCE), empleando canagliflozina en pacientes con DM tipo 2 fenotipo albuminúrico, con TFG estimada entre 30 a 90 mL/min/1.73 m2, albuminuria de 300 a 5000 mg/gCr evaluando directamente resultados renales 47. Este último trabajo corrobora los beneficios de los iSGLT-2 para la ERD en pacientes con DM tipo 2 28. Los mecanismos que median los efectos renoprotectores de los iSGLT-2 no están del todo dilucidados, sin embargo, se conoce que tienen efectos benéficos renales tanto directos como indirectos. Los efectos indirectos más relevantes son: favorecer el control metabólico, bajar de peso, mejorar variables hemodinámicas y disminuir el riesgo cardiovascular y dentro de los efectos directos los más relevantes son: la corrección de la hiperfiltración glomerular, la mejoría en la casada inflamatoria renal y la mejoría de la hipoxia renal 28. Los beneficios de estos medicamentos se extienden a pacientes con ERC no diabética, resultados derivados de ECA de fase III, incluyendo los resultados favorables derivados del Dapagliflozin in Patients with Chronic Kidney Disease (DAPA-CKD), demostraron que en pacientes con ERC diabética y no diabética, la intervención con dapagliflozina mejoraba desenlaces cardiovasculares, renales y mortalidad por todas las causas. El estudio Study of Heart and Kidney Protection with empagliflozin (EMPA-KIDNEY), también demostró beneficios cardiovasculares y renales 57. Una descripción detallada de su utilidad fuera de la ERD escapa a los objetivos de esta revisión 48,49. Por todo lo anterior, este grupo de medicamentos son considerados de primera línea junto con la metformina en el manejo de pacientes con ERD.
Los agonistas del receptor del péptido similar al glucagón (aR GLP-1) son un grupo de agentes antidiabético con potencial para prevenir el desarrollo de ERD 21. El GLP-1 es una hormona perteneciente al grupo de las incretinas que estimula la secreción de insulina en respuesta a la ingesta alimenticia y sus análogos son ampliamente empleados en el tratamiento de la DM tipo 2 6,50. En los ensayos clínicos LEADER y SUSTAIN-6, el tratamiento con liraglutida y semaglutida respectivamente, favoreció una reducción en la tasa de eventos cardiovasculares mayores y muerte 51,52. Por otro lado, en los ensayos clínicos mencionados anteriormente, y posteriormente en el estudio REWIND, con dulaglutida, el uso de Ar GLP-1 demostró beneficios renales independientemente del comportamiento de la HbA1c, reflejando principalmente una reducción en la aparición de albuminuria 50-53. Los efectos sobre la albuminuria se han logrado desprender del comportamiento de la HbA1c también en análisis post hoc de estos estudios 50.
Los inhibidores de la Dipeptidil peptidasa-4 (DPP-4i) prolongan la actividad de GLP-1 inhibiendo su catabolismo y se emplean con regímenes de dosificación ajustados en pacientes con ERD 54,55. Estos medicamentos son hipoglucemiantes orales que han demostrado eficacia en el control glucémico de personas con DM tipo 2 y ND, bajo riesgo de hipoglucemia, efecto neutro sobre el peso corporal y un perfil de seguridad cardiovascular que permite su uso en pacientes con ERC 55. No obstante, a pesar que pueden mejorar dos componentes de la ND, como son la hiperglucemia y albuminuria, los ECA no han sido concluyentes con relación a su probable rol en el manejo de la ERD 54.
En los últimos años se han desarrollado guías relacionadas con DM y enfermedad renal crónica 6,41. Las guías más relevantes a nivel mundial son las guías KDIGO publicadas en el año 2020, las cuales se refieren al tratamiento de la ERD 56. Estas guías debido a la importante literatura reciente que ha venido surgiendo en los últimos meses se han actualizado y básicamente proponen, en primera instancia que el manejo de la ERD debe ser holístico donde es importante el control del estilo de vida, modificar hábitos, reducción de peso, eliminar el sedentarismo y tabaquismo, entre otras indicaciones 56. En primera línea para el tratamiento de los pacientes con DM tipo 2 está la metformina hasta TFG de 30 mL/min/1.73 m2 e inhibidores de SGLT-2 (dapagliflozina, empagliflozina y canagliflozina) los cuales pueden ser empleados para su iniciación hasta TFG de 20 mL/min/1.73 m2 56. Además, para los pacientes con DM tipo 1 y tipo 2 en primera línea está incluido el bloqueo RAS y también se trazan objetivos en los cuales juega un papel importante el uso de las estatinas 6,56. En segunda línea, para los pacientes con DM tipo 2, luego del uso de iSGLT-2 y metformina cuando queremos mejorar el control metabólico, bajar de peso o incrementar la protección cardiorenal, se deben utilizar los agonistas rGLP-1 que hayan demostrado cardioprotección y beneficios renales (dulaglutida, liraglutida y semaglutida) 6,56. También es importante resaltar que en las nuevas guías se empieza a indicar los antagonistas selectivos no esteroideos del receptor mineralocorticoide específicamente finerenona, el cual se ubica en las guías cuando el paciente con ERD tiene alto riesgo cardiovascular y a pesar del uso de IECA o ARAII no se consigue el control de la albuminuria 6,56. Recalcamos que en Colombia se publicó en el año 2021, las guías colombianas de adopción para el manejo de ERD, las cuales hablan sobre tamización, diagnóstico, riesgo cardiovascular y también tratamiento 6.
CONCLUSION
La ERD constituye una de las complicaciones más importantes de los pacientes con DM con repercusiones definidas en la calidad de vida y en el pronóstico global de la enfermedad. Se han presentado diferentes avances en la fisiopatología de esta entidad y crecimiento en las intervenciones terapéuticas derivadas de este conocimiento, por lo tanto, es importante una actualización en los principales conceptos al respecto. El futuro es promisorio.
Contribución de los autores:
Jorge Rico-Fontalvo, Rodrigo Daza-Arnedo y Tomas Rodriguez-Yanez: elaboración del protocolo, reclutamiento de datos, análisis de resultados, escritura del artículo.
Maria Raad-Sarabia y Juan Diego Montejo-Hernandez: concepción y diseño de la investigación, análisis de resultados, escritura del artículo, análisis de conclusiones.
Mauricio Lopera-Vargas y Javier Jiménez: búsqueda bibliográfica, reclutamiento de datos, análisis de resultados, revisión del artículo.
Lourdes Carolina Vázquez Jiménez: revisión del artículo, análisis de conclusiones.
Conflicto de intereses: El Dr. Javier Jimenez Quintero es empleado de Astra Zeneca con propiedad, opciones y/o intereses en el stock de Astra Zeneca. Los demás autores para este artículo no reportan conflicto de interés.
Financiación: Los autores reportan que la financiación para este artículo fue con recursos propios.