INTRODUCCION
La neurofibromatosis consiste en un grupo de trastornos genéticos predominantemente hereditarios, de carácter autosómico dominante, que condicionan una anormalidad neuroectodérmica, fue reconocida por primera vez como entidad nosológica en 1882 por Friederich Daniel Von Recklinghausen 1. Se ha descrito dos tipos de presentación que fueron denominadas tipo I y tipo II 1,2.
La neurofibromatosis tipo I (NF1) es la más frecuente de las presentaciones, afecta aproximadamente a 1 de cada 3000 personas; se presenta clínicamente con las bien conocidas máculas “café au lait” o formación de múltiples neurofibromas, generalmente plexiformes, en todo el cuerpo, aunque se caracteriza por su gran variabilidad de manifestaciones 3.
La neurofibromatosis tipo II (NF2) afecta aproximadamente a 1 de cada 25.000 a 50.000 individuos y se presenta de otra manera puesto que demuestra predilección por el sistema nervioso central, afectando encéfalo y médula espinal, y siendo los schwannomas vestibulares bilaterales los hallazgos patognomónicos de esta entidad; de igual manera pueden resultar hallazgos en este contexto otras neoformaciones como schwannomas espinales y periféricos múltiples, meningiomas y ependimomas 4.
Sin embargo, los hallazgos tumorales del sistema nervioso no son exclusivos de la NF2, en la NF1 podemos encontrar gliomas, glioblastomas y tumores malignos de la vaina del nervio periférico, este último correspondiente al caso que es presentado a continuación. Además de estos, en la NF1 también se ha documentado extensamente formación de tumores no dependientes del sistema nervioso central, comprometiendo al aparato digestivo, glándulas mamarias, suprarrenales, entre otros órganos 3,5,6.
De manera a ahondar un poco en el tema pertinente, el tumor maligno de la vaina del nervio periférico (TMVNP o también conocido por sus otros nombres: neurilemoma maligno, sarcoma neurogénico, neurofibrosarcoma, schwannoma maligno o neurofibroma anaplásico) es un tipo de neoplasia neurogénica que puede surgir en cualquier parte del cuerpo. Se ve con mayor frecuencia en adultos y posee una incidencia de 2 al 29% en pacientes con NF1 6 aunque también han sido descritos con una incidencia sumamente baja en la población general y en niños 6,7.
El rol de la radiología en el estudio de TMVNP es el de valorar la lesión por la que inicialmente acudió el paciente y descartar la presencia de otras posibles tumoraciones que podrían llegar a existir en el contexto de una NF1, siendo los métodos de mayor utilidad la tomografía computada (TC), la tomografía computada por emisión de positrones (PET-TC) y la resonancia magnética (RM) 1,6,8.
La TC de un paciente con NF1 resulta de especial atención puesto que estos pueden llegar a presentar neurofibromas en cualquier zona del cuerpo, pudiendo prestar a confusiones por su capacidad de simular a otras patologías neoplásicas o secundarismo cuando se presentan en gran cantidad. Los neurofibromas son neoformaciones benignas que pueden presentar una baja atenuación con características de tejidos blandos hipovasculares al estudio tomográfico contrastado, esta baja atenuación puede ser producida por múltiples factores como la degeneración quística de la lesión, características xantomatosas, áreas confluentes de hipocelularidad y/o células de Schwann ricas en lípidos, en las variantes plexiformes también puede deberse a tejido adiposo atrapado en su interior. Las regiones de mayor captación poscontrastal pueden deberse a componentes celulares densos o regiones ricas en colágeno, estas regiones pueden ser confluentes hacia áreas internas del tumor, aunque resulta más típica su visualización en la periferia de la lesión 9.
El TMVNP se presenta al estudio tomográfico como una neoformación de morfología irregular y, en algunas ocasiones, de márgenes poco claros, presenta un tamaño generalmente mayor que 5 cm, de crecimiento rápido constatable en controles evolutivos, de aspecto heterogéneo con áreas centrales hipocaptantes y periféricas de mayor captación, con capacidad de infiltración de tejidos adyacentes y destrucción ósea; salvo por este último signo, ninguno puede definir la sospecha diagnóstica, sin embargo al encontrarse en conjunto permiten orientar hacia la malignidad 10.
La RM puede utilizarse como un método de evaluación complementario y para realización de controles evolutivos en el caso del TMVNP, en esta se podrá visualizar, además de los hallazgos ya mencionados anteriormente, otros signos de manera más sensible que en el estudio tomográfico, como ser el edema peritumoral caracterizado por hiperseñal en secuencias edema-sensibles, signos de sangrado intralesional visibles como hiperintensidad en secuencias ponderadas en T1 y correcta identificación de áreas de degeneración quística y componentes grasos internos 10. Otra utilidad de la RM es la de valorar las eventuales lesiones del sistema nervioso central con gran sensibilidad y especificidad, aunque en esta ocasión no se hará énfasis en estas lesiones debido a que no resultan pertinentes para el caso presentado 11.
Por último, y si bien su uso en nuestro medio aún no está muy extendido, es importante conocer lo que permite valorar la PET-TC, la cual cobra su importancia en la diferenciación de lesiones benignas y malignas a través de la medición del valor de absorción estándar para fluor-18-fluorodesoxiglucosa (18F-FDG); existen además otros parámetros medibles como el volumen tumoral metabólico y glicólisis total de la lesión, pero no existe evidencia suficiente aún que justifiquen su uso rutinario 12.
El diagnóstico final de cualquiera de las lesiones mencionadas previamente se da mediante el estudio histopatológico e inmunohistoquímica 6.
Con el propósito de valorar los hallazgos radiológicos encontrados en este tipo de pacientes y confrontar con los datos aportados por anatomía patológica se presenta el siguiente caso.
PRESENTACIÓN DEL CASO
Paciente adulto de 47 años, sexo masculino, conocido portador de Neurofibromatosis tipo I (diagnóstico realizado a los 12 años por biopsia de lesión cutánea), también de hemorroides que acudió al servicio de urgencias por cuadro de rectorragia y melena. Al examen físico de la región afecta se constató un abdomen blando, distendido, depresible, no doloroso, ruidos hidroaéreos presentes y al tacto rectal heces de coloración normal. A nivel de piel y faneras se constataron manchas “café con leche” de distribución difusa en todo el cuerpo. A la exploración torácica impresionó un tórax simétrico, con excursión respiratoria conservada, sin tirajes, retracciones ni tumoraciones. Al examen laboratorial presentó una HB de 7 g/dl y Hto de 21%, por lo que se procedió a realizar una Endoscopía digestiva alta donde se visualizó una úlcera pequeña en región prepilórica de alrededor de 1 cm, cubierta de fibrina (Forrest I) y otra úlcera de gran tamaño, infranqueable, por lo que resultó difícil cuantificar sus dimensiones, de bordes sobreelevados, con cubierta de fibrina e importante edema perilesional que deformaba y producía estenosis el píloro. Se tomaron muestras de biopsias que reveló una lesión inflamatoria no neoplásica.
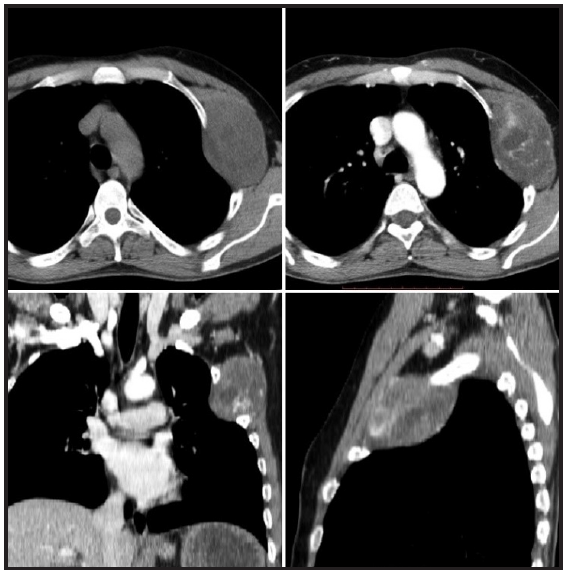
Figura 1. Reconstrucción multiplanar del estudio tomográfico sin y con contraste realizado en el año 2019 donde se aprecia la masa en parrilla costal izquierda
Se le solicitó un barrido tomográfico (Figura 1) donde se visualizó, a nivel de la parrilla costal izquierda, una masa de densidad tisular, de bordes regulares y bien delimitada, con realce heterogéneo de contraste a expensas de áreas centrales necróticas hipocaptantes, mide 8 cm de diámetro mayor. En ambas glándulas suprarrenales se evidenciaron lesiones sólidas, a derecha mide 36 x 29 mm (anteroposterior x transversal) con un lavado absoluto del 47% y lavado relativo del 28%, y a izquierda mide 13 x 9 mm con un lavado absoluto de 51% y relativo del 31%; estas dos imágenes son interpretadas como lesiones tumorales teniendo en cuenta los valores de lavado relativo y absoluto.
En segmento III del hígado se visualizó una lesión hipovascular única que inicialmente fue considerada como imagen tumoral de etiología a filiar, con tendencia hacia el diagnóstico de secundarismo hepático; en región antro-pilórica se constató además un segmento de 5 cm de engrosamiento parietal concéntrico de hasta 27 mm de espesor, relacionadas a lesión estenosante antes descripta en la exploración endoscópica.
Posterior a la realización de este estudio se perdió el contacto con el paciente, el cual retornó luego de 10 meses con motivo de consulta de dificultad respiratoria; al examen físico presentó en esta ocasión un tórax asimétrico abombado a izquierda a expensas de tumoración sólida sin cambios inflamatorios. En esta internación se volvió a solicitar un nuevo barrido tomográfico para valoración evolutiva de los hallazgos previamente descritos.
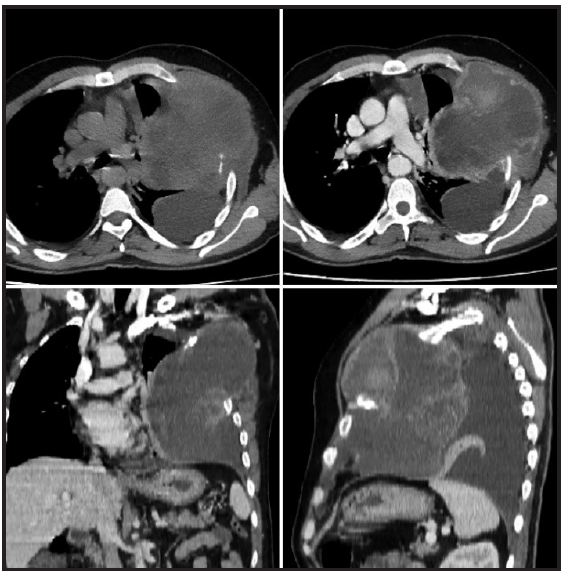
Figura 2. Reconstrucción multiplanar del estudio tomográfico sin y con contraste realizado en el año 2020 donde se aprecia la masa en parrilla costal izquierda, de mayor tamaño en relación con el estudio previo
En este nuevo estudio (Figura 2) se constató un aumento de tamaño de la masa en parrilla costal izquierda con una dimensión de 15 cm de diámetro mayor, sin variación de la captación del medio de contraste respecto al estudio previo, abarcaba el hemitórax izquierdo, de vértice a base, englobaba a la tercera costilla ipsilateral, producía atelectasia tanto en el lóbulo superior e inferior por obstrucción del bronquio principal izquierdo y efecto de masa sobre las estructuras mediastínicas.
Las lesiones de glándulas suprarrenales y la lesión hepática se constataron estables con respecto al estudio anterior, por lo que, en esta segunda valoración se interpretaron como procesos neoplásicos benignos; persistía además la lesión en región antropilórica, sin modificaciones. En los cortes que pasan por el cráneo, no se apreciaron alteraciones del parénquima encefálico ni captación anómala del medio de contraste.
Se procedió a toma de biopsia de la masa tumoral localizada en hemitórax izquierdo; en el informe histopatológico se constató un proceso proliferativo fusocelular con atipia nuclear moderada, que compatible con un tumor maligno de la vaina del nervio periférico (Figura 3). No se pudo realizar tinciones de inmunohistoquímica por la limitación del tamaño de la biopsia.
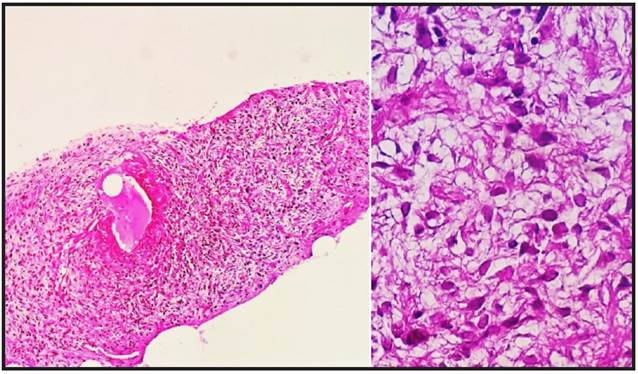
Figura 3. Histología de la biopsia del tumor en región torácica. Cortes histológicos a mediano y mayor aumento, con coloraciones de H y E, correspondientes al Tumor Maligno de la vaina del nervio periférico. Gentileza del Departamento de Anatomía Patológica-Hospital de Clínicas, San Lorenzo-Paraguay
DISCUSION
El tumor maligno de la vaina del nervio periférico (TMVNP) se desarrolla fundamentalmente a expensas de troncos nerviosos principales, incluyendo el nervio ciático, el plexo braquial y plexo sacro 13.
Inicialmente el paciente en cuestión fue sometido a un barrido tomográfico donde se constató una tumoración sólida heterogénea en pared torácica izquierda, de aproximadamente 8 cm de diámetro mayor, de bordes irregulares, con áreas centrales de degeneración quística/necrótica. En su segunda tomografía la tumoración aumentó de tamaño, llegando hasta 15 cm de diámetro mayor, y envolvía a la 3era. costilla. Estas características radiológicas concuerdan con las descripciones presentadas en los trabajos de Yong-hui y col 10 y Patel y col 14, en los cuales habla que en un paciente conocido portador de NF1, una tumoración sólida de gran tamaño, captación heterogénea del contraste, bordes irregulares y destrucción ósea son sugestivos de TMVNP, posteriormente evaluado por el equipo de anatomía patológica de nuestro centro hospitalario, quienes plantearon el mismo proceso neoplásico como diagnóstico.
En cuanto a las lesiones de glándulas suprarrenales y la lesión hepática, ya que estas se mantuvieron estables en el tiempo sin tratamiento neoadyuvante y en ausencia de una clínica (hipertensión arterial) que oriente hacia neoplasia primaria como el feocromocitoma o secundarismo, fueron interpretadas como lesiones benignas, probables neurofibromas; persiste además la lesión en región antropilórica, sin modificaciones, hallazgos descriptos en el trabajo de Fortman y col 9.
Además, nuestro paciente presentó engrosamiento parietal de la región antropilórica que, tras la realización de una endoscopía con posterior toma de biopsia se llegó al diagnóstico de un proceso inflamatorio. Estos hallazgos se diferencian con lo presentado en los trabajos de Toapanta-Yanchapaxi y col 15 y Valle y col 16, en el primero nos muestra que las evacuaciones melénicas de la paciente se debieron a un Tumor estromal gastrointestinal fusocelular (GIST), diagnosticado por inmunohistoquímica; y en el segundo trabajo el paciente presentó un cáncer de colon en células de anillos de sello. Es importante recordar que las personas portadoras de NF1 pueden tener varias manifestaciones gastrointestinales, desde hiperplasia de la submucosa y de las células Schwann de los plexos nerviosos mioentéricos hasta formación de variedades de tumores estromales.
La ausencia de sintomatología o focalización alguna y un estudio tomográfico sin hallazgos patológicos a nivel encefálico llevó a que el paciente no amerite la realización de estudios más sensibles para la valoración de dicha región, como sería una RM; a pesar de esto se ha descrito extensamente en la bibliografía otros hallazgos en el sistema nervioso central, como son los gliomas de la vía óptica que fueron presentados por otros autores como O'Brien y col 11 y Jiménez Caballero y col 17.
Debido a que el TMVNP es el tumor más frecuente asociado a NF1, la asociación entre los hallazgos radiológicos encontrados (los cuales son típicos para la patología) y las coloraciones de rutina de anatomía patológica resultó suficiente para el diagnóstico. Como dificultad encontrada durante este caso, no se ha podido definir la estirpe celular mediante la inmunohistoquímica debido a dificultades con la escasa muestra inicial y la falta de colaboración del paciente debido a motivos religiosos.
Es importante tener siempre presente que la NF1 suele estar asociada a múltiples tumores, desde el TMVNP - uno de los más frecuentes y correspondiente al caso presentado - hasta tumores del SNC y variedades de tumores estromales gastrointestinales.
Por lo tanto, para el médico radiólogo es de vital importancia tener conocimiento de la patología y de los hallazgos radiológicos de la NF1, para no confundir los múltiples neurofibromas - los cuales son neoformaciones benignas - con neoplasias malignas o lesiones sugerentes de secundarismo.
Conflicto de intereses: Ninguno de los autores posee conflicto de intereses en lo relacionable con el caso presentado.















