Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Ciencias Médicas (Asunción)
Print version ISSN 1816-8949
An. Fac. Cienc. Méd. (Asunción) vol.49 no.2 Asunción Dec. 2016
https://doi.org/10.18004/anales/2016.049(02)49-068
ARTÍCULO DE REVISION
MANEJO DEL FETO CON TRANSLUCENCIA NUCAL AUMENTADA
MANAGEMENT OF THE FETUS WITH INCREASED AT NAPE TRANSLUCENCY
RuotiCosp M.
Profesor Adjunto. Cátedra de Ginecología y Obstetricia. Facultad de Ciencias Médicas. Universidad Nacional de Asunción (UNA). Magister en Medicina Perinatal. UNA. Paraguay.
RESUMEN
La medida de la TranslucenciaNucal (TN) es un método ampliamente aceptado en el cribado de anomalías cromosómicas. Su técnica está bien descrita y estandarizada, refiriéndose como aumentada cuando la medida está por encima del percentil 95.
Su combinación con la edad materna, hueso nasal y marcadores bioquímicos, pueden detectar aproximadamente el 90% de los fetos con Trisomía 21 y en forma aislada el 70% con una tasa de falsos positivos del 5%.
Se han atribuido como causa de su aumento a la falla cardíaca, alteración en la composición de la matriz extracelular, hipoproteinemia fetal, congestión venosa en cabeza y cuello, fallo del drenaje linfático, infecciones congénitas o anemia fetal.
Su aumento se ha asociado a abortos o muertes fetales, anomalías fetales mayores y entre ellas las cardíacas o bien Síndromes genéticos, asociado a infecciones, macrosomía e incluso retraso en el desarrollo, por lo que no solamente se circunscribe a las alteraciones cromosómicas. De ahí radica su importancia de conocer el manejo de estas pacientes, en especial si el cariotipo es normal.
Palabras Clave:trasnlucencianucal, cromosomopatías, ecografía semana 11 – 13+6, cribado.
ABSTRACT
The extent of the Nuchal Translucency (NT) is a widely accepted method in screening for chromosomal abnormalities. His technique is well described and standardized, referring as increased when the measure is above the 95th percentile.
Its combination with maternal age, nasal bone and biochemical markers, can detect approximately 90% of fetuses with trisomy 21 and in isolated form 70% with a false positive rate of 5%.
Have been attributed as the cause of his increase to the heart failure, alteration in the composition of the extracellular matrix, hypoproteinaemia fetal, venous congestion in the head and neck, failure of lymphatic drainage, congenital infections or fetal anemia.
Its growth has been associated with abortion or fetal deaths, fetal abnormalities elderly and among them those of heart or genetic syndromes, associated to infections, macrosomia and even delay in development, so that not only is confined to the chromosomal alterations. Hence lies its importance of knowing the management of these patients, in particular if the karyotype is normal.
Key Words:nuchal translucency, aneuploidies, ultrasound week 11 – 13+6, screening.
INTRODUCCION
La exploración ecográfica entre las semanas 11 y 13+6 tiene un papel fundamental en el cribado de anomalías cromosómicas y la medida de la TranslucenciaNucal (TN) es un método bien establecido y ampliamente aceptado para este fin. La técnica para su evaluación está bien descrita y estandarizada (1). Se refiere como aumentada cuando la medida está por encima del percentil 95 y se emplea independientemente de que la colección de líquido este septada (higroma) o no y de que este´ confinada al cuello o envuelva al feto. La determinación de la TN en combinación con la edad materna, hueso nasal y marcadores bioquímicos (PAPP – A y ß hCG), pueden detectar aproximadamente el 90% de los fetos con Trisomía 21 y otras anomalías cromosómicas mayores (2). Utilizándolo en forma aislada para la detección del síndrome de Down puede alcanzar el 70% con una tasa de falsos positivos del 5% (3). Una vez descartada la existencia de cromosomopatías mediante la realización de una prueba invasiva, hay hasta un 4,4% (4) de fetos con cariotipo normal que presentan una TN aumentada. Numerosos trabajos coinciden en la utilidad de este marcador no solo para el diagnóstico de aneuploidías, sino también de malformaciones estructurales, síndromes genéticos, displasias, disrupciones, o sea, aporta información pronostica de carácter general a la gestación, de manera que el grosor se asocia, de forma directamente proporcional, con un pronóstico perinatal adverso.
Múltiples y diferentes mecanismos se han relacionado con el incremento de la TN entre las semanas 11 y 13+6, por lo que su conocimiento será de gran utilidad al momento de realizar una exploración dirigida, fundamentalmente en aquellas gestaciones euploides evolutivas tras el resultado normal del cariotipo fetal. FISIOPATOLOGÍA DEL AUMENTO DE LA TRANSLUCENCIA NUCAL
El conocimiento de la fisiopatología del aumento del líquido a nivel cervical fetal es motivo de controversia, debido a la gran variedad de anomalías relacionadas con una TN aumentada, lo que sugiere un mecanismo multifactorial.
Fallo cardiaco
Se basa en la asociación existente con malformaciones cardiacas (5) e incluso, el aumento de anomalías en el flujo del ductus venoso en fetos con dichas anomalías. Pero es difícil de explicar el mecanismo exacto de esta posible relación, ya que se encuentran diferentes tipos de defectos congénitos cardíacos y consecuentemente diferentes alteraciones hemodinámicas (6).
Una alternativa podría ser insuficiencia cardíaca (7) aunque en la actualidad la relación entre la función cardiaca deteriorada aún no ha sido establecida por todos los grupos de investigación.
Alteración en la composición de la matriz extracelular
Numerosas proteínas que componen la matriz extracelular se codifican en los cromosomas 21, 13 y 18, por lo que este mecanismo podría estar implicado en dichas cromosomopatías (8,9).
Los cambios en la matriz extracelular debido a una mayor concentración de ac. hialurónico da como resultado una hidratación excesiva de ella, alterando tanto la función como la migración de las células de la cresta neural, lo que facilita la aparición de defectos craneofaciales y anomalías cardíacas, presentes por ejemplo, en el síndrome de Noonan y otros síndromes asociados TN aumentada (10).
Por otro lado, también podría ser el mecanismo subyacente en anomalías genéticas asociadas a alteraciones del metabolismo del colágeno (acondroge´nesis tipo II), alteraciones en el metabolismo de los peroxisomas (síndrome de Zellweger) o bien en anomalías en los receptores de los factores de crecimiento de fibroblastos (acondroplasia o displasia tanatofo´rica) (11).
Hipoproteinemia fetal
En primer trimestre podría ser el mecanismo responsable en fetos con síndrome nefrótico
congénito (12).
Congestión venosa en cabeza y cuello
Podría explicar la TN aumentada en el síndrome de banda amniótica (13), hernia diafragmática por la compresión/desplazamiento del mediastino (14) o el tórax estrecho en las displasias
esqueléticas (11).
Fallo del drenaje linfático
Se debería a una dilatación de los sacos linfáticos yugulares, a una dilatación primaria anormal de los vasos linfáticos o bien a un retraso en el desarrollo del sistema linfático, lo que interfiere, con cualquiera de esas hipótesis, con el flujo normal entre los sistemas linfático y venoso (15).
Un estudio realizado por Mooij et al (16) demostró que hay una alteración en la diferenciación endotelial linfática en fetos euploides con TN aumentadas, teniendo un fenotipo similar al de los fetos aneuploides con agrandamiento de sacos linfáticos yugulares. Sin embargo, se necesita de mayores investigaciones para asegurar de que ésta teoría es plausible para todos los casos de aumento de la TN.
Además, el drenaje linfático deficiente causado por hipoplasia o aplasia de los vasos linfáticos se encuentra en asociación con el síndrome de Noonan y linfedema congénito.
En los trastornos neuromusculares congénitas, como distrofia miotónica o la atrofia muscular espinal, puede ser la consecuencia del drenaje linfático lento resultante de los movimientos fetales reducidos (11).
Infecciones congénitas
No parece existir una mayor incidencia de infecciones en los fetos con TN aumentada; la única infección asociada a dicho hallazgo es el Parvovirus B19 (17) aunque en estos casos el aumento de la TN se debe a disfunción miocárdica o a anemia fetal secundaria a la supresión de la hematopoyesis.
Anemia fetal
La anemia fetal de origen genético (a talasemia, anemia de Blackfan-Diamond, porfiriaeritropoye´tica congénita, anemia diseritropoye´tica, anemia de Fanconi) o asociada a infecciones congénitas puede presentarse con una TN aumentada (11).
ABORTO O MUERTE FETAL
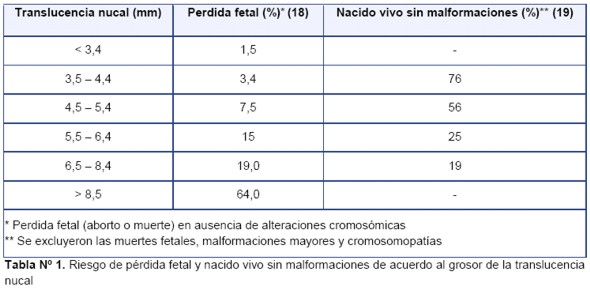
En los fetos euploides la prevalencia de aborto o muerte fetal aumenta de forma exponencial con el grosor de la TN como puede observarse en la Tabla 1 (18,19), datos que fueron confirmados por otros autores (20,21).
Para Souka et al (22) la prevalencia de aborto o muerte fetal fue estimada en 1,4% con la TN en el percentil 95 (3,4 mm), 2,0% entre 3,5 a 4,4 mm, 2,9% entre 4,5 a 5,4 mm, 8,3% entre 5,5 a 6,4 mm y a 16,9% de los fetos con TN de 6,5 mm o mas.
En los resultados recogidos por Bilardo et al (23), la prevalencia de aborto o muerte fetal aumento´ desde un 1,6% en fetos con TN entre los percentiles 95-99, a aproximadamente un 20% con una TN = 6,5 mm. La mayoría de las muertes fetales se produjeron antes de la semana 20 de gestación.
Por su parte, recientemente Pitkanen et al (24) analizaron 27,144 fetos únicos, de los cuales 16 (0,06%) presentaron TN = 6.5 mm. De estos, 2 fetos abortaron espontáneamente en la semanas 13 y 14 respectivamente, un feto normal llego al termino de la gestación y no informaron alteraciones estructurales o la presencia de algún síndrome, 11 de ellos fueron aneuploides (5 de ellos T21, otros 5 fueron 45X0 y 1 T18), reportaron 1 defecto cardíaco mayor y 1 feto con el diagnóstico de Incontinencia pigmenti.
Por los datos expuestos, se debe asesorar a los padres de esta posibilidad antes de cualquier técnica invasiva y también después de ellas sobre todo si el resultado del cariotipo es normal.
ANOMALÍAS FETALES MAYORES
La presencia de TN aumentada en un feto con cariotipo normal significa un riesgo mayor de anomalías estructurales fetales, si bien el pronóstico perinatal no empeora de forma estadísticamente significativa hasta que el grosor de la medida alcance 3,5 mm o más (>p99). La probabilidad de que el feto no este afectado es del 70% para valores de TN entre 3,5 – 4,4 mm y disminuye a medida que la TN aumenta de grosor como lo demuestra la Tabla Nº 1 (18,19).
Hay una amplia variedad de anomalías estructurales y de alteraciones del desarrollo descritas en el contexto de una TN aumentada. Una revisión realizada por Souka et al (11) mostró grandes diferencias entre los estudios de prevalencia de anomalías mayores, que van del 3% al 50%, principalmente a causa de las diferencias en la población estudiada y en la definición de aumento de la TN.
Un estudio realizado por Westin et al (25) demostró que una TN de 3 mm o más aumentó la probabilidad de malformaciones letales o graves en 15 veces, de 3,5 mm o más a 40 veces, y TN de 4,5 mm o más a 80 veces.
Defectos cardíacos
Hay suficiente evidencia para afirmar que el aumento de la TN en un feto euploide se asocia con un mayor riesgo de anomalías estructurales, especialmente defectos cardíacos congénitos. Los estudios anatomopatológicos del corazón y grandes vasos en fetos euploides con aumento de la TN, han demostrado una alta prevalencia de este tipo de anomalías (26).
Hyett et al (27) evaluaron la relación entre el grosor de la TN y defectos cardíacos en más de 29.000 fetos euploides, reportando que la incidencia de defectos cardíacos aumentó junto con el tamaño de la TN. La prevalencia fue de sólo el 0,8 por 1.000 en fetos con TN normal y aumentó a 28,9 por 1000 con TN de 3,5 a 4,4 mm; 90,9 por 1000 con TN de 4,5 a 5,4 mm, y 195,1 por 1 000 mm con TN de 5,5 mm.
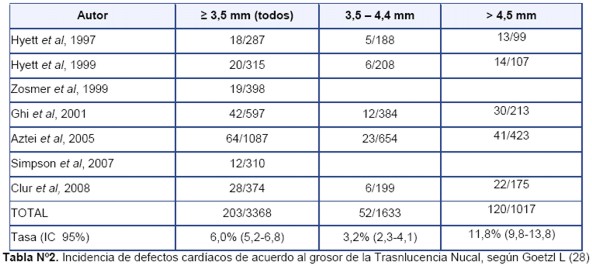
Goetzl(28) analizó 7 estudios en los que la TN aumentada se relacionó con defectos cardíacos como se observa en la Tabla 2, determinando que para una TN =3,5 mm la incidencia global fue del 6,0%. Al estratificar la medida, halló que de 3,5 a 4,4 mm fue del 3,2%, mientras que para TN más de 4,5 mm de la incidencia de anomalías cardíacas subió hasta el 11,8%, sin que predomine un tipo en particular de ellos.
Un meta-análisis de Makrydimas et al (29) mostró una TN en el percentil 99 se asoció a 30% de defectos congénitos cardíacos en lugar del 56%, sugerido inicialmente por Hyett et al (27).
Por su parte, Michailidis et al (20) reportaron que el 27% y el 36% de todas las anomalías cardiacas mayores ocurrieron en el grupo de los fetos cromosómicamente normales con TN por encima del percentil 95 y 99, respectivamente. En contraste, Mavrides et al (30) encontraron que sólo el 11% y el 15% de las cardiopatías congénitas mayores se produjeron en esos grupos similares.
Muller et al (31) encontraron resultados similares, con una prevalencia de cardiopatías congénitas mayores en fetos con TN por encima del percentil 99 de 9,5%. Un reciente meta-análisis de Sotiriadis et al (32) mostró que cuando el análisis se restringió a los estudios con operadores certificados por la Fetal Medicine Foundation, la sensibilidad fue del 40,7% utilizando el percentil 95 de corte y el 14,5% con el percentil 99.
Hasta el momento, la heterogeneidad de los estudios impide la evaluación del valor predictivo verdadero de medición de la TN en la detección de defectos congénitos cardíacos.
El hallazgo de que el aumento de la TN no se limita a tipos específicos de defectos cardíacos tiene implicaciones potencialmente importantes en cuanto al desarrollo de estrategias de cribado de anomalías cardiacas mayores. Defectos como tetralogía de Fallot, transposición de las grandes vasos o coartación aórtica raramente se detectan mediante un examen de rutina en el segundo trimestre en la evaluación cardiaca de 4 cámaras. Sin embargo, una alta proporción de estas anormalidades cursan con aumento de la TN.
Con base en estos hallazgos, el aumento de TN en fetos euploides debería constituirse en indicación más para la realización de una ecocardiografía fetal (33), lo que resultaría sin lugar a dudas, en una mejor detección prenatal de los defectos cardíacos congénitos
Otras anomalías
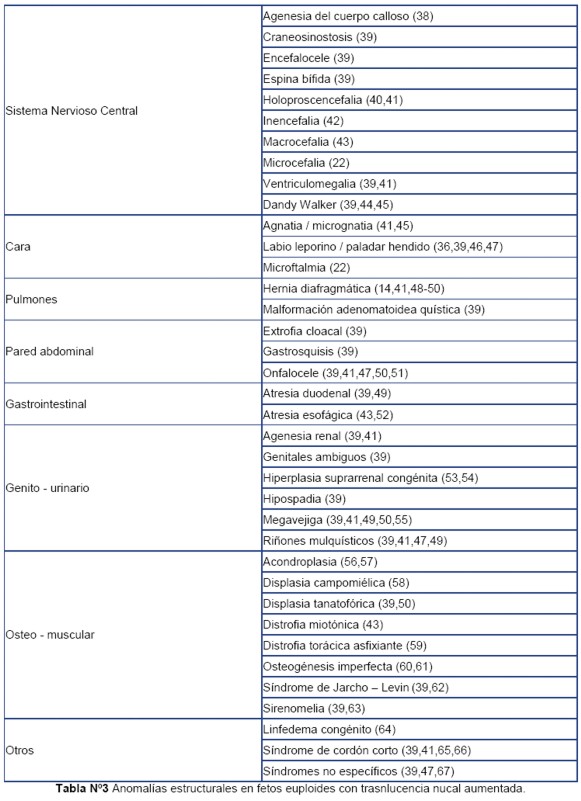
En la literatura (34) se han reportado diversas anomalías estructurales como hernia diafragmática, onfalocele, displasias esqueléticas, síndrome de cordón corto, megavejiga, entre otros. En la Tabla 3 se detalla un listado de anomalías que han sido reportadas con TN aumentada en fetos euploides, pero este listado no hace un análisis exhaustivo, sin embargo, sirve para orientar hacia una búsqueda detallada.
Un reciente artículo publicado (35), en la cual analizaron 75.899 fetos euploides sin cardiopatías, hallaron 1.379 (181,7/10.000) fetos con alguna malformación congénita mayor, entre los que cabe destacar defectos genitourinarios obstructivos (37,7/10.000), hipospadias, epispadias y otras anomalías del pene (45,6/10.000), anomalías del cráneo y de la cara (22,5/10.000), labio leporino (16,9/10.000), estenosis congénita hipertrófica del píloro (16,7/10.000), entre las principales.
Las anomalías que presentaron TN=percentil 99 destacaron las pulmonares (RR 7,9; IC 95%
2,6-23,5); del sistema nervioso central (RR 4,9; IC 95% 1,6-14,8), musculoesqueléticas (RR 3,4 IC 95% 1,7-7,2) y genitourinarias (RR 1,9 IC 95% 1,0-3,7).
Por otra parte, cuando compararon cada uno de los defectos congénitos de acuerdo al valor de la TN, determinaron que habían diferencias estadísticamente significativas entre aquellos que tenían un valor =95 percentil que los valores de <95 percentil, resultando para la agenesia, hipoplasia o displasias pulmonares RR 4,7 (IC 95% 2,3-9,5); atresia y estenosis intestinal RR 4,3 (IC 95% 1,8-10,2), osteodistrofias RR 4,3 (IC 95% 1,3-14, 7), anomalías del diafragma RR 3,8 (IC 95% 1,6-9,3), hidrocefalia RR 3,0 (IC 95% 1,2-7,3), fistulas traqueoesofágicas, atresias esofágicas y estenosis RR 2,7 (IC 95% 1,0-7,8), hipospadias, epispadias y otras anomalías del pene RR 1,7 (IC 95% 1,2-2,4), defectos obstructivos del tracto genitourinario RR 1,6 (IC 95% 1,1-2,4), entre las principales.
Por su parte, Timmerman et al (36) demostraron que hay 19 veces mas probabilidades que el feto tenga una hendidura facial cuando la TN esta aumentada en comparación con fetos de TN normal.
Scott et al (37) examinaron 120 casos de fetos con TN de más de 6,5 mm; hallando que el 74% tenían una anomalía cromosómica y el 26% restante cariotipo normal. En este ultimo grupo, sólo 8 nacieron vivos, de los cuales 7 no mostraron anomalías en la ecografía detallada pero 4 de los 7 recién nacidos tenían una anormalidad estructural o síndrome genético diagnosticada al nacimiento.
Por lo expuesto, no cabe dudas que un feto euploide con TN aumentada debe ser sometido a una ecografía que evalúe en detalle la anatomía fetal. Sin embargo, el momento ideal para su realización, no está establecido. Algunos han sugerido (11) primariamente hacerlo entre las 14 - 16 semanas, a manera de una evaluación preliminar de la anatomía fetal y para observar si la TN ha desaparecido o aumentado, considerando un pronóstico más favorable en le primer caso y desfavorable si progresa a hidrops fetal.
La evaluación posterior a las 20 - 22 semanas de gestación se puede realizar para completar el análisis anatómico según sea necesario y para evaluar la anatomía cardiaca fetal en especial.
Sin embargo, estas recomendaciones se basan en opinión de expertos y no reflejan ninguna comparación prospectiva sistemática de la utilidad de diversas estrategias. Por lo tanto, el momento ideal para su evaluación debe basarse en una combinación de factores, incluyendo la preferencia del médico, la preferencia del paciente y el índice de masa corporal materno.
Si cariotipo fetal es normal y la evaluación anatómica detallada en la semana 20 también lo es, para Bilardo et al (23) la posibilidad de un resultado normal es similar a la de la población general, alrededor de 4%.
SINDROMES GENETICOS
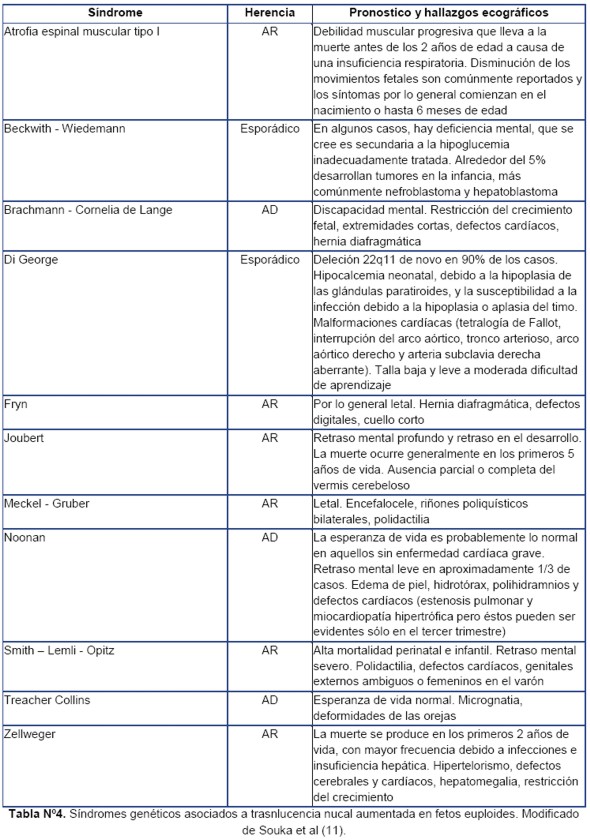
Los síndromes genéticos asociados con el aumento de la TN se resumen en la Tabla 4, listado que cada día aumenta por lo que exponemos los más significativos. El síndrome de Noonan y afines (68), el síndrome de Smith-Lemli-Opitz (69), atrofia muscular espinal (70) y otros trastornos músculo-esqueléticos tienen una alta asociación con una TN aumentada y cariotipo normal.
Prenatalmente, el síndrome de Noonan es el notificado con mayor frecuencia en asociación con aumento de la TN, con una incidencia promedio del 25% (33). Es un trastorno autosómico dominante, causado en aproximadamente 50% de los casos por una mutación en el gen PTPN 11 en el cromosoma 12 (71).
Houweling et al (72) proponen dada la alta incidencia de síndrome de Noonan en fetos con aumento de la TN y cariotipo normal, asesoramiento genético y detección de las mutaciones en todos los casos, independientemente de anomalías adicionales.
Otros síndromes son relativamente raros, por lo tanto, una indiscutible asociación entre su presencia y TN aumentada es en difícil de probar.
INFECCIONES
Un aumento de la TN en un feto euploide se asoció a infección por Parvovirus B19 (73). Este hallazgo en el primer trimestre se asocia con un resultado adverso en el 20% de los casos (28). Sin embargo, la exactitud de esta afirmación es poco aceptada debido al bajo número de reportes en tal sentido y a la falta de estudios que evalúen la presencia del Parvovirus en todas las gestantes con TN aumentada. Sin embargo, si hay una historia de contacto previo con un individuo afectado o síntomas maternos, sería razonable pensar en ello y realizar las serologías maternas específicas.
Si el aumento de TN conduce a signos de hidropesía fetal en las semanas 20 - 22, se recomienda el cribado de Parvovirus B19, además de evaluar las infecciones típicas asociadas con hidropesía fetal, como la Toxoplasmosis y Citomegalovirus (34).
MACROSOMÍA
Poon et al (74) determinaron que los fetos con TN aumentada tienden a presentar al nacimiento mayor peso, relacionando las características maternas como raza, peso, talla, tabaquismo y antecedentes de feto macrosómico, hipertensión crónica y diabetes, así como las características fetales.
Estos resultados fueron confirmados por otros autores cuando se compararon fetos con TN aumentada con aquellos con TN normal (33).
Por su parte, Weissmann - Brenner et al (75) también mostraron la relación entre la TN y peso al nacer en gestaciones únicas de madres no diabéticas. Esta correlación fue independiente del sexo, y el efecto predictivo de la TN se limitó a fetos grandes para la edad gestacional.
RETRASO EN EL DESARROLLO
No existen aún resultados consistentes sobre la relación entre la TN aumentada en fetos euploides y la probabilidad de retraso psicomotor dentro del diagnóstico de un cuadro sindro´mico o no.
Bakker et al (33) analizaron 14 estudios que realizaron seguimiento de esos niños a largo plazo, determinando que la proporción de retraso del desarrollo en la primera infancia oscila entre 0 y 8,7%.
Sin embargo, hay diversos inconvenientes por la ausencia de estandarización en los valores de corte de la TN, la edad de los niños en seguimiento, diferentes métodos de determinación de retraso en el desarrollo y el bajo número de estudios que incluyeron controles (solo 3 de los 14 analizados); por lo que la heterogeneidad en los estudios prenatales y postnatales hace que la información sobre la prevalencia de retraso del desarrollo neurológico en fetos euploides con aumento de la TN sea de difícil interpretación para llegar a una conclusión final.
En los estudios en los que se utilizó un grupo de control, y después de haber excluido anomalías cromosómicas, defectos estructurales y síndromes genéticos, se encontró una diferencia estadísticamente significativa entre los fetos con un aumento de la TN en comparación con la población general, donde el retraso del desarrollo fue de aproximadamente 4 - 5% (76-78).
En una revisión sistemática de Sotiriadiset al (79) llegaron a la misma conclusión. Sin embargo, se necesitan más estudios de seguimiento y a largo plazo.
MANEJO DE LA GESTACIÓN
Se considera que el punto de corte del aumento de la TN en el que alcanza una relación costo beneficio adecuada para llevar a cabo algún protocolo de estudio incluyendo una ecocardiografía, es el percentil 99 (3,5 mm). No hay consenso en el grupo con TN entre el percentil 95 y 99, en vista de que el valor predictivo positivo es más bien bajo (2%) (31,68). Sin embargo, si los recursos técnicos y humanos están disponibles, se sugiere su realización con un punto de corte en el percentil 95 (33).
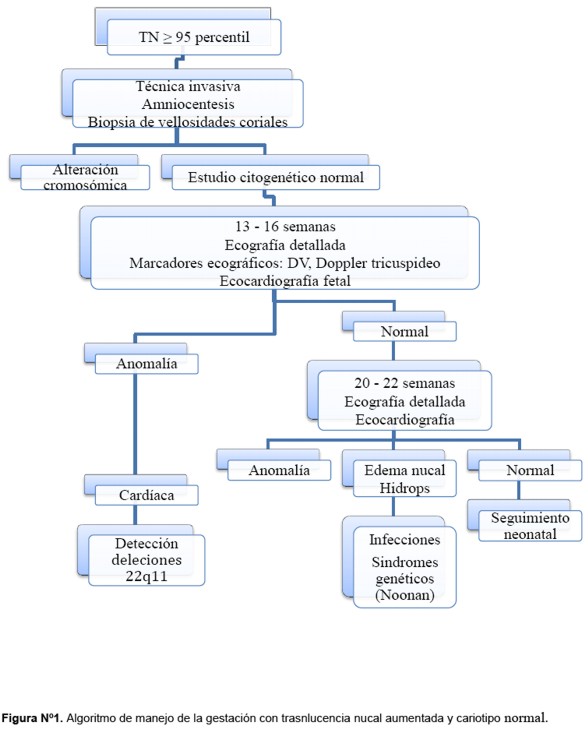
En la Figura 1 se presenta un posible algoritmo de manejo diagnóstico de estas gestantes.
Es recomendable llevar a cabo una valoración morfológica precoz a finales del primer trimestre o principios del segundo incluyendo la evaluación de posibles anomalías morfológicas y una ecocardiografía fetal. De esta manera si existiera una anomalía fetal por un lado, permite la realización de otras pruebas diagnósticas y el asesoramiento de los padres por un lado y por otro, si es subsidiaria de una interrupción voluntaria del embarazo (IVE) puede hacerse de manera más precoz con lo que el impacto emocional puede ser menor.
Los resultados de varios estudios (80-82) muestran que con la mejoría tecnológica en equipamientos de ultrasonografía y una mayor experiencia del operador, es posible detectar entre 40 - 70% de las anomalías congénitas graves, incluso podría llegar a 84%.
Se deben utilizar otros marcadores ecográficos como el Doppler del ductus venoso (DV) y el del flujo de la válvula tricúspide, ya que la presencia de uno o ambos, se asocian a un peor resultado perinatal (anomalías cardiacas o de otros orígenes y aumento de muerte fetal) (83,84). Además, el uso de estos dos marcadores en el cribado del primer trimestre reduce la tasa de falsos positivos.
Posteriormente habrá´ que completar este estudio con la ecografía morfológica de semana 20 que incluye una ecocardiografía para la exclusión o diagnóstico de anomalías mayores y defectos más sutiles que puedan hacernos sospechar una anomalía genética.
Si no hay hallazgos patológicos podemos informar a los padres de que el riesgo de tener un recién nacido con una anomalía o retraso psicomotor grave no es mayor del de la población general.
En aquellos casos en los que se identifiquen anomalías o defectos sutiles que nos hagan sospechar un cuadro sindro´mico, es de gran utilidad contar con el asesoramiento de un genetista que realice una valoración del caso con atención a sus posibles antecedentes familiares, los posibles diagnósticos y la existencias de técnicas diagnósticas específicas.
La detección de síndrome de Noonan se debe discutir con los padres si el edema nucal o hidrops persiste en el segundo trimestre o ante algunas características ecográficas sutiles.
El estudio de posibles infecciones no debe ser rutinario (14) pero si debe plantearse en aquellos casos en los que la TN continúa aumentada en el segundo trimestre o se produce una evolución a edema generalizado o hidrops o si existen datos de infección materna reciente (85). En estos casos, solicitar serologías de Toxoplasma, Citomegalovirus y Parvovirus B19.
El empleo de técnicas genéticas adicionales tales como el estudio molecular con CGH array (86) y la técnica MPLA (68,87) son técnicas muy prometedoras en la identificación de aberraciones geno´micasmicrosco´picas (microdeleciones, traslocacionesdisbalanceadas) responsables de asociaciones sindro´micas incluyendo anomalías estructurales y retraso mental. No obstante, dado que no existen amplias series de resultados, se debe ser muy cauto en la interpretación de hallazgos aislados en fetos sin anomalías.
El screening de deleciones 22q11 sólo debe llevarse a cabo con una anomalía cardíaca confirmada (88).
CONCLUSIONES
El aumento de la TN está relacionado sin duda como un buen marcador para el síndrome de Down. Sin embargo, también se asocia con otras anomalías cromosómicas, anomalías estructurales, síndromes genéticos, un mayor riesgo de aborto involuntario y muerte intrauterina.
Cuando no hay anomalías estructurales o marcadores ecográficos presentes en las exploraciones ecográficas detalladas, la posibilidad de un resultado favorable es alta.
REFERENCIAS BIBLIOGRAFICAS
1. Nicolaides KH. Nuchal translucency and other first-trimester sonographic markers of chromosomal abnormalities. Am J ObstetGynecol 2004;191(1):45-67. [ Links ]
2. Cicero S, Bindra R, Rembouskos G, Spencer K, Nicolaides KH. Integrated ultrasound and biochemical screening for trisomy 21 using fetal nuchal translucency, absent fetal nasal bone, free beta-hCG and PAPP-A at 11 to 14 weeks. PrenatDiagn 2003;23(4):306-10. [ Links ]
3. Malone FD, Canick JA, Ball RH, Nyberg DA, Comstock CH, Bukowski R, et al, for the First - and Second - Trimester Evaluation of Risk (FASTER) Research Consortium. First-trimester or second-trimester screening, or both, for Down's syndrome. N Engl J Med 2005;353(19):2001-11. [ Links ]
4. Souka A, Von Kaisenberg C, Nicolaides K. Aumento de la traslucencianucal con cariotipo normal. En: La ecografi´a de las 11-13+6 semanas. KH Nicolaides O Falco´n editores. Londres; 2004: 75-98. [ Links ]
5. Von Kaisenberg CS, Huggon I, Hyett JA, Farzaneh F, Nicolaides KH. Cardiac expression of sarcoplasmic reticulum calcium ATPase in fetuses with trisomy 21 and trisomy 18 presenting with nuchal translucency. Fetal DiagnTher 1997;12:270-3. [ Links ]
6. Clur SA, Oude Rengerink K, Mol BW, Ottenkamp J, Bilardo CM. Fetal cardiac function between 11 and 35 weeks gestation and nucal translucency thickness. Ultrasound ObstetGynecol 2011;37:48–56. [ Links ]
7. Bilardo CM, Muller MA, Zikulnig L, Schipper M, Hecher K. Ductusvenosus studies in fetuses at high risk for chromosomal or heart abnormalities: relationship with nuchal translucency measurement and fetal outcome. UltrasoundObstetGynecol 2001;17:288-94. [ Links ]
8. Von Kaisenberg CS, Brand-Saberi B, Christ B, Vallian S, Farzaneh F, Nicolaides KH. Collagen type VI gene expression in the skin of trisomy 21 fetuses. ObstetGynecol 1998;91: 319-23. [ Links ]
9. Von Kaisenberg CS, Krenn V, Ludwig M, Nicolaides KH, Brand-Saberi B. Morphological classification of nuchal skin in fetuses with trisomy 21, 18 and 13 at 12-18 weeks and in a trisomy 16 mouse. AnatEmbryol 1998;197:105-24. [ Links ]
10. Nakamura T, Gulick J, Pratt R, Robbins J. Noonan syndrome is associated with enhanced pERK activity, the repression of which can prevent craniofacial malformations. ProcNatlAcadSci U S A 2009;106(36):15436-41. [ Links ]
11. Souka AP, Von Kaisenberg CS, Hyett JA, Sonek JD, Nicolaides KH. Increased nuchal traslucency with normal karyotype. Am J ObstetGynecol 2005; 192:1005-21. [ Links ]
12. Souka AP, Skentou H, Geerts L, Bower S, Nicolaides KH. Congenital nephrotic syndrome presenting with increased nuchal translucency in the first trimester. PrenatDiagn 2002;22:93-5. [ Links ]
13. Smrcek JM, Germer U, Krokowski M, Berg C, Krapp M, Geipel A, et al. Prenatal ultrasound diagnosis and management of body stalk anomaly: analysis of nine singleton and two multiple pregnancies. Ultrasound ObstetGynecol 2003;21:322-8. [ Links ]
14. Sebire NJ, Snijders RJM, Davenport M, Greenough A, Nicolaides KH. Fetal nuchal translucency thickness at 10–14 weeks of gestation and congenital diaphragmatic hernia. ObstetGynecol 1997;90:943-7. [ Links ]
15. Bekker MN, van den Akker NM, Bartelings MM, Arkesteijn JB, Fischer SG, Polman JA, et al. Nuchal edema and venous-lymphatic phenotype disturbance in human fetuses and mouse embryos with aneuploidy. J SocGynecolInvestig 2006;13:209–16. [ Links ]
16. De Mooij YM, van den Akker NM, Bekker MN, Bartelings MM, van Vugt JM, Gittenberger-de Groot AC. Aberrant lymphatic development in euploid fetuses with increased nuchal translucency including Noonan syndrome. PrenatDiagn 2011;31:159–66. [ Links ]
17. Sohan K, Carroll S, Byrne D, Ashworth M, Soothill P. Parvovirus as a differential diagnosis of hydropsfetalis in the first trimester. Fetal DiagnTher 2000;15:234-6. [ Links ]
18. Clur S, Ottenkamp J, Bilardo C. The nuchal translucency and the fetal heart: a literature review. Prenatal diagnosis 2009;29(8):739-48. [ Links ]
19. Mula R, Goncé A, Bennásar M, Arigita M, Meler E, Nadal A, et al. Increased nuchal translucency and normal karyotype: perinatal and pediatric outcomes at 2 years of age. UltrasoundObstetGynecol 2012; 39: 34–41. [ Links ]
20. Michailidis GD, Economides DL. Nuchal translucency measurement and pregnancy outcome in karyotypically normal fetuses. UltrasoundObstetGynecol 2001;17:102-5. [ Links ]
21. Ayras O, Tikkanen M, Eronen M, Paavonen J, Stefanovic V. Increased nuchal translucency and pregnancy outcome: a retrospective study of 1063 consecutive singleton pregnancies in a single referral institution. PrenatDiagn 2013;33:856-62. [ Links ]
22. Souka AP, Snijders RJ, Novakov A, Soares W, Nicolaides KH. Defects and syndromes in chromosomally normal fetuses with increased nuchal translucency thickness at 10–14 weeks of gestation. UltrasoundObstetGynecol 1998;11:391–400. [ Links ]
23. Bilardo CM, Müller MA, Pajkrt E, Clur SA, Van Zalen MM, Bijlsma EK. Increased nucaltraslucency thickness and normal karyotype: time for parental reassurance. UltrasoundObstetGynecol 2007; 30:11-18. [ Links ]
24. Pitkanen S, Laitinen P, Yla-Outinen A, Heikkila M, Honkasalo T, et al. Extremely large nuchal translucency measurement predicts adverse pregnancy outcome. J ObstetGynaecol 2015; 35: 22–4. [ Links ]
25. Westin M, Saltvedt S, Almström H, Grunewald C, Valentin L. By how much does increased nuchal translucency increase the risk of adverse pregnancy outcome in chromosomally normal fetuses? A study of 16.260 fetuses derived from an unselected pregnant population. UltrasoundObstetGynecol 2007;29:150–8. [ Links ]
26. Hyett J, Moscoso G, Papapanagiotou G, Perdu M, Nicolaides KH. Abnormalities of the heart and great arteries in chromosomally normal fetuses with increased nuchal translucency thickness at 11-13 weeks of gestation. UltrasoundObstetGynecol 1996;7:245-50. [ Links ]
27. Hyett J, Perdu M, Sharland G, Snijders R, Nicolaides KH. Using fetal nuchal translucency to screen for major congenital cardiac defects at 10-14 weeks of gestation: population based cohort study. BMJ 1999;318:81-5. [ Links ]
28. Goetzl L. Adverse Pregnancy Outcomes after Abnormal First Trimester Screening for Aneuploidy. ClinLabMed 2010; 30(3): 613–28. [ Links ]
29. Makrydimas G, Sotiriadis A, Ioannidis JP. Screening performance of first-trimester nuchal translucency for major cardiac defects: a meta-analysis. Am J ObstetGynecol 2003;189:1330–5. [ Links ]
30. Mavrides E, Cobian-Sanchez F, Tekay A, Moscoso G, Campbell S, et al. Limitations of using first-trimester nuchal translucency measurement in routine screening for major congenital heart defects. Ultrasound ObstetGynecol 2001;17:106–10. [ Links ]
31. Muller MA, Clur SA, Timmerman E, Bilardo CM. Nuchal translucency measurement and congenital heart defects: modest association in low-risk pregnancies. PrenatDiagn 2007;27:164–9. [ Links ]
32. Sotiriadis A, Papatheodorou S, Eleftheriades M, Makrydimas G. Nuchal translucency and major congenital heart defects in fetuses with normal karyotype: a meta-analysis. UltrasoundObstetGynecol 2013;42:383–9. [ Links ]
33. Bakker M, Pajkrt E, Bilardo CM. Increased nuchal translucency with normal karyotype and anomaly scan: What next?. Best Pract Res ClinObstetGynaecol 2014;28:355–66. [ Links ]
34. Salman Guraya S. The associations of nuchal translucency and fetal abnormalities; significance and implications. J ClinDiagn Res 2013;7(5):936-41. [ Links ]
35. Baer RJ, Norton ME, Shaw GM, Flessel CM, Goldmanet S, et al. Risk of selected structural abnormalities in infants after increased nuchal translucency measurement. Am J ObstetGynecol 2014;211:675.e1-19. [ Links ]
36. Timmerman E, Pajkrt E, Maas SM, Bilardo CM. Enlarged nuchal translucency in chromosomally normal fetuses: strong association with orofacial clefts. Ultrasound ObstetGynecol 2010;36:427–32. [ Links ]
37. Scott F, Evans J, McLennan A. Perinatal outcome in fetuses with extremely large nuchal translucency measurement. Aust N Z J ObstetGynaecol 2009;49:254–7. [ Links ]
38. Mangione R, Guyon F, Taine L, Wen ZQ, Roux D, Vergnaud A, et al. Pregnancy outcome and prognosis in fetuses with increased first-trimester nuchal translucency. Fetal DiagnTher 2001;16:360-3. [ Links ]
39. Souka AP, Krampl E, Bakalis S, Heath V, Nicolaides KH. Outcome of pregnancy in chromosomally normal fetuses with increased nuchal translucency in the first trimester. UltrasoundObstetGynecol 2001;18:9-17. [ Links ]
40. Salvesen DR, Goble O. Early amniocentesis and fetal nuchal translucency in women requesting karyotyping for advanced maternal age. PrenatDiagn 1995;15:971-4. [ Links ]
41. Pandya PP, Kondylios A, Hilbert L, Snijders RJM, Nicolaides KH. Chromosomal defects and outcome in 1015 fetuses with increased nuchal translucency. UltrasoundObstetGynecol 1995;5:15-9. [ Links ]
42. ChaBan FK, van Splunder P, Los FJ, Wladimiroff JW. Fetal outcome in nuchal translucency with emphasis on normal fetal karyotype. PrenatDiagn 1996;16:537-41. [ Links ]
43. Adekunle O, Gopee A, El-Sayed M, Thilaganathan B. Increased first-trimester nuchal translucency: pregnancy and infant out- comes after routine screening for Downs syndrome in an unselected antenatal population. Br J Radiol 1999;72:457-60. [ Links ]
44. Chen SH, Lin MY, Chang FM. Prenatal diagnosis of Dandy- Walker syndrome in early pregnancy presenting with increased nuchal translucency and generalized edema at 13 weeks of gestation. PrenatDiagn 2003;23:514-5. [ Links ]
45. Bilardo CM, Pajkrt E, de Graaf IM, Mol BWJ, Bleker OP. Outcome of fetuses with enlarged nuchal translucency and normal karyotype. UltrasoundObstetGynecol 1998;11:401–37. [ Links ]
46. Markov D, Jacquemyn Y, Leroy Y. Bilateral cleft lip and palate associated with increased nuchal translucency and maternal cocaine abuse at 14 weeks of gestation. ClinExpObstetGynecol 2003;30:109-10. [ Links ]
47. Ville Y, Lalondrelle C, Doumerc S, Daffos F, Frydman R, Oury JF, et al. First-trimester diagnosis of nuchal anomalies: significance and fetal outcome. Ultrasound ObstetGynecol 1992;2:314-6. [ Links ]
48. Varlet F, Bousquet F, Clemenson A, Chauleur C, Kopp-Dutour N, Tronchet M, et al. Congenitaldiaphragmatic hernia. Two cases with early prenatal diagnosis and increased nuchal translucency. Fetal DiagnTher 2003;18:33-5. [ Links ]
49. Van Vugt JM, Tinnemans BW, Van Zalen-Sprock RM. Outcome and early childhood follow-up of chromosomally normal fetuses with increased nuchal translucency at 10-14 weeks gestation. Ultrasound ObstetGynecol 1998;11:407-9. [ Links ]
50. Mangione R, Guyon F, Taine L, Wen ZQ, Roux D, Vergnaud A, et al. Pregnancy outcome and prognosis in fetuses with increased first-trimester nuchal translucency. Fetal DiagnTher 2001;16:360-3. [ Links ]
51. Schemm S, Gembruch U, Germer U, Janig U, Jonat W, von Kaisenberg CS. Omphalocele – exstrophy - imperforate anus - spinal defects (OEIS) complex associated with increased nuchal translucency. Ultrasound ObstetGynecol 2003;22:95-7. [ Links ]
52. Brown RN, Nicolaides KH. Increased fetal nuchal translucency: possible association with esophageal atresia. UltrasoundObstetGynecol 2000;15:531-2. [ Links ]
53. Fincham J, Pandya PP, Yuksel B, Loong YM, Shah J. Increased first-trimester nuchal translucency as a prenatal manifestation of salt-wasting congenital adrenal hyperplasia. UltrasoundObstetGynecol 2002;20:392-4. [ Links ]
54. Flores Anton B, Bonet Serra B, Adiego Burgos B, Martínez Orgado J, Martin Ancel A, Perez-LescurePicarzo J. Congenital adrenal hyperplasia: anassociationwithincreased fetal nuchaltranslucency. AnPediatr (Barc) 2003;58:52-4. [ Links ]
55. Liao AW, Sebire NJ, Geerts L, Cicero S, Nicolaides KH. Megacystis at 10-14 weeks of gestation: chromosomal defects and outcome according to bladder length. UltrasoundObstetGynecol 2003;21:338-41. [ Links ]
56. Hernadi L, Torocsik M. Screening for fetal anomalies in the 12th week of pregnancy by transvaginalsonography in an unselected population. PrenatDiagn 1997;17:753-9. [ Links ]
57. Fukada Y, Yasumizu T, Takizawa M, Amemiya A, Hoshi K. The prognosis of fetuses with transient nuchal translucency in the first and early second trimester. Acta ObstetGynecolScand 1998;76:913-6. [ Links ]
58. Hafner E, Schuchter K, Liebhart E, Philipp K. Results of routine fetal nuchal translucency measurement at weeks 10–13 in 4,233 unselected pregnant women. PrenatDiagn 1998;18:29-34. [ Links ]
59. Ben Ami M, Perlitz Y, Haddad S, Matilsky M. Increased nuchal translucency is associated with asphyxiating thoracic dysplasia. UltrasoundObstetGynecol 1997;10:297-8. [ Links ]
60. Makrydimas G, Souka A, Skentou H, Lolis D, Nicolaides K. Osteogenesisimperfecta and other skeletal dysplasias presenting with increased nuchal translucency in the first trimester. Am J MedGenet 2001;98:117-20. [ Links ]
61. Viora E, Sciarrone A, Bastonero S, Errante G, Botta G, Franceschini PG, et al. Osteogenesisimperfecta associated with increased nuchal translucency as a first ultrasound sign: report of another case. UltrasoundObstetGynecol 2003;21:200-2. [ Links ]
62. Clementschitsch G, Hasenohrl G, Steiner H, Staudach A. Early diagnosis of a fetal skeletal dysplasia associated with increased nuchal translucency with 2D and 3D ultrasound. UltraschallMed 2003;24:349-52. [ Links ]
63. Monteagudo A, Mayberry P, Rebarber A, Paidas M, Timor-Tritsch IE. Sirenomelia sequence: first-trimester diagnosis with both two- and three-dimensional sonography. UltrasoundMed 2002;21:915-20. [ Links ]
64. Souka AP, Krampl E, Geerts L, Nicolaides KH. Congenital lymphedema presenting with increased nuchal translucency at 13 weeks of gestation. PrenatDiagn 2002;22:91-2. [ Links ]
65. Smrcek JM, Germer U, Krokowski M, Berg C, Krapp M, Geipel A, et al. Prenatal ultrasound diagnosis and management of body stalk anomaly: analysis of nine singleton and two multiple pregnancies. Ultrasound ObstetGynecol 2003;21:322-8. [ Links ]
66. Cheng C, Bahado-Singh RO, Chen S, Tsai M. Pregnancy outcomes with increased nuchal translucency after routine Down syndrome screening. Int J GynaecolObstet 2004;84:5–9. [ Links ]
67. Prefumo F, Homfray T, Jeffrey I, Moore I, Thilaganathan B. A newly recognized autosomal recessive syndrome with abnormal vertebral ossification, rib abnormalities, and nephrogenic rests. Am J MedGenet 2003;120A:386-8. [ Links ]
68. Bilardo CM, Timmerman E, Pajkrt E, van Maarle M. Increased nuchal translucency in euploid fetuses–what should we be telling the parents? PrenatDiagn 2010;30(2):93–102. [ Links ]
69. Sharp P, Haant E, Fletcher JM, Khong TY, Carey WF. First trimester diagnosis of Smith - Lemli - Opitz syndrome. PrenatDiagn 1997;17:355–61. [ Links ]
70. Parra J, Alias L, Also-Rallo E, Martínez-Hernández R, Senosiain R, Medina C, et al. Evaluation of fetal nuchal translucency in 98 pregnancies at risk for severe spinal muscular atrophy: possible relevance of the SMN2 copy number. J Matern Fetal Neonatal Med 2012;25(8):1246-9. [ Links ]
71. Tartaglia M, Mehler EL, Goldberg R, Zampino G, Brunner HG, Kremer H, et al. Mutations in PTPN11, encoding the protein tyrosine phosphatase SHP-2, cause Noonan syndrome. Nat Genet 2001;29:465–8. [ Links ]
72. Houweling AC, de Mooij YM, van der Burgt I, Yntema HG, Lachmeijer AM, Go AT. Prenatal detection of Noonan syndrome by mutation analysis of the PTPN11 and the KRAS genes. PrenatDiagn 2010;30:284–6. [ Links ]
73. Petrikovsky BM, Baker D, Schneider E. Fetal hydrops second- ary to human parvovirus infection in early pregnancy. Prenatal Diagn1999;16(4):342-4. [ Links ]
74. Poon LC, Karagiannis G, Stratieva V, Syngelaki A, Nicolaides KH. First-trimesterprediction of macrosomia. Fetal DiagnTher 2011;29:139–47. [ Links ]
75. Weissmann-Brenner A, Weisz B, Lerner-Geva L, Gindes L, Achiron R. Increased nuchal translucency is associated with large for gestational age neonates in singleton pregnancies. J PerinatMed 2011;39:305–9. [ Links ]
76. Saldanha FA, BrizotMde L, Moraes EA, Lopes LM, Zugaib M. [Increased fetal nuchal translucency thickness and normal karyotype: prenatal and postnatal follow-up]. RevAssocMedBras 2009;55(5):575-80.
77. Westin M, Saltvedt S, Almstrom H, Grunewald C, Valentin L. By how much does increased nuchal translucency increase the risk of adverse pregnancy outcome in chromosomally normal fetuses? A study of 16,260 fetuses derived from an unselected pregnant population. UltrasoundObstetGynecol 2007;29:150–8. [ Links ]
78. Miltoft CB1, Ekelund CK, Hansen BM, Lando A, Petersen OB, Skovbo P, et al. Increased nuchal translucency, normal karyotype and infant development. Ultrasound ObstetGynecol 2012;39(1):28-33. [ Links ]
79. Sotiriadis A, Papatheodorou S, Makrydimas G. Neurodevelopmental outcome of fetuses with increased nuchal translucency and apparently normal prenatal and/or postnatal assessment: a systematic review. UltrasoundObstetGynecol 2012;39:10–9. [ Links ]
80. Timor-Tritsch IE, Fuchs KM, Monteagudo A, Dalton ME. Performing a fetal anatomy scan at the time of first-trimester screening. ObstetGynecol 2009;113(2): 402-7. [ Links ]
81. Syngelaki A, Chelemen T, Dagklis T, Allan L, Nicolaides KH. Challenges in the diagnosis of fetal non-chromosomal abnormalities at 11–13 weeks. PrenatDiagn 2011;31:90–102. [ Links ]
82. Becker R, Schmitz L, Kilavuz S, Stumm M, et al. 'Normal' nuchal translucency: a justification to refrain from detailed scan? Analysis of 6858 cases with special reference to ethical aspects. PrenatDiagn 2012;32(6):550-6. [ Links ]
83. Martinez JM, Comas M, Borrell A, Bennasar M, Gómez O, et al. Abnormal first-trimester ductusvenosus blood flow: a marker of cardiac defects in fetuses with normal karyotype and nuchal translucency. UltrasoundObstetGynecol 2010;35(3):267-72. [ Links ]
84. Maiz N, Valencia C, Emmanuel EE, Staboulidou I, Nicolaides KH. Screening for adverse pregnancy outcome by ductusvenosus Doppler at 11-13+6 weeks of gestation. ObstetGynecol 2008;112(3):598-605. [ Links ]
85. Kempe A, Rosing B, Berg C, Kamil D, Heep A, et al. First - trimester treatment of fetal anemia secondary to parvovirus B19 infection. UltrasoundObstetGynecol 2007; 29(2):226-8. [ Links ]
86. Law LW, Lau TK, Fung TY, Leung TY, Wang CC, Choy KW. De novo 16p13.11 microdeletion identified by high-resolution array CGH in a fetus with increased nuchal translucency. BJOG 2008;116(2):339-43. [ Links ]
87. Cheng PJ, Chang SD, Shaw SW, Soong YK. Nuchal translucency thickness in fetuses with chromosomal translocation at 11–12 weeks of gestation. ObstetGynecol 2005;105(5):1058-62. [ Links ]
88. Lautrup CK, Kjaergaard S, Brondum-Nielsen K, et al. Testing for 22q11 microdeletion in 146 fetuses with nuchal translucency above the 99th percentile and a normal karyotype. Acta ObstetGynecolScand 2008;87(11):1252-55 [ Links ]