Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Anales de la Facultad de Ciencias Médicas (Asunción)
Print version ISSN 1816-8949
An. Fac. Cienc. Méd. (Asunción) vol.48 no.1 Asunción June 2015
https://doi.org/10.18004/anales/2015.048(01)69-082
ARTÍCULO REVISIÓN
Reacciones alérgicas: aspectos claves y nuevas perspectivas
Allergic reactions: key aspects and new perspectives
Duque Restrepo D
Facultad de Medicina; Universidad Pontificia Bolivariana, Medellín - Colombia
RESUMEN
Las reacciones alérgicas son una respuesta inmune exacerbada a un alérgeno en un individuo atópico. En éstas, influyen dos factores el genético y el ambiental. Con base en lo anterior, la Organización Mundial de Alergia determinó como enfermedades alérgicas al asma, rinitis, sinusitis, conjuntivitis, anafilaxia, alergia a medicamentos, alimentos, animales, insectos y hongos, eczema, urticaria y angioedema; las cuales han aumentado en el último tiempo, convirtiéndose en un problema de salud pública con repercusiones económicas exorbitantes. Asimismo, se han dado avances tanto en el diagnóstico, cuyos pilares siguen siendo la historia clínica, la medición de inmunoglobulina E específica y pruebas cutáneas; el tratamiento y las bases genéticas, que cada vez son más relevantes en el manejo clínico de estas entidades.
Palabras clave: Alérgeno, ambiente, atopia, genética, reacción alérgica.
ABSTRACT
Allergic reactions are an exaggerated immune response to an allergen in atopic individuals. In these, two factors influence: the genetic and environmental. Therefore, the World Allergy Organization determined as allergic diseases asthma, rhinitis, sinusitis, conjunctivitis, anaphylaxis, drug allergy, foods, animals, insects and fungi, eczema, urticaria and angioedema; which have increased in recent times, becoming a public health problem with an exorbitant economic burden. Also, there have been advances in diagnosis, whose pillars are still medical history, measurement of specific immunoglobulin E and skin tests; treatment and genetic basis, which are increasingly important in the clinical management of these entities.
Key Words: Allergen, environment, atopy, genetic, allergic reaction.
INTRODUCCIÓN
El término reacción alérgica o hipersensibilidad se refiere a una respuesta inmune exacerbada o inapropiada del individuo predispuesto genéticamente o atópico, que se da en presencia de un alérgeno específico, definido como una molécula proteica vegetal, animal o fúngica que induce la producción de anticuerpos (Ac) tipo inmunoglobulina E (Ig E) (1). En ésta, influyen principalmente factores genéticos y ambientales. El primer factor se considera el más importante por sí solo (2), al decirse que si un progenitor es alérgico, el riesgo de que su hijo lo sea es del 30%, si ambos padres lo son, se habla del 50%; y si son gemelos idénticos la probabilidad es de un 70% (1). En cuanto al segundo factor, las principales fuentes de alérgenos son: 1-) Alimentos como mariscos, soja, trigo, maní, leche, huevos, siendo estos tres últimos los que más comúnmente generan reacciones alérgicas (3,4), 2-) Medicamentos, entre los que están: ß-lactámicos, ácido acetilsalicílico (ASA), trimetoprim-sulfametoxazol, vancomicina, antiinflamatorios no esteroideos (AINES), 3-) Animales, como reptiles e insectos y 4-) Otros como látex, vacunas, medios de contraste radiológicos y polen (5).
Con base en esto, la Organización Mundial de Alergia (WAO), señala las siguientes como enfermedades alérgicas: asma, rinitis, sinusitis, conjuntivitis, anafilaxia, alergia a medicamentos, alimentos, animales, insectos y hongos, eczema, urticaria y angioedema (6).
Definiciones enfermedades alérgicas.
1. Asma: Enfermedad inflamatoria crónica de las vías respiratorias, asociadas a los cambios estructurales variables, que afecta a los niños y adultos de todas las edades. Entre las características clínicas de la entidad se destacan la hiperreactividad bronquial, la obstrucción al flujo aéreo, que es a menudo reversible espontáneamente o con tratamiento y la hipersecreción de la mucosa. En cuanto a los síntomas se presenta tos, disnea, sibilancias y malestar en el pecho y al examen físico se nota ruidos respiratorios disminuidos, campos pulmonares hiperinsuflados, hiperresonancia a la percusión; o incluso no presentarse alteraciones (6).
2. Rinitis: Trastorno crónico de la vía aérea superior consistente en inflamación mediada por Ig E, secundaria a la exposición de alérgenos. Es más común en niños que en adultos. Puede contribuir con el desarrollo de rinosinusitis, otitis media y asma. Los síntomas incluyen: congestión nasal, estornudos, rinorrea y prurito de la nariz, paladar, garganta y ojos. A la rinoscopia generalmente se ven los cornetes edematizados y eritematosos (7).
3. Sinusitis: Condición inflamatoria dada por la acumulación de moco en algunos de los cuatro pares de estructuras que rodean las cavidades nasales y que no pueden drenar directamente a los meatos, ocasionando infección de los senos paranasales. Habitualmente, se afecta más de un par de senos siendo los más comúnmente afectados en orden decreciente: seno maxilar, etmoidal, frontal y esfenoidal. Los síntomas son rinorrea, congestión nasal, dolor o presión facial y cefalea (8).
4. Conjuntivitis: Inflamación de la conjuntiva que clínicamente se caracteriza por prurito, epifora y ojo rojo. Otros signos incluyen el eritema conjuntival, las papilas grandes o en adoquines en la conjuntiva palpebral al hipertrofiarse (dada en las formas más severas, como en reacción a los lentes de contacto) y secreción de cualquier tipo (9).
5. Alergia a medicamentos: Hace parte de las reacciones adversas a fármacos, que afectan del 6% al 10% de los pacientes. Están farmacológicamente divididos es dos clases:
A. Tipo A (85% - 90% de los casos): debido a los efectos del medicamento que son predecibles y dosis dependiente. Son los efectos adversos o secundarios.
B. Tipo B (10% - 15% de los casos): son reacciones de hipersensibilidad, que tienen distintas presentaciones clínicas que son: reacciones adversas cutáneas (urticaria, exantema, angioedema), Síndrome de Stevens-Johnson (SJS) y necrólisis epidérmica tóxica (TEN) agrupados en el término necrólisis epidérmica (10), reacción a medicamentos con eosinofilia y síntomas sistémicos (DRESS) o síndrome de hipersensibilidad inducida por medicamentos (DIHS). Se caracterizan por ser menos dosis dependiente, impredecibles y estar determinados por la genética de la persona. Pueden ser: efectos alérgicos (5% - 10%) o efectos no alérgicos (90% - 95%) (11).
? Necrólisis epidérmica: Reacciones mucocutáneas agudas que amenazan la vida y se caracterizan por formación de ampollas y desprendimiento de epidermis, que resulta en necrosis de esta capa en ausencia de inflamación dérmica subyacente. Si afecta un área de superficie corporal (ASC) < 10% se habla de SJS, si el ASC comprometida es del 10% al 30% se denomina superposición SJS/TEN y si es > 30% ASC se nombra como TEN. Presentan inicialmente lesiones dolorosas en la piel, fiebre > 39°C, dolor de garganta y conjuntivitis por compromiso mucosal. Pueden tener afectación de los órganos internos, siendo los intestinos y pulmones los más afectados (12,13).
6. Eczema: Tipo de dermatitis. Es un patrón de reacción que se presenta con manifestaciones clínicas variables cuyo hallazgo histológico común es la espongiosis o edema intercelular de la epidermis. Incluyen lesiones primarias como máculas eritematosas, pápulas y vesículas, que pueden coalescer formando placas y lesiones secundarias a la infección o excoriación, como costras y liquenificación. Una característica común es el prurito. Incluye a la dermatitis atópica y la dermatitis de contacto (14, 15).
7. Urticaria: Lesión de la piel típicamente pruriginosa, que consiste en edema intracutáneo bien definido –pápula-, rodeado por un área eritematosa que no está bien circunscrita. Los habones o ronchas, pueden durar desde 30 minutos hasta 36 horas y ser de forma ovalada, redondeada o irregular, que abarcan desde un milímetro hasta llegar a ser de 20 centímetros de diámetro. A la digitopresión, se tornan blancos al comprimir los vasos dilatados, lo que también explica la palidez central de la roncha. Los vasos sanguíneos dilatados y el aumento de la permeabilidad que caracterizan la urticaria están presentes en la dermis superficial e implica el plexo venular en esa ubicación (16).
8. Angioedema: Edema bien definido que afecta la dermis profunda, el tejido subcutáneo y puede llegar a comprometer los párpados, labios, lengua, laringe y el tracto gastrointestinal, con o sin presencia de eritema. En cuanto a la sintomatología, hay menos prurito pero puede cursar con dolor o ardor; y su mayor manifestación es el edema. Puede presentarse sola o junto con urticaria (16 - 18).
Epidemiología.
La prevalencia de las enfermedades alérgicas ha aumentado dramáticamente, tanto en los países desarrollados, como en los que están en vía de desarrollo. En cuanto a distribución por edades, el principal grupo comprometido son los niños, que representan la mayor carga al sistema de salud por este problema, a tal punto que se necesitan US$5 billones anuales para tratar sólo la rinitis alérgica en esta población en los Estados Unidos (19).
Adicionalmente se hace necesario un manejo integral, que debería ser dado por los alergólogos y otros especialistas instruidos en la temática, pues la Organización Mundial de la Salud (OMS), estima que alrededor de 250.000 muertes anuales por asma en el mundo pueden ser evitadas (6).
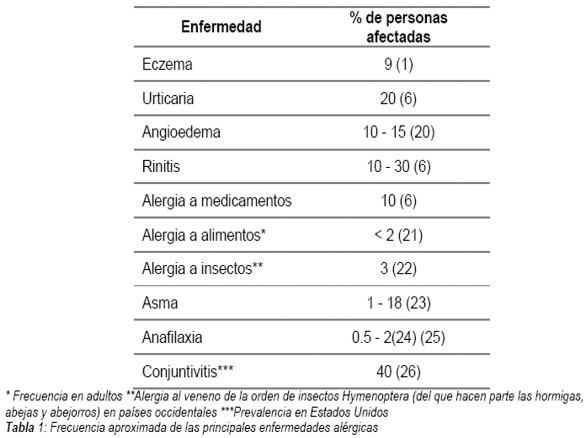
En la tabla 1 se resume la frecuencia mundial de las principales enfermedades alérgicas, según datos recopilados de varias fuentes (1,6,20-26).
Tipos de reacciones de hipersensibilidad.
Las reacciones de hipersensibilidad se dividen en cuatro:
Tipo I: Hipersensibilidad inmediata (15 minutos - 30 minutos): Se da cuando el sujeto ya está sensibilizado, que es cuando el antígeno (Ag), se une a la Ig E, y el factor cristalizable (Fc) de la inmunoglobulina, se ciñe a la superficie de los mastocitos y basófilos. Posteriormente, ante un nuevo contacto, se genera rápidamente la liberación de varios mediadores inflamatorios preformados como la histamina y triptasa y se induce la producción de prostaglandinas y leucotrienos (1). Cabe aclarar que aunque se toman como sinónimos, la reacción alérgica se refiere estrictamente a la hipersensibilidad tipo I (19).
La forma más severa de este tipo de reacción es la anafilaxia, definida por las guías WAO, como una reacción de hipersensibilidad sistémica potencialmente mortal, caracterizada por un inicio rápido de problemas en las vías aéreas, respiración, circulación y gastrointestinales, que se asocia usualmente con cambios en la piel y las mucosas (25, 27, 28), cuyos criterios diagnósticos en adultos se resumen en la tabla 2 (29). Ésta tiene como factores de riesgo la edad, enfermedades cardiovasculares y respiratorias existentes, manejo inadecuado de crisis asmáticas, mastocitosis, aumento de la triptasa de mastocitos (30 - 34); y puede ser de dos clases: reacción anafiláctica, que está mediada por Ig E y reacción anafilactoide que no está mediada por Ig E (5).
* Tipo II: Hipersensibilidad citotóxica (Minutos a horas): Se da cuando un Ac dirigido a antígenos en una membrana celular, activa el complemento. Está mediado por inmunoglobulina G (Ig G) e inmunoglobulina M (Ig M) (35,36).
* Tipo III: Hipersensibilidad del complejo inmune (3-8 horas hasta semanas): Ocurre cuando un complejo Ag-Ac induce una respuesta inflamatoria tisular, al depositarse en esos lugares. Está mediado por Ig G e Ig M (35,36).
* Tipo IV: Hipersensibilidad tardía o mediada por células (2 días - 3 días o más): Es función de linfocitos T (LT), tanto linfocitos T citotóxicos (LTC), como linfocitos T cooperadores (LTh) 1, no de Ac. Los LTh, sensibilizados por Ag, liberan linfoquinas hasta el segundo contacto con el mismo Ag, que inducen inflamación y activan los macrófagos (35,36).
Hipótesis de origen de las alergias.
No se ha dilucidado bien la noxa de la epidemia alérgica, por lo que se ha tratado de ligar a la higiene, el estilo de vida occidental, un acelerado ritmo de vida, antioxidantes de la dieta, sodio, lípidos y la vitamina D, sin ser ninguna de estas la que responda a todos los aspectos de la alergia (1).
Presentación clínica.
Las reacciones alérgicas se acompañan de signos y síntomas característicos que son muy variados, debido a factores como la duración de la exposición, la vía de entrada y el tejido blanco; pero en general se relacionan con hallazgos en piel: eritema, prurito y urticaria transitoria. En casos severos se puede encontrar angioedema (37).
La alergia a alimentos se puede dividir según si está mediado por Ig E como en la urticaria, anafilaxis, angioedema, rinitis aguda, asma aguda y síndrome de alergia oral (respuesta de la mucosa oral a los alérgenos y que varía con la labilidad del antígeno) (38), o mediado por células como en la dermatitis de contacto, dermatitis herpetiforme, proctocolitis, enfermedad celiaca, síndrome de Heiner y en la que hay una combinación de inmunidad celular y humoral como en dermatitis atópica, enteritis eosinofílica y la esofagitis eosinofílica (EoE) (21,39,40).
De las anteriores, la EoE ha cobrado especial importancia en la actualidad. Es una condición clínico-patológica distinta a la eosinofilia esofágica y la eosinofilia esofágica que responde a inhibidores de la bomba de protones (PPI-REE). La EoE se encuentra en todas edades y su mecanismo parece ser que los alérgenos activan los LTh2, como resultado producen citocinas como la interleucina (IL) -13 y la IL-4 (41), que estimulan al esófago para expresar eotaxina-3, un potente factor quimiotáctico de eosinófilos. La lesión epitelial, se produce por la degranulación de los tóxicos de este tipo de leucocitos. Igualmente, la inflamación prolongada por la eosinofilia, da lugar a la remodelación del tejido, caracterizado por hiperplasia del epitelio y músculo liso esofágico, fibrosis subepitelial y angiogénesis. Estos cambios patológicos, pueden causar complicaciones graves, como la creación de anillos esofágicos y originar alteraciones de la motilidad, que son responsables de la disfagia (42-44).
Asimismo, se debe mencionar la existencia de reacciones alérgicas particulares a ciertos medicamentos como anticonvulsivantes aromáticos, antidepresivos, sulfonamidas, antiinfecciosos, antiinflamatorios, IECAS, beta-bloqueadores, entre otros; que se agrupan en el síndrome DRESS o también llamado DIHS, que se caracteriza por una extensa erupción mucocutánea, junto con fiebre, linfadenopatía, hepatitis, alteraciones hematológicas con eosinofilia y linfocitos atípicos, e incluso puede involucrar a otros órganos con infiltración eosinofílica, produciendo daños en varios sistemas, especialmente los riñones, el corazón, los pulmones y el páncreas. La incidencia del DRESS/DIHS es de 1 por cada 1000 a 10.000 exposiciones , es más común en adultos que en niños y se da en mayor proporción con respecto al SJS, que tiene una incidencia de 1.2 a 6 casos por cada millón de personas (45).
En cuanto a la reacción anafiláctica, además de asociarse a la piel, se experimentan manifestaciones respiratorias (disfonía, disnea, sibilancias, tos y opresión en el pecho), manifestaciones gastrointestinales (náuseas, vómitos, dolor abdominal tipo cólico y diarrea) y manifestaciones cardiovasculares (vasodilatación periférica, taquicardia refleja, y la hipotensión con colapso cardiovascular resultante) (37).
Diagnóstico.
Principalmente el diagnóstico de las reacciones alérgicas se basa en la historia clínica (en la cual se consignan los antecedentes alérgicos del paciente y la reacción producida) y en exámenes de laboratorio, en donde se usan dos métodos: la concentración sérica de Ig E específico, en la que se usa enzimoinmunoanálisis, que en valores mayores a 0.35 kU/L sugieren sensibilización, más no una enfermedad y no se relacionan con la posible severidad que esta pueda tener y en la que se ha establecido una sensibilidad de del 60% a 95% y una especificidad del 30% al 95% (46, 47) y por pruebas cutáneas en las que se le aplica al paciente epidérmica o intradérmicamente un extracto preparado a partir de determinado alérgeno y se inocula principalmente en los antebrazos y la espalda, tomándose como positiva si se genera un habón de 10 a 20 minutos después (1,48).
Otros métodos incluyen la determinación sérica de la triptasa de los mastocitos, cuyo papel no ha sido del todo esclarecido, y su uso se extiende a los efectos alergénicos de los medicamentos administrados por anestesiólogos en cirugía (48-50).
Por otro lado, la EoE se ha convertido en una condición prevalente en las personas y se necesita de la clínica e histología para su diagnóstico. Hay cuatro criterios para realizar su diagnóstico: a-) síntomas relacionados con disfunción esofágica (como disfagia, gastritis, dolor en pecho, retención de comida, etc) (51), b-) biopsia esofágica, que se recomienda que se tome tanto en la parte proximal como en la distal de éste, con hallazgos de inflamación con predominio eosinofílico, consistente en valores de recuento de eosinófilos = 15 por campo de alto poder (CAP) (43,52), c) eosinofilia en la mucosa, solamente presente en esófago y que persiste después de aplicarle inhibidores de la bomba de protones (PPI), d) otras causas de eosinofilia esofágica excluidas (53).
Genética.
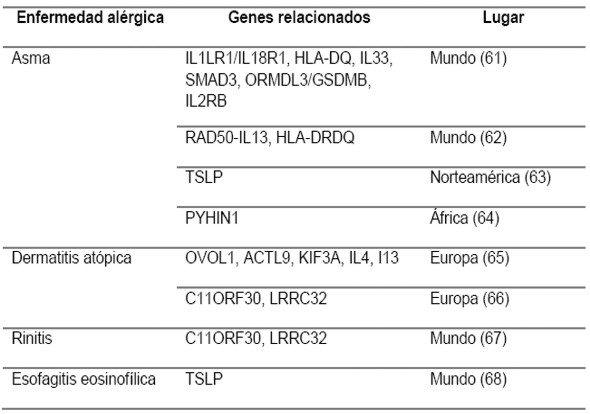
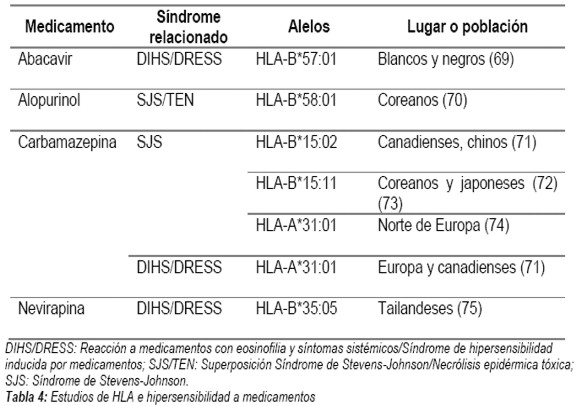
Históricamente, se le ha visto poco interés a buscar el componente genético de las reacciones alérgicas, dada su complejidad, poca disponibilidad y altos costos (54-57). No obstante, las reacciones a medicamentos severas (como SJS y TEN), que pueden ser evitadas aproximadamente en un 80%, se han visto relacionadas en el caso de tener el HLA-B*5701 e iniciar tratamiento con el abacavir (inhibidor de la transcriptasa reversa de tipo nucleótido usado en el virus de la inmunodeficiencia humana), por lo que este es un ejemplo de un examen rutinario usado ampliamente en la práctica clínica de los países desarrollados (58-60). Es por esto, que se habla de la epigenética, es decir cómo influyen los factores ambientales en la expresión de ciertos genes (2,11). En la tabla 3 se dan ejemplos de los genes relacionados con algunas enfermedades alérgicas (61-68) y en la tabla 4 los estudios de HLA en hipersensibilidad a medicamentos (69-75).
Tratamiento.
Tiene dos pilares: Prevención y manejo médico. En cuanto a la primera se consideran dos medidas:
1. Evitar la sensibilización del individuo: Que se asocia al: consumo de leche materna a temprana edad, aunque el Instituto Nacional de Alergia y Enfermedades Infecciosas considera que hay datos insuficientes en el caso de prevenir la alergia a alimentos (76), una dieta adecuada de la madre durante la gestación y el consumo de antioxidantes y ácidos grasos omega-3 (como elemento intrínseco al pescado) por parte del infante. Estas dos últimas podrían ser protectores para la hipersensibilidad en la niñez. Asimismo evitar el sobrepeso y la obesidad y la exposición a poluciones aéreas serían otras disposiciones a tener presente, sin embargo están todavía en estudio (77).
2. Manejo del medio ambiente (siendo ésta la medida preventiva ideal) (78).
Cuando la reacción alérgica ha iniciado se recurren a medicamentes:
1. Esteroides: Previenen la síntesis de mediadores inflamatorios y disminuyen la permeabilidad vascular en las fases tardías de la respuesta alérgica. Se emplea cuando los antihistamínicos no controlan la sintomatología (37).
2. Cromoglicato de sodio: Estabiliza la membrana celular de los mastocitos. Utilizado en asma, rinitis y conjuntivitis (8).
3. Antihistamínicos: Se prefieren los de 2º y 3º generación por sus menores efectos adversos (8).
4. Antileucotrienos como el montelukast y zafirlukast: Bloquean la respuesta inflamatoria tardía (1).
5. Agonistas adrenérgicos a y ß: Los primeros como la fenilefrina y oximetazolina se utilizan en rinitis para aliviar la congestión y obstrucción nasal, mientras los ß adrenérgicos se usan ampliamente en crisis de asma, donde relajan el músculo liso bronquial (37).
6. Inmunoterapia moduladora, tanto específica como no específica, que a partir de la administración continua y progresiva por largos períodos de tiempo (3años - 5 años) de un compuesto, se busca la producción de Ig G4 específicas contra el (los) alérgeno (s), que no se unen a los mastocitos y de LT reguladores sobre la respuesta inmune LTh1 y LTh2 (79,80). Se están generando nuevas estrategias como el uso de alérgenos recombinantes, péptidos contenidos en epítopes de células B y T, vacunación con DNA e inmunoterapia sublingual (que ha demostrado su eficacia y seguridad, pero no ha sido aprobado su utilización por parte de la administración de alimentos y medicamentos –FDA-) (81,82).
Anticuerpos monoclonales como el anti IgE omalizumab, que es derivado de DNA recombinado humanizado y se indica en la terapia de pacientes con seis años o más de asma alérgica permanente severa no controlada en la escala de tratamiento cuatro o cinco y se ha visto en los estudios que disminuye las exacerbaciones respecto a los esteroides inhalados, pero no se ha comparado su eficacia con los corticosteroides orales (1,83).
REFERENCIAS BIBLIOGRÁFICAS
1. Cardona R, Rojas W. Capítulo 33. Mecanismos básicos de las alergias. En: Rojas W, Anaya JM, Cano LE, Gómez LM, Lopera D. 16 eds. Inmunología de Rojas. Medellin, Antioquia: CIB; 2012. [ Links ]
2. Lockett GA, Patil VK, Soto-Ramírez N, Ziyab AH, Holloway JW, Karmaus W. Epigenomics and allergic disease. Epigenomics. 2013 Dec;5(6):685-99. [ Links ]
3. Lodge CJ, Allen KJ, Lowe AJ, Dharmage SC. Overview of evidence in prevention and aetiology of food allergy: a review of systematic reviews. Int J Environ Res Public Health. 2013 Nov 4;10(11):5781-806. [ Links ]
4. Rona RJ, Keil T, Summers C, Gislason D, Zuidmeer L, Sodergren E, et al. The prevalence of food allergy: A meta-analysis. J. Allergy Clin. Immunol. 2007, 120, 638–646. [ Links ]
5. Rowe BH, Gaeta TJ. Chapter 27. Anaphylaxis, Acute Allergic Reactions, and Angioedema. In: Tintinalli JE, Stapczynski J, Ma O, Cline DM, Cydulka RK, Meckler GD, T. eds. Tintinalli's Emergency Medicine: A Comprehensive Study Guide, 7e. New York, NY: McGraw-Hill; 2011. http://accessmedicine.mhmedical.com/content.aspx?bookid=348&Sectionid=40381488. Accessed January 20, 2015. [ Links ]
6. Pawankar R, Canonica GW, Holgate ST, Lockey RF. WAO White Book on Allergy 2011-2012: Executive Summary. 1 ed. Milwaukee: WAO; 2011. [ Links ]
7. Friedman NR, Scholes MA, Yoon PJ. Ear, Nose, & Throat. In: Hay WW, Jr., Levin MJ, Deterding RR, Abzug MJ. eds. CURRENT Diagnosis & Treatment: Pediatrics, 22e. New York, NY: McGraw-Hill; 2013. http://accessmedicine.mhmedical.com/content.aspx?bookid=1016&Sectionid=61597764. Accessed January 18, 2015. [ Links ]
8. Boyce A, Austen K. Allergies, Anaphylaxis, and Systemic Mastocytosis. In: Kasper D, Fauci A, Hauser S, Longo D, Jameson J, Loscalzo J. eds. Harrison's Principles of Internal Medicine, 19e. New York, NY: McGraw-Hill; 2015. http://accessmedicine.mhmedical.com/content.aspx?bookid=1130&Sectionid=79749806. Accessed July 03, 2015. Accessed January 29, 2015. [ Links ]
9. Braverman R. Eye. In: Hay WW, Jr., Levin MJ, Deterding RR, Abzug MJ. eds.CURRENT Diagnosis & Treatment: Pediatrics, 22e. New York, NY: McGraw-Hill; 2013. http://accessmedicine.mhmedical.com/content.aspx?bookid=1016&Sectionid=61596695. Accessed January 18, 2015. [ Links ]
10. Valeyrie-Allanore LL, Roujeau J. Chapter 40. Epidermal Necrolysis (Stevens–Johnson Syndrome and Toxic Epidermal Necrolysis). In: Goldsmith LA, Katz SI, Gilchrest BA, Paller AS, Leffell DJ, Wolff K. eds. Fitzpatrick's Dermatology in General Medicine, 8e. New York, NY: McGraw-Hill; 2012. http://accessmedicine.mhmedical.com/content.aspx?bookid=392&Sectionid=41138737. Accessed January 19, 2015. [ Links ]
11. Sukasem C, Puangpetch A, Medhasi S, Tassaneeyakul W. Pharmacogenomics of drug-induced hypersensitivity reactions: challenges, opportunities and clinical implementation. Asian Pac J Allergy Immunol. 2014 Jun;32(2):111-23. [ Links ]
12. Shinkai K, Roujeau J, Stern RS, Wintroub BU. Chapter 55. Cutaneous Drug Reactions. In: Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson J, Loscalzo J. eds. Harrison's Principles of Internal Medicine, 18e. New York, NY: McGraw-Hill; 2012. http://accessmedicine.mhmedical.com/content.aspx?bookid=331&Sectionid=40726780. Accessed January 19, 2015. [ Links ]
13. Pavlos R, Mallal S, Phillips E. HLA and pharmacogenetics of drug hypersensitivity. Pharmacogenomics. 2012 Aug;13(11):1285-306. [ Links ]
14. Lawley LP, McCall CO, Lawley TJ. Chapter 52. Eczema, Psoriasis, Cutaneous Infections, Acne, and Other Common Skin Disorders. In: Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson J, Loscalzo J. eds. Harrison's Principles of Internal Medicine, 18e. New York, NY: McGraw-Hill; 2012. http://accessmedicine.mhmedical.com/content.aspx?bookid=331&Sectionid=40726777. Accessed January 18, 2015. [ Links ]
15. Hess MR, Hess SP. Chapter 249. Skin Disorders Common on the Trunk. In:Tintinalli JE, Stapczynski J, Ma O, Cline DM, Cydulka RK, Meckler GD, T. eds.Tintinalli's Emergency Medicine: A Comprehensive Study Guide, 7e. New York, NY: McGraw-Hill; 2011.http://accessmedicine.mhmedical.com/content.aspx?bookid=348&Sectionid=40381736. Accessed January 18, 2015. [ Links ]
16. Kaplan AP. Chapter 38. Urticaria and Angioedema. In: Goldsmith LA, Katz SI, Gilchrest BA, Paller AS, Leffell DJ, Wolff K. eds. Fitzpatrick's Dermatology in General Medicine, 8e. New York, NY: McGraw-Hill; 2012. http://accessmedicine.mhmedical.com/content.aspx?bookid=392&Sectionid=41138735. Accessed January 18, 2015. [ Links ]
17. Austen K. Chapter 317. Allergies, Anaphylaxis, and Systemic Mastocytosis. In:Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson J, Loscalzo J. eds.Harrison's Principles of Internal Medicine, 18e. New York, NY: McGraw-Hill; 2012. http://accessmedicine.mhmedical.com/content.aspx?bookid=331&Sectionid=40727118. Accessed January 18, 2015. [ Links ]
18. Disease. In: Longo DL, Fauci AS, Kasper DL, Hauser SL, Jameson J, Loscalzo J. eds. Harrison's Principles of Internal Medicine, 18e. New York, NY: McGraw-Hill; 2012. http://accessmedicine.mhmedical.com/content.aspx?bookid=331&Sectionid=40726778. Accessed January 18, 2015. [ Links ]
19. Sampson HA, Munoz-Furlong A, Campbell RL, et al: Second symposium on the definition of anaphylaxis: a summary reportSecond National Institute of Allergy and Infectious Diseases/Food Allergy and Anaphylaxis Network Symposium. J Allergy Clin Immunol 117: 391, 2006. [ Links ]
20. Lewis LM. Angioedema: etiology, pathophysiology, current and emerging therapies. J Emerg Med. 2013 Nov;45(5):789-96. [ Links ]
21. Cianferoni A, Spergel JM. Food allergy: review, classification and diagnosis. Allergol Int. 2009 Dec;58(4):457-66. [ Links ]
22. Bonadonna P, Lombardo C, Zanotti R. Mastocytosis and allergic diseases. J Investig Allergol Clin Immunol. 2014;24(5):288-97. [ Links ]
23. Global Iniciative for Asthma. Global Strategy for Asthma Management and Prevention 2014. Available from: www.ginaasthma.org. Accessed December 10, 2014. [ Links ]
24. Laemmle-Ruff I, O'Hehir R, Ackland M, Tang ML. Anaphylaxis - identification, management and prevention. Aust Fam Physician. 2013 Jan-Feb;42(1-2):38-42. [ Links ]
25. Siracusa A, Folletti I, Gerth van Wijk R, Jeebhay MF, Moscato G, Quirce S, Raulf M, Rueff F, Walusiak-Skorupa J, Whitaker P, Tarlo SM. Occupational anaphylaxis – an EAACI task force consensus statement. Allergy 2015; 70: 141–152. [ Links ]
26. Azari AA, Barney NP. Conjunctivitis: a systematic review of diagnosis and treatment. JAMA. 2013 Oct 23;310(16):1721-9. [ Links ]
27. Arnold JJ, Williams PM. Anaphylaxis: recognition and management. Am Fam Physician. 2011 Nov 15;84(10):1111-8. [ Links ]
28. Simons FE, Ardusso LR, Dimov V, Ebisawa M, El-Gamal YM, Lockey RF, Sanchez-Borges M, Senna GE, Sheikh A, Thong BY, Worm M; World Allergy Organization. World Allergy Organization Anaphylaxis Guidelines: 2013 update of the evidence base. Int Arch Allergy Immunol. 2013; 162(3):193-204. [ Links ]
29. Muraro A, Roberts G, Worm M, Bil_o MB, Brockow K, Fern_andez Rivas M et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy 2014;69:1026–1045. [ Links ]
30. Worm M, Babina M, Hompes S. Causes and risk factors for anaphylaxis. J Dtsch Dermatol Ges. 2013 Jan;11(1):44-50. [ Links ]
31. Worm M, Edenharter G, Ruëff F, Scherer K, Pfohler C, Mahler V, Treudler R, Lang R, Nemat K, Köhli A, Niggemann B, Hompes S. Symptom profile and risk factors of anaphylaxis in central Europe. Allergy 2012; 67: 691–8. [ Links ]
32. Calvani M, Cardinale F, Martelli A, Muraro A, Pucci N, Savino F, Zappala D, Panetta V. Risk factors for severe pediatric food anaphylaxis in Italy. Pediatr Allergy Immunol 2011; 22: 813–9. [ Links ]
33. Iribarren C, Tolstykh IV, Miller MK, Eisner MD. Asthma and the prospective risk of anaphylactic shock and other allergy diagnoses in a large integrated health care delivery system. Ann Allergy Asthma Immunol 2010; 104: 371–7. [ Links ]
34. Brockow K, Ring J. Update on diagnosis and treatment of mastocytosis. Curr Allergy Asthma Rep 2011; 11: 292–9. [ Links ]
35. Levinson W. Hypersensitivity (Allergy). In: Levinson W. eds. Review of Medical Microbiology and Immunology, 13e. New York, NY: McGraw-Hill; 2014. http://accessmedicine.mhmedical.com/content.aspx?bookid=1023&Sectionid=57053512. Accessed January 25, 2015. [ Links ]
36. Greidinger EL. Chapter 15. The Immune System. In: Janson LW, Tischler ME. eds. The Big Picture: Medical Biochemistry. New York, NY: McGraw-Hill; 2012. http://accessmedicine.mhmedical.com/content.aspx?bookid=397&Sectionid=39898622. Accessed January 11, 2015. [ Links ]
37. Manning KD, Winawer NH, Murali MR. Chapter 237. Allergy and Anaphylaxis. In: McKean SC, Ross JJ, Dressler DD, Brotman DJ, Ginsberg JS. eds. Principles and Practice of Hospital Medicine. New York, NY: McGraw-Hill; 2012. http://accessmedicine.mhmedical.com/content.aspx?bookid=496&Sectionid=41304230. Accessed January 29, 2015. [ Links ]
38. Kondo Y, Urisu A. Oral allergy syndrome. Allergol Int. 2009 Dec;58(4):485-91. [ Links ]
39. Imamura T, Kanagawa Y, Ebisawa M. A survey of patients with self-reported severe food allergies in Japan. Pediatr Allergy Immunol 2008;19:270-4. [ Links ]
40. Burks AW, Jones SM, Boyce JA, Sicherer SH, Wood RA, Assa'ad A, Sampson HA. NIAID-sponsored 2010 guidelines for managing food allergy: applications in the pediatric population. Pediatrics. 2011 Nov;128(5):955-65. [ Links ]
41. Wang J, Sampson HA. Food allergy. J Clin Invest. 2011 Mar;121(3):827-35. [ Links ]
42. Kivity S. Adult-onset food allergy. Isr Med Assoc J. 2012 Jan;14(1):70-2. [ Links ]
43. Cheng E, Souza RF, Spechler SJ. Tissue remodeling in eosinophilic esophagitis. Am J Physiol Gastrointest Liver Physiol. 2012 Dec 1;303(11):G1175-87. [ Links ]
44. Hong S, Vogel NM. Food allergy and eosinophilic esophagitis: learning what to avoid. Cleve Clin J Med. 2010 Jan;77(1):51-9. [ Links ]
45. Criado PR, Avancini J, Santi CG, Medrado AT, Rodrigues CE, de Carvalho JF.Drug reaction with eosinophilia and systemic symptoms (DRESS): a complex interaction of drugs, viruses and the immune system. Isr Med Assoc J. 2012 Sep;14(9):577-82. [ Links ]
46. Sicherer SH, Wood RA; American Academy of Pediatrics Section On Allergy And Immunology. Allergy testing in childhood: using allergen-specific IgE tests. Pediatrics. 2012 Jan;129(1):193-7. [ Links ]
47. Siles RI, Hsieh FH. Allergy blood testing: A practical guide for clinicians. Cleve Clin J Med. 2011 Sep;78(9):585-92. [ Links ]
48. Michalska-Krzanowska G. Tryptase in diagnosing adverse suspected anaphylactic reaction. Adv Clin Exp Med. 2012 May-Jun;21(3):403-8. [ Links ]
49. Kroigaard M, Garvey LH, Gillberg L, Johansson SG: Scandinavian Clinical Practice Guidelines on the diagnosis, management and follow-up of anaphylaxis during anaesthesia. Acta Anaesthesiol Scand 2007, 51, 655–670. [ Links ]
50. Harboe T, Guttormsen AB, Dybendal T: Anaphylaxis during anesthesia in Norway. Anesthesiology 2005, 102, 897–903. [ Links ]
51. Dellon ES. Diagnosis and management of eosinophilic esophagitis. Clin Gastroenterol Hepatol. 2012 Oct;10(10):1066-78. [ Links ]
52. Liacouras CA, Furuta GT, Hirano I, Atkins D, Attwood SE, Bonis PA, Burks AW, Chehade M, Collins MH, Dellon ES, Dohil R, Falk GW, Gonsalves N, Gupta SK, Katzka DA, Lucendo AJ, Markowitz JE, Noel RJ, Odze RD, Putnam PE, Richter JE, Romero Y, Ruchelli E, Sampson HA, Schoepfer A, Shaheen NJ, Sicherer SH, Spechler S, Spergel JM, Straumann A, Wershil BK, Rothenberg ME, Aceves SS. Eosinophilic esophagitis: updated consensus recommendations for children and adults. J Allergy Clin Immunol. 2011 Jul;128(1):3-20.e6; quiz 21-2. [ Links ]
53. Dellon ES, Gonsalves N, Hirano I, Furuta GT, Liacouras CA, Katzka DA; American College of Gastroenterology. ACG clinical guideline: Evidenced based approach to the diagnosis and management of esophageal eosinophilia and eosinophilic esophagitis (EoE). Am J Gastroenterol. 2013 May;108(5):679-92; quiz 693. [ Links ]
54. Lockett GA, Holloway JW. Genome-wide association studies in asthma; perhaps, the end of the beginning. Curr Opin Allergy Clin Immunol. 2013; 13(5):463–469. [ Links ]
55. Bønnelykke K, Matheson MC, Pers TH, et al. Meta-analysis of genome-wide association studies identifies ten loci influencing allergic sensitization. Nat Genet. 2013; 45(8):902–906. [ Links ]
56. Lee SH, Park JS, Park CS. The search for genetic variants and epigenetics related to asthma. Allergy Asthma Immunol Res. 2011; 3(4):236–244. [ Links ]
57. Manolio TA, Collins FS, Cox NJ, et al. Finding the missing heritability of complex diseases. Nature. 2009; 461(7265):747–753. [ Links ]
58. Phillips EJ, Mallal SA. Pharmacogenetics of drug hypersensitivity. Pharmacogenomics. 2010 Jul;11(7):973-87. [ Links ]
59. Gomes ER, Demoly P. Epidemiology of hypersensitivity drug reactions. Curr Opin Allergy Clin Immunol 2005;5:309–316. [ Links ]
60. Chung WH, Hung SI, Hong HS, et al. Medical genetics: a marker for Stevens–Johnson syndrome. Nature 2004;428:486. [ Links ]
61. Moffatt MF, Gut IG, Demenais F et al. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med 2010;363:1211-21. [ Links ]
62. Li X, Howard TD, Zheng SL et al. Genome-wide association study of asthma identifies RAD50-IL13 and HLA-DR DQ regions. J Allergy Clin Immunol 2010;125:328-35. [ Links ]
63. Hunninghake GM, Lasky-Su J, Soto-Quirós ME et al. Sexstratified linkage analysis identifies a female-specific locus for IgE to cockroach in Costa Ricans. Am J Respir Crit Care Med 2008;177:830-6. [ Links ]
64. Tamari M, Tanaka S, Hirota T. Genome-wide association studies of allergic diseases. Allergol Int. 2013 Mar;62(1):21-8. [ Links ]
65. Esparza-Gordillo J, Weidinger S, Fölster-Holst R et al. A common variant on chromosome 11q13 is associated with atopic dermatitis. Nat Genet 2009;41:596-601. [ Links ]
66. Paternoster L, Standl M, Chen CM et al. Meta-analysis of genome-wide association studies identifies three new risk loci for atopic dermatitis. Nat Genet 2011;44:187-92. [ Links ]
67. Ramasamy A, Curjuric I, Coin LJ et al. A genome-wide meta-analysis of genetic variants associated with allergic rhinitis and grass sensitization and their interaction with birth order. J Allergy Clin Immunol 2011;128:996-1005. [ Links ]
68. Rothenberg ME, Spergel JM, Sherrill JD et al. Common variants at 5q22 associate with pediatric eosinophilic esophagitis. Nat Genet 2010;42:289-91. [ Links ]
69. Saag M, Balu R, Phillips E, Brachman P, Martorell C, Burman W, et al. High sensitivity of human leukocyte antigen-b*5701 as a marker for immunologically confirmed abacavir hypersensitivity in white and black patients. Clin Infect Dis. 2008;46:1111-8. [ Links ]
70. Jung JW, Song WJ, Kim YS, Joo KW, Lee KW, Kim SH, et al. HLA-B58 can help the clinical decision on starting allopurinol in patients with chronic renal insufficiency. Nephrol Dial Transplant. 2011 Nov;26:3567-72. [ Links ]
71. Amstutz U, Ross C, Castro-Pastrana L, Rieder M, Shear N, Hayden M, et al. HLA-A*31:01 and HLA-B*15:02 as genetic markers for carbamazepine hypersensitivity in children. Clin Pharmacol Ther. 2013;94:142-9. [ Links ]
72. Kim S-H, Lee KW, Song W-J, Kim S-H, Jee Y-K, Lee S-M, et al. Carbamazepine-induced severe cutaneous adverse reactions and HLA genotypes in Koreans. Epilepsy Res. 2011;97:190-7. [ Links ]
73. Kaniwa N, Saito Y, Aihara M, Matsunaga K, Tohkin M, Kurose K. HLA-B*1511 is a risk factor for carbamazepine-induced Stevens-Johnson syndrome and toxic epidermal necrolysis in Japanese patients. Epilepsia. 2010;51:2461–5. [ Links ]
74. McCormack M, Alfirevic A, Bourgeois S, Farrell JJ, Kasperaviciute D, Carrington M, et al. HLA-A*3101 and carbamazepine-induced hypersensitivity reactions in Europeans. N Engl J Med. 2011;364:1134–43. [ Links ]
75. Chantarangsu S, Mushiroda T, Mahasirimongkol S, Kiertiburanakul S, Sungkanuparph S, Manosuthi W, et al. HLA-B*3505 allele is a strong predictor for nevirapine-induced skin adverse drug reactions in HIV-infected Thai patients. Pharmacogenet Genomics 2009;19:139-46. [ Links ]
76. A, Boyce J Assa'ad A, Burks AW, Jones SM, Sampson HA, Wood RA, Plaut M, Cooper SF, Fenton MJ, Arshad SH, Bahna SL, Beck LA, Byrd-Bredbenner C, Camargo CA Jr, Eichenfield L, Furuta GT, Hanifin JM, Jones C, Kraft M, Levy BD, Lieberman P, Luccioli S, McCall KM, Schneider LC, Simon RA, Simons FE, Teach SJ, Yawn BP, Schwaninger JM; NIAID-Sponsored Expert Panel. Guidelines for the Diagnosis and Management of Food Allergy in the United States: Summary of the NIAID-Sponsored Expert Panel Report. J Allergy Clin Immunol. 2010 Dec;126(6):1105-18. [ Links ]
77. Saadeh D, Salameh P, Baldi I, Raherison C. Diet and allergic diseases among population aged 0 to 18 years: myth or reality? Nutrients. 2013 Aug 29;5(9):3399-423. [ Links ]
78. Muche-Borowski C, Kopp M, Reese I, Sitter H, Werfel T, Schäfer T. Allergy prevention. Dtsch Arztebl Int. 2009 Sep;106(39):625-31. [ Links ]
79. Syed A, Kohli A, Nadeau KC. Food allergy diagnosis and therapy: where are we now? Immunotherapy. 2013 Sep;5(9):931-44. [ Links ]
80. Gupta RS, Springston EE, Warrier MR, et al. The prevalence, severity, and distribution of childhood food allergy in the United States. Pediatrics. 2011;128(1):e9–e17. [ Links ]
81. Bidad K, Nicknam MH, Farid R. A review of allergy and allergen specific immunotherapy. Iran J Allergy Asthma Immunol. 2011 Mar;10(1):1-9. [ Links ]
82. Larché M, Akdis CA, Valenta R. Immunological mechanisms of allergen-specific immunotherapy. Nat Rev Immunol 2006; 6(10):761-71. [ Links ]
83. Norman G, Faria R, Paton F, Llewellyn A, Fox D, Palmer S, Clifton I, Paton J, Woolacott N, McKenna C. Omalizumab for the treatment of severe persistent allergic asthma: a systematic review and economic evaluation. Health Technol Assess. 2013 Nov;17(52):1-342. [ Links ]