INTRODUCCIÓN
Las Buenas Prácticas de Manufactura (BPM), así como los controles de calidad a medicamentos surgieron, en respuesta a hechos graves relacionados con la falta de calidad, pureza y eficacia de alimentos y medicamentos1,2.
Los productos farmacéuticos no estériles permiten un máximo de carga microbiana, pero debe haber ausencia de patógenos3.
La contaminación con microorganismos objetables en los productos farmacéuticos no estériles puede tener el potencial de disminuir o inactivar la actividad farmacológica y terapéutica del principio activo y por ende representar un peligro de gran riesgo para la salud de la persona que está en tratamiento con fármacos4.
En el trabajo de investigación, se realizó el análisis de riesgo microbiológico de microorganismo objetable encontrado, aplicadas a un suplemento dietario: cápsulas blandas con aceite de Krill, tomando como base los retiros del mercado de los productos farmacéuticos no estériles, por causa mayoritaria por presencia de microorganismos objetables, con el fin de disminuir los riesgos, garantizar la inocuidad de los medicamentos y proteger la salud del paciente.
MATERIALES Y MÉTODOS
Diseño del estudio observacional-descriptivo, de corte transverso. Fue realizado en una Industria Farmacéutica (Departamento de Microbiología) de la ciudad de Asunción.
Se realizó mediante prueba bioquímica llamada API 20A-V4.0, sistema de identificación rápida para bacterias, establecidos para los controles microbiológicos según los estándares de la Farmacopea de los Estados Unidos- USP 40 - NF 35, capítulos generales <62>, <1111>, <1113> y <2022> para las diversas determinaciones realizadas5.
RESULTADOS
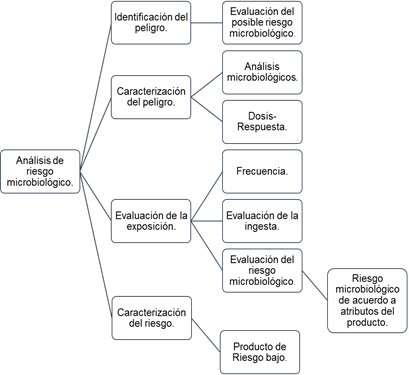
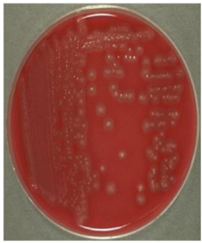
Se realizó el análisis de riesgo desarrollado en un producto farmacéutico no estéril en una industria farmacéutica: cápsulas blandas de aceite de Krill 500 mg (suplemento dietario) en el cuál se encontró en el control higiénico del producto, la presencia de un microorganismo Clostridium sp, realizándose posteriormente un análisis de riesgo microbiológico para determinar si el microorganismo encontrado podría ser objetable o no, y por ende determinar si es factible permitir la liberación de lotes de dicho producto.
Las fases que comprende el análisis del riesgo fueron tres: evaluación del riesgo, gestión del riesgo, y comunicación del riesgo.
Acorde a los resultados obtenidos en el análisis de riesgo con todos los parámetros analizados (ver Figura 1), se determinó que solo un lote se vio afectado por la contaminación microbiana, y que de acuerdo a las pruebas bioquímicas realizadas (API 20 E) no corresponden a un microorganismo objetable patógeno, por lo cual, se determinó que dicho suplemento es de riesgo bajo, debido a que la incidencia de infecciones debidas al uso de productos contaminados es extremadamente baja y está asociada principalmente con la condición de salud del receptor. Las personas que se verían afectadas por el consumo de este producto farmacéutico no estéril serían adultos y adultos mayores, siendo estos según las categorías de RIESGO BAJO por la forma farmacéutica (del tipo sólidos orales como suplementos dietarios) y además, según pruebas microbiológicas y bioquímicas realizadas arrojando como resultado confirmatorio la presencia de Clostridium sp, considerado microorganismo objetable, pero de la especie no patógena, que se conocen por bibliografía, por lo tanto es apto para el uso humano y se encuentra aprobado para la liberación del lote.
DISCUSIÓN
En Paraguay no existen normativas, que nos mencionen acerca de los análisis de microorganismos objetables, a diferencia con otros países de la región como Argentina, y desde hace tiempo en EE. UU y países europeos, que se reportan a través de la FDA, de ahí la importancia de la realización del análisis de riesgo a este tipo de producto, en el cual se encontró la presencia de un microorganismo objetable, el cual sienta las bases, para la Industria Farmacéutica para la realización de un control microbiológico más profundo, de modo a asegurar que los medicamentos fabricados sean seguros, confiables y eficaces para consumo humano. Sin embargo, existen precedentes de análisis de riesgo microbiológicos realizados en alimentos, en países de la región, así como en diferentes partes del mundo, y la aplicación de análisis de riesgos microbiológicos a productos farmacéuticos como medicamentos veterinarios en países como España6.
En Argentina, en el año 2010 la ANMAT, se establecieron los límites microbiológicos para productos farmacéuticos no obligatoriamente estériles, y que la calidad microbiológica de los productos farmacéuticos no obligatoriamente estériles contribuye a la seguridad e inocuidad de los mismos, debido a que evidencia el cumplimiento de las Buenas Prácticas de Fabricación, debido a que los productos pueden llegar a ser vehículo de microorganismos objetables, tanto por ser patógenos, como por provocar alteración de productos, o ser indicadores de calidad higiénica deficiente7-8.
Se propone la realización de un plan de seguimiento a los controles microbiológicos realizados a los productos farmacéuticos no estériles, que puede consistir en procedimientos operativos estándar de pruebas microbiológicas con ligeras modificaciones, para detectar en productos a los microorganismos potencialmente objetables, y éste debe estar basado en un análisis de riesgo para determinar el nivel y probabilidad de ocurrencia de daños a la salud del paciente, de manera a seguir mejorando continuamente los controles de fabricación, la detección y la toma de decisiones para excluir los microorganismos objetables de sus productos.