INTRODUCCIÓN
Se ha descrito que determinadas variables de la onda P, tales como las variaciones en morfología, voltaje, y duración, en el electrocardiograma (ECG) standard de 12 derivaciones permite identificar a los pacientes con riesgo de desarrollar arritmias auriculares, entre ellas la fibrilación auricular (FA) (1-5. Además, se ha observado que ciertos parámetros electrocardiográficos han sido utilizados para estratificar a los pacientes y realizar un seguimiento más estricto de aquellos con alta probabilidad de desarrollar FA (2.
Uno de estos parámetros electrocardiográficos arriba mencionados es el bloqueo interauricular (BIA) 6-11. Esta alteración del ECG denota un retraso de conducción entre las aurículas derecha e izquierda a causa de un enlentecimiento en la conducción de impulsos a través del haz de Bachmann. El BIA es un marcador significativo en la predicción del desarrollo de FA 8,11,12,13. El sustrato histopatológico que se observa en el proceso de remodelación auricular es la fibrosis del miocardio auricular induciendo disincronía interauricular. La disfunción electromecánica de la aurícula izquierda (AI) produce una activación anormal de sus paredes, el aumento de la presión, la dilatación, la disfunción endotelial, y la fibrosis de la AI 14-19. Estas alteraciones fisiopatológicas favorecen la conducción lenta, el bloqueo unidireccional y el desarrollo de mecanismos de reentrada con la aparición de la FA con sus nefastas complicaciones, entre ellas el accidente cerebrovascular (ACV) 20-23.
El BIA avanzado (Figura 1) se desarrolla debido a una conducción auricular totalmente bloqueada o parcialmente enlentecida a nivel del haz de Bachmann, lo que puede generar alteraciones en los períodos refractarios de la AI y la aparición de extrasístoles auriculares que podrían desarrollar arritmias auriculares, FA, y eventualmente embolias sistémicas y ACV 20-23. Por lo tanto, es nuestra intención realizar un análisis detallado sobre del papel que posee el BIA en la detección y predicción de accidentes cerebrovasculares. Es fundamental poseer una mejor comprensión del BIA en ciertos pacientes con la predisposición clínica a desarrollar ACV y para refinar los criterios de selección diagnósticos y estrategias informativas para el manejo adecuado de la anticoagulación.
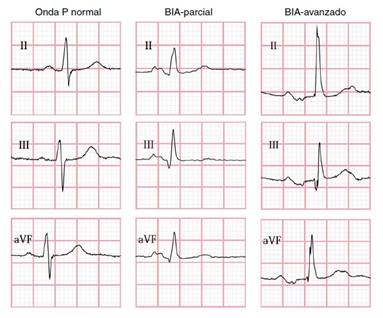
Figura 1. Ejemplos electrocardiográficos de una onda P normal, y de Bloqueo interauricular (BIA) parcial y avanzado. El ejemplo del bloqueo interauricular avanzado tiene una morfología de patrón bifásico (positivo-negativo) con negatividad terminal en las derivaciones electrocardiográficas inferiores II, III, y aVF. Reimpreso con permiso de Carrillo-Loza K, Baranchuk A, Serrano F, Hassebb S, Espinosa Lirac F. Soriano E et al. El bloqueo interatrial avanzado predice recurrencia de infarto cerebral embólico de origen no determinado. Neurologia (Engl Ed) 2019; S0213-4853(19)30136-7. doi: 10.1016/j.nrl.2019.10.007. (24)
Relación entre el BIA y los accidentes cerebrovasculares
Es fundamental dar el énfasis necesario a la prevención y al diagnóstico precoz de enfermedades con gran impacto social, médico y económico a la salud pública como son la FA y los ACV isquémicos. Por lo tanto, es primordial intentar detectar la enfermedad en etapas tempranas de su evolución, en estadio sub-clínico, e identificar factores que determinen con gran confiabilidad la aparición y desarrollo de la enfermedad. El ECG convencional de 12 derivaciones es un método auxiliar de diagnóstico muy útil, de fácil disponibilidad, muy accesible para detectar cambios en el sistema de conducción cardíaca. El bloqueo interauricular que se produce por un bloqueo del haz de Bachmann es un marcador electrocardiográfico de arritmias auriculares, y se lo ha asociado clínicamente con un riesgo aumentado de FA e infarto cerebral 24-28. El haz de Bachmann está formado por un conjunto de fibras miocárdicas paralelas especializadas para la conducción de impulsos y representa el 80 a 85% de la conducción interauricular. Se encuentra ubicado en las paredes antero-superiores de ambas aurículas y su afectación parcial o total, da lugar al bloqueo interauricular, que puede ser: BIA parcial, si la conducción está retrasada de tal forma que en el ECG produce una onda P ≥ 120 ms. Puede ser BIA avanzado si la conducción está del todo interrumpida y la despolarización auricular izquierda ocurre en dirección retrógrada caudo-craneal, por lo tanto la onda P es ≥ 120 ms y bifásica en las derivaciones inferiores II, III y aVF (Figura 2).
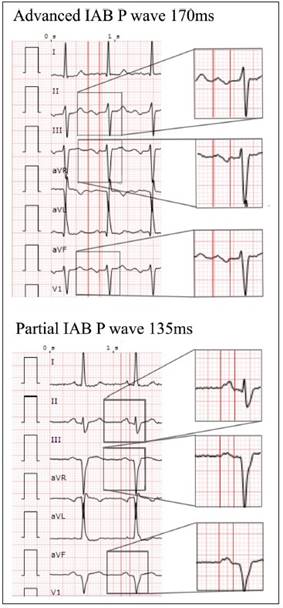
Figura 2. Ejemplos electrocardiográficos de Bloqueo interauricular (IAB) parcial y avanzado. Reimpreso con permiso de Vicent L, Fernandez-Cordon C, Nombela-Franco L, Escobar-Robledo LA, Ayesta A, Sole A, et al. Baseline ECG and Prognosis After Transcatheter Aortic Valve Implantation: The Role of Interatrial Block. J Am Heart Assoc. 2020; 9: e017624. DOI: 10.1161/JAHA.120.017624 (49)
Asad N y Spodik DH analizaron 1000 ECG no seleccionados, consecutivos, en pacientes hospitalizados, y observaron la presencia del BIA en el 47% de los pacientes que tenían ritmo sinusal normal durante la internación hospitalaria 26. Por otro lado, Ninios I, et al. encontraron una prevalencia de BIA del 59% con una correlación significativa con la hipertensión arterial sistémica en un estudio realizado en la población general ambulatoria de una comunidad de ancianos mayores de 65 años 28. Ariyarajah V, et al. observaron una prevalencia de BIA de 48,6% en un estudio realizado sobre una población de la comunidad de ancianos de un programa de atención integral para personas mayores 19. Agarwal YK, et al. analizaron prospectivamente la prevalencia del BIA en un estudio con un seguimiento medio de 16 meses. La prevalencia de BIA fue comparada entre 308 pacientes que desarrollaron FA con un grupo control de 308 pacientes que permanecieron en ritmo sinusal durante el período de seguimiento. La prevalencia de BIA fue significativamente más alta (52%) en los pacientes que desarrollaron FA, en comparación con solo un 18% en los pacientes controles 29. Es evidente que el BIA es un hallazgo electrocardiográfico bastante frecuente, por ende, es importante buscarlo e identificarlo sobre todo en personas mayores. El sustrato anatómico del BIA avanzado es el de una miocardiopatía auricular fibrótica que desencadena una disincronía auricular que actúa como un mecanísmo desencadenante y de mantenimiento de la FA. Esta alteración de la arquitectura del miocardio auricular produce un remodelado auricular, estasis sanguínea e hipercoagulabilidad y la formación de trombos intra-auriculares 14-19. Sin embargo, todavía no se ha demostrado el beneficio de la terapia de anticoagulación para los pacientes sin FA documentada. Por lo tanto, es recomendable una búsqueda proactiva de FA en los pacientes con BIA avanzado, ya que en este grupo de pacientes el sustrato anatómico y funcional de miocardiopatía auricular fibrótica con disincronía auricular, se traduce en una aurícula izquierda dilatada, hipocontractil que propicia el remodelado auricular y la favorece la estasis sanguínea y formación de trombos 14-19.
Es importante notar que la asociación entre el BIA y los infartos cerebrales parece estar limitada a infartos no lacunares y se mantiene independientemente de la presencia de FA 28-31. Existen evidencias clínicas que consideran a la cardiomiopatía auricular como un factor de riesgo independiente para ACV de tipo isquémico y que la existencia de trombos en la auricula izquierda ocurre independientemente del registro de FA 32-35. En algunos estudios como los de He J, et al 13. han demostrado que ciertas anormalidades de la onda P, tales como la fuerza terminal de la onda P en la derivación V1, la duración de la onda P, y el área máxima de la onda P, predijeron episodios de ACV isquémico independientemente de la presencia de FA 13. Debido a los cambios producidos por la remodelación auricular y su asociación con la dilatación auricular izquierda y con la disfunción auricular electromecánica, el BIA puede facilitar las alteraciones histológicas y electrofisiológicas y producir un sustrato anatómico-eléctrico para la formación de trombos intraauriculares y las embolias cerebrales y sistémicas 32. En un estudio bien diseñado, Lorbar M, et al 3. estudiaron en forma retrospectiva a 104 pacientes en ritmo sinusal con accidentes cerebrovasculares embólicos y observaron que el BIA estaba presente en un 80% de estos pacientes 3. En otro estudio retrospectivo, Ariyarajah V, et al 20. compararon 85 pacientes con ACV embólico con 208 pacientes con ACV no embólico, que fueron emparejados por factores de riesgo de accidente cerebrovascular. Este estudio demostró que un 88% de los pacientes estaban en ritmo sinusal, pero la prevalencia de BIA fue significativamente mayor en los pacientes con ACV embólico (60.6%) en comparación con los pacientes que tenían ACV no embólico (39.8%) 20. Los factores de riesgo cardiovascular para el BIA avanzado, la FA y el ACV embólico parecen ser muy similares, y la patogénesis subyacente probablemente se deba a fibrosis miocárdica y remodelación auricular 14-19. El BIA avanzado produce una disfunción eléctrica y mecánica auricular que propicia el desarrollo de una miocardiopatía fibrótica auricular que ha sido muy bien descrita por un consenso de expertos (32. La fibrosis favorece la estasis sanguínea y la trombosis intrauricular, principalmente en la orejuela, así como también favorece el desarrollo de arritmias supraventriculares, especialmente la FA 33. El tratamiento que demostró categóricamente una mejoría de la sobrevida en pacientes con FA fue la prevención del ACV embólico mediante la anticoagulación 32. De hecho, un 20% de los episodios de ACV embólico se atribuyen a la FA, aumentando así al doble la tasa de mortalidad y la tasa de un nuevo ACV en cinco veces 36-39. Durante el tratamiento preventivo del ACV embólico, la escala CHA2DS2-VASc, ha sido ampliamente validada para decidir la anticoagulación en la población general y de esta manera prevenir la aparición de eventos tromboembólicos 40-50. Por otro lado, la escala HASBLED valora el riesgo de hemorragias. El balance adecuado entre ambas escalas determina en gran medida el éxito terapéutico y la seguridad de la anticoagulación. Teniendo en cuenta los efectos adversos de la anticoagulación, es de vital importancia estandarizar la indicación de la misma basándose en criterios validados en estudios previos con alto nivel de confiabilidad 41.
Estudios clínicos sobre el BIA y los ACV embólicos
La FA era considerada como la causa común final que originaba las tromboembolias sistémicas y cerebrales. De hecho, se ha observado una asociación entre FA y ACV isquémico en un estudio reciente 48 con seguimiento a 10 años obtenidos al agregar el bloqueo interauricular a los modelos de factores de riesgo convencionales (Figura 3). Sin embargo, se ha demostrado que existe una ausencia de una relación temporal de los episodios paroxísticos de FA con la aparición de ACV embólicos 46-49. Por esta razón la fibrosis miocárdica auricular adquiere una relevancia muy importante por su relación con el desarrollo de estasis sanguínea en las aurículas y orejuelas auriculares que favorece la formación de trombos intracavitarios. Es entendible y evidente el énfasis preponderante que se ha puesto en los medios auxiliares de diagnóstico por imágenes actualmente como medio de diagnóstico de fibrosis auricular. La resonancia magnética nuclear cardiaca es el gold standard para detectar la miocardiopatía auricular fibrótica (15, 44), que es el sustrato anatomopatológico de la mayoría de los casos de pacientes con BIA avanzado y de FA. Incluso se ha demostrado que los pacientes con BIA avanzado pueden presentar un alto grado de fibrosis del miocardio auricular sin FA documentada 15. Por otro lado, la ecocardiografía con la técnica de speckle-tracking también permite valorar adecuadamente la fibrosis auricular y tiene implicaciones no solamente diagnósticas sino pronósticas en lo que respecta a las recurrencias de los episodios de FA (17, 23, 45).
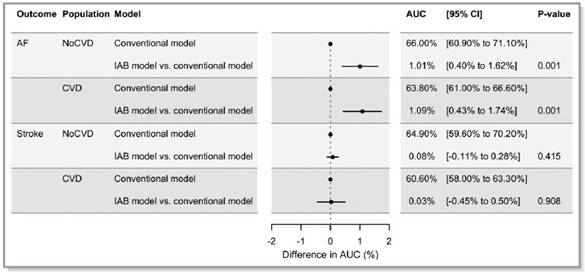
Figura 3. Diferencias en el área bajo la curva para los resultados a 10 años de fibrilación auricular y ACV isquémico obtenidos al agregar el bloqueo interauricular a los modelos de riesgo convencionales de fibrilación auricular y ACV isquémico, respectivamente, estratificados por la presencia o ausencia de enfermedades cardiovasculares al inicio del estudio. AF indica fibrilación auricular; AUC, área bajo la curva; IC: intervalo de confianza; CVD: enfermedad cardiovascular al inicio del estudio; IAB, bloqueo interauricular; sin CVD, sin enfermedad cardiovascular al inicio del estudio. Reimpreso con permiso de Skov MW, Ghouse J, Kuhl JT, Pyotr G, Platonov PG, Graff C, Fuchs A. Risk Prediction of Atrial Fibrillation Based on Electrocardiographic Interatrial Block J Am Heart Assoc. 2018; 7: e008247. DOI: 10.1161/JAHA.117.008247.
El estudio ARIC ha servido como fuente de análisis para investigar la relación existente entre el BIA y los ACV isquémicos. En este contexto, O´Neal et al 27. examinaron la asociación entre BIA y la incidencia de infarto cerebral 27. Ellos demostraron que el BIA fue un factor de riesgo independiente para el ACV isquémico. Se estima que en USA, ocurren aproximadamente 700.000 nuevos casos de ACV isquémico por año y no se ha determinado aún cuál es el mejor tratamiento de prevención secundaria (28, 29). Los resultados obtenidos por dos estudios que investigaron la recurrencia de infarto cerebral en pacientes con ACV isquémico tratados con ACO no han sido satisfactorios. Por un lado, el estudio ESUS NAVIGATE, que comparó 15 mg de rivaroxaban contra 100 mg de aspirina; y por el otro, el estudio RESPECT ESUS, que comparó dos dosis de dabigatrán (100 y150 mg dos veces por día) contra la aspirina. Estos dos ensayos clínicos fallaron en demostrar la eficacia de los ACO en la prevención de recurrencia de infarto cerebral en este grupo de pacientes. Además, en el caso del rivaroxaban, se observó la asociación con un mayor riesgo de hemorragia (30, 31). Un dato muy interesante a tener en cuenta es que ambos grupos de tratamiento mostraron una tasa elevada de recurrencia en el estudio ESUS NAVIGATE. Este hecho singular pone de relieve la necesidad de una mejor selección de pacientes y una mejor opción terapéutica.
Por otro lado, Carrillo-Loza k, et al. (24) investigaron al BIA avanzado como predictor de recurrencia de ACV embólico en pacientes con infarto cerebral embólico de origen no determinado (ESUS). Los autores analizaron los datos clínicos, las características de la onda P y presencia de BIA en el electrocardiograma de 104 pacientes con diagnóstico confirmado de ESUS con un seguimiento medio de 15 meses. La recurrencia de ESUS fue el desenlace primario. Se encontró BIA en 36 pacientes (34,6%), de los cuales tenían BIA parcial en 29 (27,9%), y BIA avanzado en 7 (6,7%) pacientes. Un total de 16 pacientes (15,4%) presentaron ACV recurrente; de los cuales 5 tenían BIA parcial, y 4 tenían BIA avanzado (p=0,01). La duración media de la onda P fue mayor en pacientes con recurrencia (p=0,009) 24. En el análisis multivariado de regresión logística, los factores de riesgo independientes para recurrencia de ACV embólico fueron: el BIA-a (p<0,001), el género masculino (p=0,028) y la edad mayor a 50 años (p=0,039). Por lo tanto, los autores concluyeron que el BIA avanzado y una edad mayor a 50 años predicen la recurrencia de ACV embólico 24. Estos hallazgos sugieren que la detección de BIA avanzado en pacientes con ACV isquémico previo permite identificar a pacientes de alto riesgo de recurrencia en los que algunas terapias farmacológicas podrían ser beneficiosas.
En un estudio descriptivo, observacional y retrospectivo fueron analizadas las características clínicas, eléctricas y ecocardiográficas de pacientes portadores de BIA. La población estudiada conformó una muestra total de 165 pacientes consecutivos, que eran mayores de edad, se hallaban en ritmo sinusal y tuvieron un seguimiento a largo plazo durante tres años 35. Se diagnosticaron 63 casos de BIA avanzado en el ECG y por lo tanto se seleccionó una muestra similar de pacientes consecutivos con BIA parcial y sin BIA que conformó una muestra total de 165 pacientes para el estudio. Los autores observaron que los factores vinculados con riesgo de padecer un BIA avanzado son tener ≥ 65 años, diabetes, disfunción diastólica del ventrículo izquierdo y dilatación de la aurícula izquierda 35. Además, observaron que los pacientes con BIA avanzado poseen una mayor tasa de ACV isquémico que aparece junto con antecedente de FA o sin ella. Estos resultados destacan la posibilidad de realizar tamizado clínico y prevención de la FA y la necesidad de individualizar y precisar si los enfermos con BIA avanzado deben anticoagularse a fin de prevenir los ACV isquémicos. El ensayo clínico randomizado ¨AtRial Cardiopathy and Antithrombotic Drugs In Prevention After Cryptogenic Stroke¨, se encuentra actualmente en pleno desarrollo e incluye pacientes con ACV isquémico de origen indeterminado y cardiomiopatía auricular que están recibiendo ya sea apixaban o aspirina 34. Existe mucho interés en los resultados de este ensayo clínico ya que los hallazgos podrían aclarar si el alto riesgo de recurrencia en pacientes con ACV isquémico de origen indeterminado puede ser reducido con otras alternativas de terapia de anticoagulación.
CONCLUSIÓN
Es evidente el interés académico, clínico, y terapéutico en el diagnóstico electrocardiográfico certero del BIA avanzado, ya que el mismo se asocia con arritmias supraventriculares, fibrilación auricular, ACV embólicos y mortalidad. La detección de BIA avanzado en pacientes con ACV isquémico previo permite identificar a pacientes de alto riesgo de recurrencia en los que algunas terapias farmacológicas podrían ser beneficiosas. Los pacientes con BIA avanzado sin episodios previos de FA documentada también presentan un riesgo aumentado de ACV embólico. Por lo tanto, es necesario realizar ensayos clínicos randomizados cuyos resultados podrían avalar el uso de anticoagulantes en ausencia de FA documentada en pacientes con BIA avanzado.















