INTRODUCCIÓN
El monomorfismo sexual es el hecho de que machos y hembras se caracterizan por tener un gran parecido en sus rasgos fenotípicos lo que imposibilita la identificación de ambos géneros a simple vista. Un gran porcentaje de las aves son monomórficas. Si bien existen métodos no moleculares que permitan la identificación para algunas especies, esto requiere de tiempo o precisan que el animal sea adulto y/o se encuentren en periodo de apareamiento1. Más aun, métodos como la endoscopía implican un proceso quirúrgico, donde hay que sedar al animal para introducir el endoscopio en el saco aéreo del mismo para observar las gónadas. En ese aspecto, las técnicas moleculares para identificación de sexo de las aves han demostrado ser de mucha ayuda por la rapidez, efectividad y total independencia del tiempo en que se encuentre la cría o el adulto de la especie a sexar. En este contexto fue muy importante el descubrimiento del gen de la cromo helicasa de unión al ADN (viene del inglés Chromo Helicase DNA-binding gene) como una región altamente conservada capaz de usarse como marcador de sexado2,3.
La amplificación del gen CHD y su uso como marcador de sexado se basa en que en las aves, a diferencia de los mamíferos, las hembras son heterogaméticas, y no los machos y ellas por tanto, tienen dos cromosomas: Z y W; el cromosoma W ha sufrido reducción del número de sus genes mientras que el cromosoma Z no, por tanto al primero se lo considera como un microsoma y al segundo como un cromosoma grande. En ambos cromosomas se descubrió la existencia del gen de la cromo helicasa de unión al ADN (CHDW/CHDZ) pero estos difieren en el tamaño de su intron según se encuentra en un cromosoma o en el otro.
Existen varios cebadores que se han diseñado para amplificar el gen CHD, y poder distinguir el sexo según el tamaño del fragmento obtenido al amplificar. Tal es así que este gen, es sin dudas el más utilizado como marcador para sexado excepto en aves ratites3,4.
En nuestro país, el sexado de aves por métodos moleculares será de gran ayuda para aquellas instituciones como el Centro de Investigación de Animales Silvestres de ITAIPU (CIASI) que viene desarrollando programas de reproducción de aves en cautiverio, especialmente en psitácidos por ser aves muy perseguidas por el tráfico ilegal de mascotas, por ello, el objetivo del trabajo fue identificar el sexo por métodos moleculares de 9 especies de aves de dicha institución.
El CIASI es parte de la reserva ecológica de la hidroeléctrica de ITAIPU lado paraguayo. El área cuenta con 12 hectáreas donde tienen animales en cautiverio y semicautiverio a fin de desarrollar actividades educativas, recreativas y de investigación. Los investigadores del CIASI trabajan en la reproducción en cautiverio de especies amenazadas de extinción como la Panthera onca, Speothos venaticus, Craz fasciolata y Blastocerus dicotomus.
MATERIALES Y MÉTODOS
Los eritrocitos de las aves, a lo largo de sus vidas, son nucleados, por tanto la sangre es una buena fuente para extracción de ADN, lo que hace que una pequeña gota sea suficiente material para trabajar. Si bien las plumas, heces e hisopado bucal constituyen una fuente de extracción de ADN no invasiva5, recurrimos a muestras de ADN extraídas de sangre previamente almacenadas a -20 grados, en el marco del protocolo “Riesgo potencial de transmisión silenciosa de Paludismo en reservorios silvestres que habitan un área históricamente endémica”, aprobado bajo código P13/2015 por los comités ético y científico del Instituto de Investigaciones en Ciencias de la salud de la Universidad Nacional de Asunción (IICS-UNA). Las muestras provienen de animales que se encuentran en el CIASI y fueron extraídas de 23 aves: 3 ejemplares de Amazona aestiva, 1 de Pipile grayi, 1 de Bubo virginianus, 4 de Ara chloropterus, 6 de Crax fasciolata, 2 de Caracara plancus, 3 de Chauna torquata, 1 de Cariama cristata y 2 de Cairina moschata.
La sangre fue extraída en una cantidad mínima que pueda depositarse como una gota en el papel de filtro siguiendo los protocolos de Bailey, 2008 y Campbell, 19946,7.
El almacenamiento de la gota de sangre se hizo en papel de filtro S&S 903 que permite colectar las muestras en campo y transportarlas a temperatura ambiente a largas distancias. La extracción de ADN se realizó mediante el uso del Chelex 100, brevemente, la gota de sangre impregnada en el papel se corta y se pone en un tubo de 1.5 ml con 1 ml de agua bidestilada, se deja reposar por 10 min a temperatura ambiente, luego se centrifuga por 3 min a 13000 rpm, se descarta el sobrenadante, se adhiere 150 ul de Chelex al 5%, se incuba a 56°C por 30 min, se agita con vortex por 10 seg, se hierve 10 min, se agita de vuelta por 10 seg y se centrifuga por 3 min a 14.000 rpm8. El sobrenadante está listo como plantilla para la PCR, y en caso de no usarse inmediatamente se puede guardar a -20°C.
Se utilizó el par de cebadores 2550F/2718R9 que amplifica el gen CHD en reacciones de un volumen final de 25 ul que contuvo 1X Buffer, 2 mM MgCl2, 0.2 mM de dNTPs, 0,05uM de cada cebador, 0,25 ul de Hot Start Taq (Thermo Scientific) y 1 ul de ADN plantilla. El ciclado fue: desnaturalización inicial de 95 °C por 3 min, 45 ciclos de 95 °C de desnaturalización inicial por 15 seg, 52 °C de alineamiento por 15 seg y 72 °C de elongación por 15 seg y una elongación final de 72 °C por 8 min (5). En el caso de las hembras se amplifican fragmentos de 400 pb y 650 pb y en el caso de los machos se amplifican fragmentos de 650 pb.
Los productos de amplificación fueron sometidos a electroforesis en geles de agarosa al 2%, teñidos con Bromuro de Etidio y visualizados a luz UV.
El manuscrito fue aprobado por los comités Científico y Ético del IICS-UNA bajo código M08/17.
RESULTADOS
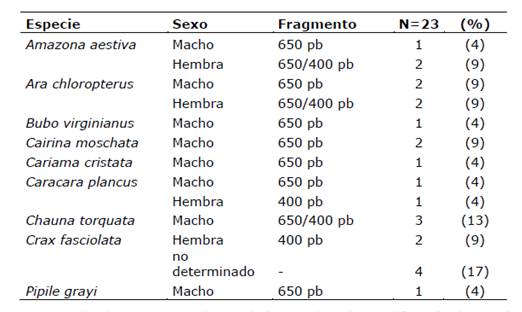
En total fue posible identificar el sexo en 19 de 23 aves de 9 especies observadas en la Tabla 1.
Tabla 1. Frecuencia de identificación molecular del sexo en aves del Centro de Investigación de Animales Silvestres de Itaipú.
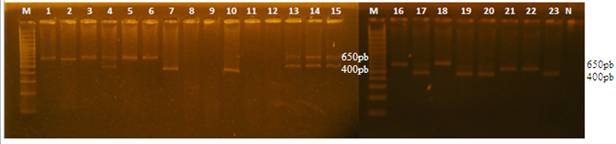
En la Figura 1 puede observarse en el caso de los machos, la amplificación de una única banda de 650 pb, sin embargo en todas las hembras se pudo amplificar la banda de 400 pb pero no se visualizó el fragmento de 650 pb en 3 de ellas, correspondientes a las especies Crax fasciolata y Caracara plancus.
DISCUSION
En el presente estudio se realizó la identificación molecular del sexo en 9 especies de aves (Tabla 1). Se observó un caso de sexo masculino de Bubo virginianus el cual es muy difícil de identificar por sus características fenotípicas debido a que sería imposible a simple vista determinar el sexo de dos individuos del mismo tamaño. Se podría utilizar medidas como el peso, pero de nuevo es un parámetro subjetivo ya que un individuo macho obeso podría ser considerado hembra o una hembra con una condición corporal baja podría ser considerada macho. Las especies Cairina moschata y Crax fasciolata sí presentan un claro dimorfismo sexual en la etapa adulta. Para estas dos especies, el sexado sería de utilidad cuando se tratase de juveniles que aún no han desarrollado las características fenotípicas de machos o de hembras.
Por otro lado, en Dubiec et al 20061, se discute que existe una amplificación preferencial de la copia más corta del gen que se encuentra en el cromosoma W, y por tanto el cromosoma Z se hace indetectable usando los cebadores 2550F/2718R. Hemos observado este fenómeno en ejemplares hembras de las especies Crax fasciolata y Caracara plancus. En cuanto a la especie Chauna torquata pudimos observar que en las hembras identificadas el fragmento de 650 pb aparece muy débil mientras que el fragmento de 400 pb es bastante fuerte a diferencia de las hembras de las especies Amazona aestiva y Ara chloropterus que presentan fragmentos que se visualizan en igual intensidad (Figura 1).
El hecho que las 4 muestras no identificadas correspondan a la especie Crax fasciolata, no creemos que sea debido a un problema de especificidad de los cebadores considerando que dos de las 6 muestras de Crax fasciolata sí pudieron ser determinadas, por lo que más bien puede deberse a algo inherente a la calidad de las muestras en sí.
Estos resultados sugieren que la técnica puede ser de utilidad para identificar el sexo lo cual contribuirá a mejorar el control y manejo nutricional adecuado de las hembras en etapa reproductiva para asegurar la provisión de calcio necesaria para la formación de las cascaras de los huevos, así como también el control de patologías propias de las aves hembras en el país.