Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.14 no.2 Asunción Aug. 2016
https://doi.org/10.18004/Mem.iics/1812-9528/2016.014(02)110-121
Articulo de Revisión/ Review Article
Presente y futuro de los anticuerpos recombinantes terapéuticos
Present and future of therapeutic recombinant antibodies
Patricia Langjahr I,II, Pablo Sotelo III *
I Dpto de Inmunología, Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción. Paraguay
II Cátedra de Inmunología Clínica, Facultad de Ciencias Químicas, Universidad Nacional de Asunción. Paraguay
III Dpto. de Biotecnología, Dir. de Investigaciones, Facultad de Ciencias Químicas, Universidad Nacional de Asunción. Paraguay
R E S U M E N
Los anticuerpos constituyen un componente fundamental del sistema inmune, permitiendo el reconocimiento con alta especificidad y posterior destrucción de moléculas extrañas. Los anticuerpos monoclonales, producidos por la tecnología del hibridoma, presentan desventajas para su uso en terapia humana debido a su origen en una especie diferente. La ingeniería genética posibilitó la utilización de los anticuerpos monoclonales para terapias humanas, generando los anticuerpos recombinantes terapéuticos. Así, los anticuerpos recombinantes se han transformado en un importante grupo de fármacos; con decenas de ellos aprobados para terapia humana y cientos en desarrollo. Se utilizan con éxito como tratamiento para un amplio rango de patologías, tales como cáncer, autoinmunidad e infecciones, siendo desde hace años el biofármaco con mayores ventas. Inicialmente todos los anticuerpos recombinantes terapéuticos presentaban la estructura convencional de los anticuerpos. Sin embargo, más recientemente, se han generado nuevos diseños que no poseen las características estructurales naturales, como los anticuerpos de simple cadena y bi-específicos. Debido al desarrollo y éxito de la tecnología de anticuerpos recombinantes, se espera un aumento constante en el número de anticuerpos terapéuticos contra nuevos blancos, además de la generación de nuevas estructuras, usos y estrategias terapéuticas. En esta revisión, nos centraremos en las características estructurales y los nuevos formatos de anticuerpos, así como su aplicación clínica en el tratamiento de diversas patologías. Además analizaremos los nuevos formatos de anticuerpos que se encuentran en el mercado y la aparición de los anticuerpos biosimilares.
Palabras clave: inmunoglobulinas, anticuerpos monoclonales, proteínas recombinantes, anticuerpos terapéuticos
A B S T R A C T
Antibodies are a key component of the immune system, acting in the highly specific recognition and subsequent destruction of foreign molecules. Monoclonal antibodies produced by hybridoma technology have disadvantages for use in human therapy because of its origin in a different species. Genetic engineering enabled the use of monoclonal antibodies for human therapies, generating recombinant therapeutic antibodies. Thus, the recombinant antibodies have become an important group of drugs; dozens of them are approved for human therapy and there are hundreds in development. They are successfully used as a treatment for a wide range of pathologies, such as cancer, autoimmunity and infections, being the biopharmaceutical with higher sales. Initially therapeutic recombinant antibodies showed the conventional structure of the antibodies. However, more recently, new designs that do not have natural structural features have been generated such as single chain formats and bi-specific antibodies. Due to development and success of recombinant antibody technology, a steady increase in the number of new therapeutic drugs against new targets is expected in addition to the generation of new structures, uses and therapeutic strategies. In this review, we will focus on their structural features and clinical application in the treatment of various pathologies. We will also discuss new formats of antibodies and the emergence of biosimilar antibodies.
Keywords: immunoglobulins, antibodies, monoclonal, recombinant proteins, therapeutic antibodies
INTRODUCCIÓN
El uso de anticuerpos en el tratamiento de enfermedades se remonta a 1890 cuando Emil Von Behring describió que la inoculación de animales con pequeñas dosis de toxinas permitía generar un suero capaz de neutralizar a éstas. Sin embargo, no fue hasta 1986 que se aprobó el primer anticuerpo monoclonal murino para uso terapéutico (1,2). Posteriormente, y gracias al desarrollo de la ingeniería genética, se generaron los primeros anticuerpos recombinantes con secuencias humanas, constituyéndose en uno de los mayores avances en la medicina y principal componente de la industria biofarmacéutica. En la última década los anticuerpos recombinantes se han posicionado como el grupo de fármacos biotecnológicos con mayores ventas en Estados Unidos (3,4).
En esta revisión nos centraremos en las características estructurales de los anticuerpos recombinantes, su uso clínico y los nuevos formatos de anticuerpos recombinantes.
ESTRUCTURA DE LOS ANTICUERPOS
Los anticuerpos, también conocidos como inmunoglobulinas, son moléculas producidas por los linfocitos B activados y constituyen un componente fundamental del sistema inmune, ya que permiten el reconocimiento y posterior destrucción de patógenos, células tumorales y moléculas foráneas.
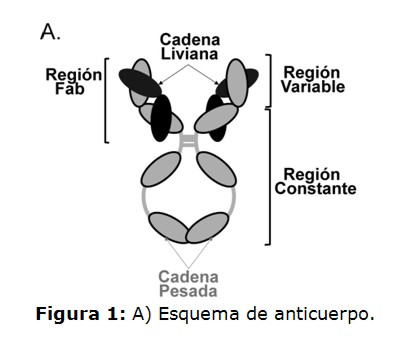
Los anticuerpos o inmunoglobulinas presentan cuatro cadenas polipeptídicas, dos cadenas pesadas (IgP) y dos cadenas livianas (IgL), las cuales forman una estructura característica tipo Y (Figura 1a). Ambas cadenas se subdividen en una región constante (RC) y una variable (RV). Esta última, presenta la función de reconocimiento y unión al antígeno o molécula blanco y está compuesta por los extremos aminoterminal de las cadenas pesadas y livianas. Las RV, tanto de la cadena IgP como de la IgL presentan gran diversidad de secuencia aminoacídica, la cual se concentra en tres regiones que presentan mayor variabilidad, denominadas regiones hipervariables o regiones determinantes de complementariedad (CDR, por sus siglas en inglés). Estas regiones interaccionan mayoritariamente con el antígeno y por lo tanto son cruciales para la afinidad y especificidad del anticuerpo. La RC de los anticuerpos presenta funciones denominadas efectoras, tales como citotoxicidad celular dependiente de anticuerpo (ADCC, por sus siglas en inglés) y citotoxicidad dependiente de complemento (CDC, por sus siglas en inglés), las cuales permiten la destrucción del blanco reconocido por el anticuerpo. Las funciones efectoras son dependientes del isotipo de inmunoglobulina y de las modificaciones postraduccionales de la RC, donde la glicosilación de la asparragina 297 es un componente fundamental (5).
ANTICUERPOS RECOMBINANTES
Los anticuerpos monoclonales (AcMo) son producidos por los hibridomas, principalmente de origen murino, desarrollados por Milstein y Kohler en 1975, lo cual les valió el premio Nobel en 1984 (6). Los AcMo derivan de una sola célula de linfocito B, por lo tanto presentan una secuencia y especificidad única dirigida contra un solo blanco.
Inicialmente, los AcMo murinos se utilizaron en terapia humana, sin embargo, demostraron baja eficacia en terapias que requieren tratamientos prolongados y con múltiples dosis en individuos inmunocompetentes. Esto deriva principalmente de la reacción inmune contra las secuencias murinas del anticuerpo o respuesta HAMA (human anti-mouse antibody); la cual provoca una rápida eliminación del AcMo de la circulación sanguínea, además de incrementar la posibilidad de sufrir una anafilaxia (7-9).
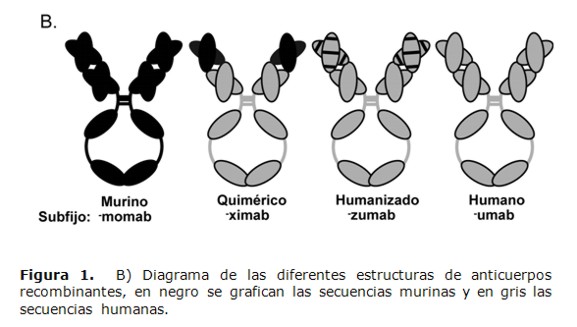
A fin de superar esta limitación, mediante la ingeniería genética, se procedió a reemplazar las secuencias murinas del AcMo por secuencias de anticuerpos humanos. La modularidad estructural de los anticuerpos facilitó la fusión de secuencias de la RV antígeno-específico de un AcMo murino a la secuencia de la RC de un anticuerpo humano, generando los anticuerpos quiméricos (Figura 1b)(10). Esto permitió disminuir la respuesta HAMA y además aportó la capacidad de realizar las funciones efectoras a estos anticuerpos.
Posteriormente, a fin de disminuir el porcentaje de secuencia murina presente en los anticuerpos recombinantes, se desarrollaron los anticuerpos humanizados que contienen un 90% de material humano. En estos AcMo las regiones CDR de un AcMo murino son incorporadas a un anticuerpo humano (Figura 1b). Más recientemente, han sido desarrollados los anticuerpos totalmente humanos, los cuales presentan un 100% de secuencias de anticuerpo humano. Existen al menos tres métodos para la obtención de anticuerpos totalmente humanos. El primero corresponde al uso de ratones productores de inmunoglobulinas humanas, en los cuales se eliminan los genes murinos de inmunoglobulinas mediante la técnica de inactivación génica o knock out y se incorporaron los genes de inmunoglobulinas humanas por medio de transgénesis. Estos ratones al ser inoculados con un antígeno de interés son capaces de producir solamente anticuerpos con secuencias humanas (11,12).
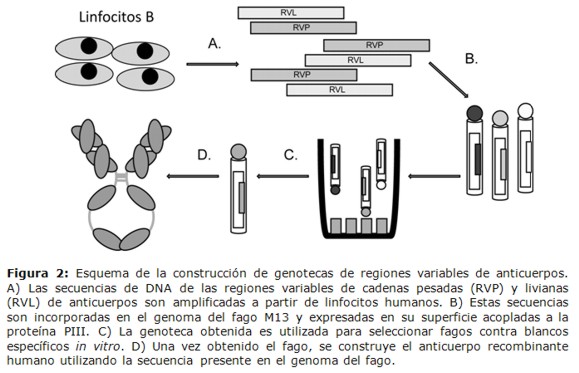
Otra técnica, más ampliamente utilizada, es la construcción de genotecas de RV de anticuerpos (GEAB). En esta tecnología, las RV son fusionadas al dominio N-terminal de la proteína estructural PIII del bacteriófago M13. Así, es posible producir una colección de fagos (entre un millón a diez mil millones de clones diferentes) donde cada virus filamentoso exponga en su superficie una sola RV, con una única especificidad antigénica. Los fagos obtenidos a partir de la genoteca, pueden ser seleccionados mediante la unión del anticuerpo a un antígeno de interés in vitro (Figura 2) (13-15).
La más reciente de las tecnologías para generar anticuerpos totalmente humanos es el sistema de aislamiento de células secretoras de inmunoglobulinas. En este método se procede a aislar células únicas de linfocitos B humanos secretores de anticuerpos de pacientes vacunados o convalecientes, utilizando citometría de flujo acoplada a cell sorting. Posteriormente, a partir de una célula individual se obtiene la secuencia del ADN complementario de IgP e IgL. Esta secuencia es sintetizada y utilizada para producir el AcMo humano (16).
NUEVA GENERACIÓN DE ANTICUERPOS RECOMBINANTES
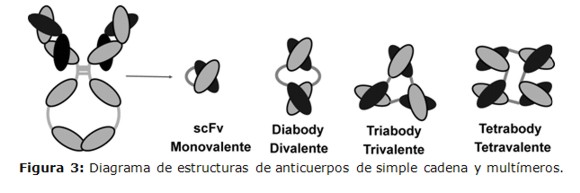
Inicialmente todos los AcMo recombinantes utilizados en terapia presentaban la estructura convencional de los anticuerpos. Sin embargo, más recientemente y aprovechando las características modulares de la molécula, se han generado diseños de anticuerpos terapéuticos que no poseen las características estructurales naturales. Así, se desarrollaron los anticuerpos de regiones variables en simple cadena (scFv, por sus siglas en inglés), en los cuales las RV de las cadenas IgP y IgL son fusionadas mediante una secuencia de unión flexible (Figura 3), reconstituyendo el sitio de unión al antígeno (17,18). La simplicidad de esta molécula ha permitido su producción en sistemas de expresión bacteriano con una alta eficiencia, sin embargo, es importante notar que estos AcMo al carecer de RC no poseen funciones efectoras (19).
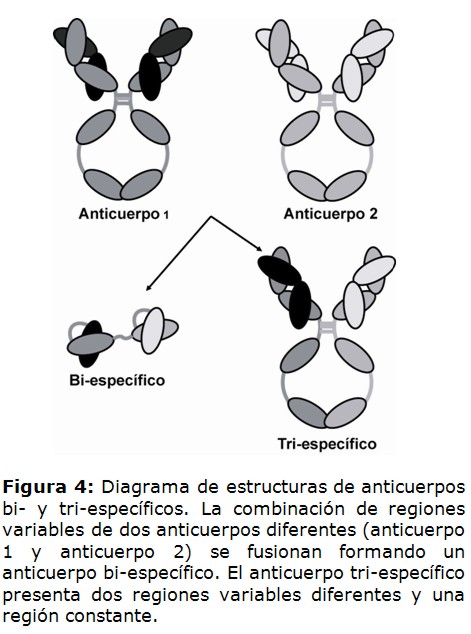
Utilizando al scFv como módulo de base se han generado múltiples tipos de anticuerpos, entre ellos los anticuerpos multivalentes, los cuales presentan varios sitios de unión a blancos (Figura 3). Además, se ha podido fusionar en una sola molécula, dos scFv con diferentes especificidades, generando lo que se denomina anticuerpos bi-específicos (Figura 4) (20). Uno de los modelos más exitosos de este tipo de anticuerpos es la tecnología de anticuerpos de anclaje de linfocitos T (BiTE, por sus siglas en inglés). Este tipo de anticuerpo está constituido por dos scFv, uno con especificidad por un marcador de linfocitos T y el otro capaz de unir a un marcador tumoral (21).
La ingeniera genética de anticuerpos también se ha enfocado en realizar modificaciones estructurales en las RC de los anticuerpos con el fin de incrementar las funciones efectoras y mejorar su eficacia terapéutica. De los diferentes isotipos de inmunoglobulinas, las gamma (IgG) son las que presentan la mejor capacidad de desarrollar funciones efectoras como ADCC y CDC (22). Recientemente, se han identificado mutaciones en la RC que aumentan la afinidad por el receptor de Fc gamma III (FcgRIII), permitiendo generar anticuerpos con una mayor capacidad de ADCC (23-25). Además, el patrón de glicosilación de los anticuerpos constituye un componente fundamental en las funciones efectoras; se ha observado que al remover residuos externos de fucosa de la RC se logra un incremento de ADCC en más de 100 veces (26,27). Recientemente, los anticuerpos Mogamulizumab y Obinutuzumab, con una disminución en residuos de fucosa, han sido aprobados para su uso (28,29).
Por otro lado, modificaciones en interacciones electroestáticas o hidrofóbicas en las RC han permitido las interacciones entre IgP de anticuerpos con RV diferentes, generando anticuerpos denominados tri-específicos (Figura 4) (30,31).
USOS TERAPÉUTICOS DE LOS ANTICUERPOS RECOMBINANTES
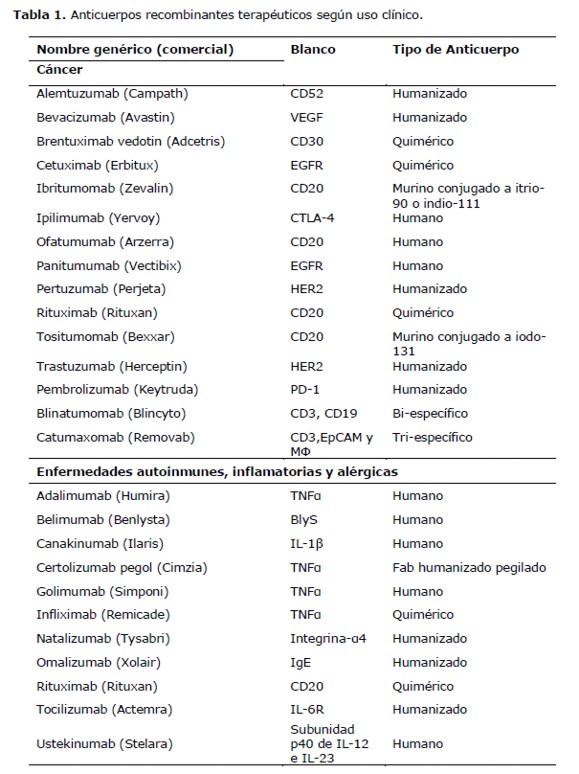
Los anticuerpos recombinantes se han transformado en un importante grupo de fármacos; más de 40 anticuerpos terapéuticos están aprobados para terapia humana y cientos se encuentran en distintas fases de desarrollo y ensayos clínicos (4). Se utilizan como tratamiento para un amplio rango de patologías, tales como cáncer, autoinmunidad e inflamación, trasplante de órganos, enfermedad cardiovascular, enfermedades infecciosas y enfermedades oftalmológicas (Tabla 1). El éxito de los anticuerpos terapéuticos ha producido un gran impacto tanto en la biomedicina como en la industria biotecnológica.
Anticuerpos recombinantes en el tratamiento del cáncer
El uso de los anticuerpos recombinantes durante la última década representa una de las estrategias terapéuticas más exitosas para pacientes con neoplasias, tanto hematológicas como de tumores sólidos. Adicionalmente, presentan la ventaja que la mayoría de ellos muestran menos efectos adversos en comparación con los agentes quimioterapéuticos convencionales (32).
Los mecanismos por los cuales los anticuerpos, utilizados exitosamente en la clínica, producen el efecto anti-tumoral incluyen: i) acción directa del anticuerpo sobre las células tumorales, mediante la unión a marcadores específicos del tumor (bloqueo o activación de un receptor, inducción de apoptosis, entrega de un agente citotóxico, entre otros); ii) efectos sobre la vasculatura y estroma del tumor; iii) inducción de muerte de la célula tumoral por mecanismos inmunes (CDC, ADCC, regulación de la función de linfocitos T) (33).
El primer anticuerpo recombinante para el tratamiento del cáncer aprobado por la Administración de Medicamentos y Alimentos (FDA, por sus siglas en inglés) en 1997 es el Rituximab, un AcMo quimérico de tipo IgG1 dirigido contra la molécula CD20, marcador de linaje de linfocitos B. El Rituximab es uno de los anticuerpos más utilizados en terapia anti-tumoral y está indicado para el tratamiento del linfoma no-Hodgkin de linfocitos B CD20+, produciendo la depleción de estas células circulantes (34). Además, está aprobado para el tratamiento de la leucemia linfocítica crónica y enfermedades autoinmunes. Entre los mecanismos de acción ejercidos por el Rituximab se encuentran la ADCC, la CDC y la quimio- y radio-sensibilización de las células tumorales (35).
Posteriormente varios anticuerpos recombinantes han sido aprobados para el tratamiento del cáncer (Tabla 1). Entre ellos se destaca el Trastuzumab, AcMo humanizado IgG1 cuyo blanco es el dominio extracelular de la proteína oncogénica receptor 2 del factor de crecimiento epidermal humano denominado HER2/neu o ERBB2, miembro de la familia del receptor de factor de crecimiento epidérmico (EGFR). Su uso fue aprobado por la FDA en 1998 para el tratamiento del cáncer de mama metastásico que sobre-expresa HER2 (HER2+) y ha demostrado gran éxito, mejorando la sobrevida de pacientes (36). Este anticuerpo actúa suprimiendo la señalización del receptor contra el cual va dirigido, además actúa induciendo factores anti-angiogénicos y a través del mecanismo de ADCC (37). En el 2010 la FDA aprobó el uso de Trastuzumab para el tratamiento de carcinoma gástrico metastásico y de la unión gastroesofágica que sobre-expresan HER2 (38).
A pesar de estos logros, alrededor de 15% de los pacientes tratados con Trastuzumab sufren recaídas (39)(40). Debido a esto se desarrolló Pertuzumab, AcMo humanizado anti-HER2 dirigido contra un epitopo diferente, lo que permite actuar bloqueando la dimerización de HER2 con otros miembros de la familia de HER (EGFR, HER3 and HER4) inhibiendo de esta manera la señalización del receptor. En el 2012, la FDA aprobó el uso de Pertuzumab en conjunto con Trastuzumab y el agente quimioterapéutico Docetaxel para el tratamiento de pacientes con cáncer de mama HER2+ metastásico que no recibieron previamente agentes anti-HER o quimioterapia (41).
La inhibición de la vascularización o angiogénesis del tumor mediante anticuerpos se utiliza en el tratamiento de tumores sólidos. El AcMo humanizado Bevacizumab, dirigido contra el factor de crecimiento endotelial vascular (VEGF), fue el primer anticuerpo anti-angiogénico aprobado en 2004 para el tratamiento de cáncer colorrectal metastásico y de carcinoma de pulmón de células no pequeñas (42). Adicionalmente, ha sido utilizado en el tratamiento de leucemia mieloide aguda, mieloma múltiple, cáncer de mama, melanoma, carcinoma de células escamosas de cabeza y cuello, cáncer de próstata, entre otros (43).
Otra estrategia importante para el tratamiento del cáncer consiste en direccionar a los linfocitos T citotóxicos hacia el tumor, con la finalidad de que estos se activen por proximidad y destruyan a la células tumorales. Para ello se han desarrollado los anticuerpos bi-específicos de tipo BiTE, capaces de unirse a la célula tumoral y al linfocito T en forma simultánea. En este grupo se encuentra el anticuerpo bi-específico Blinatumomab aprobado para casos de leucemia linfoblastíca aguda (ALL) (20). Es de notar que existen varios anticuerpos BiTE en proceso de aprobación.
El Catumaxomab utilizado en ascitis maligna es un anticuerpo considerado tri-específico, ya que posee dos RV diferentes (uno capaz de unir a un linfocito T y el otro a un marcador tumoral) y una RC pudiendo unirse a tres tipos de células en forma simultánea (44).
Anticuerpos recombinantes en el tratamiento de enfermedades autoinmunes e inflamatorias
Los anticuerpos recombinantes utilizados para el tratamiento de enfermedades autoinmunes e inflamatorias producen el efecto terapéutico a través de diferentes mecanismos, tales como bloqueo o neutralización de citoquinas o factores de crecimiento, bloqueo de un receptor, depleción de tipos celulares específicos (45).
Entre los anticuerpos terapéuticos bloqueantes de citoquinas más exitosos se encuentran los AcMo antagonistas del Factor de Necrosis Tumoral alfa (TNFα). El primer anticuerpo terapéutico aprobado en 1998 para el tratamiento de enfermedades inflamatorias fue el Infliximab. Este anticuerpo ha demostrado ser exitoso en el tratamiento de la artritis reumatoide y otras patologías inflamatorias (46). El Infliximab es un AMo quimérico, el cual se une de manera específica tanto a la forma soluble de la citoquina y como también a la unida a la membrana celular, principalmente de macrófagos. La unión del anticuerpo a la citoquina bloquea su unión al receptor y además induce apoptosis de las células que presentan TNFα a nivel de la membrana celular (45).
El desarrollo de la ingeniería de anticuerpos condujo a la producción de otros agentes bloqueantes del TNFα (Tabla I), como el Adalimumab, un AcMo totalmente humano derivado de una librería de fagos (45) (47).
En la terapia para las enfermedades autoinmunes también se utilizan anticuerpos que se unen a un receptor, bloqueando la unión ligando-receptor. Entre ellos se encuentran: el Tocilizumab, un AcMo anti-receptor de IL-6 (IL-6R), para artritis reumatoide y artritis idiopática juvenil sistémica (48); el Natalizumab, un anti-subunidad α4 de integrinasα 4β1 y α4β7, indicado para esclerosis múltiple y enfermedad de Crohn (49)(50).
Anticuerpos recombinantes en cardiología
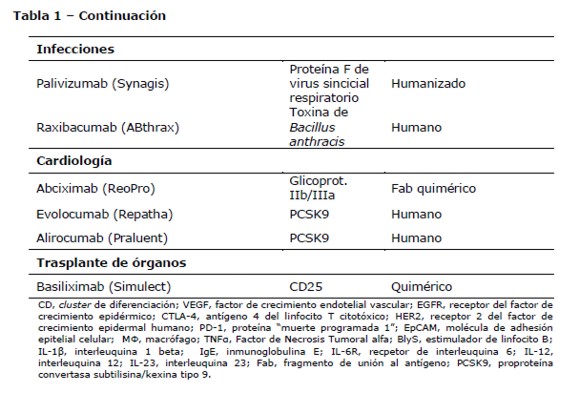
Las plaquetas participan en los mecanismos fisiopatológicos del síndrome coronario agudo y de las complicaciones trombóticas en la intervención coronaria percutánea. A fin de inhibir la agregación plaquetaria se utiliza el Abciximab, una molécula de fragmento de unión al antígeno (Fab) quimérica indicada en la intervención coronaria percutánea. Abciximab se une al receptor plaquetario glicoproteína IIb/IIIa e impide la adhesión al fibrinógeno, factor von Willebrand y otras moléculas adhesivas. Adicionalmente, Abciximab se une al receptor de vitronectina (aVb3) presente tanto en las plaquetas como en las células endoteliales (51).
Anticuerpos anti-proproteína convertasa subtilisina/kexina tipo 9 (PCSK9), denominados genéricamente como “inhibidores de PCSK9”, se utilizan para el tratamiento de la hipercolesterolemia y se encuentran aprobados para el uso en pacientes con niveles elevados de colesterol de lipoproteínas de baja densidad (LDL-C) no controlados por los tratamientos convencionales (52). Entre ellos se encuentra Evolocumab, AcMo totalmente humano, aprobado en el 2015 por la FDA para el tratamiento de pacientes con hipercolesterolemia familiar o enfermedad cardiovascular aterosclerótica. Estos agentes inhiben la actividad de la enzima PCSK9, la cual produce degradación hepática del receptor de lipoproteínas de baja densidad (LDLR) permitiendo un aumento del receptor y por lo tanto una disminución en los niveles de LDL-C en sangre (53,54).
Anticuerpos recombinantes en infectología
El AcMo quimérico IgG1 Palivizumab está dirigido contra la proteína F del virus respiratorio sincicial (VRS), fue aprobado en 1998 por la FDA para la profilaxis de la infección con VRS en niños con alto riesgo, tales como niños prematuros o con enfermedad cardíaca congénita. Este AcMo, al unirse al virus, inhibe su fusión con las células endoteliales pulmonares previniendo la infección (55).
Raxibacumab es un AcMo humano aprobado por la FDA en el 2012 para el tratamiento o prevención del ántrax, causado por el Bacillus anthracis. Este anticuerpo neutraliza las toxinas de la bacteria, uniéndose al antígeno protectivo e impidiendo la unión a su receptor, de este modo inhibe la entrada de las toxinas bacterianas factor letal (LF) y de edema (EF) a la célula (56).
BIOSIMILARES
La caída de las patentes de gran parte de los anticuerpos terapéuticos en los últimos años ha permitido el desarrollo de los denominados anticuerpos biosimilares. Este término se aplica a aquellos biofármacos producidos por un fabricante diferente al del biofármaco innovador, utilizando sus propios bancos celulares, procesos y métodos analíticos. Por lo tanto, los biosimilares pese a tener la misma secuencia no son idénticos al producto de referencia.
Existe un amplio debate sobre los requerimientos a nivel de ensayos clínicos necesarios para la aprobación y registro de AcMo biosimilares. En torno a este tema, la agencia de registro de medicamentos europea (EMA) ha liderado el proceso y ha establecido criterios de bio-comparabilidad para el registro de estos productos. Así, en el 2013 los primeros AcMo biosimilares al Infliximab fueron comercializados en Europa, bajo los nombres de Resima e Inflectra.
Actualmente hay un fuerte interés en la introducción de AcMo biosimilares en diferentes mercados de Latinoamérica; en abril del 2015 Brasil aprobó el uso del primer AcMo biosimilar (57). Se espera que esta clase de productos, debido a su menor precio, permita una mayor penetración de los AcMo recombinantes en el mercado. Sin embargo, temas como los criterios de calidad, seguridad y farmacovigilancia deben ser abordados y discutidos por las autoridades pertinentes con el fin de asegurar el beneficio de los pacientes.
CONCLUSIÓN
Debido a su alta eficacia en el tratamiento de diferentes tipos de patologías, existen más de 300 anticuerpos recombinantes terapéuticos en diferentes fases de ensayos clínicos contra múltiples blancos.
Se estima que el número de anticuerpos aprobados se encuentra limitado principalmente por número de blancos antígenos con funciones conocidas. La disponibilidad de nuevos blancos validados es uno de los mayores desafíos para el desarrollo de nuevos productos. Sin embargo, a medida que las “omicas” y la biología de sistemas avancen en comprender el proteoma humano se podrá contar con nuevos blancos para el desarrollo de anticuerpos recombinantes.
Los distintos diseños de anticuerpos plantean nuevas posibilidades y usos para los AcMo, desde moléculas multiméricas capaces de unir y neutralizar una gran cantidad de blancos hasta su uso como transportador de moléculas tóxicas o virus a células tumorales. Dentro de esta área, merece un comentario particular el desarrollo de los anticuerpos bi- y tri-específicos, ya que amplían las funciones terapéuticas de los AcMo a áreas anteriormente impensables. Un ejemplo de ello es el AcMo humanizado ACE910/RG6013, que se encuentra en fase II para su uso en casos de hemofilia A. Este AcMo es capaz de unir los factores de coagulación IXa y X y gracias a esto reemplazar al factor VIII de la coagulación (58).
La aparición de nuevas técnicas de producción, así como la introducción de los biosimilares sugieren una disminución en los precios de estos productos, lo que permitirá una mayor penetración de los mismos en mercados emergentes como los de Latinoamérica.
En conclusión, dado el desarrollo y éxito de la tecnología de AcMo recombinantes, se espera un aumento constante en el número de anticuerpos terapéuticos contra nuevos blancos, además del desarrollo de nuevas estructuras, usos y estrategias terapéuticas.
Agradecimientos
PS agradece el apoyo del INBIO y la DGICT UNA.
REFERENCIAS BIBLIOGRÁFICAS
1. Cosimi AB, Colvin RB, Burton RC, Rubin RH, Goldstein G, Kung PC et al Use of monoclonal antibodies to T-cell subsets for immunologic monitoring and treatment in recipients of renal allografts. N Engl J Med. 1981;305(6):308-14. [ Links ]
2. Thistlethwaite JR, Cosimi AB, Delmonico FL, Rubin RH, Talkoff-Rubin N, Nelson PW et al. Evolving use of OKT3 monoclonal antibody for treatment of renal allograft rejection. Transplantation . 1984 Dec;38(6):695-701. [ Links ]
3. Aggarwal S. What’s fueling the biotech engine - 2012 to 2013. Nat Biotechnol. 2014;32(1):32-9. [ Links ]
4. Ecker DM, Jones SD, Levine HL. The therapeutic monoclonal antibody market. MAbs. 2015;7(1):9-14. [ Links ]
5. Deisenhofer J. Crystallographic refinement and atomic models of a human Fc fragment and its complex with fragment B of protein A from Staphylococcus aureus at 2.9- and 2.8-A resolution. Biochemistry. 1981;20(9):2361-70. [ Links ]
6. Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature. 1975;256(5517):495-7. [ Links ]
7. Legouffe E, Liautard J, Gaillard JP, Rossi JF, Wijdenes J, Bataille R et al. Human anti-mouse antibody response to the injection of murine monoclonal antibodies against IL-6. Clin Exp Immunol. 1994 Nov ;98(2):323-9. [ Links ]
8. Klee GG. Human anti-mouse antibodies. Arch Pathol Lab Med . 2000;124(6):921-3. [ Links ]
9. Dillman RO, Shawler DL, McCallister TJ, Halpern SE. Human anti-mouse antibody response in cancer patients following single low-dose injections of radiolabeled murine monoclonal antibodies. Cancer Biother. 1994 ;9(1):17-28. [ Links ]
10. Takeda S, Naito T, Hama K, Noma T, Honjo T. Construction of chimaeric processed immunoglobulin genes containing mouse variable and human constant region sequences. Nature. 1985; 314(6010):452-4. [ Links ]
11. Wells WA. Eek, a XenoMouse: Abgenix, Inc. Chem Biol. 2000;7(8):R185-6. [ Links ]
12. Davis CG, Gallo ML, Corvalan JR. Transgenic mice as a source of fully human antibodies for the treatment of cancer. Cancer Metastasis Rev. 1999;18(4):421-5. [ Links ]
13. Bazan J, Calkosinski I, Gamian A. Phage display; A powerful technique for immunotherapy. 2012;(December):1829-35. [ Links ]
14. Hust M, Thie H, Schirrmann T, Dübel S. Antibody Phage Display, in Therapeutic Monoclonal Antibodies: From Bench to Clinic (ed Z. An), John Wiley & Sons, Inc., Hoboken, NJ, USA. 2009. doi: 10.1002/9780470485408.ch8 [ Links ]
15. Daly SJ, Dillon PP, Manning BM, Dunne L, Killard A, Kennedy RO. Production and Characterization of Murine Single Chain Fv Antibodies to Aflatoxin B 1 Derived From a Pre-immunized Antibody Phage Display Library System. 2002;1:255-74. [ Links ]
16. Wrammert J, Smith K, Miller J, Langley WA, Kokko K, Larsen C et al. Rapid cloning of high-affinity human monoclonal antibodies against influenza virus. Nature. 2008;453(7195):667-71. [ Links ]
17. Bird RE, Walker BW. Single chain antibody variable regions. Trends Biotechnol. 1991;9(4):132-7. [ Links ]
18. Huston JS, Tai MS, McCartney J, Keck P, Oppermann H. Antigen recognition and targeted delivery by the single-chain Fv. Cell Biophys. 1993;22(1-3):189-224. [ Links ]
19. Huston JS, Levinson D, Mudgett-Hunter M, Tai MS, Novotný J, Margolies MN et al. Protein engineering of antibody binding sites: recovery of specific activity in an anti-digoxin single-chain Fv analogue produced in Escherichia coli. Proc Natl Acad Sci U S A; 1988;85(16):5879-83. [ Links ]
20. Weidle UH, Kontermann RE, Brinkmann U. Tumor-antigen-binding bispecific antibodies for cancer treatment. Semin Oncol. Elsevier; 2014;41(5):653-60. [ Links ]
21. Brischwein K, Parr L, Pflanz S, Volkland J, Lumsden J, Klinger M et al. Strictly target cell-dependent activation of T cells by bispecific single-chain antibody constructs of the BiTE class. J Immunother. 2007;30(8):798-807. [ Links ]
22. Kaneko E, Niwa R. Optimizing Therapeutic Antibody Function. BioDrugs. 2011;25(1):1-11. [ Links ]
23. Lazar GA, Dang W, Karki S, Vafa O, Peng JS, Hyun L et al. Engineered antibody Fc variants with enhanced effector function. Proc Natl Acad Sci U S A. 2006;103(11):4005-10. [ Links ]
24. Shields RL, Namenuk AK, Hong K, Meng YG, Rae J, Briggs J et al. High resolution mapping of the binding site on human IgG1 for Fc gamma RI, Fc gamma RII, Fc gamma RIII, and FcRn and design of IgG1 variants with improved binding to the Fc gamma R. J Biol Chem . 2001;276(9):6591-604. [ Links ]
25. Stavenhagen JB, Gorlatov S, Tuaillon N, Rankin CT, Li H, Burke S et al. Fc optimization of therapeutic antibodies enhances their ability to kill tumor cells in vitro and controls tumor expansion in vivo via low-affinity activating Fcgamma receptors. Cancer Res . 2007;67(18):8882-90. [ Links ]
26. Umaña P, Jean-Mairet J, Moudry R, Amstutz H, Bailey JE. Engineered glycoforms of an antineuroblastoma IgG1 with optimized antibody-dependent cellular cytotoxic activity. Nat Biotechnol. 1999;17(2):176-80. [ Links ]
27. Schuster M, Umana P, Ferrara C, Brünker P, Gerdes C, Waxenecker G et al. Improved effector functions of a therapeutic monoclonal Lewis Y-specific antibody by glycoform engineering. Cancer Res. 2005;65(17):7934-41. [ Links ]
28. Mössner E, Brünker P, Moser S, Püntener U, Schmidt C, Herter S et al. Increasing the efficacy of CD20 antibody therapy through the engineering of a new type II anti-CD20 antibody with enhanced direct and immune effector cell-mediated B-cell cytotoxicity. Blood. 2010;115(22):4393-402. [ Links ]
29. Subramaniam JM, Whiteside G, McKeage K, Croxtall JC. Mogamulizumab: first global approval. Drugs. 2012;72(9):1293-8. [ Links ]
30. Ridgway JB, Presta LG, Carter P. "Knobs-into-holes" engineering of antibody CH3 domains for heavy chain heterodimerization. Protein Eng. 1996;9(7):617-21. [ Links ]
31. Gunasekaran K, Pentony M, Shen M, Garrett L, Forte C, Woodward A et al. Enhancing antibody Fc heterodimer formation through electrostatic steering effects: applications to bispecific molecules and monovalent IgG. J Biol Chem . American Society for Biochemistry and Molecular Biology; 2010;285(25):19637-46. [ Links ]
32. Scott AM, Wolchok JD, Old LJ. Antibody therapy of cancer. Nat Rev Cancer. Nature Publishing Group. 2012;12(4):278-87. [ Links ]
33. Scott AM, Allison JP, Wolchok JD. Monoclonal antibodies in cancer therapy. Cancer Immun. 2012;12(14):1-8. [ Links ]
34. Maloney DG, Liles TM, Czerwinski DK, Waldichuk C, Rosenberg J, Grillo-Lopez A et al. Phase I clinical trial using escalating single-dose infusion of chimeric anti-CD20 monoclonal antibody (IDEC-C2B8) in patients with recurrent B-cell lymphoma. Blood. 1994;84(8):2457-66. [ Links ]
35. Eisenbeis CF, Caligiuri MA, Byrd JC. Rituximab: converging mechanisms of action in non-Hodgkin’s lymphoma? Clin Cancer Res. 2003;9(16 Pt1):5810-2. [ Links ]
36. Spector NL, Blackwell KL. Understanding the mechanisms behind trastuzumab therapy for human epidermal growth factor receptor 2-positive breast cancer. J Clin Oncol . 2009;27(34):5838-47. [ Links ]
37. Hudis CA. Trastuzumab--mechanism of action and use in clinical practice. N Engl J Med . 2007;357(1):39-51. [ Links ]
38. Gunturu KS, Woo Y, Beaubier N, Remotti HE, Saif MW. Gastric cancer and trastuzumab: first biologic therapy in gastric cancer. Ther Adv Med Oncol . SAGE Publications; 2013;5(2):143-51. [ Links ]
39. Lionakis MS, Lahdenranta J, Sun J, Liu W, Lewis RE, Albert ND et al. Development of a ligand-directed approach to study the pathogenesis of invasive aspergillosis. Infect Immun. 2005;73(11):7747-58. [ Links ]
40. Nahta R, Hung M-C, Esteva FJ. The HER-2-targeting antibodies trastuzumab and pertuzumab synergistically inhibit the survival of breast cancer cells. Cancer Res. 2004;64(7):2343-6. [ Links ]
41. Jiang H, Rugo HS. Human epidermal growth factor receptor 2 positive (HER2+) metastatic breast cancer: how the latest results are improving therapeutic options. Ther Adv Med Oncol. 2015;7(6):321-39. [ Links ]
42. Hurwitz H, Fehrenbacher L, Novotny W, Cartwright T, Hainsworth J, Heim W et al. Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N Engl J Med . 2004;350(23):2335-42. [ Links ]
43. Ribatti D. From the discovery of monoclonal antibodies to their therapeutic application: An historical reappraisal. Immunol Lett . Elsevier B.V.; 2014;161(1):96-9. [ Links ]
44. Fan G, Wang Z, Hao M, Li J. Bispecific antibodies and their applications. J Hematol Oncol. 2015;8:130. [ Links ]
45. Chan AC, Carter PJ. Therapeutic antibodies for autoimmunity and inflammation. Nat Rev Immunol. 2010;10(5):301-16. [ Links ]
46. Lipsky PE, van der Heijde DM, St Clair EW, Furst DE, Breedveld FC, Kalden JR et al. Infliximab and methotrexate in the treatment of rheumatoid arthritis. Anti-Tumor Necrosis Factor Trial in Rheumatoid Arthritis with Concomitant Therapy Study Group. N Engl J Med . 2000;343(22):1594-602. [ Links ]
47. Bykerk VP. Adalimumab for early rheumatoid arthritis. Expert Rev Clin Immunol . 2008;4(2):157-63. [ Links ]
48. Fleischmann RM, Halland A-M, Brzosko M, Burgos-Vargas R, Mela C, Vernon E et al. Tocilizumab inhibits structural joint damage and improves physical function in patients with rheumatoid arthritis and inadequate responses to methotrexate: LITHE study 2-year results. J Rheumatol . 2013;40(2):113-26. [ Links ]
49. Ghosh D, Lee Y, Thomas S, Kohli AG, Yun DS, Belcher AM et al. M13-templated magnetic nanoparticles for targeted in vivo imaging of prostate cancer. Nat Nanotechnol. 2012;7(10):677-82. [ Links ]
50. Ghosh S, Goldin E, Gordon FH, Malchow HA, Rask-Madsen J, Rutgeerts P et al. Natalizumab for active Crohn’s disease. N Engl J Med . 2003;348(1):24-32. [ Links ]
51. Dziewierz A, Rakowski T, Dudek D. Abciximab in the management of acute myocardial infarction with ST-segment elevation: Evidence-based treatment, current clinical use, and future perspectives. Ther Clin Risk Manag. 2014;10(1):567-76. [ Links ]
52. Gouni-Berthold I, Berthold HK. PCSK9 antibodies for the treatment of hypercholesterolemia. Nutrients . 2014;6(12):5517-33. [ Links ]
53. Foltz IN, Karow M, Wasserman SM. Evolution and emergence of therapeutic monoclonal antibodies what cardiologists need to know. Circulation. 2013;127(22):2222-30. [ Links ]
54. Gouni-Berthold I, Berthold HK. PCSK9 antibodies for the treatment of hypercholesterolemia. Nutrients. 2014;6(12):5517-33. [ Links ]
55. Lanari M. Vandini S, Arcuri S, Galletti S, Faldella G. The use of humanized monoclonal antibodies for the prevention of respiratory syncytial virus infection. Clin Dev Immunol. 2013; 2013: 359683. doi: 10.1155/2013/359683 [ Links ]
56. Kummerfeldt CE. Raxibacumab: Potential role in the treatment of inhalational anthrax. Infect Drug Resist. 2014;7:101-9. [ Links ]
57. Teixeira FV, Kotze PG, Damião AOMC. Anvisa Approves the First Biosimilar Monoclonal Antibody Based on Comparability in Brazil. Arq Gastroenterol. 2016;53(2):60-1. [ Links ]
58. Uchida N, Sambe T, Yoneyama K, Fukazawa N, Kawanishi T, Kobayashi S et al. A first-in-human phase 1 study of ACE910, a novel factor VIII-mimetic bispecific antibody, in healthy subjects. Blood . 2016;127(13):1633-41. [ Links ]
Fecha de recepción: junio 2016. Fecha de aceptación: agosto 2016
Autor correspondiente:Patricia Langjahr. Dpto. de Inmunología, IICS, UNA y Pablo Sotelo, Dpto. de Biotecnología, Dir. de Investigaciones, Facultad de Ciencias Químicas, UNA
E-mail: plangjahr@gmail.com, phsotelo@qui.una.py*