Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.14 no.2 Asunción Aug. 2016
https://doi.org/10.18004/Mem.iics/1812-9528/2016.014(02)08-016
Articulo Original/ Original Article
Frecuencia de Staphylococcus aureus meticilino resistente y del factor de virulencia PVL en pacientes ambulatorios con infección de piel y partes blandas de Asunción, Paraguay
Frequency of methicillin-resistant Staphylococcus aureus and PVL virulence factor in ambulatory patients with skin and soft tissue infections of Asuncion, Paraguay
Sonia AbenteI*, Letizia CarpinelliI, Rosa GuillénI, Fátima RodríguezI, Norma FariñaI, II, Florentina LaspinaI, Yolanda LópezI
I Instituto de Investigaciones en Ciencias de la Salud Universidad Nacional de Asunción. Paraguay
II Laboratorio de Microbiología. Sanatorio San Roque. Asunción, Paraguay
R E S U M E N
Staphylococcus aureus (S. aureus) es actualmente el agente etiológico más frecuente en infecciones de piel y tejidos blandos. El S. aureus meticilino resistente (SAMR) aislado en infecciones de pacientes de la comunidad ha ido aumentando, constituyéndose en un problema de salud pública a nivel mundial. En Paraguay existen pocos registros sobre la meticilino resistencia y factores de virulencia a nivel comunitario, por lo que se realizó este estudio observacional descriptivo para determinar la frecuencia de SAMR y del factor de virulencia leucocidina de Panton Valentine (PVL-Panton Valentine leukocidin), así como el perfil de resistencia antimicrobiana acompañante a la meticilino resistencia en S. aureus aisladosde infecciones de piel y partes blandas de pacientes ambulatorios de dos laboratorios de Asunción, Paraguay, entre octubre de 2012 a febrero de 2014. La identificación bacteriana se realizó mediante técnicas microbiológicas convencionales y la susceptibilidad antimicrobiana por la prueba de difusión en disco. Elgen mecA y luk-PV fueron detectados por la técnica de PCR. De los 70 aislados de S. aureus estudiados, el 54,3% (38/70) fue SAMR tanto por método fenotípico como molecular. La frecuenciade PVL fue de 15,7% (11/70), siendo mayor en los SAMR (21%; 8/38) que en los SAMS (9,4%; 3/32). El 2,6% de los SAMR presentó resistencia a ciprofloxacina, no se observó multiresistencia en ningún aislado. Se encontró alta frecuencia de SAMR comparado con reportes previos en Paraguay. Se requiere fortalecer estrategias de vigilancia, prevención y control de la resistencia bacteriana en ambientes hospitalarios y de la comunidad.
Palabras claves: Staphylococccus aureus meticilino resistente, leucocidina de Panton Valentine, mecA, infección de piel y partes blandas.
A B S T R A C T
Staphylococcus aureus (S. aureus) is currently the most common etiologic agent of skin and soft tissue infections. The isolation of methicillin-resistant S. aureus (MRSA) from infections of patients in the community has increased, becoming a public health problem worldwide. In Paraguay, there are few records about methicillin resistance and virulence factors at community level. Therefore, this descriptive observational study was performed to determine the frequency of MRSA and factor virulence of Panton-Valentine leukocidin (PVL) as well as the antimicrobial resistance profile accompanying methicillin resistance in S. aureus isolated from skin and soft tissue infections in ambulatory patients from two laboratories of Asuncion, Paraguay from October, 2012 to February, 2014. The bacterial identification was performed using conventional microbiological techniques and the antimicrobial susceptibility was determined by disk diffusion. The mecA and luk-PV genes were detected by PCR technique. Out of the 70 S. aureus isolates studied, 54.3% (38/70) was SAMR by phenotypic and molecular methods. PVL frequency was 15.7% (11/70) being higher in MRSA (21%; 8/38) than in the SAMS (9.4%; 3/32), 2.6% of the MRSA was resistant to ciprofloxacin and multidrug resistance was not observed in any isolates.A high frequency of MRSA was found compared with previous reports in Paraguay. It is required to strengthen surveillance, prevention and control of bacterial resistance strategies in hospital and community environments.
Keywords: methicillin-resistant Staphylococccus aureus, Panton Valentine leucocidin, mecA, skin and soft tissue infections.
INTRODUCCIÓN
Staphylococcus aureus representa uno de los principales patógenos de importancia clínica en el humano, su distribución es mundial y el impacto en la morbilidad y mortalidad es relevante no solamente en las infecciones hospitalarias sino también a nivel comunitario (1).
En los últimos años, se han descrito en Australia, Estados Unidos, Japón y algunos países latinoamericanos cepas de SAMR de adquisición comunitaria (SAMR-AC) (2-4). Los SAMR-AC se diferencian de los SAMR de adquisición hospitalaria (SAMR-AH), en sus características epidemiológicas, microbiológicas y clínicas. Tienen un patrón de sensibilidad antibiótica diferente, no se asocian a los factores de riesgo clásicos descritos para SAMR-AH como ser internación reciente, uso previo de antibióticos, infección por VIH, homosexualidad, uso de drogas intravenosas, diálisis, entre otros; además su base genética y sus factores de virulencia son distintos (3).
La cepa de SAMR fue descrita inicialmente en 1960, poco tiempo después de la introducción de este antimicrobiano en la práctica clínica. Esta resistencia es conferida por una proteína de unión a penicilina (PBP-penicilin binding protein) conocida como PBP2a, la cual no está presente en las cepas sensibles a meticilina (SAMS) y es codificada por el gen mecA, el cual forma parte de un complejo móvil que reside dentro de una isla genómica, denominado cassette cromosómico estafilocóccico (SCCmec) (5).
Los SAMR-AH portan un cassette cromosómico de mayor tamaño SCCmec tipo I, II o III que además del gen mecA, contienen otros genes que codifican la resistencia a diferentes antimicrobianos no betalactámicos (macrólidos, aminoglucósidos, quinolonas), de ahí el fenotipo de multirresistencia característico de las cepas nosocomiales. Por el contrario, los SAMR-AC poseen SCCmec de tipo IV y V, que son de menor tamaño por lo que son fácilmente trasmisibles y generalmente no contienen genes de resistencia a otras familias de antibióticos, por lo que presentan el fenotipo de ser bastante sensibles (6,7).
La leucocidina de Panton-Valentine (PVL) es una citotoxina que forma poros heptaméricos en la membrana de los leucocitos causando destrucción de los mismos y necrosis tisular, facilitando la producción de abscesos (6). Desde el punto de vista clínico, las cepas PVL positivas, tienden a causar infecciones de piel y partes blandas (IP y PB) como forunculosis (93%), abscesos cutáneos (50%) e incluso neumonías rápidamente progresivas con un alto grado de fatalidad (10%). Es por esto que el rol determinante de la PVL como factor de virulencia, aún sigue siendo motivo de controversia (1,3,4,6,8). La producción de PVL está relacionada con las cepas SAMR-AC, ya que comúnmente son las que producen esta citotoxina, en comparación con los SAMS y SAMR-AH (1).
En Sudamérica, una de las primeras publicaciones de infecciones por SAMR en pacientes ambulatorios adultos con infección de piel fue en Brasil en el 2002 (9). Posteriormente, fueron apareciendo otros reportes, así en Argentina, en un estudio multicéntrico, realizado en pacientes pediátricos ambulatorios con IP y PB, de noviembre de 2006 a noviembre de 2007, llegaron al 62% de SAMR de los aislamientos (10) y en el Congreso de la Sociedad Argentina de Infectología de 2011 se presentaron datos correspondientes a varios estudios epidemiológicos de IP y PB adquiridas en la comunidad, efectuados en más de 500 pacientes adultos, en los que se observó una prevalencia de SAMR que osciló entre 70 y 87% (11). En Paraguay la mayoría de los estudios de SAMR se llevaron a cabo en medio hospitalario, son pocos los estudios de prevalencia de SAMR-AC. Entre estos estudios se pueden mencionar el realizado en el 2011 por Guillén et al quienes reportaron una prevalencia de 18,7% de SAMR en pacientes ambulatorios pediátricos con IP y PB y sepsis, de hospitales de referencia de Paraguay (12) y en el 2013, la prevalencia de SAMR-AC en ambulatorios en el Instituto de Medicina Tropical de Asunción en pacientes pediátricos con IP y PB fue del 61% y en pacientes adultos 31% (13).
La detección de la meticilino resistencia se realiza comúnmente en los laboratorios de rutina por el método de difusión en disco, sin embargo la prueba de referenciaes la detección del gen mecA por PCR (14). Carpinelli et al estandarizaron una PCR múltiple para la detección simultanea del gen mecA y luk-PV que fue utilizada para la identificación de estos genes en aislados de estafilococos como portación en el personal de salud de un hospital pediátrico encontrando una prevalencia de 31,7% de mecA. (15)
Con el aumento en la prevalencia de SAMR en pacientes ambulatorios con IP y PB hubo un cambio epidemiológico en los últimos años respecto a las infecciones producidas por S. aureus, lo que lo convierte en un hecho de importancia clínica y terapéutica, de gran trascendencia en la salud pública (16). Consecuentemente hubo una modificación en el patrón de resistencia de S.aureus, dificultando el uso de beta-lactámicos como opción preferencial de tratamiento para las IP y PB (17). Razón por la cual es fundamental el conocimiento actualizado de los patrones de resistencia locales, a fin defacilitar la elección empírica del tratamiento antibiótico. Por todo lo expuesto, se realizó este estudio donde el objetivo fue determinar la frecuencia de SAMR, el factor de virulencia PVL y el perfil de resistencia antimicrobiana acompañante en los aislados de S. aureus de pacientes ambulatorios con IP y PB, que acudieron a un laboratorio público y otro privado de microbiología de Asunción, Paraguay de octubre de 2012 a febrero de 2014.
MATERIALES Y MÉTODOS
Se realizó un estudio observacional, descriptivo, con muestreo de casos consecutivos, en el cual se estudiaron los aislados de S. aureus obtenidos de pacientes ambulatorios con IP y PB que acudieron a los laboratorios de Microbiología del Instituto de Investigaciones en Ciencias de la Salud (IICS) y del Sanatorio San Roque, de Asunción, Paraguay de octubre de 2012 a febrero de 2014.
Las muestra de los abscesos y forúnculos fueron recolectadas por punción-aspiración y las lesiones supurativas por hisopado. Los procedimientos fueron realizados en los consultorios de urgencia del Sanatorio San Roque y en la Cátedra de dermatología del Hospital de Clínicas y las muestras fueron inmediatamente remitidas para su procesamiento a los laboratorios del San Roque y del IICS.
Las muestras fueron cultivadas utilizando técnicas microbiológicas convencionales, en agar sangre de oveja al 5% e incubadas a 37°C en atmósfera de 5% de CO2 por 72 horas. Para la identificación de S. aureus se realizaron coloración de Gram, prueba de catalasa, coagulasa, manitol y DNAsa (18).
La prueba de susceptibilidad a los antimicrobianos fue realizada en agar Mueller-Hinton, según el método de difusión de discos de Kirby-Bauer, siguiendo las recomendaciones y puntos de cortes del CLSI (Clinical Laboratory Standard Institute). La resistencia fenotípica a meticilina se detectó utilizando discos de cefoxitina de 30μg (BioRad, FR), informando sensible o resistente a oxacilina y basados en los puntos de corte para cefoxitina que se detalla a continuación, halos mayor o igual a 22 mm de diámetro se reporta sensible a oxacilina y halos menor o igual a 21 mm de diámetro se reporta resistente a oxacilina (19). Además se ensayaron discos de gentamicina de 10μg (BioRad, FR), eritromicina de 15 μg (BioRad, FR), clindamicina de 2 μg (BioRad, FR), trimetoprim/sulfametoxazol de 1,25/23,7 μg (BioRad, FR) y ciprofloxacina de 5 μg (BioRad, FR).
Los aislados de S. aureus fueron conservados en caldo cerebro corazón - glicerol al 15% a -20 ⁰C hasta la realización de los estudios moleculares. La caracterización genotípica fue realizada en el laboratorio de Biología Molecular del IICS. La extracción de ADN se realizó por el método de ebullición, descrito previamente por Zhang et al . (20), con las modificaciones descritas por Carpinelli et al . (15).
El método fue ajustado en el laboratorio de Biología Molecular del IICS, empleando unas 5 UFC (Unidad Formadoras de Colonias) del cultivo agar sangre con 24 a 48 hs de crecimiento, se suspendieron en 100 uL de agua bidestilada y se procedió a realizar dos ciclos de temperatura de 100° durante 15 min, luego la muestra fue sometida durante 5 min a baño frio. El sobrenadante conteniendo el ADN extraído se preservó a – 20ºC hasta su uso.
Para la detección de los genes mecA y luk-PV se utilizó una reacción de PCR múltiple, que emplea los oligonucleótidos descritos por Murakami et al . (21) para mecA; y Lina et al . (22)para luk-PV. Los reactivos utilizados y sus concentraciones óptimas para la reacción de PCR fueron los siguientes: buffer 1X (Fermentas, EU), dNTPs 0,4 mM (Bioline, UK), cebadores mecA-R, mecA-F, luk-PV-1 y luk-PV-2 0,5 μM (Genbiotech, AR), MgCl2 2,0 mM (Fermentas, EU), Taq polimerasa 1 U (Fermentas, EU) y agua tridestilada. Para la reacción de PCR se utilizó 2,5 µL ADN molde obtenido, en un volumen total de reacción entre 25 μL. La amplificación de ADN se llevó a cabo durante 40 ciclos como sigue: desnaturalización de 94°C durante 30 s, hibridación a 55°C durante 30 s, y extensión a 72°C durante 1 min con una extensión final a 72°C durante 5 min. Se utilizó el termociclador PTC100 (MJ Research, USA).
Los productos de PCR fueron visualizados por electroforesis en gel de agarosa al 2% (FlukaAnalytical, Sigma, USA) en buffer TAE 1X (0,04M tris-acetato – 0,001M EDTA), realizadas en cuba electroforética (Thermo SCIENTIFIC, USA) a 100V. Los tamaños de las bandas se verificaron corriendo en paralelo un marcador de peso molecular de 100 pb (Bioline, UK) y visualizados con luz UV utilizando un transiluminador previa tinción con bromuro de etidio (5 μg/mL). Los geles de agarosa fueron fotografiados utilizando una cámara digital.
Se utilizaron las siguientes cepas control: Staphylococcus aureus ATCC 25923 para las pruebas de identificación, pruebas de sensibilidad para los discos ensayados y control negativo para el gen mecA y luk-PV; Staphylococcus aureus ATCC 43300 como control positivo para el gen mecA; para luk-PV se utilizó un aislado de portador del gen mec-A y luk-PV, previamente caracterizado.
Los datos obtenidos fueron introducidos y almacenados en una hoja de cálculo de Microsoft Excel, utilizándose estadística descriptiva (frecuencia absoluta y relativa porcentual) para resumir los datos.
RESULTADOS
Se estudiaron un total de 70 aislados de S. aureus obtenidos de pacientes ambulatorios con el diagnóstico IP y PB, entre 5 a 83 años de edad, con media: 35,814 y DE: 16,791, de los cuales el 51% (36/70) fueron del sexo femenino.
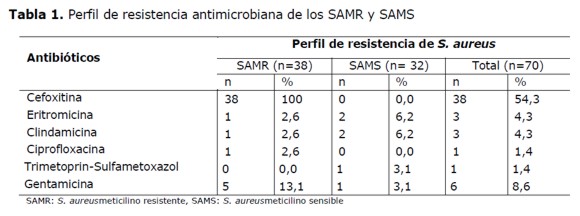
De los 70 aislados, el 54% (38/70) resultó ser resistente a oxacilina (SAMR). (Tabla 1).
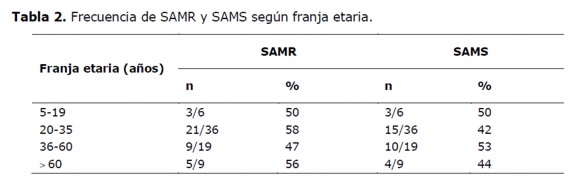
La franja etaria con mayor frecuencia de SAMR fue la de 20-35 años con 58% (21/36), (Tabla 2).
El 55,3% (21/38) de los SAMR fueron aislados de pacientes de sexo femenino.
El perfil global de resistencia antimicrobiano observado en todos los aislados de S. aureus yel perfil de resistencia antimicrobiana de los SAMR y SAMS se detalla en la Tabla 1. La prueba de D-test fue positiva en 3 de los 70 aislados (4,3%), uno de ellos resistente a meticilina.
En este trabajo fue estudiada la sensibilidad frente a 6 antibióticos, cada uno perteneciente a una familia distinta yconsiderando multirresistentes a aquellos que presentanresistencia a 5 o más familias de antibióticos, no se obtuvo multirresistencia en ninguno de los aislados de S. aureus.
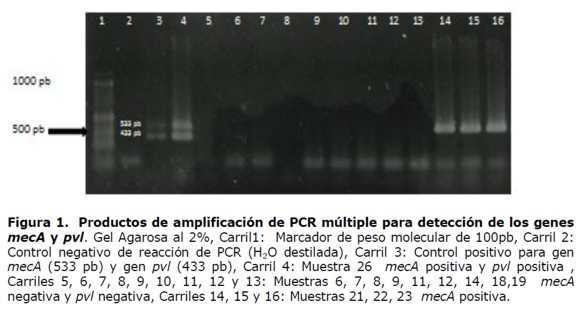
El gen mecA se detectó en 38 aislados, dando un producto de amplificación de 533 pb (Figura 1), obteniendo así una frecuencia del mecA de 54,3 %, todos estos aislados fueron meticilino resistentes por el método fenotípico, no se detectó el gen mecA en los aislados caracterizados fenotípicamente como meticilino sensibles.
Se detectó la presencia del gen pvl en 11 aislados de S. aureus, dando un producto de amplificación de 433 pb, obteniendo así la frecuencia de S. aureus portadores del gen de 15,7% (11/70) (Figura 1), de estos, 8 fueron SAMR y 3 SAMS (Tabla 3).
Los 3 aislados de SAMS portadores de PVL fueron sensibles a todos los antibióticos ensayados y de los 8 aislados de SAMR portadores de PVL, 2 presentaron resistencia a otro antibiótico además de la meticilino resistencia, uno a ciprofloxacina y el otro a gentamicina.
DISCUSIÓN
Este trabajo se realizó con el propósito de determinar la frecuencia de SAMR y el factor de virulencia PVL en los aislados obtenidos de pacientes ambulatorios con IP y PB provenientes de dos instituciones de la ciudad de Asunción.
La frecuencia de SAMR en este trabajo fue de 54,3%, un valor relativamente alto si lo comparamos con otros estudios de Paraguay, así Sanabria et al. reportaron valores del 9% de SAMR-AC en pacientes con IP y PB en un periodo que abarca de 2002 a 2006 para luego incrementarse al 22,6% en el periodo de 2007 a 2008, en un estudio hecho en el Instituto de Medicina Tropical de la ciudad de Asunción (23). Luego en el 2012, en la misma institución describen cifras del 61% (11/18) en pacientes pediátricos y 31% (5/16) en adultos (13). Era de esperar que la frecuencia de aislamientos SAMR en IP y PB vaya aumentando según pasan los años, así como lo muestran los registros.
Es sabido que las frecuencias varían de una región a otra, en Argentina en el trabajo realizado por Bermejo et al. en pacientes ambulatorios con IP y PB que consultaron en un hospital de Buenos Aires entre los años 2009 y 2011, se encontró una prevalencia de SAMR de 74,7% (62/83), (17). Mientras que Verón et al . describen un 55,5%de SAMR (15/27) en pacientes adultos ambulatorios con IP y PB atendidos en una institución privada de Gran Buenos Aires 2006 a de 2011 (2), este último con valores muy similares al encontrado en este estudio.
En España, encontraron frecuencias menores, así en el trabajo realizado por Casado et al. en pacientes adultos con infección cutánea supurativa adquirida en la comunidad, que acudieron a un hospital de Madrid, en el año 2010, reportaron una prevalencia SAMR de 33,3% (13/39) (24), valor bastante similar fue reportadopor García Agudo et al. en aislamientos de S. aureus de muestras de IP y PB de pacientes ambulatorios en el periodo de 2007 a 2009, con una cifra del 33,5% de SAMR. En este mismo estudio se describe una resistencia a gentamicina de 16% (4), cuyo valor es semejante al de este trabajo (13,1%), que fue el más elevado entre los antibióticos acompañantes ensayados, por lo que no se recomienda su uso ya que supera el 10 % de resistencia. Además la gentamicina esun antibiótico poco utilizado para el tratamiento de infecciones purulentas, ya que en estas se dan ciertas condiciones que reducen el potencial eléctrico de la membrana bacteriana como la anaerobiosis o el bajo pH del medio, disminuyendo el ingreso de este antibiótico al citoplasma bacteriano, las concentraciones alcanzadas son muy bajas, lo que hacen que este antibiótico tenga baja actividad en ese medio (25).
En este trabajo se encontró resistencia de 2,6% para eritromicina, clindamicina y ciprofloxacina en los aislados de SAMR, valores de resistencia inferiores a los encontrados por Bermejo et al. que fueron de 20,4%, 17,7% y 4,8% respectivamente (17). La prueba de D-test utilizada para detectar el mecanismo de resistencia a los macrólidos y lincosamidas mostró que el mecanismo enzimático por producción de metilasa fue en solo un caso 2,6% (1/38) de los SAMR en este trabajo, valor inferior al reportado por Anodal et al. que encontraron 20% (6 /30) casos de D-test positivo entre sus aislados de SAMR estudiados (26) y al de otro estudio en India en 2014, que fue de 16,9% (10/59) (27). Esto probablemente se debe a que en nuestro sistema sanitario estos antibióticos no suelen emplearse en el tratamiento empírico inicial de las IP y PB, pero en otros países con el aumento de las prevalencias de SAMR en IP y PB se suelen excluir a los betalactámicos como monoterapia en el tratamiento empírico inicial, por lo que cada vez aparecen más resistencias a otros grupos de antibióticos.
En los aislados de SAMR del presentetrabajo no se obtuvo resistencia a trimetoprima-sulfametoxazol, al igual que en los valores descritos por Anodal et al. en pacientes ambulatorios con IP y PB que acudieron al servicio de dermatología en un hospital de Argentina durante los años 2009 y 2010 (26), por lo que podría ser una opción válida para el tratamiento de estas infecciones.
El término resistencia a meticilina incluye resistencia a derivados betalactámicos tanto en S. aureus de origen hospitalario como comunitario, los SAMR-H presentan frecuentemente resistencia a varios grupos de antibióticos. En este estudio realizado en aislados de la comunidad la resistencia acompañante fue baja, losSAMS no presentaron un valor de resistencia superior al 10% entre los antibióticos ensayados y en los SAMR solo gentamicina superó el 10% de resistencia, tampoco se obtuvo ningún aislado multiresistente, coincidente con lo que describe la teoría para los SAMR-AC (7).
La técnica de PCR múltiple permitió detectar de manera simultánea la presencia de los genes mecA y luk-PV en S. aureus aislados de pacientes ambulatorios. De los 70 aislados de S. aureus, en 38 de ellos se detectó el gen mecA, todos resistentes a meticilina por el método fenotípico de difusión con discos, obteniendo una concordancia del 100% con ambos métodos, lo que indica que el mecanismo determinante de la resistencia a meticilina es la producción de PBP2a.
En el presente trabajo se detectó el gen luk-PV en 11 (15,7%) aislados de S. aureus, 8 fueron meticilino resistente y 3 meticilino sensible, valor similar al encontrado por Cobos Trigueros et al., quienes describieron una prevalencia del 11,2% (37/329) de PVL en SAMR de aislados de IP y PB de pacientes de un hospital de Barcelona de octubre de 2007 a julio de 2009 (28). En cambioCasado Verrier et al. encontraron una cifra de 84,6% (11/13) para el gen luk-PV en los aislados de SAMR de pacientes ambulatorios con infecciones cutáneas supurativas que acudieron a Urgencias de un Hospital de Madrid (24). La mayor cantidad del factor PVL fue detectado en los SAMR como era de esperar debido a que el factor de virulencia PVL se asocia con mayor frecuencia a los SAMR-AC.
En trabajos anteriores realizados en Paraguay se pueden mencionar el del 2011 por Guillén et al., quienes reportaron valores de 43% (10/23) de portación de PVL en los SAMR en pacientes ambulatorios pediátricos con IP y PB y sepsis, de hospitales de referencia de Paraguay (12) y el de Rodriguez et al., en el que se analizaron 50 aislados de S. aureus adquiridos de la comunidad obtenidos a partir de muestras clínicas de secreciones de piel, partes blandas o líquidos corporales de pacientes menores de 17 años que concurrieron al Hospital General Pediátrico Niños de Acosta Ñú durante el año 2.010, donde la portación del gen codificante de la PVL se observó en más de la mitad de los aislados estudiados (58%; 29/50) y la mayoría de ellos (90%; 26/29) produjo IP y PB (29); también en el trabajo de Cataldo et al. donde se estudio laportación deStaphylococcus aureus multiresistentes a antimicrobianos en cavidad bucal de niños que concurren para un tratamiento en una clínica odontológica, y ninguno de ellos portaba el factor de virulencia PVL, comparado con los valores más bajos obtenidos en este trabajo se puede ver que las cepas de S. aureus portadoras de la PVL se encuentran muy asociadas a las IP y PB . y no se puede descartar el riesgo de que los mismos bajo ciertas condiciones del huésped puedan ocasionar patologías más graves.
Con este estudio se ha logrado actualizar la frecuencia de SARM por métodos fenotípicos y genotípicos y se ha confirmado un aumento de la frecuencia de estos aislados en la comunidad. Además se ha determinado que un porcentaje importante de los aislados de pacientes de la comunidad portan PVL, y por lo tantovinculadas a infecciones más severas. Por otra parte se puede aseverar que las cefalosporinas de primera generación utilizada hace unos años en el tratamiento empírico de estas infeccionesya no pueden ser utilizadas, y que antibióticos como trimetoprima-sulfametoxazol, macrólidos y clindamicina podrían ser indicados como terapia inicial para infecciones por S. aureus de la comunidad.
Con el trascurso del tiempo hay un claro aumento en la prevalencia de aislados de SAMR-AC en infecciones en Paraguay.La vigilancia de las infecciones por SARM en la comunidad es fundamental para determinar el tratamiento antibiótico empírico adecuado, ya sea para las infecciones locales o invasivas.
REFERENCIAS BIBLIOGRÁFICAS
1. De Colsa A. Staphylococcus aureus: De la genómica a la clínica. Microbiología molecular para el clínico. Revista de Enfermedades Infecciosas en Pediatría. 2011; 24(95):91-4. [ Links ]
2. Verón MT, Ojeda MG, Avino F, Spelzzini A, Barboza A, Pedrozzino Y. Incidencia y distribución estacional de Staphylococcus aureus resistente a la meticilina en pacientes adultos ambulatorios en una clínica de la provincia de Buenos Aires: período 2006 - 2011. Rev Argent Microbiol. 2012;44(4):306-11. [ Links ]
3. Noriega LM, González P, Hormazábal JC, Pinto C, Canals M, Munita JM et al. Staphylococcus aureus comunitario resistente a cloxacilina: Comunicación de los primeros cinco casos descritos en Chile. Rev Med Chile. 2008;136(7):885-91. [ Links ]
4. García-Agudo L, Huertas M, Asencio MA, Carranza R, García-Martos P. Sensibilidad a antimicrobianos de cepas de Staphylococcus aureus resistente a meticilina procedentes de pacientes ambulatorios. Rev Esp Quimioter. 2011;24(2):91-5. [ Links ]
5. Castellano M, Pedrozo A, Vivas R, Ginestre M, Rincón G. Tipificación molecular y fenotípica de Staphylococcus aureus resistentes a meticilina (SAMR) en un hospital universitario. Rev Chilena Infectol. 2009;26(1):39-48. [ Links ]
6. Klein E, Smith DL, Laxminarayan R. Community-associated methicillin-resistant Staphylococcus aureus in outpatients, United States, 1999-2006. Emerg Infect Dis. 2009;15 (12):1925-30. [ Links ]
7. Cercenado E, Ruiz de Gopegui E. Staphylococcus aureus resistente a la meticilina de origen comunitario. Enferm Infecc Microbiol Clin. 2008;26(Supl13):19-24. [ Links ]
8. De Vedia L, Lista N, Piovano G, Amaya Akkauy V, Rodríguez A, Eusebio MJ et al. Staphylococcus aureus meticilino resistente adquirido en la comunidad: una nueva amenaza. Rev Am Med Resp. 2012;12(4):131-9. [ Links ]
9. Ribeiro A, Dias C, Silva-Carvalho MC, Berquó L, Ferreira FA, Santos RN et al. First report of infection with community-acquired methicillin-resistant Staphylococcus aureus in South America. J Clin Microbiol. 2005;43(4):1985-8. [ Links ]
10. Paganini H, Della Latta MP, Muller Opet B, Ezcurra G,Uranga M,Aguirre C et al. Community-acquired methicillin-resistant Staphylococcus aureus infections in children: multicenter trial. Arch Argent Pediatr. 2008;106(5):397-403. [ Links ]
11. López Furst MJ. Grupo de Estudio de Infecciones por Staphylococcus aureus de la Comunidad, Sociedad Argentina de Infectología. Staphylococcus aureus resistente a la meticilina en la comunidad: la emergencia de un patógeno. Medicina (B Aires). 2011;71:585-6. [ Links ]
12. Guillén RM, Basualdo W, Castro H, Campuzano de Rolón A, Macchi M, Ortellado J, et al. Sthaphylococcus aureus adquiridos en la comunidad: Caracterización clínica, fenotípica y genotípica de aislados en niños que concurren a hospitales de referencia de Asunción y Dpto. Central. Rev Inst Med Trop. 2011;6 Supl:45-5. [ Links ]
13. Irala J. Progresión de la resistencia de Staphylococcus aureus a Oxacilina en el Instituto de Medicina Tropical de Asunción - Paraguay. Rev Inst Med Trop. 2013;8(1): 18-25. [ Links ]
14. Ulloa MT, Porte L, Carmi A, Varela C, Fica A. Comparación de reacción de polimerasa en cadena, látex y antibiograma para detección de Staphylococcus aureus meticilina resistente. Rev Chilena Infectol. 2001;18(4):255-60. [ Links ]
15. Carpinelli ML, Guillen R, Fariña N, Basualdo W, Aquino R. PCR múltiple para la detección simultanea de los genes mecA y pvl en Staphylococcus spp. Mem Inst Investg Cienc Salud. 2012;10(1):5-13. [ Links ]
16. Tobeña M, Coll F, García C, Bartolomé R, Moraga F. Fascitis necrosante por Staphylococcus aureus resistente a la meticilina adquirido en la comunidad productor de leucocidina de Panton-Valentine. An Pediatr (Barc). 2009;70(4):374-8. [ Links ]
17. Bermejo V, Spadaccini L, Elbert G, Duarte A, Erbin M, Cahn P. Prevalencia de Staphylococcus aureus resistente a meticilina en infecciones de piel y partes blandas en pacientes ambulatorios. Medicina (B Aires). 2012; 72 (4): 283-6. [ Links ]
18. Winn WC, Allen SD, Janda WM, Koneman EW, Procop GW, Schrenckenberger PC, et al. Koneman. Diagnóstico Microbiológico: texto y atlas en color. 6º ed. Buenos Aires: Médica Panamericana; 2008. [ Links ]
19. Clinical and Laboratory Standards Institute (CLSI). Performance Standards for Antimicrobial Susceptibility testing; twenty-fourth informational supplement. 2014; 34(1):M100-S21. [ Links ]
20. Zhang K, Sparling J, Chow BL, Elsayed S, Hussain Z, Church DL, et al. New quadriplex PCR assay for detection of methicillin and mupirocin resistance and simultaneous discrimination of Staphylococcus aureus from coagulase-negative staphylococci. J Clin Microbiol. 2004; 42(11): 4947-55. [ Links ]
21. Murakami K, Minamide W, Wada K, Nakamura E, Teraoka H, Watanabe S. Identification of methicillin-resistant strains of staphylococci by polymerase chain reaction. J Clin Microbiol. 1991;29(10): 2240-4. [ Links ]
22. Lina G, Piémont Y, Godail-Gamot F, Bes M, Peter MO, Gauduchon V, et al. Involvement of Panton-Valentine leukocidin-producing Staphylococcus aureusin primary skin infections and pneumonia. Clin Infect Dis. 1999; 29(5):1128-32. [ Links ]
23. Sanabria G. Araya S. Arbo A. Situación actual de la susceptibilidad a antibióticos de cepas de Staphylococcus aureus aislados en infecciones invasoras en niños. Rev Inst Med Trop. 2008; 2(1):29-34. [ Links ]
24. Casado-Verrier B, Gómez-Fernández C, Paño-Pardo JR, Gómez-Gil R, Mingorance-Cruz J,Moreno-Alonso de Celada R, et al. Community-acquired methicillin resistant Staphylococcus aureus skin and soft tissue infections in Madrid: prevalence study. Enferm Infec Microbiol Clin. 2012; 30(6):300-6. [ Links ]
25. Noblia L. Aminoglucósidos. Recuperado en: http://www.infecto.edu.uy/terapeutica/atbfa/amino/AMINOGLUC%D3SIDOS.htm
26. Anodal M, Villani ME, Rodriguez L, Schijman M, Terzano M, Gardella N. Infecciones de piel y partes blandas por Staphylococcus aureus meticilino resistente de la comunidad. Análisis molecular y genético. Dermatol Argent. 2012; 18(3): 213-20 [ Links ] Arial, Helvetica, sans-serif" size="2">
Fecha de recepción:. Fecha de aceptación: agosto 2016
Autor correspondiente: Sonia Abente.* Instituto de Investigación en Ciencias de la Salud, UNA
E-mail:sonia_abente@hotmail.com