Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.10 no.2 Asunción Dec. 2012
ESPECIFICACIONES TÉCNICAS
Validación de un método por cromatografía líquida de alta resolución (HPLC) para la determinación de ivabradina en comprimidos
Validation of a high resolution liquid chromatography method (HPLC) for the determination of ivabradine tablets
* Roig CI, Gauto GI, Ibarrola NI, Duarte MI, Monges LI, Romero DI, Riva AII
IDepartamento de Investigación & Desarrollo – Laboratorio de Productos ÉTICOS
IIDirección Industrial – Laboratorio de Productos ETICOS
RESUMEN
Se presentan los resultados obtenidos en la validación de un método analítico por cromatografía líquida de alta resolución, para la determinación de ivabradina en comprimidos, el cual se diseñó para identificar y cuantificar a dicho analito, con la utilización de una columna RP-18 (150 x 4,6 mm) 5 mm y un detector UV-Vis a una λ: 285 nm. Dicho método se empleará para el control de la calidad y estabilidad de ivabradina comprimidos. El método fue validado siguiendo una metodología de trabajo de acuerdo a los lineamientos de la Conferencia Internacional sobre Armonización de Requisitos Técnicos para el Registro de Medicamentos de uso humano, Validación de procedimientos analíticos (ICH Q2), obteniendo los siguientes resultados: linealidad (r2 = 0,999), precisión Desviación estándar relativa (DSR) = 0,67 % para comprimidos del lote piloto y DSR=0,31% para comprimidos del lote comercial) y exactitud recuperación media=100,2%, demostrando de esta manera que el método propuesto es aplicable a la dosificación de ivabradina en comprimidos, tanto en el análisis del producto terminado cómo en los estudios de estabilidad.
ABSTRACT
We present the results obtained in the validation of an analytical method, performed by high resolution liquid chromatography for the determination of ivabradine in tablets, which was designed to identify and quantify this analyte using an RP18 (150 x 4.6 mm) 5 mm column and a UV-Vis detector at λ: 285 nm. This method will be used to control the quality and stability of ivabradine tablets. The method was validated using a work methodology that followed the guidelines of The International Conference on Harmonization of Technical Requirements for the Registration of Pharmaceuticals for Human Use, Validation of Analytical Procedures (ICH Q2). The following results were obtained: linearity (r2 = 0.999), precision Relative Standard Deviation (RSD) = 0.67 for pilot lot tablets and RSD = 0.31% for commercial lot tablets and accuracy, mean recovery = 100.2% thus demonstrating that the proposed method is applicable to the dosage of ivabradine in tablet form, both in the finished product analysis as in the stability studies.
INTRODUCCIÓN
La ivabradina denominada según IUPAC comoSynonyms: 3-[3-[[(8S)-3, 4-Dimethoxy-8-bicyclo[4.2.0]octa-1, 3, 5-trienyl]methyl-methylamino]propyl]-7, 8-dimethoxy-2, 5-dihydro-1H-3-benzazepin-4-one hydrochloride 3 - [3 - ({[(7S) -3, 4-dimetoxibiciclo [4.2.0] octa-1, 3, 5-trien-7-il] metil}(metil)amino) propil] -7, 8-dimetoxi- 2,5-dihidro-1H-3-benzacepin-4-ona con CAS number 155974-00-8 está clasificada como agente cardiotónico. Molecular Weight 505.05 CAS Registry Number 148849-67-6.
La ivabradina disminuye la frecuencia cardíaca debido a una inhibición selectiva y específica de la corriente If del marcapasos cardíaco, que controla la despolarización diastólica espontánea en el nódulo sinusal y regula la frecuencia cardíaca. Los efectos cardíacos son específicos del nódulo sinusal, sin efecto sobre los tiempos de conducción intraauricular, auriculoventricular o intraventricular, ni sobre la contractilidad miocárdica ni sobre la repolarización ventricular (1,2). La ivabradina también puede interaccionar con la corriente Ih retiniana, por lo que interviene en la resolución temporal del sistema visual restringiendo la respuesta de la retina a los estímulos luminosos brillantes. En circunstancias propicias (cambios bruscos de luminosidad), la inhibición parcial de la corriente Ih por la ivabradina origina los fenómenos luminosos o fosfones que pueden experimentar ocasionalmente los pacientes. El descenso de la frecuencia cardíaca con ivabradina es de aproximadamente 10 lpm (latidos por minuto) en reposo y durante el esfuerzo, por lo que se produce una reducción del trabajo cardíaco y del consumo miocárdico de oxígeno. Su absorción es rápida y casi completa tras su administración oral y alcanza su pico plasmático en aproximadamente 1 hora cuando se administra en ayunas (3,4).
Si bien existen métodos analíticos validados que emplean;cromatografía líquida (LC) con detección fluorimétrica y con detección mediante espectro de masas para cuantificar la ivabradina en la orina y plasma (5,6), no es fácil encontrar en la bibliografía una metodología analítica de fácil aplicación que permita la identificación y cuantificación de ivabradina en comprimidos de liberación inmediata; es por esta razón que este trabajo propone un método preciso, específico, exacto y confiable que permita dosificar ivabradina en esta forma farmacéutica. El objetivo del presente trabajo fue validar un método que emplea cromatografía líquida para la identificación y dosificación de ivabradina en comprimidos de liberación inmediata siguiendo los lineamientos establecidos por la Conferencia Internacional sobre Armonización de Requisitos Técnicos para el registro de productos farmacéuticos de uso humano, validación de procedimientos analíticos (ICH Q2).
MATERIAL Y MÉTODOS
Equipamientos
Se empleó un cromatógrafo líquido de alta resolución- HPLC WATERS (2695), detector con arreglo de diodos (DAD) WATERS PDA 2996, inyector automático WATERS, horno para columnas WATERS y SOFTWARE de procesamiento de datos EMPOWER TM. Se utilizó material volumétrico aforado marca BRAND; Balanza analítica OHAUS modelo AR 1140 ± 0,1 mg; pH metro oakton pH/con S10 Series y estufa Cole Palmer.
Reactivos y soluciones
Los reactivos empleados fueron: fosfato di básico de amonio (Merck), acetonitrilo grado HPLC (Merck), metanol grado HPLC (Merck), tetrahidrofurano grado HPLC (JTBaker), buffer fosfato di básico de amonio pH 7.3: se pesó 1.32 g de fosfato dibásico de amonio y se llevó a un matraz aforado de 1000,0 ml. Se agregó 800 ml de agua destilada calidad HPLC. Fue ajustado el pH a 7.3 con ácido fosfórico (1:5) y se llevó a volumen de 1000 ml con agua destilada calidad HPLC.
La fase móvil utilizada estuvo compuesta por un buffer fosfato dibásico de amonio pH 7.3: acetonitrilo: metanol: tetrahidrofurano en una relación (550:315:112.5:22.5), materia prima ivabradina clorhidrato y la referencia de trabajo fueron suministrados por Ind-Swift Laboratories Limed (Chandigarh, India) y los comprimidos de ivabradina utilizados fueron suministrados por el Laboratorio de Desarrollo Galénico de Laboratorios ETICOS CEISA Paraguay.
Procedimiento
Preparación de la solución de referencia: En un matraz aforado de 50 ml se pesó 25 mg de IVABRADINA HCl REF. Se disolvió y llevó a volumen con FASE MOVIL. Se tomó 2 ml de la solución anterior y se llevó a matraz aforado de 10 ml, se diluyó y llevó a volumen con Fase Móvil. Para Filtrar se utilizó membrana de Nylon de 0.45 µm. (Conc.: 100 µg/ml).
Condiciones cromatograficas: Los desarrollos cromatográficos se realizaron empleando una Columna Gemini C-18 (150 x 4,6 mm) 5 mm S/N: 462044-1 y S/N: 462460-3, un detector UV-Vis a una longitud de onda de 285 nm, un flujo de 1 ml/min, inyectándose 10 µL en cada corrida.
Parámetros a ser validados
Los parámetros a estudiar se seleccionaron en función de las características y de los objetivos del método analítico utilizado y el rango de concentraciones en que se analizó la ivabradina en los comprimidos (7,8).
Linealidad
Se determinó la linealidad del método empleando concentraciones del analito en el rango 50% a 150% de la concentración propuesta para la determinación de ivabradina en el comprimido. Las determinaciones de cada una de las soluciones se realizaron por triplicado. El criterio de aceptación o rechazo de la linealidad del método se basó en el cálculo del estadístico de student (t).
Exactitud
La exactitud del método se evaluó preparando tres muestras de comprimidos cuya concentración de ivabradina era conocida y correspondía al 80, 100 y 120% de la cantidad declarada de ivabradina por comprimido. Cada muestra se analizó por triplicado, determinando en cada caso la recuperación del analito empleando la metodología analítica propuesta. Utilizando una matriz de 3 x 3 se determinó la recuperación media, la desviación estándar del método y el estadístico F. El criterio de aceptación o rechazo utilizado se basó en el valor medio de la recuperación y en el cálculo del estadístico F.
Precisión
Para este ensayo se seleccionó un lote comercial y otro lote piloto elaborado por el Departamento de Investigación & Desarrollo (I&D), con el cual se procedió de la siguiente forma, fueron analizadas 6 muestras de productos.
Preparación de las muestras: Se pesaron no menos de 20 comprimidos y se determinó su peso medio. Se procedió a molerlos en polvo fino en un mortero. En un matraz aforado de 50 ml se pesó el equivalente a 5 mg de ivabradina, se agregó 35 ml de fase móvil y se llevó a baño de ultrasonido durante 20 min. Una vez que alcanzó la temperatura ambiente y se llevó a volumen con fase móvil. Se agitó y filtró por membrana de Nylon de 0.45 µm. (Conc: 100 µg/ml). Se determinó la desviación estándar relativa (DSR) entre las concentraciones obtenidas en los análisis.
Especificidad
Para el estudio de este parámetro se preparó una solución de referencia (solución de trabajo) a partir de la cual, se realizaron otras soluciones y estas fueron sometidas a condiciones de degradación ácida, alcalina, oxidante, reductora, térmica y fotolitica. Las soluciones que se obtuvieron fueron inyectadas en el HPLC en las condiciones descriptas en el método y se evaluó la capacidad del sistema para separar el analito principal de los productos de degradación o impurezas.
Adecuación del sistema
Para el estudio de este parámetro se analizó con 5 muestras de un lote. La preparación de las muestras y las soluciones de referencia se realizó como se indica en el parámetro de exactitud. En los cromatogramas obtenidos se determinó el factor de cola (T), la eficiencia de la columna (N), la resolución (R) y la precisión de la inyección (DSR). Los cálculos se realizaron con las siguientes fórmulas:
RESULTADOS
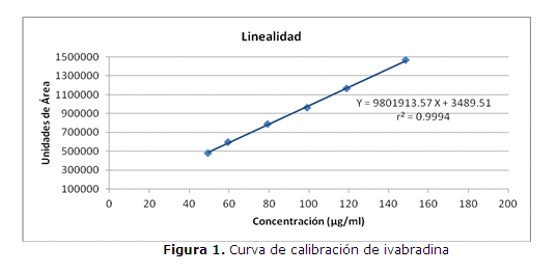
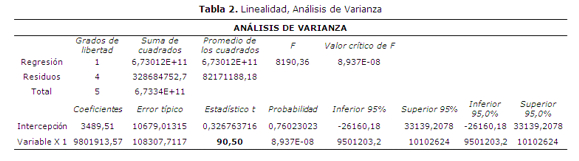
Como resultado del análisis de la linealidad del método analítico se obtuvo un valor de coeficiente de correlación r2 = 0.9994 y t calculado = 90.50 en el siguiente rango de trabajo 50 – 149 µg/ml, (figura 1).
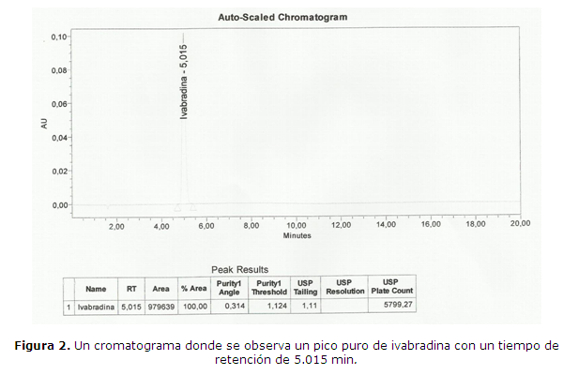
Los análisis estadisticos se visualizán en las tablas 1, 2 y en la figura 2.
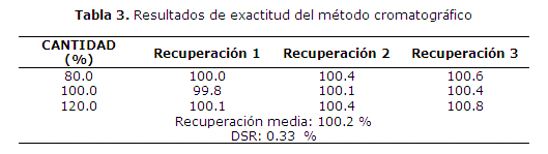
Los resultados del análisis del parámetro de exactitud se muestran en la tabla 3. En donde se observan los porcentajes de recuperación de las tres formulaciones distintas.
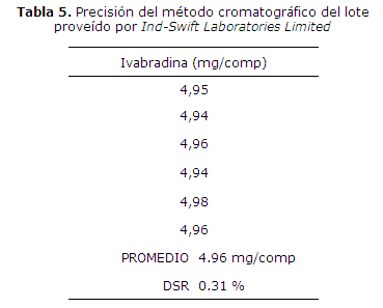
El análisis de los ensayos de precisión se presentan en las tablas 4 y 5 con valores de DSR menores que los criterios de aceptación establecidos (menor o igual que 5.50 %).
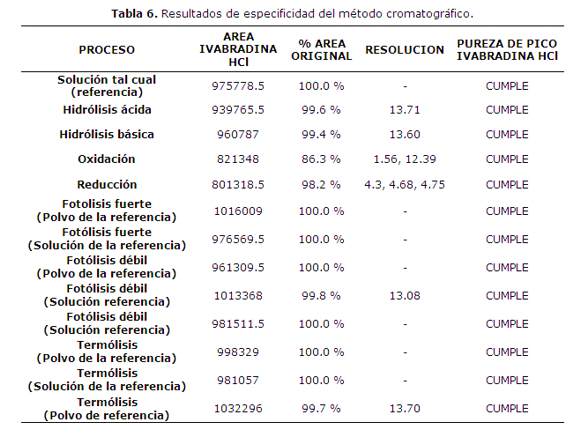
En el estudio del parámetro de especificidad se observó que la ivabradina tiene una resolución mayor a 1,5 con los picos de productos de degradación ácida, básica, oxidante, reductora, fotolítica débil y termolítica y se presenta puro en todos los ensayos de degradación forzada propuestos (tabla 6).
La tabla 7 detalla los valores obtenidos en la Adecuación del sistema, en cuanto a factor de cola (T no mayor a 1.5). La desviación estandar relativa (DSR) entre inyecciones sucesivas (no debe ser mayor a 2,0%). Y la eficiencia de la columna (no debe ser menor a 4000 platos teóricos).
CONCLUSIÓN
Como resultado del análisis de la linealidad del método, dicho parámetro cumplió con los criterios de aceptación establecidos, y hubo una relación lineal entre las concentraciones estudiadas y las áreas obtenidas para cada una.
La recuperación media entre las 9 determinaciones fue de 100.2% la SRD de 0.33%. Aplicando el test de ANOVA se obtiene un valor de F calculado = 2.63, mientras que el F crítico para las condiciones de ensayo es 5.14, por lo tanto se puede considerar que el método es exacto.
En el estudio de la precisión del método para 6 determinaciones (repetitividad) se encontraron desviaciones estándar relativas (DSR) menores a las establecidas en las tablas límites, por lo tanto se afirma que el método propuesto es preciso.
Asimismo se puede afirmar que el método es específico para la ivabradina, ya que permite diferenciar el analito principal de los posibles productos secundarios y de degradación que se generen durante el almacenamiento de la forma farmacéutica.
Basados en los resultados obtenidos se puede afirmar que la metodología analítica propuesta para la dosificación de ivabradina en comprimidos, tanto para el control de calidad de productos terminados cómo para estudios de estabilidad es lineal, exacta, precisa y específica.
REFERENCIAS BIBLIOGRÁFICAS
1. Du XJ, Feng X, Gao XM, Tan TP, Kiriazis H, Dart A M. If channel inhibitor ivabradine lowers heart rate in mice. Br J Pharmacol 2004; 142: 107-12. [ Links ]
2. Evans ND, Godfrey KR, Chapman MJ, Chappell MJ, Aarons L, Duffull SB. An Identifiability analysis of a parentmetabolite pharmacokinetic model for ivabradine. J. Pharmacokinet Pharmacodyn 2001; 28:93-105 [ Links ]
3. EMEA (European Medicines Agency). EPARs for authorised medicinal products for human use.2007. Ingress communications. [ Links ] Disponible en: http://www.ema.europa.eu/ema/index.jsp?curl=search.jsp&q=humans&btnG=Search&mid= (Acceso el 5 de Mayo 2011).
4. Tardif JC, Ford I, Tendera M, Bourassa MG, Fox K. Efficacy of ivabradine, a new selective If inhibitor, compared with atenolol in patients with chronic stable angina. Eur Heart J. 2005; 26: 2529 36. [ Links ]
5. Klippert P, Jeanniot JP, Polve S, Lefevre C, Merjan H. Determination of ivabradine and its N-demethylated metabolite in human plasma and urine, and in rat and dog plasma by a validated high-performance liquid chromatography method with fluorescence detection. J chromatogr B Biomed Sci Appl 1998; 719:125-33. [ Links ]
6. Francois-Bouchard M, Simonin G, Bossant MJ, Boursier-Neyret C. Simultaneous determination of ivabradine and its metabolites in human plasma by liquid chromatography-tandem mass spectrometry. J chromatogr B Biomed Sci Appl 2000; 745: 261-9. [ Links ]
7. Castro CM, Gascón S, Pujol M, Sans JM, Vicente L. Validación de métodos analíticos. Madrid: Asociación española de Farmacéuticos de la Industria; 1989. [ Links ]
8. ICH Secretarial. Q2(R1) Validation of Analytical Procedures. Text and Methodology. Geneva: ICH Secretarial; 2005. [ Links ]
*Autor Correspondiente: Dra. Carmen Roig. Departamento de Investigación & Desarrollo–Laboratorio de Productos ETICOS
Email: croig@eticos.com.py
Fecha de recepción: Agosto de 2012; Fecha de aceptación: Octubre de 2012