Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.3 no.1 Asunción Dec. 2005
ARTICULO ORIGINAL
Valores de referencia del antígeno prostático específico
Reference values of prostate specific antigen
Blanes MI;Velázquez GII; Cabral MII
ILaboratorio Medical Center
IIInstituto de Investigaciones en Ciencias de la Salud
RESUMEN
En el presente estudio se determinaron los valores de referencia del PAS (antígeno prostático específico) en individuos en estado de salud para patologías prostáticas, teniendo en cuenta la falta de información en individuos en estas condiciones. Se incluyeron en el estudio, 618 individuos del sexo masculino, con edades comprendidas entre 40 y 69 años, que concurrieron al laboratorio Medical Center entre 1999 y 2001, procedentes de consultorios urológicos, con solicitudes de estudios laboratoriales. Para la selección de los individuos se siguieron las recomendaciones del Panel de Expertos en Teoría de los Valores de Referencia de la IFCC (Federación Internacional de Química Clínica). Individuos sin patología prostática, clínicamente sin dificultad en la micción y examen dígito rectal normal, con resultados negativos a los auxiliares de diagnóstico citoscopía y ecografía. Se realizó la medición con el método inmunoensayo de partículas (MEIA), IMX Abbott, USA. En primer término se analizó el tipo de distribución de los valores de concentración de PAS de todos los individuos, empleando el test de Kolmogorov – Smirnov. Los valores de referencia de PAS obtenidos, entre los percentiles 2,5% y 97,5% mostraron diferencias de valores por grupo etário, con aumento progresivo (Kruskall–Wallis, p<0,0001). Los valores de referencia del PAS en ng/mL, fueron: de 40 a 49 años de 0,25 a 2; de 50 a 59 años de 0,64 a 3,24; de 60 a 69 años de 0,54 a 3,7. Los valores obtenidos servirán de guía para aplicar criterios de medicina preventiva que ayudaran al profesional de la salud en el diagnóstico precoz de patología prostática.
Palabras claves: Marcadores tumorales, Antígeno prostático específico.
ABSTRACT
Development of prostate hyperplasia is an almost universal phenomenon in aging men. The PSA levels in serum are useful in the clinical evaluation in men over the age of 45. The objective of this study was to establish the reference values of prostate specific antigen (PSA) in serum in a selected Paraguayan population by microparticle enzimoimmunoassay MEIA. Six hundred eighteen people were evaluated with ages ranging from 40 to 69 years old who attended to Laboratory Medical Center in Asunción, Paraguay during 1999–2001. All were subjected to digital rectal examination, biopsy and echograph to assure the prostate disease free state. The International Federation of Chemical Chemistry (IFCC) reference value guidelines were used for individual selection. PSA concentrations were determined by microparticle enzimoimmunoassay (Autoanalyzer IMXABBOT/USA). The PSA concentration was presented as percentiles since neither the values nor the logarithms fitted into a normal distribution (Kolmogorov–Smirnov Test). Therefore, a nonparametric test (Kruskal–Wallis) was used for the estimation of differences between datum groups. According to age, our data showed statistical differences (p<0,0001). At increasing levels of PSA: 40 – 49 years old the serum value ranged from 0.25 – 2.0 ng/mL, 50 – 59 years old from 0.64 to 3.24 ng/mL and 60 – 69 from 0.54 to 3.7 ng/mL. These data represented the percentiles 2.5% and 97.5%. These PSA reference values will serve in screening programs as tools to detect prostate diseases in our population.
Keyw ords: Tumour markers, Prostate specific antigen.
INTRODUCCION
La patología tumoral maligna representa un problema de salud pública en todo el mundo. Según datos de la Organización Mundial de la Salud (OMS) la tasa de mortalidad por cáncer de próstata ajustada por edad y por 100.000 habitantes es en España 13.9, EEUU 15.9, Francia 15.8, Inglaterra 16.6. La tasa de incidencia es del 2% anual representando el 13% del total de muertes por cáncer en varones1.
La incorporación extensa de la determinación serológica del antígeno prostático específico (PAS) ha condicionado, en la última década, una modificación substancial en los padrones asistenciales y en el perfil diagnóstico en la patología prostática, de tal forma que la mayoría de los nuevos casos diagnosticados corresponden a estadios precoces y formas localizadas de la enfermedad y en grupos de población que en ausencia de las determinaciones de PAS, nunca serían sometidos a programas de screening o diagnóstico precoz2.
Un 80% de los portadores de cáncer tienen concentraciones séricas de PAS mayores a 4 ng/mL, según estudios realizado entre los años 1992 a 1995 en la División de Urología de la Universidad de Colorado, en 116.073 sujetos, con edades comprendidas entre 40 y 79 años. Los valores predictivos de rangos de referencia del PAS según la edad eran de: 27.7% (en 22014 sujetos con valores por encima de 4 ng/mL) 17.7% (en 17561 sujetos con EDR examen dígito rectal anormal) 56% (en combinación de ambas determinaciones). Con sensibilidades de 34.9%, 27.01% y 38% y especificidad de 75%, 32.8%, 92.2% respectivamente. Demostrando el alto valor predictivo del PAS de acuerdo a los rangos de referencia según la edad, se sugirió una disminución de biopsias innecesarias3.
Un 20% de los hombres con cáncer de próstata tienen un PAS menor de 4 ng/mL como consecuencia de procesos benignos tales como, hiperplasia prostática benigna (HPB), según se demuestra en 2 estudios realizados por Barry y otros, en el año 2001. En biopsias realizadas en sujetos con valores de PAS comprendidos entre 2,5 y 4,0 ng/mL y examen dígito rectal normal del 12 al 23% presentaron cáncer de próstata4. Niveles de PAS por encima de los rangos de referencia, deben despertar sospecha y remitirse al paciente a estudio anátomo patológico5.
Cuando el valor de PAS es inferior a 10 ng/mL, los resultados varían, según el nivel de corte que se escoja6.
Los valores de referencia se establecen considerando que el nivel de PAS aumenta progresivamente con la edad. La sensibilidad es mayor en varones menores de 60 años, mientras que la especificidad es mayor en los que superan esta edad, según el estudio realizado por Katja M y colaboradores en el año 1995, en 5548 sujetos en edades comprendidas entre 20 y 93 años7.
En un estudio realizado entre los años 1995 a 1997, a 5.206 sujetos en edades comprendidas entre 55 y 89 años, sin evidencias de cáncer de próstata, en el departamento de urología de la Facultad de Medicina en Kyoto, Nakanishi y otros, estudiaron la concentración serológica del PAS (método en papel de filtro Delphia). Se evidenció mayor valor de PAS en relación con el aumento de franjas etárias, en el percentilo 95%, 2.1 ng/mL de 55 a 59 años, 3.2 ng/mL de 60 a 69 años y 4.4 ng/mL de 70 a 79 años8.
En el año 1999, en el Departamento de Urología del Hospital Universitario de Angers Francia, Chautard y otros determinaron los niveles de PAS con metodología MEIA, ASXYM/Abbott en 1274 sujetos con edades comprendidos entre 20 y 69 años, demostrando que el nivel de PAS se mantiene constante hasta los 40 años, aumentando con la edad de 40 a 70 años, según regresión lineal edad/logaritmo de concentración de PAS con r=0.29, p<0.0001. Esta variación es importante para validación de rangos de referencia en función de la metodología y la población a la que se aplica9.
En los laboratorios de análisis clínicos en nuestro medio usualmente se informan los rangos de referencia de suministrados por el proveedor de reactivos de las técnicas analíticas implementadas, los cuales están determinados en poblaciones con características determinadas, no especificándose valores para franjas etarias debajo del punto de corte de 4 ng/ml.
El objetivo de este trabajo fue la determinación de los rangos de referencia del antígeno prostático específico (PAS) en suero, por metodología MEIA inmunoensayo de partículas; IMX/ABBOTT, en individuos del sexo masculino, en edades comprendidas entre 40 a 69 años, en estado de salud para patologías prostáticas, en un laboratorio privado de Asunción – Paraguay.
Los valores obtenidos servirán de guía para aplicar criterios de medicina preventiva que ayudaran al profesional de la salud en el diagnóstico precoz de patología prostática.
MATERIALES Y METODOS
En este estudio de diseño observacional descriptivo de corte transverso, se incluyeron 618 individuos del sexo masculino, con edades entre 40 a 69 años, agrupados en franjas etárias de: 40 a 49, 50 a 59 y 60 a 69 años respectivamente, que concurrieron al Laboratorio Medical Center entre 1999 y 2001, procedentes de consultorios urológicos, con solicitudes de estudios laboratoriales. Para la selección de los individuos se siguieron las recomendaciones del Panel de Expertos en Teoría de los Valores de Referencia de la IFCC (Federación Internacional de Química Clínica)10–14 siendo los criterios de inclusión ausencia de patología prostática, clínicamente sin dificultas en la micción, el examen dígito rectal normal con resultados negativos a los métodos auxiliares de diagnóstico: citoscopía, y ultrasonografía, previos a la determinación del PAS.
Para la determinación de valores de referencia del PAS en individuos en estado de salud sin patologías prostáticas, se procedió a toma de muestra de sangre venosa y obtención de suero, con ayuno alimentario y sin ingesta de alcohol las 12 horas previas.
Se determinó la medición de concentración de PAS con el método MEIA (inmunoensayo de micro partículas) IMX/Abbot, USA.
En la calibración del equipo, se utilizaron 6 frascos de calibradores No 2245–01, con concentraciones de PAS: 0, 2, 10, 30, 60 y 100 ng/mL para la realización de la curva estándar.
En cada corrida analítica, se verificó el estado de la curva de calibración, con auto calibración en una concentración de 10 ng/mL.
En el control interno, se midieron los valores del PAS con los controles No 9C04–10, con rangos de concentraciones en ng/mL en 3 niveles: L (Low) 3–5, M (Medium) 12–18, H (High) 36–54.
Para el cálculo del tamaño de muestra, se emplearon los valores de PAS en ng/mL de 20 individuos en los que se tuvieron en cuenta los criterios de inclusión, determinándose una media de 1,68 ng/mL y un desvío estándar de 0.74 ng/mL. El tamaño de muestra mínima, (empleando la tabla 13D cálculo de muestras descriptivas de una variable continua según Hulley, 1993), es de 126 sujetos para cada grupo etario15.
En la gestión de datos se siguió las recomendaciones para el tratamiento estadístico de valores de referencia, según el Panel de Expertos de la IFCC. La estadística descriptiva y la analítica se procesó, con los paquetes informáticos Epi–Info 6 (versión 6,04a, versión en español, 1996) y SPSS–PC (versión 1987). Se analizó el tipo de distribución de los valores de PAS, empleando el test de Kolmogorov–Smirnov. Se empleó estadística descriptiva no paramétrica para la descripción de los valores de referencia del PAS (mediana, percentiles 2,5% y 97,5%). Dichos valores se analizaron por estratos de edad, previa comparación de los valores de PAS empleando el test de Kruskal – Wallis.
RESULTADOS
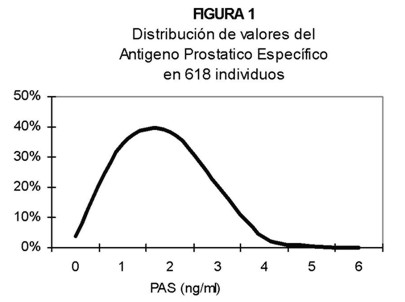
En el análisis de los resultados se observó que los valores de PAS de la población en general del estudio eran de distribución no paramétrica (Kolmogorov– Smirnov; p<0,0001), Figura 1.
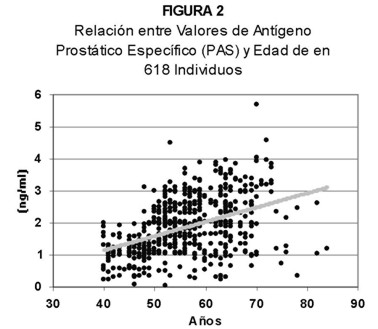
Se observó que los valores de PAS iban aumentando con la edad, con un coeficiente de correlación positivo de 0.42 y una débil fuerza de asociación para un rango del 95% de confianza (r=0,42; 0,09<0,17<0,25). Representado en un gráfico de regresión lineal simple, se observó que a medida que aumenta la edad, aumenta la concentración de PAS, pero con una gran dispersión, solo 17% de los puntos estaban cerca de la línea (Figura 2).
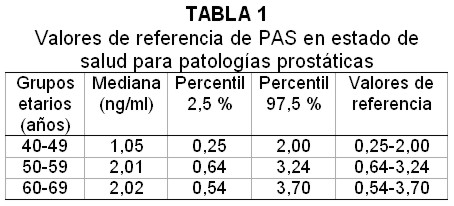
Los valores de referencia de PAS en estado de salud prostática obtenidos es este estudio fueron: 40 a 49 años de 0.25 a 2.0 ng/ml, 50 a 59 años de 0.64 a3.24 ng/ml, 60 a 69 años de 0.54 a 3.7 ng/ml, entre los percentiles 2,5% y 97,5%, siendo diferentes por grupos de edad (Kruskal– Wallis, p<0,0001). Tabla 1.
DISCUSION
En nuestro estudio se observó que los puntos de corte por franja etária son de 2,0 ng/ml de 40 a 49 años, 3,24 ng/ml de 50 a 59 años, 3.7 ng/ml de 60 a 69 años. Los mismos demuestran una tendencia en aumento correlacionado con el incremento de edad.
Los rangos de referencia del PAS obtenidos, aumentan con la edad. Este estudio corresponde a lo referido por Nakanishi8 Chautenad9 Mitrunen16, siendo más apropiada la determinación de los mismos en franjas etarias, principal factor de modificación de los niveles de antígeno prostático específico, ya que; se observa variación del punto de corte con respecto a la determinación única del mismo.
Durante el V Congreso de Actualización Científica en Urología Oncología realizado en Caracas Venezuela en el año 2000, se conscensuó la necesidad de disminuir el valor de corte por debajo de 4 ng/ml de PAS17. En el presente trabajo se demostró que el punto de corte en edades comprendidas entre 40 y 69 años, disminuía a 3,7 ng/ml.
Según estudios realizados por Barry y otros del 12 al 23% de hombres desarrollaron cáncer de próstata con valores de PAS menores a 4 ng/ml4, por lo tanto se sugiere a los profesionales urólogos que en trabajos posteriores se investigue, la relación de pacientes con cáncer de próstata con valores de concentración de PAS entre 3,0 a 3,7 ng/ml.
Se acepta universalmente, que a pesar de las diferencias geográficas en la tasa de incidencia, la determinación de la concentración de antígeno prostático específico, ha condicionado en la última década, una modificación en los padrones asistenciales y el perfil diagnóstico de patologías prostáticas, de tal manera que la mayoría de los nuevos casos diagnosticados de cáncer de próstata corresponden a estadios precoces y formas localizadas de la enfermedad. Si los pacientes presentan valores inferiores a 1,0 ng/ml de PAS, es poco probable que tengan cáncer de próstata, y se omite el examen dígito rectal17.
El hallazgo de valores de concentración de PAS de 3.7 ng/ml como punto de corte en la población paraguaya del sexo masculino, en edades comprendidas entre 40 y 69 años en ausencia de patologías prostáticas, servirá de guía para aplicar criterios de medicina preventiva que ayudaran al profesional de la salud en el diagnóstico precoz de patologías prostáticas.
REFERENCIAS
1.Brawer MK, Benson MC, Bostwick DG, Djavan B, Lilja H, Semjonow Su S, Zhou Z. Prostate–specific antigen and other markers: current concepts from the World Health Organization Second International Consultation on Prostat Cancer. Smin–Urol–Oncol.1999 Nov;17(4):206–1. [ Links ]
2.Caballero JA. Las metástasis óseas en el cáncer de próstata. Problema y enfoque terapeútico. Rev–Cancer (Madrid) 2001;15:30–8. [ Links ]
3.Crawford ED, Leewansangtong S, GokTas S, Holthaus K, Baier M. Efficiency of prostate–specific antigen and digital rectal examination in screening, using 4.0 ng/ml and age–specific reference ranges as a cut–off for abnormal values. Prostate. 1999 Mar 1;38(4):296–302. [ Links ]
4.Barry MJ. Prostate specific antigen testing for early diagnosis of prostate cancer. N Engl J Med 2001;(344)18:1373–77. [ Links ]
5.Valdevenito R, Valdevenito JP, Lopez M, Farías JC, Rodrigo C. Utilidad del antígeno prostático específico. Rev Hosp Clin Univ de Chile 1999;10:1–10. [ Links ]
6.Anderson C, et al. PSA Dilemmas. Soc Iberoamericana de Investigación Científica 2001;25:725–48. [ Links ]
7.Katja M, et al. Evaluación de la prueba de detección del antígeno prostático específico. Clinical Chemistry 1995;41:1115–20. [ Links ]
8.Nakanishi H, Nakao M, Nomoto T, Miki T, Nakagawa S, Kitamura K, Watanabe H. The investigation of age–specific PSA reference range as the cutt–off values in the mass screening for prostatic cancer. Nippon–Hinyokika–Gakkai–Zasshi 1999 Nov;90(11):853–8. [ Links ]
9.Chautard D, Daver A, Mermod B, Tichet A, Bocquillon V, Soret J. Values for free to total prostate–specific antigen ratio as function of age: necessity of reference range validation. Eur–Urol 1999;36(3):181–6. [ Links ]
10.Solberg HE. Petit C. Recomendaciones aprobadas (1987) sobre teoría de los valores de referencia, Parte I. El concepto de los valores de referencia. Acta Bioquímica Clínica Latinoamericana 1988;22:297–703. [ Links ]
11.Solberg HE, Petit C. Recomendaciones aprobadas (1987) sobre teoría de los valores de referencia, Parte II. Selección de individuos para la producción de los valores de referencia. Acta Bioquímica Clínica Latinoamericana 1988; 22:443–51. [ Links ]
12.Solberg HE, Petit C. Recomendaciones aprobadas (1987) sobre teoría de los valores de referencia. Parte III. Preparación de individuos y obtención de especímenes para la producción de valores de referencia. Acta Bioquímica Clínica Latinoamericana 1988;22:603–11. [ Links ]
13.Solberg HE, Petit C. Recomendaciones aprobadas (1987) sobre teoría de los valores de referencia. Parte IV. Presentación de los valores observados relacionados con los valores de referencia. Acta Bioquímica Clínica Latinoamericana 1988;22:613–62. [ Links ]
14.Solberg HE, Petit C. Recomendaciones aprobadas (1987) sobre teoría de los valores de referencia. Parte V. Tratamiento estadístico de valores de referencia obtenidos. Determinación de límites de referencia. Acta Bioquímica Clínica Latinoamericana 1988;22:452–75. [ Links ]
15.Hulley SB, Cumming SR. Diseño de la investigación clínica. Barcelona, Ediciones Doyma, 1993. [ Links ]
16.Mitrunen K, Pettersson K, Pironen T, et al. Dual–Label one–step immunoassay for simultaneous measurement of free and total prostate specific antigen concentrations and ratios in serum. Clinical Chemistry 1995;41(8)1115–20. [ Links ]
17.García B. Avances en la lucha contra el cáncer de próstata. V Congreso de actualización en Urología Oncológica. Caracas–Venezuela Feb/2000. [ Links ]