INTRODUCCIÓN
Las infecciones respiratorias agudas constituyen un problema de salud pública. En el mundo, cada año mueren aproximadamente 4 millones de niños a causa de las infecciones respiratorias agudas (IRA), especialmente por las neumonías1,2. Habitualmente los niños presentan entre 5 y 8 episodios de IRA por año, la gran mayoría leves y autolimitados, pero la magnitud de casos representa una gran carga para el sistema de salud, además de que un grupo de niños, especialmente los que poseen factores de riesgo, pueden evolucionar a una neumonía o una enfermedad más grave, lo cual aumenta la posibilidad de muerte y requiere atención hospitalaria1,2.
Las infecciones de las vías respiratorias bajas continúan siendo causas importantes de morbilidad y mortalidad en los niños menores de 5 años, constituyendo una de las principales causas de años perdidos debido a la muerte, enfermedad o discapacidad (AVAD) en este grupo de edad, representando el 11% del total de AVAD. Por otro lado, las infecciosas respiratorias, junto con la infección gastrointestinal, la tuberculosis y la meningitis, son el segundo grupo de causas de muerte en el <5 años, principalmente en países en vías de desarrollo3.
VIRUS SINCITIAL RESPIRATORIO
El virus sincitial respiratorio (VSR) fue descubierto hace más de 50 años4,5, y desde entonces se ha identificado como la causa más frecuente de infección respiratoria aguda en lactantes, así como una de las principales causas de hospitalización en <2 años, constituyendo la segunda causa de muerte en este grupo de edad3. El VSR humano, científicamente conocido como orthopneumovirus humano, es un virus con envoltura lipídica y un genoma constituido por una única molécula de ARN lineal, monocatenaria y polaridad negativa, perteneciente al género Orthopneumovirus de la familia Pneumoviridae del Orden Mononegavirales5,6. Sus viriones pueden ser del tipo esférico de un tamaño entre 100-350 nm de diámetro o bien largos con filamentos de 10 μm y 60-200 nm de diámetro. Su único huésped conocido es el hombre, y su transmisión es principalmente por contacto con saliva o gotitas de flugge. Su nombre deriva del resultado de la fusión de las células infectadas del epitelio respiratorio, creando formaciones celulares conocidas como sincitios7.
El VSR tiene una elevada transmisibilidad por medio de gotitas de flugge de personas sintomáticas, con un período de contagio de 3 a 8 días8,9. El virus puede permanecer hasta 15 días en la vía respiratoria. Se estima que más del 95% de los niños se habrán infectado por el VSR antes de los 2 años de edad10. Jain et al., reportaron que el VSR en menores de 5 años, constituye el principal microorganismo causante de neumonía en Estados Unidos11.
Los síntomas se presentan dentro de los 4 a 6 días después del contagio y la presentación clínica en niños y adultos varía significativamente desde formas leves a infecciones respiratorias agudas graves, incluyendo la neumonía y bronquiolitis que pueden progresar con requerimiento de ingreso a terapia intensiva y asistencia ventilatoria mecánica. Los niños menores de 6 meses y particularmente los menores de tres meses, los prematuros y aquellos pacientes con determinadas condiciones subyacentes (cardiopatías, enfermedades pulmonares crónicas, enfermedades con inmunocompromiso) pueden desarrollar cuadros severos asociados al virus10.
La sintomatología más frecuente comprende secreción nasal, disminución del apetito o rechazo de la alimentación; tos, estornudos, fiebre y sibilancias. En los lactantes menores, los únicos síntomas podrían ser irritabilidad, adinamia y dificultad respiratoria o para alimentarse12,13.
Este virus produce una importante morbilidad y mortalidad en niños y adultos, lo cual genera una importante carga asistencial y un significativo impacto económico en los sistemas de salud14. En ese sentido, Shi et al., estimaron que en el año 2015, se produjeron 33,1 millones de episodios de infección aguda de las vías respiratorias inferiores asociada al VSR en niños de 0 a 60 meses, lo que dio como resultado un total de 118 200 muertes en todo el mundo15.
Por otro lado, Li et al., estiman que el VSR contribuye sustancialmente a la carga de morbilidad y mortalidad a nivel mundial en niños < de 2 años, especialmente durante los primeros 6 meses de vida y en los países de ingresos bajos y medios. En el Año 2019, Li estima que la carga de mortalidad general de la enfermedad por VSR en todo el mundo, es de una de cada 50 muertes en niños de 0 a 60 meses y una de cada 28 muertes en niños de 28 días a 6 meses son atribuibles al VSR. Por otro lado, por cada muerte intrahospitalaria por infección aguda de las vías respiratorias inferiores asociada al VSR, estiman que se producen aproximadamente tres muertes más atribuibles al VSR en la comunidad16.
Los costos sanitarios derivados de la hospitalización de pacientes infectados por el VSR son importantes. En el año 2020, Zhang et al.,17 estimaron un costo global por infección respiratoria alta relacionadas con el VRS, desde la perspectiva de los pagadores de atención médica, de 4.820 millones de euros (año de costos 2017). Este valor representó el 0,7% del gasto mundial en atención médica en 2017. Siendo que los costos de hospitalización en países de ingresos medios altos, eran superiores a los gastos de países con ingresos altos, a saber, 1.530 millones de euros por año en los países de ingresos medios altos, comparado con 1.150 millones de euros por año en los países con ingresos altos17.
En el año 2023, Ramos Rocha et al., realizaron una revisión sistemática para identificar y evaluar la evidencia actual disponible sobre los costos del manejo de pacientes pediátricos hospitalizados con diagnóstico de virus respiratorio sincitial (VSR) en países de ingresos medios altos, donde el menor costo por paciente en la sala pediátrica se observó en Malasia ($347.60), mientras que el más alto en Colombia ($709.66). Por otro lado, en las unidades de cuidados intensivos pediátrico, el menor costo se observó en China ($1,068.26), mientras que el más alto fue en México ($3,815.56); esta revisión resalta que incluso entre países con niveles de desarrollo económico similares, se presenta una diferencia sustancial en los costos18.
El virus respiratorio sincitial se descubrió hace más de 50 años1,2 y desde entonces se lo ha identificado como la causa más común de infecciones agudas de las vías respiratorias en los lactantes3,4. En consonancia con la enorme carga de enfermedad que plantea la infección por VSR, existe una gran cantidad de información que se ha dilucidado sobre la replicación, patogénesis y transmisión del VSR. A pesar de todo el conocimiento sobre la virología del VSR, hasta hace unos años existían pocas estrategias disponibles para prevenir y tratar la infección por VSR.
VSR - Consideraciones epidemiológicas
Si bien el mayor factor de riesgo general de infección grave por VSR es la edad7, varios estudios epidemiológicos han identificado factores que pueden predisponer a cuadros severos por el VSR. Entre estos factores podemos citar el hacinamiento, la exposición al humo (de cocina y tabaco), evidencia de asma en la madre y nivel socioeconómico bajo19-28.
Aunque la edad es el factor de susceptibilidad más importante, existen factores notables que contribuyen significativamente al riesgo de infección por VSR, como ser la prematuridad, el bajo peso al nacer (<2500 g)7,16,21, trastornos inmunológicos subyacentes (congénitos o adquiridos), anomalías genéticas y cromosómicas (p. ej., síndrome de Down), la presencia de otros procesos de enfermedad pulmonar, neoplasias, patologías cardiacas7,16,19-22. Los niños con defectos cardíacos congénitos tienen un riesgo particularmente superior21,24. Los factores de riesgo de muerte por VSR en las unidades de cuidados intensivos pediátricos incluyen el síndrome de Down y la evidencia de infecciones nosocomiales23.
En el año 2023, se registró un aumento de la actividad de los virus respiratorios, entre los cuales se encontraba el VSR y consecuentemente las hospitalizaciones asociadas predominantemente entre niños menores de 2 años, en la subregión andina y el cono sur. Teniendo en cuenta esta situación, la Organización Panamericana de la Salud (OPS) emitió una alerta epidemiológica en junio del 202326.
En el Paraguay, las infecciones por el VSR constituyen una carga importante al sistema de salud. En el año 2019, el VSR presentó una actividad de mayor intensidad comparado con las últimas 3 temporadas (2016 a 2018)28. La temporada 2019 presentó una curva unimodal, caracterizada por un inicio más temprano, con circulación intensa del VSR y; un pico más alto, representada por la superposición de los virus de Influenza con el VSR. En el mismo año, se registraron 8.984 hospitalizaciones por IRAG en los 10 Centros Centinelas del país, lo que corresponde al 7% de todas las hospitalizaciones en los mencionados centros durante el año 201928. En el 94% de los casos reportados se obtuvo una muestra para detección de virus respiratorios (8.422/8.984)28. Fueron reportados un total de 2.491 casos con resultados positivos (30%), siendo el VSR identificado con mayor frecuencia 64% (1603/2491), seguido del virus de la Influenza 28% (682/2491)28. Entre los años 2020 a 2022, la mayor circulación estuvo dada por SARS-CoV2. En el año 2023, el VSR constituyó la segunda causa de hospitalización, de ingreso a UCI y de mortalidad, después del SARS.CoV2. La vigilancia centinela, muestra que el 32% de los hospitalizados eran <2 años. Por otro lado, 1347 pacientes <19 años requirieron hospitalización, de los cuales el 15% (205/1347) requirieron ingreso a UCI y el 1,3 % (18/1347) falleció28.
En relación a la estacionalidad podemos observar que el VSR circula durante todo el año, con un incremento importante de la circulación entre las Semanas epidemiológicas (SE) 12 - 13 a las SE 30 - 31 (Gráfico 1, En lila en el año 2016, y celeste oscuro en los años siguientes)28.
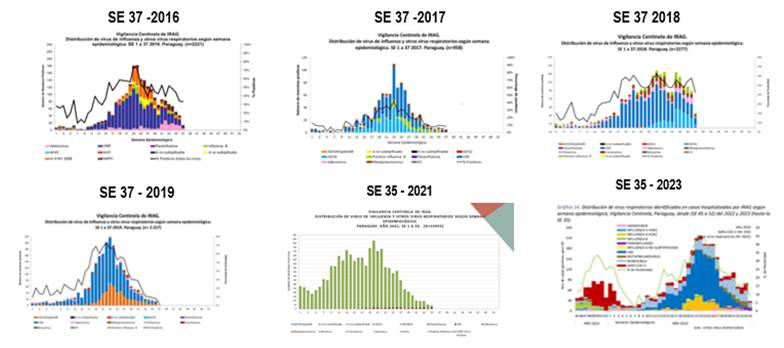
Fuente: DGVS - MSP y BS
Gráfico 1 Vigilancia centinela de IRAG. Distribución de virus según semana epidemiológica. Paraguay 2016 - 2023
Por otro lado, el ministerio de salud de argentina reporto 4.407 casos hospitalizados por IRAB causada por el VSR, de los cuales el 76,5% (3372) ocurrieron en ≤1 año de edad. El 5,8% (196/3372) requirió ser ingresado a una Unidad de Cuidados Intensivos y el 1,5% (3/196) falleció29.
Por su parte, el Departamento de Epidemiología del Ministerio de Salud de Chile, previo a la pandemia por COVID-19, reportó que el VSR fue el agente etiológico más frecuentemente detectado en la vigilancia de infecciones respiratorias agudas graves. En 2016, VSR se detectó en el 65% de los casos de IRAG en <2 años, grupo que constituyó el 48% del total de casos. En personas de 60 años y más, que representaron el 25% de los casos de IRAG, el VSR fue el segundo virus más detectado (20%), después de los virus influenza A y B (66%). Además, VSR se identificó en el 36,4% de los casos de IRAG ingresados a UCI y en el 21,5% de los fallecidos. Durante los años 2017-2019, la circulación de VSR fue similar en magnitud, pero con una disminución de la gravedad, registrándose 19% de ingreso a UCI y 1% de letalidad en 2019. Luego de las medidas restrictivas asociadas a la pandemia (2020 - 2021), en el año 2022, la positividad acumulada de VSR subió a 24,6%, siendo el virus más detectado en casos de IRAG. Además, se observó una mayor gravedad en comparación con 2019, con un aumento del 22% en los casos que requirieron ingreso a unidades de pacientes críticos. Los menores de 2 años fueron el grupo etario más afectado por VSR (36% de positividad), presentando factores de riesgo como prematurez (11%), cardiopatía crónica (3%) y bajo peso al nacer (2%). En este grupo, el 30% requirió ingreso a UCI y el 2% falleció30.
En el año 2022, You Li et al.16 llevaron a cabo una exhaustiva revisión sistemática de 481 estudios, con el objetivo de analizar el impacto del virus respiratorio sincicial (VSR) en la población pediátrica a nivel global. Los resultados de este meticuloso estudio arrojaron datos alarmantes: durante el año 2019, se estimaron 33 millones de infecciones agudas por VSR en niños menores de cinco años, lo que derivó en 3,6 millones de hospitalizaciones y 101.400 muertes atribuibles a este virus. Al profundizar en el análisis de los datos, se observó que los lactantes menores de 6 meses fueron particularmente vulnerables, con 6,6 millones de episodios agudos y 45.700 fallecimientos por infección de VSR. Asimismo, se determinó que el VSR fue responsable del 2% de todas las causas de muerte en menores de 5 años a nivel mundial, elevándose esta proporción al 3,6% en lactantes menores de 6 meses16.
Por otra parte, Stein y sus colaboradores realizaron un estudio enfocado en la incidencia global anual de infección respiratoria aguda (IRA) por VSR por cada 1.000 niños. Sus resultados revelaron una incidencia de 4,37 casos (IC 95%, 2,98 - 6,42) en menores de 5 años; 19,19 (IC 95%, 15,04 - 24,48) en menores de 1 año; 20,01 (IC 95%, 9,65 - 41,31) en niños <6 meses y una cifra alarmante de 63,85 (IC 95%, 37,52 - 109,70) en prematuros <1 año. En cuanto a la letalidad global por IRA asociada a VSR por cada 1.000 niños, se estimó en 6,21 (IC 95%, 2,64 - 13,73) para menores de 5 años, 6,60 (IC 95%, 1,85 - 16,93) para menores de 1 año y 1,04 (IC 95%, 0,17 - 12,06) en prematuros menores de 1 año31.
Tanto la situación epidemiológica del VSR en Paraguay, Chile, Argentina, como en la revisión sistemática de You Li, ponen de manifiesto la necesidad imperiosa de incorporar estrategias efectivas de prevención y tratamiento para combatir el VSR, especialmente en la población pediátrica más vulnerable. La comunidad científica y las autoridades sanitarias deben aunar esfuerzos para abordar este problema de salud pública y reducir la carga de morbilidad - mortalidad asociada al virus respiratorio sincicial.
Objetivo
Analizar las alternativas de prevención para el VSR y elaborar recomendaciones orientadas a la prevención de infecciones por VSR, con el propósito de disminuir las hospitalizaciones por IRAG en lactantes.
Revisión de las estrategias de prevención de la infección por el VSR
Ningún tratamiento disponible acorta el curso de la bronquiolitis o acelera la resolución de los síntomas. La bronquiolitis por VSR presenta una evolución que puede variar de cuadros leve a severos, generando dificultades para predecir la evolución del paciente, resultando en la hospitalización aún con síntomas leves32.
Teniendo en cuenta la situación epidemiológica del VSR, en el año 2015 la Organización Mundial de la Salud diseñó una hoja de ruta para apoyar las actividades de desarrollo de vacunas contra el VSR con especial énfasis en la población infantil de países de medianos y bajos ingresos para la prevención de enfermedades y muerte por VSR. Actualmente, existen en estudio más de 33 tecnologías sanitarias, incluyendo vacunas, anticuerpos monoclonales y antivirales, para la prevención y tratamiento de la infección por VSR. Como se mencionó previamente, existen pocas estrategias disponibles para prevenir y tratar la infección por VSR, a continuación, se presentan algunas de las herramientas disponibles.
Palivizumab
El palivizumab biológico (MedImmune, EE. UU.), es un anticuerpo monoclonal humanizado, producido por tecnología de DNA recombinante. Este anticuerpo está dirigido al epítope conservado de un sitio antigénico de la proteína F de fusión de la superficie viral, impidiendo el cambio conformacional necesario para la fusión de la envoltura del VSR con la membrana plasmática de la célula del epitelio respiratorio33. Este fármaco autorizado por la FDA reduce el riesgo de infecciones respiratorias por el VSR en lactantes con riesgo aumentado, es decir lactantes nacidos prematuros y aquellos con trastornos cardiopulmonares33. Se administra cada 30 días, 15 mg/kp. Los niños con indicación de este monoclonal deben recibir la primera dosis al comienzo de la temporada del VSR, requiriéndose al menos 5 dosis33. En cuanto a los costos de esta estrategia de prevención, los análisis de rentabilidad muestran consistentemente que el coste de la profilaxis con Palivizumab supera en mucho el beneficio económico de evitar un pequeño número de hospitalizaciones, incluso entre lactantes de mayor riesgo33.
Es un biológico seguro y eficaz, el Grupo de Estudio del Impacto del Palivizumab, ha demostrado la reducción de las hospitalizaciones en un 55%26 y el estudio realizado por Feltes y colaboradores han demostrado una reducción del 45% de las mismas32. Su seguridad se ha demostrado ampliamente, siendo los efectos adversos principalmente reacciones adversas leves en el sitio de inyección32.
Nirsevimab
El 31 de octubre de 2022 la EMA autorizó el anticuerpo monoclonal Nirsevimab y el 17 de julio de 2023, fue aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA), para la prevención de las IRAB causada por VSR en recién nacidos y lactantes nacidos durante o al ingresar a su primera temporada de VSR, en prematuros entre 32 y 35 semanas y para niños/as de hasta 24 meses de edad que siguen siendo vulnerables a la enfermedad grave por VSR durante su segunda temporada de VSR34.
El Nirsevimab, es un anticuerpo monoclonal de vida media prolongada específico para la conformación de prefusión de la proteína F del VSR. Es una inmunoglobulina G1 kappa (IgG1k) humana producida mediante tecnología de ADN recombinante, indicada para la prevención de la enfermedad respiratoria inferior producida por el VSR en recién nacidos y lactantes durante su primera exposición a este virus34.
La forma farmacéutica corresponde a una solución inyectable en jeringa prellenada disponible en dos dosificaciones: 50 y 100 mg de Nirsevimab, contenidas en 0,5 y 1 ml, respectivamente. Se recomienda una dosis de 50 mg administrados por vía intramuscular en lactantes con peso corporal menor a 5 kg, y una dosis única de 100 mg administrados por vía intramuscular para lactantes con peso corporal mayor o igual a 5 kg. Se debe administrar en neonatos y lactantes antes del comienzo de la circulación del VSR, o desde el nacimiento en lactantes nacidos durante la circulación del VSR34.
Griffin, et al., determinaron la vida media de Nirsevimab de 59,3 +/- 9,6 días. En el 97,9% de los lactantes que recibieron Nirsevimab (833/851), se determinaron concentraciones séricas superiores al umbral de concentración efectiva del 90% (6,8 ug/ml) al día 15135. La incidencia de infección de las vías respiratorias inferiores que requirió atención médica en lactantes con profilaxis con Nirsevimab fue 70,1% menor (IC 95% 52,3 - 81,2) que en aquellos que recibieron placebo (2,6% [n=25 lactantes] vs. 9,5% [n=46 lactantes]; p<0,001), con el uso de una dosis del anticuerpo al inicio de la circulación de VSR en 1453 lactantes prematuros sanos menores de 1 año nacidos entre las 29 semanas y las 34 semanas33,36.
En cuanto a la incidencia de hospitalización por infección de las vías respiratorias inferiores asociada al VSR en el grupo que recibió Nirsevimab fue 78,4% menor (IC 95% 51,9 - 90,3) que el grupo que recibió placebo (0,8% [n=8 lactantes] vs. 4,1% (n=20 lactantes, p<0,001). Estas diferencias fueron consistentes durante un periodo de seguimiento de 150 días desde la administración de la dosis y entre diferentes zonas geográficas y subtipos de VSR, concluyendo que una sola dosis de Nirsevimab resultó en una reducción en lactantes prematuros sanos con infecciones de las vías respiratorias inferiores por VSR y hospitalizaciones asociadas comparado con el grupo que recibió placebo durante la temporada del VSR36.
Una dosis única de Nirsevimab protegió a lactantes sanos nacidos a término o prematuros de infecciones de vías aéreas inferiores, ingreso hospitalario e infecciones severa asociado a VSR. Los datos farmacocinéticos respaldan la extrapolación de la eficacia a recién nacidos y lactantes con enfermedad pulmonar crónica, cardiopatía congénita o prematuridad extrema. El estudio HARMONIE ha demostrado un impacto significativo del Nirsevimab, en prevenir la hospitalización por infecciones respiratorias por VSR en un 83.2%, con una eficacia de 75,7% para prevenir la enfermedad severa por VSR y una reducción del 58% de hospitalizaciones por infecciones respiratorias del tracto respiratorio36-39.
Teniendo en cuenta, los datos disponibles, esta nueva herramienta para la prevención de las infecciones producidas por el VSR, Nirsevimab, (administrado en dosis única a todos los lactantes nacidos de término como de pre-término), en reemplazo del Palivizumab (5 dosis, dirigido solo a lactantes prematuros y con patologías crónicas pulmonares y cardíacas), tiene el potencial de cambiar el panorama de la enfermedad infantil por VSR y producir un impacto en la reducción la mortalidad y morbilidad infantil; reduciendo la carga al sistema de salud, en lo que se refiere a la disminución de la ocupación de camas hospitalarias tanto en sala como en unidades de cuidados intensivos, así como la disminución de la carga para los cuidadores, médicos y proveedores de atención médica y la mortalidad infantil.
Vacuna de prefusión para gestantes
La vacuna prefusión para gestantes es una vacuna de subunidades proteicas bivariante (RSV-A y RSV-B), sin adyuvante, que contiene la proteína de prefusión F40. La vacuna preF contra la infección por VSR fue aprobada por la FDA el 21 de agosto de 2023. Es una vacuna inmunogénica, segura para gestantes de 18 a 49 años, que debe ser aplicada entre las 24 y 36 semanas de gestación. Los estudios para la aprobación de la vacuna documentan una eficacia del 51.3% (29.4-66.8%) para las infecciones respiratorias baja por VSR, y del 56.8% (10.1-80.7%) en las hospitalizaciones por infección respiratoria bajas por VSR37. Las valoraciones de costo-efectividad han documentado ser una estrategia relativamente beneficiosa.
Un punto fundamental, es que desde el punto de vista programático se resalta que debe considerarse el momento adecuado de vacunación, dado que los resultados muestran menor eficacia al aplicar la vacuna antes de las 28 semanas y que no podría coadministrarse con triple bacteriana acelular ni antigripal porque no cumple con los criterios de no inferioridad al aplicarlas juntas, presentando menor respuesta para el componente de B. pertussis y H3N2 respectivamente. Los estudios de coadministración no se realizaron en personas gestantes por lo cual también se debería evaluar la posibilidad de impacto sobre la estrategia de vacunación con dTpa.
Sumado a lo mencionado anteriormente, la vacuna de prefusión, no ha sido precalificada por la Organización Mundial de la Salud, por lo tanto, no forma parte de las vacunas disponibles en el Fondo Rotatorio, requisito fundamental para la incorporación de vacunas en el Paraguay conforme a la Ley Nacional de Vacunas N° 4621/2015.
El 9 de noviembre de 2023 la Comisión Nacional de Inmunizaciones de la Argentina (CoNaIn) trató entre varios temas, la estrategia de prevención del virus sincitial respiratorio (VSR) y emitió las siguientes recomendaciones: i) Considerar llevar a cabo un análisis epidemiológico de la circulación viral en las distintas regiones del país, con el fin de comprender el patrón de circulación del VSR, así como la duración de los anticuerpos y los costos asociados. Esto debería ayudar a determinar si la estrategia de vacunación en personas gestantes debería limitarse a una temporada o abarcar a toda la cohorte de personas gestantes y ii) Recomendar la estrategia combinada de vacunación de personas gestantes y el uso de Niservimab28.
Por su parte el Comité Asesor en Vacunas y Estrategias de Inmunización de Chile (CAVEI) ha recomendado: i) No incorporar la vacunación programática contra VSR en embarazadas hasta documentar mayor evidencia sobre seguridad y factibilidad para su adherencia; ii) Monitorear la implementación e impacto de la vacunación contra VSR en embarazadas a nivel internacional. iii) Evaluar el impacto de la incorporación del anticuerpo monoclonal Nirsevimab en el Programa Nacional de Inmunizaciones29. A su vez Chile ha conformado una coalición, con representantes por el sector académico, asistencial, representantes de la prensa y de la sociedad, cuyo propósito fue apoyar cualquier decisión del Ministerio de Salud en políticas públicas que intenten un cambio en el paradigma del control de esta enfermedad por la salud de los niños/as del país9.
Luego del análisis de la situación epidemiológica de las infecciones por VSR y su impacto en la salud pública, y las nuevas estrategias de prevención, se establecen las siguientes conclusiones:
Las infecciones por el VSR en Paraguay constituyen una causa importante de morbilidad, hospitalización, ausentismo escolar y laboral, así como de mortalidad, produciendo una sobrecarga al sistema de salud que generalmente no está preparado para dar respuesta a los brotes ocasionados por este virus.
La evaluación e implementación oportuna de nuevas tecnologías sanitarias preventivas, para el uso universal en recién nacidos y lactantes que se enfrentan a su primera temporada de VSR y en aquellos lactantes de alto riesgo en su segunda temporada de VSR, puede significar un escenario totalmente diferente para los próximos años.
Las intervenciones integrales adoptadas por el Ministerio de Salud de Chile constituyen un modelo que puede considerarse al momento de diseñar estrategias aplicables al contexto nacional, incluida la estrategia innovadora del uso de un anticuerpo monoclonal específico.
Se requiere realizar capacitación continua a los profesionales de la salud para el manejo de infecciones respiratorias agudas, con enfoque centrado en las personas, la calidad de los servicios y el bienestar de los pacientes y los hogares afectados. La academia, así como las sociedades científicas tienen un rol clave en esta tarea.
Es necesario continuar y reforzar la vigilancia epidemiológica de VSR para ajustar la temporalidad de las estrategias preventivas en el país, basada en una vigilancia activa que incluya modelos predictivos.
Fortalecer la vigilancia epidemiológica de otros virus, así como las infecciones invasivas por Streptococcus pneumoniae y otros microorganismos, considerando que la incorporación de las estrategias de prevención contra el VSR puede tener un impacto directo positivo en la incidencia de las infecciones causadas por otros virus.
La implementación de estrategias efectivas de información y comunicación de riesgos resulta imperativa para optimizar la adherencia a las medidas preventivas en salud disponibles en el país.
Es fundamental llevar a cabo un estudio fármaco-económico exhaustivo, así como una planificación estratégica y presupuestaria por parte del Ministerio de Salud, para determinar la viabilidad de incorporar las nuevas herramientas disponibles.
RECOMENDACIONES PARA LA PREVENCIÓN DE LAS INFECCIONES RESPIRATORIAS
Teniendo en cuenta el análisis realizado, se consideran importantes las siguientes recomendaciones, para la prevención de las infecciones respiratorias, incluyendo las infecciones por el VSR en el país:
Conformar un grupo de expertos para analizar las mejores intervenciones de prevención e impulsar las actividades de prevención del VSR, influenza, SARS-CoV-2 y otros virus respiratorios.
Evaluar las nuevas tecnologías y herramientas para la prevención de las enfermedades respiratorias. En ese sentido, teniendo en cuenta los datos disponibles, esta nueva herramienta para la prevención de las infecciones producidas por el VSR, Nirsevimab, (administrado en dosis única a todos los lactantes nacidos de término como de pre-término), en reemplazo del Palivizumab (5 dosis, dirigido solo a lactantes prematuros y con patologías crónicas pulmonares y cardíacas), tiene el potencial de cambiar el panorama de la enfermedad infantil por VSR y producir un impacto en la reducción la mortalidad y morbilidad infantil; reduciendo la carga al sistema de salud, en lo que se refiere a la disminución de la ocupación de camas hospitalarias tanto en sala como en unidades de cuidados intensivos, así como la disminución de la carga para los cuidadores, médicos y proveedores de atención médica y la mortalidad infantil.
Optimizar los sistemas de vigilancia de las Enfermedades Tipo Influenza (ETI) y de las Infecciones Respiratorias Agudas Graves (IRAG), complementándolos con estrategias avanzadas de vigilancia genómica. Esto permitirá monitorizar de manera precisa los cambios epidemiológicos y las tendencias de circulación viral, facilitando la evaluación de los patrones de transmisión, la gravedad clínica y el impacto tanto en el sistema de salud como en la sociedad en general.
Fortalecer las capacidades operativas y técnicas de las Unidades Epidemiológicas regionales y la red de laboratorios, con el objetivo de optimizar la capacidad diagnóstica tanto a nivel nacional como regional.
Robustecer la infraestructura y los recursos humanos de los establecimientos de salud, así como ampliar la red de servicios públicos. Estas acciones están orientadas a lograr el acceso universal a la atención sanitaria, contando con profesionales altamente capacitados e infraestructura adecuada para responder eficazmente a futuros brotes de infecciones respiratorias.
Garantizar el suministro continuo y oportuno de insumos y medicamentos esenciales en el sistema de salud para dar respuesta eficaz a los cuadros respiratorios.
Establecer un plan estratégico que promueva una comunicación efectiva de riesgos a la comunidad. Este plan debe enfatizar prácticas fundamentales como el lavado de manos y medidas preventivas para la diseminación del virus, así como implementar políticas de restricción de asistencia escolar para niños con cuadros respiratorios activos.
Realizar un estudio farmacoeconómico exhaustivo orientado a evaluar la viabilidad y el impacto de la introducción de las nuevas herramientas disponibles para la prevención de la infección producida por el VSR.
Promover activamente la vacunación anual contra la Influenza y contra el SARS-CoV-2, priorizando la inmunización de los grupos poblacionales de mayor riesgo.















