Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.43 no.1 Asunción Apr. 2016
https://doi.org/10.18004/ped.2016.abril.45-51
ARTÍCULO ORIGINAL
Tratamiento con solución salina hipertónica en lactantes hospitalizados con bronquiolitis aguda
Treatment with hypertonic saline in hospitalized infants with acute bronchiolitis
Ricardo Iramain(1), Alfredo Jara(1), Julia Coronel(2), Laura Cardozo(1), Norma Bogado(1), Rocio Morinigo(1), Jesús Lopez-Herce(3)
1 Cátedra de Pediatría, Hospital de Clínicas, Universidad Nacional de Asunción. Asunción, Paraguay.
2. Hospital General Barrio Obrero. Asunción, Paraguay.
3. Hospital General Universitario Gregorio Marañón, Instituto de Investigación Sanitaria. Red de Salud Materno Infantil y del desarrollo (Red SAMID), Escuela de Medicina. Universidad Complutense de Madrid, España.
Correspondencia: Prof. Dr. Ricardo Iramain. E-mail: iramainricardo@gmail.com
Recibido: 01/10/2015; Aceptado: 18/03/2016.
Los autores declaran que no existen conflictos de interés en el presente estudio.
RESUMEN
Introducción: El edema de las vías aéreas y las secreciones mucosas son características patológicas predominantes en lactantes con bronquiolitis aguda (BA). La nebulización con solución salina hipertónica al 3% (SSH) puede reducir los cambios patológicos y disminuir la obstrucción de la vía aérea. Objetivos: Evaluar en lactantes con bronquiolitis aguda la eficacia del uso de SSH para disminuir días de internación y mejoría en el score clínico (SC). Material y Métodos: Un total de 106 pacientes (edad media de 5,1 ± 6,4 meses) (rango: 1-14 meses) fueron admitidos y reclutados para recibir tratamiento de BA, en tres hospitales: Catedra de Pediatría del Hospital de Clínicas, Hospital Barrio Obrero, Instituto Privado del Niño. Los pacientes fueron internados en sala de internación común. El periodo de estudio fue de mayo del 2011 a julio del 2014. Se realizó un ensayo clínico, aleatorizado, controlado y a doble ciego, divididos en 2 grupos para recibir solución salina hipertónica (SSH) o solución salina normal (SSN) con Epinefrina. Resultados: Los lactantes del grupo SSH tuvieron importante disminución en los días de hospitalización 1,7±0,76 vs 4,9±2,3 del grupo SSN, p<0,001. El SC demostró mejoría significante en el grupo SSH comparando con el grupo SSN p<0,001. Conclusiones: La solución salina al 3% con Epinefrina es más efectiva que la solución salina normal con Epinefrina en pacientes moderadamente severos con bronquiolitis aguda.
Palabras clave: Solución salina hipertónica, epinefrina, bronquiolitis aguda.
ABSTRACT
Introduction: Airway edema and mucous secretions are predominant pathological features in infants with acute bronchiolitis (AB). Nebulization with hypertonic saline at 3% (HSS) can reduce the pathological changes and decrease airway obstruction. Objectives: To evaluate the effectiveness of using HSS in infants with acute bronchiolitis to decrease hospital length-of-stay and improvement in the clinical score (CS). Material and Methods: A total of 106 patients (mean age of 5.1 ± 6.4 months) (range: 1-14 months) were admitted and enrolled for AB treatment in three hospitals: University Hospital, Barrio Obrero Hospital, and the Private Children's Institute. Patients were admitted to regular hospital rooms. The study period was from May 2011 to July 2014. We performed a randomized, controlled, double-blinded clinical trial, dividing the subjects into 2 groups: one to receive hypertonic saline (HSS) or normal saline (NS) with Epinephrine. Results: Infants in the HSS group had a significant decrease in hospital length-of-stay days, 1.7 ± 0.76 vs. 4.9 ± 2.3 in the NS group, p <0.001. The CS showed significant improvement in the HSS group compared to the NS group, p <0.001. Conclusions: 3% saline with Epinephrine is more effective than normal saline plus Epinephrine in patients with moderately severe acute bronchiolitis.
Keywords: Hypertonic saline, epinephrine, acute bronchiolitis.
INTRODUCCIÓN
La bronquiolitis es una enfermedad viral aguda del tracto respiratorio inferior caracterizado por dificultad respiratoria, sibilancias e hiperinsuflación. Presenta un patrón estacional definido en los climas templados, con un aumento anual de casos en invierno y principios de primavera. Es una enfermedad común durante el primer año de vida, con una tasa máxima de ataque entre los 2 y 10 meses de edad (1).
El virus sincicial respiratorio (VSR) es responsable de la mayoría de los casos de bronquiolitis de origen viral, aunque otros virus menos comunes como el Metapneumovirus humano, adenovirus, parainfluenza, rhinovirus, Mycoplasma pneumoniae (M. pneumoniae) e influenza también tienen un papel importante (2-4).
Si bien es cierto que la etiología viral es la más común en bronquiolitis, la reincidencia de estos cuadros obstructivos en la primera infancia hace sospechar que pudiera existir un componente genético ya que se ha visto en miembros de una familia, asma u otros eventos silbantes (3).
Virtualmente todos los lactantes son infectados por el VRS debajo de los 2 años alrededor del 40 al 50%, y en 1 a 2% de los casos pueden ser severos llevando a la hospitalización (5-7). En las últimas décadas ha existido un aumento en la tendencia de la tasa de hospitalización de los niños con bronquiolitis observados en Estados Unidos y Canadá.(6,8,9).
En la bronquiolitis aguda el principal hallazgo patológico incluye un infiltrado peribronquial de células inflamatorias, edema de la mucosa y sub-mucosa, necrosis con descamación de células epiteliales y exceso de secreción mucosa (10-12).
El diagnóstico de la bronquiolitis aguda generalmente se basa en aspectos clínicos. A pesar de que la definición difiere de un país a otro, es generalmente aceptado que la bronquiolitis aguda se refiere al primer episodio de aguda sibilancia en niños menores de 2 años. Sin embargo algunos autores invocan que el segundo episodio podría deberse a una recaída de la bronquiolitis secundaria a infección con Rhinovirus(13).
Los criterios diagnósticos para bronquiolitis han sido usados ampliamente en varios trabajos clínicos (14-17).
Por otra parte, se estima que el 50% de los niños con bronquiolitis desarrollan hiperreactividad bronquial o asma durante las siguientes 2 décadas de la vida (5), es decir, que la genética y los factores ambientales son determinantes.
En la última década varios estudios han demostrado que la inhalación de 6% a 10% de Solución Salina Hipertónica (SSH) mejora la depuración inmediata y a largo plazo de los pequeños aeroconductos en pacientes con fibrosis quística. (18,19). La SSH ha sido mostrada que aumenta el clereance mucociliar en individuos sanos, en pacientes con asma, bronquiectasia, y enfermedades sinusales (20-22). Tales efectos son esperados ser beneficiosos en los niños menores de 1 año (23). Los mecanismos de acción postulados para la SSH son los siguientes: 1) La SSH induce un flujo osmótico de agua dentro de la capa mucosa, rehidratando la superficie liquida de la vía aérea y mejora el clearance mucoso (24,25). 2) La SSH rompe las bandas iónicas dentro del gel mucoso, por lo tanto reduce la viscosidad y la elasticidad de la secreción mucosa (26). 3) La SSH estimula el “batimiento cilial” mediante la liberación de la prostaglandina E2 (27). Además, por absorción del agua de la mucosa y submucosa, la SSH puede teóricamente reducir el edema de la pared de la vía aérea en lactantes con bronquiolitis aguda (23,24,28).
En un estudio se demostró que los niños hospitalizados por bronquiolitis virales, la administración regular de SSH al 3% combinado con epinefrina disminuyó los días de internación en aproximadamente 22% comparado con niños que recibieron la misma dosis de epinefrina mezclado en 0,9% de SSN (29). En forma similar, en pacientes ambulatorios, fue encontrado que la inhalación de SSH al 3% (con terbulina) mejora el escore clínico pero no produce una disminución de la tasa de hospitalización (28). Ambos estudios usaron una dosis de tres veces al día, lo cual ha sido significativamente menor que al régimen de tres a seis veces por hora a menudo utilizado para aplicar medicación por nebulización a niños con distrés respiratorio (17,30). Se han reportado algunos trabajos donde evaluaron la efectividad de la SSH como tratamiento en el departamento de emergencias para evitar la hospitalización con resultados contradictorios (31-33).
El objetivo del presente estudio es determinar la eficacia de la adición de nebulizaciones frecuentes con SSH al 3% al tratamiento estándar con Epinefrina; de manera a lograr: 1) La disminución del requerimiento de O2 y 2) La mejoría de la Oxigenación (Sat.O2).
MATERIALES Y MÉTODOS
Pacientes: Fueron enrolados 106 pacientes. Lactantes menores de 2 años quienes fueron admitidos al Hospital para el tratamiento de bronquiolitis moderadamente severa fueron elegidos para el estudio. El diagnóstico de bronquiolitis moderadamente severa requirió de una historia precedida de infección de las vías aéreas superiores, la presencia de sibilancias o rales a la auscultación del tórax con un score de TAL modificado (34) de > 4. Los criterios de exclusión fueron: Enfermedad cardiaca, enfermedad respiratoria crónica, inmunodeficiencia, episodio anterior de sibilancias, saturación de O2 <85% del aire en la habitación, conciencia alterada, insuficiencia respiratoria progresiva que requirió ventilación mecánica, prematurez ≤ 34 sem., uso previo de SHH 12 horas previas.
Diseño: Estudio tipo ensayo clínico, aleatorizado, controlado a doble ciego; realizado desde Mayo del 2011 a Julio del 2014, los pacientes admitidos fueron evaluados dentro de las 12 hrs de su ingreso al estudio. Si los criterios de inclusión/exclusión han sido satisfechos, el consentimiento de los padres fue obtenido y el paciente se randomizó para recibir tratamiento con 4 ml de nebulización conteniendo solución salina hipertónica al 3% (grupo de estudio) más 1,5 mgrs de Epinefrina o solución salina normal 0,9% (grupo control) más 1,5 mgrs de Epinefrina. La solución del estudio fue administrada cada 8 hrs hasta el alta. La ramdomización fue aleatorizada. Dichos sobres estaban numerados por fuera y dentro se encontraba escrito en una hoja doblada en cuatro partes el grupo al cual pertenecería el paciente y las letras del frasco que le tocaba recibir de acuerdo al grupo. La asignación a cada grupo se realizó de acuerdo a la tabla de números aleatorios.
El oxígeno fue administrado por medio de mascara o bigotera según demanda a partir de 92% de Saturación de Oxigeno.
Las soluciones fueron preparadas por una farmacia independiente contratada para tal efecto (Botica Magistral), y fueron identificadas como frasco A y B. Ambos tenían el mismo color, olor y nivel de líquido de cada frasco. Ninguno de los médicos intervinientes, pacientes ni padres sabían cuál era la solución de los frascos. La respuesta clínica, dada por el score y la Sat. de O2, fueron evaluadas por los médicos del staff de cada sala y jefes de guardia, ya sea al ingreso del protocolo y diariamente hasta el alta. Los investigadores participaban del cuidado de los pacientes pero ignorando cuál era la solución de los frascos.
Determinación del tiempo de estadía: El tiempo de estadía fue definida entre el ingreso al protocolo dentro de las 12 hrs de admisión a sala común del Hospital y el tiempo del alta. El protocolo definió el alta cuando el paciente tenía el score ≤ 4 y por lo menos una Sat. de O2 de 95% sostenida en aire ambiente por 6 horas.
Cuestiones Éticas: El estudio fue aprobado por los comités de investigación de las respectivas instituciones. El consentimiento escrito informado se obtuvo de por lo menos uno de los padres de cada uno de los pacientes.
Estrategia Estadística: Una reducción en la estadía hospitalaria de por lo menos 1 día fue propuesto previamente para ser clínicamente significativo (30) Se anticipó que esto requeriría de por lo menos 34 pacientes en cada grupo para tener significancia estadística. La comparación de los días promedios de tiempo de estadía, los scores de gravedad entre los dos grupos fue realizada mediante la prueba t de student o Mc Whitney según corresponda. La proporción de lactantes hospitalizados se comparó mediante la prueba de chi2 o Fisher según corresponda.
Mejoría del score clínico y de la oxigenación, Saturación intermitente de O2, cada 6 hrs.
RESULTADOS
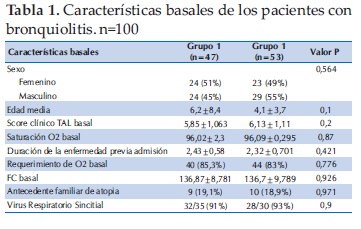
Fueron incluidos en el estudio 106 pacientes con bronquiolitis moderada, con edad media de 5,1 ± 6,4 meses (rango: 1-14 meses). De los cuales 5 fueron posteriormente desvinculados del protocolo, porque han sido trasladados a UTI por convertirse en categoría severo, y otro paciente fue extraído también, porque los padres no quisieron firmar el consentimiento, quedando 100 pacientes para el análisis, de ellos 47 pacientes fueron asignados aleatoriamente al grupo que recibió Solución Salina Hipertónica (SSH) y 53 al grupo que recibió solución salina normal (SSN) No se observaron diferencias significativas entre los dos grupos en las características basales (Tabla 1).
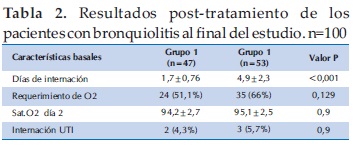
Se observó que el promedio de los días de internación fue significativamente (p<0,001) menor en el grupo que recibió el tratamiento con SSH (1,7±0,76) comparado al grupo control (4,9±2,3). Hubo una disminución de 3.2 días de internación entre los dos grupos. El requerimiento de O2 entre ambos grupos no fue diferente. La saturación de oxígeno al segundo día de internación fue similar en los 2 grupos. Fueron trasladados a UTI por la mala evolución de moderada a severa 5 pacientes, 2 del Grupo 1 y 3 del Grupo 2, no ha existido diferencias significativas (Tabla 2).
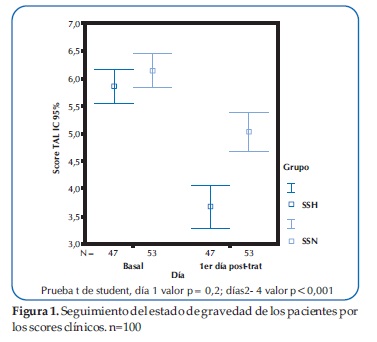
El estado de gravedad de los pacientes por los scores clínicos muestra mejores condiciones en el grupo 1 que en 2 (Figura 1).
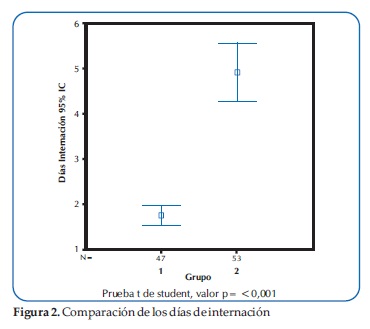
Los pacientes del grupo 1 tuvieron significativamente en promedio menor días de internación que el grupo 2 (Figura 2).
DISCUSIÓN
En el presente estudio se demostró, que la inhalación de la SSH al 3% es un tratamiento efectivo, siendo una verdadera droga activa en el tratamiento de la Bronquiolitis, para pacientes hospitalizados. La solución salina hipertónica ha sido probada ser una droga efectiva aumentado el volumen de la superficie líquida y aumentando la frecuencia del clearance mucociliar (35).
Frecuentes nebulizaciones de la SSH al 3% redujeron el tiempo de estadía hospitalaria hasta aproximadamente 3 días, lo que representa un 34%; coincidiendo con una reciente revisión evaluado por el Cochrane que demostró que no solamente pacientes internados han disminuido la frecuencia de hospitalización sino también los pacientes externos que consultaron a Urgencias (36). Sin embargo últimamente han aparecido resultados contradictorios con respecto al uso de SSH y riesgo de internación en el departamento de emergencias (32,33).
Las características basales de nuestros pacientes fueron similares mostrando una edad media de 5,1 ± 6,4 meses. El score clínico, la Sat. de O2, el requerimiento de O2 y la FC basal fueron también semejantes al inicio del trabajo. También es importante destacar que la duración de la enfermedad previa, el antecedente familiar de atopia, y el screning virológico para VRS en sus resultados reflejaron igualmente similitud. Todos estos datos demuestran que los dos grupos fueron comparables entre sí.
En nuestra población de pacientes la dosis de nebulización SSH 3 veces al día probó ser suficiente para acortar el tiempo de estadía hospitalaria significantemente (Figura 2), coincidiendo con un reporte que han utilizado la misma indicación con resultados óptimos(23). En nuestro ensayo clínico, ambos grupos recibieron tratamiento convencional, Hidratación, Oxigeno según necesidad, y Adrenalina, adicionándole SSH al grupo tratamiento, dicha combinación ha sido demostrada ser efectiva también en algunos reportes (23,29).
Este estudio demostró una mejoría significante en el score clínico de severidad luego de la inhalación de la solución salina hipertónica al 3% comparando con la solución salina normal (Figura 1).
Nosotros hemos usado una relativa baja concentración al 3% de solución salina hipertónica para disminuir los posibles efectos negativos de más altas concentraciones (5% o 7%). Hemos administrado siempre a los 2 grupos de estudio y de control Epinefrina no solo por creer que forma parte del tratamiento de toda bronquiolitis sino también para evitar los riesgos de broncospasmo de la SSH. Un reporte evaluó la ramdomización en tres grupos de la SSH, al 3%, al 5% y al 0,9%, adicionando Epinefrina a todos, resultando la mezcla al 5% más segura y eficaz, pero dicho estudio ha tenido un tamaño de muestra pequeña (37).
No se encontró diferencias significativas entre el grupo control y el tratado con SSH en relación a requerimiento de Oxigeno y Saturación de O2, en concordancia con otras publicaciones.(23,31,38). Hemos intentado, demostrar la disminución en el requerimiento de O2, no encontrando ninguna diferencias entre ambos grupos. Tampoco hemos hallado valores estadísticos significativos en la Saturación de O2, entre el grupo control y tratamiento durante el estudio, en concordancia con algunas publicaciones (23,31,38).
Analizando la evolución de nuestra población en cuanto a admisión a Terapia Intensiva, el porcentaje de pacientes que ha sido trasladado a UTI, fue de 4,3% en el Grupo tratamiento y de 5,7% en el grupo control. Todos ellos ingresaron a asistencia respiratoria mecánica (ARM). Estos datos son casi coincidente al referido por otros autores. Green reportó 6,9% (39) y Wang 9% (40) de ingreso a ARM en poblaciones sin enfermedad subyacente.
Más recientemente Jacobs y cols. (41) han analizado la utilización de solución hipertónica al 7% en bronquiolitis moderado a severo con Epinefrina, no encontrando mejoría en el score clínico.
Las limitaciones de nuestro estudio consisten en el tamaño de muestra y que el análisis ha tenido que ser enfocado en un determinado grupo etario, menores de 6 meses, por las características de nuestros pacientes hospitalizados. Como sabemos esta enfermedad puede abarcar hasta los 2 años de edad.
CONCLUSIÓN
Sobre la base de una más rápida frecuencia del alta del hospital y una mejoría significante en el score clínico, concluimos que la solución salina al 3% con Epinefrina es más efectiva que la solución salina normal en pacientes moderadamente severos con bronquiolitis aguda.
Dada la alta prevalencia de esta enfermedad en los lactantes menores de 2 años y la tremenda carga relacionada a la hospitalización, esta reducción puede ser considerada clínicamente relevante y puede potencialmente tener un efecto positivo en el impacto económico para tanto, el sistema de salud y las familias individuales.
REFERENCIAS
1. Mandell G, Bennett J, Dolin R. Enfermedades infecciosas: principios y práctica. 5a ed. Madrid: Panamericana; 2002. [ Links ]
2. Smyth RL, Openshaw PJM. Bronchiolitis. Lancet. 2006;368:312-22. [ Links ]
3. Jacques J, Bouscambert-Duchamp M, Moret H, Carquin J, Brodard V, Lina B, Motte J, Andréoletti L. Association of respiratory picornaviruses with acute bronchiolitis in French infants. J Clin Virol. 2006;35(4):463-66. [ Links ]
4. Garcia-Garcia ML, Calvo C, Perez-Brena P, De Cea JM,Acosta B, Casas I. Prevalence and clinical characteristics of human metapneumovirus infections in hospitalized infants in Spain. Pediatr Pulmonol. 2006;41(9):863-71. [ Links ]
5. Rakshi K, Couriel JM. Management of acute bronchiolitis. Arch Dis Child. 1994;71(5):463-69. [ Links ]
6. Shay DK, Holman RC, Newman RD, Liu LL, Stout JW, Anderson LJ. Bronchiolitis hospitalizations. JAMA. 1999;282(15):1440-46. [ Links ]
7. Meissner HC. Selected populations at increased risk from respiratory syncytial virus infection. Pediatr Infect Dis J.2003;22(Suppl 2):40-44. [ Links ]
8. Njoo H, Pelletier L, Spika L. Respiratory disease in Canada, Ottawa: Canadian Institute for Health Information. Health Canada and Statistics Canada. 2001:65-87. [ Links ]
9. Langley JM, LeBlanc JC, Smith B, Wang EEL. Increasing incidence of hospitalization for bronchiolitis among Canadian children, 1980-2000. J Infect Dis. 2003;188(11):1764-67. [ Links ]
10. Panitch HB. Respiratory syncytial virus bronchiolitis:supportive care and therapies designed to overcome airway obstruction. Pediatr Infect Dis J. 2003;22(Suppl):83-88. [ Links ]
11. Wohl ME, Chernick V. State of the art: bronchiolitis. Am Rev Respir Dis. 1978;118(4):759-81. [ Links ]
12. Coffin S. Bronchiolitis: in patient focus. Pediatric Clin North Am. 2005;52(4):1047-57. [ Links ]
13. Hasegawa K, Mansbach J, Teach S. Multicenter study of viral etiology and relapse in hospitalized children with bronchiolitis. Pediatr Infect Dis J. 2014;33(8):809-13. [ Links ]
14. Panitch HB, Callahan CW, Schidlow DV. Bronchiolitis in children. Clin Chest Med. 1993;14(4):715-31. [ Links ]
15. Klassen TP. Recent advances in the treatment of bronchiolitis and laryngitis. Pediatr Clin North Am. 1997;44(1):249-61. [ Links ]
16. Schuh S, Johnson D, Canny G, Reisman J, Shields M, Kovesi T, Kerem E, Bentur L, Levison H, Jaffe D. Efficacy of adding nebulized ipratropium bromide to nebulized albuterol therapy in acute bronchiolitis. Pediatrics.1992;90(6):920-23. [ Links ]
17. Wainwright C, Altamirano L, Cheney M, Cheney J, Barber S, Price D, . Moloney S, Kimberley A, Woolfield N, Cadzow S, Fiumara F, Wilson P, Mego S, VandeVelde D, Sanders S, O'Rourke P, Francis P. A multicenter, randomized, double-blind, controlled trial of nebulized epinephrine in infants with acute bronchiolitis. N Engl J Med. 2003;349(1):27-35. [ Links ]
18. Suri R, Grieve R, Normand C, Metcalfe C, Thompson S, Wallis C, Bush A. Effects of hypertonic saline, alternate day and daily rhDNase on healthcare use, costs and outcome in children with cystic fibrosis. Thorax. 2002;57(10):841-46. [ Links ]
19. Elkins MR, Robinson M, Rose BR, Harbour C, Moriarty CP, Marks GB, Marks GB, Belousova EG, Xuan W, Bye PT, National Hypertonic Saline in Cystic Fibrosis (NHSCF) Study Group. A controlled trial of long-term inhaled hypertonic saline in patients with cystic fibrosis. N Engl J Med. 2006;354(3):229-40. [ Links ]
20. Daviskas E, Anderson SD, Gonda I, Eberl S, Meikle S, Seale JP, Bautovich G. Inhalation of hypertonic saline aerosol enhances mucociliary clearance in asthmatic and healthy subjects. Eur Respir J.1996;9(4):725-32. [ Links ]
21. Kellett F, Redfern J, Niven RM. Evaluation of nebulised hypertonic saline (7%) as an adjunct to physiotherapy in patients with stable bronchiectasis. Respir Med.2005;99(1):27-31. [ Links ]
22. Shoseyov D, Bibi H, Shai P, Shoseyov N, Shazberg G, Hurvitz H. Treatment with hypertonic saline versus normal saline nasal wash of pediatric chronic sinusitis. J Allergy Clin Immunol. 1998;101(5):602-605. [ Links ]
23. Mandelberg A, Tal G, Witzling M, Someck E, Houri S, Balin A, et al. Nebulized 3% hypertonic saline solution treatment in hospitalized infants with viral bronchiolitis. Chest. 2003;123(2):481-87. [ Links ]
24. Mandelberg A, Amirav I. Hypertonic saline or high volume normal saline for viral bronchiolitis: mechanisms and rationale. Pediatr Pulmonol. 2010;45(1):36-40. [ Links ]
25. Robinson M, Hemming AL, Regnis JA, Wong AG, Bailey DL, Bautotvich GJ, King M, Bye PT. Effect of increasing doses of hypertonic saline on mucociliary clearance in patients with cystic fibrosis. Thorax. 1997;52(10):900-903. [ Links ]
26. Ziment I. Respiratory pharmacology and therapeutics. Philadelphia: WB Saunders; 1978. [ Links ]
27. Assouline G, Leibson V, Danon A. Stimulation of prostaglandin output from rat stomach by hypertonic solution. Eur J Pharmacol. 1977;44(3):271-73. [ Links ]
28. Sarrell EM, Tal G, Witzling M, Someck E, Houri S, Cohen HA, Mandelberg A. Nebulized 3% hypertonic saline solution treatment in ambulatory children with viral bronchiolitis decreases symptoms. Chest. 2002;122(6):2015-20. [ Links ]
29. Tal G, Cesar K, Oron A, Houri S, Ballin A, Mandelberg A. Hypertonic saline/epinephrine treatment in hospitalized infants with viral bronchiolitis reduces hospitalizations stay: 2 years experience. Isr Med Assoc J. 2006;8(3):169-73. [ Links ]
30. Patel H, Platt RW, Pekeles GS, Ducharme FM. A randomized, controlled trial of the effectiveness of nebulized therapy with epinephrine compared with albuterol and saline in infants hospitalized for acute viral bronchiolitis. J Pediatr. 2002;141(6):818-24. [ Links ]
31. Grewal S, Ali S, McConnell D, Vandermeer B, Klassen TP. A randomized trial of nebulized 3% hypertonic saline with epinephrine in the treatment of acute bronchiolitis in the emergency department. Arch Pediatr Adolesc Med. 2009;163(11):1007-1012. [ Links ]
32. Florin T, Shaw K, Kittick M, Yakscoe S, Zorc J. Nebulized hypertonic saline for bronchiolitis in the emergency department: a randomized clinical trial. JAMA Pediatr. 2014;168(7):664-70. [ Links ]
33. Wu S, Baker C, Lang ME, Schrager SM, Liley FF, Papa C, Mira V, Balkian A, Mason WH. Nebulized hypertonic saline for bronchiolitis: a randomized clinical trial. JAMA Pediatr. 2014;168(7):657-63. [ Links ]
34. Bello O. Emergencias Pediátricas. Montevideo: Biblio Medica;2003. [ Links ]
35. Sood N, Bennett WD, Zeman K, Brown J, Foy C, Boucher RC, Knowles MR. Increasing concentration of inhaled saline with or without amiloride: effect on mucociliary clearance in normal subjects. Am J Respir Crit Care Med. 2003;167(2):158-63. [ Links ]
36. Zhang L, Mendoza-Sassi RA, Wainwright C, Klassen TP. Nebulised hypertonic saline solution for acute bronchiolitis in infants. Cochrane Database Syst Rev. 2013 Jul 31;7:CD006458. [ Links ]
37. Al-Ansari K, Sakran M, Davidson BL, El Sayyed R, Mahjoub H, Ibrahim K. Nebulized 5% or 3% hypertonic or 0.9% saline for treating acute bronchiolitis in infants. J Pediatr. 2010;157(4):630-34. [ Links ]
38. Ipek IO, Yalcin EU, Sezer RG, Bozaykut A. The efficacy of nebulized salbutamol, hypertonic saline and salbutamol/hypertonic saline combination in moderate bronchiolitis. Pulm Pharmacol Ther. 2011;24(6):633-37. [ Links ]
39. Green M, Brayer AF, Schenkman KA, Wald ER. Duration of hospitalization in previously well infants with respiratory syncytial virus infection. Pediatr Infect Dis J. 1989;8(9):601-605. [ Links ]
40. Wang EE, Law BJ, Stephens D. Pediatric Investigators Collaborative Network on Infections in Canada (PICNIC) prospective study of risk factors and outcomes in patients hospitalized with respiratory syncytial viral lower respiratory tract infection. J Pediatr. 1995;126(2):212-19. [ Links ]
41. Jacobs J, Foster M, Wan J, Pershad J. 7% Hypertonic saline in acute bronchiolitis: a randomized controlled trial. Pediatric. 2014;133(1):e8-13. [ Links ]














