Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.42 no.1 Asunción Apr. 2015
https://doi.org/10.18004/ped.2015.abril.22-30
ARTÍCULO ORIGINAL
Incidencia de Dengue Grave en lactantes
Incidence of Severe Dengue in Infants in Paraguay
Silvina Lugo(1), Manuel Arce(1), Mirta Mesquita(1), Viviana Pavlicich(1)
1. Hospital General Pediátrico Niños de Acosta Ñu. Reducto, San Lorenzo, Paraguay.
Correspondencia: Dra. Silvina Lugo. E-mail: silvina.lugo@hotmail.com
Recibido: 02/09/2014; Aceptado: 21/02/2015.
Los autores declaran que no existen conflictos de interés en el presente estudio.
RESUMEN
Introducción: Identificar grupo etario con riesgo de Dengue Grave (DG) dentro del grupo de lactantes, podría evitar hospitalizaciones innecesarias. Objetivo: Determinar la incidencia de DG en lactantes hospitalizados durante la epidemia 2013. Materiales y Métodos: Diseño de cohorte retrospectivo, se incluyeron todos los niños menores de un año con Fiebre Dengue confirmado por serología. Resultados: De 60 lactantes, 82% fueron menores de 6 meses de edad. 15 (25%) evolucionaron a DG, 3 presentaron shock sin fuga capilar, uno fue diagnosticado de miocarditis y otro hepatitis. Los niños con DG tenían ≤ 6 meses (RR= 1.4 IC 1.2–1.4p = 0.02). Durante el seguimiento 34 (56,6%) desarrollaron signos de alarma, 15 clasificaron como DG, 19 (31,6%) fueron de alta como DSA. Ingresaron en fase febril (DG: 2.6 ±1.3 días versus DNG: 2.1±1.2 p: 0.14). La fuga capilar se produjo entre el día 4-5 de la enfermedad (media 4.6 DS ±0.7). Los niños con DG tuvieron más signos de shock temprano (66.7% versus 18.2% RR= 1.9 IC= 1.1–3.3 p <0.001) y algún signo de alarma (RR=1.8 IC 1.3-2.4 p < 0.001), más plaquetopenia en el día 5° (86.6% versus 33.3% RR= 1.7 IC= 1.2- 2.4 p < 0.001), niveles más elevados de transaminasas (33.3 % versus 2.2 % RR= 1.5 IC= 1–2.2 p = 0.006) e hipoalbuminemia (2.6 ±0.48 versus 3.6 ±0.49 p <0.001). Requirieron más bolos de cristaloides (100% versus 33.3% RR= 2 IC= 1.4-2.8 p <0.001), hidratación parenteral (93.3% versus 46.5% RR= 1.6 IC= 1.2 - 2.1 p= 0.001), soporte vasoactivo y transfusiones con hemoderivados. Conclusiones: Se observa tendencia de mayor riesgo de la enfermedad en menores con edad igual o menor a 6 meses.
Palabras clave: Dengue, factores de riesgo, alerta temprana, lactante.
ABSTRACT
Introduction: Identification of infant age groups at risk for severe dengue (SD) could avoid unnecessary hospital admissions. Objective: To determine the incidence of SD in infants hospitalized during the 2013 epidemic. Materials and Methods: We conducted a retrospective cohort study including all children under age 1 year with serologically-confirmed dengue fever. Results: Of 60 infants, 82% were under age 6 months: 15 (25%) developed SD, 3 presented shock with no capillary leakage, 1 was diagnosed with myocarditis, and 1 with hepatitis. Children with SD were aged ≤ 6 months (RR=1.4, CI 1.2-1.4, p=0.02). During follow up 34 (56.6%) developed alarm signs, 15 were classified as having SD, and 19 (31.6%) were discharged as having dengue with warning signs. Fever was reached in SD at 2.6 ±1.3 days, versus NSD at 2.1 ±1.2 days (p=0.14). Capillary leakage occurred at 4-5 days of illness in (mean SD: 4.6 ±0.7). Children with SD had more sign of early-onset shock (66.7% vs. 18.2%, RR: 1.9, CI 1.1-3.3, p<0.001), alarm sign (RR: 1.8, CI 1.3-2.4, p<0.001), thrombocytopenia at day 5 (86.6% vs. 33.3%, RR: 1.7, CI 1.2-2.4, p<0.001), and higher transaminase levels (33.3% vs. 2.2%, RR 1.5, CI 1-2.2, p=0.006) and hypoalbuminemia (2.6 ±0.48 vs. 3.6 ±0.49, p<0.001). They also more frequently required crystalloid boluses (100% vs. 33.3%, RR 2, CI 1.4-2.8, p<0.001), parenteral hydration (93.3% vs. 46.5%, RR 1.6, CI 1.2-2.1, p<0.001), vasoactive agents, and blood product transfusion. Conclusions: A tendency toward more risk of the disease was seen in infants aged ≤6 months.
Keywords: Dengue, risk factors, early warning, infant.
INTRODUCCIÓN
Paraguay, es un país endémico de Dengue, con circulación viral durante todo el año, y aumento de casos entre los meses de enero a mayo. Los primeros casos reportados datan del año 1988 con la introducción del serotipo 1, hasta la epidemia del 2006-2007, fecha en que prevaleció el serotipo 3, en el año 2010 ingresó el serotipo 2; y desde el 2012 están en circulación los 4 serotipos, siendo el DEN-2 el causante de epidemias en los dos últimos años. El número de casos confirmados se ha incrementado de 28.182 reportados en 2007 a 106.194 casos en 2013. El país acumula una tasa de incidencia de 2.084 por cien mil habitantes, con una incidencia acumulada superior a 300 por 100.000 habitantes. La tasa de hospitalización se ha triplicado éste año con respecto al 2012 (6.070 a 19.919 casos). La proporción de Dengue Grave (DG) aumentó de 1,7% a 5,29%. El grupo etario más afectado fue en todas las epidemias la población entre 20 a 39 años de edad seguido del grupo de mayores de 60 años; y la prevalencia de Dengue Grave y muerte por Dengue fue mayor en pacientes mayores de 60 años (1,2).
Un hecho particular en la última epidemia fue la inversión del patrón etario, comprobándose predominio de Dengue Grave en niños menores de un año de edad en relación a los adultos mayores en años previos (10,7% vs 7,3% de los casos) (2).
La tasa de letalidad de 2013 fue de 0,04%, siendo el grupo etario más afectado la población adulta con edades comprendidas entre 20 a 39 años (2).
El Dengue es y seguirá siendo un importante problema de salud pública en Paraguay, en donde la falta de unidades suficientes para cubrir las necesidades de salud en épocas de epidemia pone en riesgo a la población más vulnerable. La implementación de protocolos de manejo de casos y criterios de hospitalización es imprescindible para evitar ocupación de camas innecesarias, sin aumentar la morbimortalidad.
Según las Guías de manejo de Fiebre Dengue de la Organización Mundial de la Salud (OMS) y las Guías Nacionales, los niños menores de 2 años de edad deben ser hospitalizados, porque representan un grupo de riesgo independientemente de la presencia de signos de alarma(3-5).
Estas guías están basadas en que la persistencia de los anticuerpos maternos en los lactantes de madres previamente sensibilizadas, aumentaría el riesgo de desarrollar formas graves de la enfermedad(6-9).
Conocer la edad pediátrica con mayor riesgo de evolución desfavorable es fundamental para decidir la hospitalización.
Hemos asistido durante la última epidemia a una importante necesidad de admisión hospitalaria de niños menores de dos años con Dengue, basándonos en el criterio de representar un grupo de riesgo señalado en el protocolo vigente de manejo de casos (3-5). Esto ha ocasionado ocupación de camas por pacientes portadores de enfermedad leve. Por otra parte estos niños son diagnosticados entre el primer y segundo día de enfermedad, prolongándose así la necesidad de observación en el hospital hasta la fase de recuperación. Durante la epidemia de 2013 en el Hospital General Pediátrico “Niños de Acosta Ñu” (HGP) se disminuyó la edad de ingreso por grupo de riesgo de dos años a un año de edad, realizándose un seguimiento estricto a los restantes. Por lo tanto todos los pacientes menores de un año con diagnóstico de Dengue fueron hospitalizados.
La incidencia de fiebre dengue en lactantes ha aumentado con respecto a años anteriores, y se observaron cambios en la distribución etaria(2). Identificar al grupo etario con riesgo de desarrollar Dengue Grave dentro del grupo de lactantes de manera a optimizar recursos evitando hospitalizaciones innecesarias representa un verdadero desafío.
El objetivo del presente trabajo es determinar la incidencia de Dengue Grave en lactantes durante la epidemia del 2013, en un centro de atención terciaria.
MATERIALES Y MÉTODOS
Estudio de cohorte llevado a cabo en el Hospital General Pediátrico “Niños de Acosta Ñu” (HGP) durante la epidemia de Fiebre Dengue ocurrida entre enero a junio del 2013.
Para definición de casos fueron incluidos todos los niños hospitalizados con edad comprendida entre 1 semana y 12 meses, con diagnóstico de Fiebre Dengue como grupo etario de riesgo, sin signos de alarma, de acuerdo a las Guías de la Organización Mundial de la Salud (OMS) y la Organización Panamericana de la Salud (OPS)(3-5).
Todos los casos fueron confirmados por serología. Se utilizó el test de Elisa, detección de antígeno NS1 y PCR (reacción en cadena de la polimerasa convencional en tiempo real). Se excluyeron los pacientes ingresados con diagnóstico de Dengue Grave (Shock por extravasación de plasma, acumulación de fluidos en pulmón y disnea, sangrado grave, daño orgánico grave), casos confirmados de transmisión vertical, pacientes con comorbilidades tales como: cardiopatías congénitas, fibrosis quística, trisomía 21, broncodisplasia, nacimiento de pretérmino y menos de 2000 gr de peso de nacimiento.
Los datos fueron recolectados mediante un formato estandarizado confeccionado para éste fin, siguiendo el protocolo de manejo recomendado por la OMS y las Guías Nacionales de Manejo de Fiebre Dengue(3-5). La información fue recabada por un investigador desde el momento de la hospitalización hasta el alta médica. Fueron consignados los datos de filiación (edad, género, procedencia), signos y síntomas presentados tanto al ingreso como durante la hospitalización (exantema, dolor abdominal, vómitos, diarrea, rechazo alimentario, sangrado de mucosas, signos de shock, presencia de signos de alarma, presencia de leucopenia, plaquetopenia, hemoconcentración, niveles de transaminasas, dosaje de albúmina sérica, días de estancia hospitalaria, días de enfermedad cursado al ingreso, días totales de fiebre). Los días 3, 5, 6 y 7 de enfermedad, se tomaron muestras de sangre 1 ml en tubos con EDTA y 2 ml en tubos secos, fueron centrifugadas y conservadas para detección de recuento de glóbulos blancos, plaquetas, hematocrito, transaminasas y dosaje de albúmina sérica.
La presencia de efusión pleural y ascitis fue confirmada por Ecografía pleural y abdominal y/o radiografías de tórax en los pacientes con sospecha de fuga capilar.
Datos inherentes a la terapéutica aplicada fueron recolectados tales como: utilización de fluidos de mantenimiento, necesidad de expansiones o bolos con cristaloides y/o coloides, transfusión de hemoderivados y uso de drogas vasoactivas.
Se registraron los diagnósticos tanto al momento de la hospitalización como al alta médica (Dengue, Dengue con signos de alarma o Dengue Grave). Para el diagnóstico final y cierre de casos cada historia clínica fue analizada por otro grupo de investigadores aplicando los criterios de la OMS para definición de casos. La cohorte se extendió desde el ingreso hospitalario hasta el día del alta médica.
Definición de variables
Se utilizaron las Guías 2009 de la OMS y 2010 de la OPS para la clasificación de los pacientes en Fiebre Dengue, Dengue con signos de alarma y Dengue Grave. El comienzo de la enfermedad fue el día de inicio de la fiebre.
La Leucopenia fue definida como un recuento de glóbulos blancos menor a 5x10³/mm³, plaquetopenia como recuento de plaquetas menor a 100x10³/mm³, hemoconcentración fue definida como elevación del hematocrito basal ≥ 20%. El hematocrito basal fue determinado por el adecuado para la edad del niño y/o el valor más estable mantenido durante el seguimiento.
Los niveles de transaminasas aspartato aminotransferasa (AST) y alanina aminotransferasa (ALAT) fueron considerados elevados cuando duplicaban sus valores de referencia (45-50 Ul/L respectivamente).
Fuga capilar y/o extravasación plasmática fue definida como la presencia de líquido libre en cavidad abdominal, pleural y/o edemas no atribuibles a sobrecarga de aporte de fluidos). Hipoalbuminemia fue considerada como dosaje menor a 3 gr/dl.
Los criterios para expansiones o bolos con cristaloides fueron: el dolor abdominal y la presencia de signos de shock.
Para el análisis de los datos se utilizó el programa epi Info 2007 versión 3.4.3 para confeccionar la base de datos y para el análisis de los mismos tanto el epi Info 2007 como el programa SPSS versión 11.5. Se utilizó la incidencia acumulada usando proporciones. La relación entre variables cualitativas se realizó por la prueba de chi cuadrado. Los resultados de riesgo de Dengue Grave se expresaron como riesgo relativo (RR). La comparación de las variables cuantitativas se hizo de acuerdo a la distribución, la prueba t student para dos grupos con distribuciones homogéneas y en caso contrario la prueba de Mann Whitney Wilcoxon. Se consideró significativa una p < 0.05.
Consideraciones éticas: Los autores declaramos que no existieron conflictos de intereses para la realización del presente estudio. El mismo fue aprobado el comité de ética institucional.
RESULTADOS
Durante el periodo de estudio, 63 niños menores de 1 año de edad fueron ingresados con diagnóstico confirmado de Fiebre Dengue, 2 pacientes fueron excluidos por transmisión vertical y otro niño con Dengue Grave al ingreso (Figura 1).
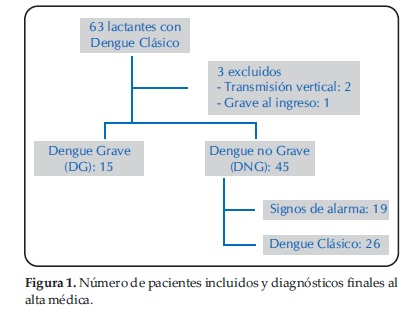
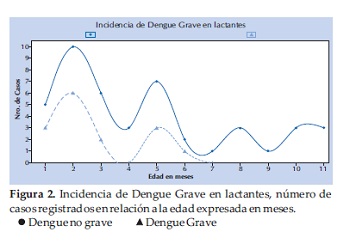
En el estudio fueron incluidos 60 lactantes, 82% fueron niños menores de 6 meses de edad. 15 (25%) evolucionaron a DG, 3 presentaron shock sin fuga capilar, 11 shock con fuga capilar, un lactante fue diagnosticado de miocarditis y otro tuvo hepatitis. Todos los niños que evolucionaron a DG tenían ≤ 6 meses de edad (RR= 1.4 IC 1.2 – 1.4p = 0,02) (Figura 2). No hubo diferencias significativas en cuanto a género y procedencia.
Durante la hospitalización 34 (56,6%) desarrollaron signos de alarma, 15 (25%) de ellos clasificaron como DG, 19 (31,6%) fueron dados de alta con diagnóstico de DSA. Todos los niños que presentaron formas graves tuvieron algún signo de alarma (RR=1.8 IC 1.3- 2.4 p < 0.001). Ingresaron y fueron dados de alta como Dengue Clásico (grupo B1), 26 (43,3%) niños (Figura 1).
Los lactantes que desarrollaron DG tuvieron una estancia hospitalaria más prolongada (6.6 ± 1.8 días versus 4.8 ± 1.7 p: 0.001). Los pacientes fueron hospitalizados durante la fase febril entre el primer y segundo día de enfermedad (DG: 2.6 ±1.3 días versus DNG: 2.1±1.2 p: 0.14). No existieron diferencias significativas al comparar días totales de fiebre (2.6 ±1.3 versus 2.1 ±1.2 p: 0.14).
La fuga capilar se produjo entre el día 4-5 de enfermedad (media 4.6 DS ±0.7). Los niños que evolucionaron a DG tuvieron más signos de shock temprano (66.7% versus 18.2% RR= 1.9 IC= 1.1 – 3.3 p <0.001). No hubo diferencias al comparar otros signos y síntomas durante el seguimiento entre los grupos DG y DNG (Tabla 1).
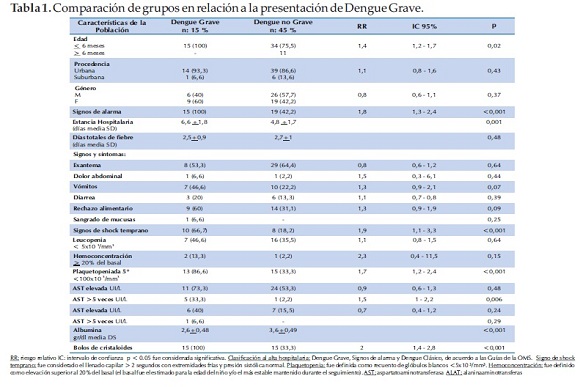
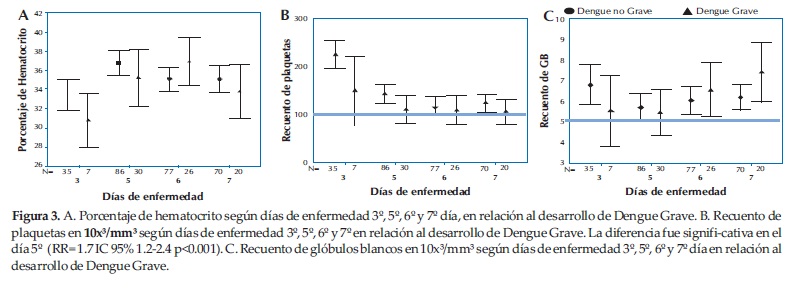
En relación a los datos laboratoriales, los lactantes que desarrollaron DG tuvieron más plaquetopenia en relación al grupo DNG (86.6% versus 33.3% RR= 1.7 IC= 1.2- 2.4 p < 0.001). Esta fue significativa en el día 5º de enfermedad, no existieron diferencias entre los grupos en los días 3, 6 y 7 de enfermedad. Niveles de AST más elevados (33.3 % versus 2.2 % RR= 1.5 IC= 1 – 2.2 p = 0.006) y presentaron con mayor frecuencia hipoalbuminemia (2.6 ±0.48 versus 3.6 ±0.49 p <0.001). Sólo un niño tuvo dosaje de ALAT superior a 900 UI/L. No hubo diferencias en el recuento de glóbulos blancos y hemoconcentración en los días 3, 5, 6 y 7 de enfermedad entre ambos grupos (Figura 3).
En relación al manejo terapéutico, el grupo DG requirió más expansiones con solución cristaloide (100% versus 33.3% RR= 2 IC= 1.4 - 2.8 p <0.001), éstas fueron administradas en casos de signos de shock, dolor abdominal y/o hemoconcentración coincidente con plaquetopenia; recibieron más frecuentemente hidratación parenteral (93.3% versus 46.5% RR= 1.6 IC= 1.2 - 2.1 p= 0.001), soporte vasoactivo y transfusiones con hemoderivados. Dos niños requirieron inotrópicos por shock refractario a fluidos, uno de ellos fue diagnósticado de miocarditis y otro presentó shock hipotensivo sin fuga capilar. Un solo niño recibió expansión con coloides (albúmina), 2 (3.3%) necesitaron transfusiones de hemoderivados (glóbulos rojos concentrados). Ingresaron a cuidados intensivos 8 (13.3%) de los lactantes que desarrollaron DG.
Los pacientes en quienes se constató extravasación plasmática tuvieron ascitis (mediana 45 rango 15-400 ml) y efusión pleural (mediana 26 ml rango 6-118 ml) mínima. Sólo un paciente tuvo 400 ml de líquido en cavidad peritoneal y 118 ml de derrame pleural.
DISCUSIÓN
Las regiones del Sudeste Asiático (Tailandia, Vietnam e India), fueron los primeros en reportar casos de Fiebre Hemorrágica por Dengue en niños pequeños(10). Uno de los países con mayor número de casos en la región de las Américas es Brasil, con circulación de cuatro serotipos, y una población altamente sensibilizada. La epidemia de mayor impacto en el Brasil ocurrió en el 2007, año en que la proporción de casos de Dengue Grave se duplicó y la población predominante fue la menor de 15 años de edad, con un incremento en la incidencia en lactantes menores de 1 año de edad, 210.7/100.000 habitantes(11,12).
En nuestra casuística la incidencia de Dengue Grave fue del 25% y todos los casos se presentaron en niños menores de 6 meses de edad. Quienes además tuvieron más shock con extravasación mínima, necesidad de bolos de cristaloides, plaquetopenia y alteración de enzimas hepáticas.
Está demostrado que las infecciones secundarias aumentan las probabilidades de desarrollar Dengue Grave en niños mayores y adultos. No obstante los lactantes pueden presentar enfermedad severa durante la primoinfección (13,14).
La hipótesis de la persistencia de anticuerpos maternos IgG subneutralizantes para el virus del dengue provenientes de madres sensibilizadas previamente, se ha postulado en la patogénesis de enfermedad severa en niños pequeños por el efecto ADE (antibody-dependentenhancement)(6-9). Varios estudios afirman que los anticuerpos maternos son detectados en menos del 50% de los lactantes menores de 6 meses de edad y que son prácticamente indetectables al cumplir éstos 12 meses de edad(15-17). En la muestra estudiada 8 niños tuvieron serología positiva IgM e IgG. Estos lactantes tenían edades menor o igual a 6 meses y desarrollaron DG.
En regiones de endemicidad de la enfermedad han establecido que el pico de incidencia de dengue grave ocurre entre el 6º y 8º mes de vida, cuando el niño adquiere la infección primaria(9). En una cohorte prospectiva en Filipinas, durante 3 años incluyeron 353 niños menores de 1 año y determinaron una incidencia de Dengue Grave de 0.5/1000 habitantes con un pico entre los 3-8 meses de edad (mediana: 5,7). No reportaron casos de DG en niños mayores de 9 meses de edad(18).
Otros autores han demostrado que los primeros meses de edad constituyen un factor de riesgo para enfermedad severa(19).
En un estudio multicéntrico realizado en Nicaragua(19), donde compararon características clínicas en pacientes con Fiebre Dengue según grupo etario, los autores también observaron que los lactantes tuvieron más shock y extravasación plasmática con respecto a niños mayores y adultos. La edad de riesgo para enfermedad severa fue entre 4 a 9 meses. Según otra publicación en niños tailandeses, los lactantes tuvieron más plaquetopenia, coriza, convulsiones, rash y petequias. Y los escolares más shock y enfermedad secundaria que los pequeños(20).
Contrario a lo observado en niños mayores (shock con extravasación masiva), en nuestra casuística los lactantes que evolucionaron a formas graves de la enfermedad, presentaron signos de hipoperfusión marcada con fuga capilar mínima o nula. La hipótesis de la respuesta inmunológica innata del lactante con alta producción de citoquinas, podría explicar éste fenómeno observado (12,21-23).
Pese a hospitalizar sólo niños menores de 1 año de edad, captados entre el primer y segundo día de fiebre mediante determinación de NS1, la estancia hospitalaria se prolongó hasta la fase de recuperación. Esto ocasionó una importante ocupación de camas por niños con enfermedad leve por el sólo hecho de representar un grupo etario de riesgo. Sólo 11 lactantes de la cohorte estudiada tenían más de 6 meses de edad. Los niños menores de 6 meses estuvieron más enfermos y tuvieron mayor necesidad de hospitalización y de éstos casi la tercera parte desarrolló dengue grave.
En las Américas la incidencia de Dengue Grave tiene un comportamiento bimodal, afectando a niños menores de 1 año de edad, escolares entre 5 a 9 años y adultos jóvenes (2,12,19,24). El grupo etario entre 1-4 años al parecer sería el menos susceptible de evolucionar a formas severas de la enfermedad.
Este estudio es un análisis preliminar de una cohorte de lactantes menores con dengue y muchos de los análisis estadísticos no tienen significancia por el escaso número de pacientes. Hemos visto una tendencia de mayor riesgo de enfermedad en los menores con edad igual o menor a 6 meses.
Actualmente se está desarrollando un protocolo de cohorte prospectiva para determinar la edad de incidencia de dengue grave en lactantes en el Hospital General Pediátrico “Niños de Acosta Ñu”.
REFERENCIAS
1. Ministerio de Salud Pública y Bienestar Social. Historia del Dengue en Paraguay. Asunción: Ministerio de Salud Púbica y Bienestar Social; 2012 (citado 2013 abr 20). Disponible en: http://www.vigisalud.gov.py/index.php?option=com_content&view=article&id=445&catid=85&Itemid=151 [ Links ]
2. Ministerio de Salud Pública y Bienestar Social. Dirección de Vigilancia de la Salud. Asunción: DGVS-MSPBS (actualizado 2013 abr 20; citado 2013 abr 20). Disponible en: http://www.vigisalud.gov.py/ [ Links ]
3. World Health Organization. Global alert and response (GAR): impact of dengue. WHO; 2013 (citado 2013 Abr 20). Disponible en: http:// www.who.int/csr/disease/dengue/impact/en/index.html [ Links ]
4. Organización Panamericana de la Salud. Actualización sobre la situación regional del dengue (17 marzo 2009): situación del dengue en las Américas, 2008. OPS; 2009 Mar (citado 2014 Abr 2). Disponible en: http://www.who.int/topics/dengue/dengue_report_10_2009_es.pdf [ Links ]
5. Ministerio de Salud Pública y Bienestar Social. Dengue guía de manejo clínico. Asunción: Ministerio de Salud Pública y Bienestar Social; 2012. [ Links ]
6. Simmons CP, Chau TN, Thuy TT, Tuan NM, Hoang DM, Thien NT, Lien le B, Quy N, Hieu NT, Hien TT, McElnea C, Young P, Whitehead S, Hung NT, Farrar J. Maternal antibody and viral factors in the pathogenesis of dengue virus in infants. J Infect Dis. 2007;196:416-24. [ Links ]
7. Halstead SB, Lan NT, Myint T, Shwe TN, Nisalak A, Kalyanarooj S, Nimmannitya S, Soegijanto S, Vaughn DW, Endy TP. Dengue hemorrhagic fever in infants: research opportunities ignored. Emerg Infect Dis. 2002;8:1474-79. [ Links ]
8. Chau TN, Hieu NT, Anders KL, Wolbers M, Lien le B, Hieu LT, Hien TT, Hung NT, Farrar J, Whitehead S, Simmons CP. Dengue virus infections and maternal antibody decay in a pro-spective birth cohort study of Vietnamese infants. J Infect Dis. 2009:15(12):1893-1900. [ Links ]
9. van Panhuis W, Luxemburger C, Pengsaa K, Limkittikul K, Sabchareon A, Lang J, Durbin AP, Cummings DA. Decay and persistence of maternal dengue antibodies among infants in Bangkok. Am J Trop Med Hyg. 2011;85(2):355-62. [ Links ]
10. Halstead SB. Dengue in the Americas and Southeast Asia: do they differ? Rev Panam Salud Publica. 2006;20:407-15. [ Links ]
11. Teixeira MG, Costa MC, Coelho G, Barreto ML. Recent shift in age pattern of dengue hemorrhagic fever, Brazil. Emerg Infect Dis. 2008;14(10):1663. [ Links ]
12. Da Rocha L, Tauil PL. Dengue em criança: aspectos clínicos e epidemiológicos, Manaus, Estado do Amazonas, no período de 2006 e 2007. Revista da Sociedade Brasileira de Medicina Tropical. 2009;42(1):18-22. [ Links ]
13. Libraty DH, Acosta LP, Tallo V, Segubre-Mercado E, Bautista A, Potts JA, Jarman RG, Yoon IK, Gibbons RV, Brion JD, Capeding RZ. A prospective nested case-control study of Dengue in infants: rethinking and refining the antibody-dependent enhance-ment dengue hemorrhagic fever model. PLoS Med. 2009;6: e1000171. [ Links ]
14. Mongkolsapaya J, Dejnirattisai W, Xu XN, Vasanawathana S, Tangthawornchaikul N, Chairunsri A, Sawasdivorn S, Duangchinda T, Dong T, Rowland-Jones S, Yenchitsomanus PT, McMichael A, MalasitP, Screaton G. Original anti-genic sin and apoptosis in the pathogenesis of dengue hemor-rhagicfeve. Nat Med. 2003;9:921-27. [ Links ]
15. van Panhuis W, Luxemburger C, Pengsaa K, Limkittikul K, Sabchareon A, Lang J, Durbin AP, Cummings DA. Decay and persistence of maternal dengue antibodies among infants in Bangkok. Am J Trop Med Hyg. 2011;85(2):355-62. [ Links ]
16. Watanaveeradej V, Endy TP, Samakoses R, Kerdpanich A, Simasathien S, Polprasert N, Aree C, Vaughn DW, Ho C, NisalakA. Transplacentally transferred maternal-infant antibod-ies to dengue virus. Am J Trop Med Hyg. 2003;69:123-28. [ Links ]
17. Pengsaa K, Luxemburger C, Sabchareon A, Limkittikul K, Yoksan S, Chambonneau L, Chaovarind U, Sirivichayakul C, Lapphra K, Chanthavanich P, Lang J. Dengue virus infections in the first 2 years of life and the kinetics of transplacentally trans-ferred dengue neutralizing antibodies in thai children. J Infect Dis. 2006;194:1570-76. [ Links ]
18. Capeding RZ, Brion JD, Caponpon MM, Gibbons RV, Jarman RG, Yoon IK, Libraty DH. The incidence, characteristics, and presentation of dengue virus infections during infancy. Am J Trop Med Hyg. 2010;82:330-36. [ Links ]
19. Hammond S, Balmaseda A, Pérez L, Tellez Y, Saborío SI, Mercado JC, Videa E, Rodriguez Y, Pérez MA, Cuadra R, Solano S, Rocha J, Idiaquez W, Gonzalez A, Harris E. Differences in dengue severity in infants, children, and adults in a 3-year hospital-bases study in Nicaragua. Am J Trop Med Hyg. 2005;73(6):1063-1070. [ Links ]
20. Witayathawornwong P. DHF in infants, late infants and older children: a comparative study. Southeast Asian J Trop Med Public Health. 2005;36 (4):896-900. [ Links ]
21. Chau TN, Quyen NT, Thuy TT, Tuan NM, Hoang DM, Dung NT, Lien le B, Quy NT, Hieu NT, Hieu LT, Hien TT, Hung NT, Farrar J, Simmons CP. Dengue in Vietnamese infants-results of infection-enhancement assays correlate with age-related disease epidemiology, and cellular immune responses correlate with disease severity. J Infect Dis 2008;198:516-24. [ Links ]
22. Green S, Vaughn DW, Kalayanarooj S, Nimmannitya S, Suntayakorn S, Nisalak A, Lew R, Innis BL, Kurane I, Rothman AL, Ennis FA. Early immune activation inacute dengue illness is related to development of plasma leakage and disease severity. J Infect Dis 1999;179:755-62. [ Links ]
23. Green S, Pichyangkul S, Vaughn DW, Kalayanarooj S, Nimmannitya S, Nisalak A, Kurane I, Rothman AL, Ennis FA. Early CD69 expression onperipheral blood lymphocytes from children with dengue hemorrhagic fever. J Infect Dis 1999;180(5):1429-35. [ Links ]
24. Hubert B, Halstead SB. Dengue 1 virus and dengue hemorrhagic fever, French Polynesia, 2001. Emerg Infect Dis. 2009;15:1265-1270. [ Links ]













