Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.41 no.3 Asunción Dec. 2014
ARTÍCULO ORIGINAL
Prescripción de Medicaciones no aprobadas (off label y sin licencia) en Recién Nacidos hospitalizados. Estudio multicéntrico en cinco hospitales de Asunción y Gran Asunción
Prescription of Off-label and Unlicensed Drugs in Hospitalized Newborns: a Multicenter Study in Five Hospitals in Greater Asuncion, Paraguay
Mirta Mesquita(1), Gladys Godoy(2), Maria Stella Cabral(3), Rosa Zavala(4), Edgar Espínola(5), Larissa Genes(6)
1. Hospital General Pediátrico Niños de Acosta Ñú, Ministerio de Salud Pública y Bienestar Social. Paraguay.
2. Hospital Nacional Itaugua, Ministerio de Salud Pública y Bienestar Social. Paraguay.
3. Departamento de Investigaciones, Ministerio de Salud Pública y Bienestar Social. Paraguay.
4. Hospital Materno Infantil Reina Sofía, Cruz Roja Paraguaya. Asunción, Paraguay.
5. Hospital Central del Instituto de Previsión Social. Asunción, Paraguay.
6. Hospital Materno Infantil San Pablo, Ministerio de Salud Pública y Bienestar Social. Paraguay.
Correspondencia: Dra. Mirta Mesquita. E-mail: mirtanmr@gmail.com
Recibido: 01/04/2014; Aceptado: 02/09/2014.
RESUMEN
Introducción: La falta de suficientes estudios clínicos sobre la eficacia y seguridad de las medicaciones en la población neonatal, conduce a la utilización de alternativas con medicaciones no aprobadas. Objetivos: Determinar la prevalencia de la utilización de medicaciones no aprobadas por la Food and Drug Administration (EEUU) en los neonatos hospitalizados en diferentes niveles de atención de cinco hospitales de Asunción y Gran Asunción. Metodología: Estudio observacional, descriptivo con componente analítico, transversal. Se incluyeron recién nacidos de las salas de terapia intensiva, intermedia y cuidados mínimos de cinco hospitales. Variables: Peso de nacimiento, edad gestacional, sexo, vía del parto, edad postnatal al ingreso al estudio, sala de internación, asistencia respiratoria mecánica y tipo y número de medicaciones no aprobadas (MNA) por paciente en el momento de llenarse el cuestionario. Los datos fueron cargados y analizados en SPSS 17 y se expresaron en proporciones y medias. Se utilizó la prueba de chi cuadrado y se consideró un error alfa del 5%. Resultados: Se analizaron 105 pacientes con edad postnatal al ingreso al estudio de 12±8 días y 11±8 días de hospitalización. Recibieron MNA 41 neonatos (39%) con 92 prescripciones no autorizadas, en mayor proporción en la unidad de terapia intensiva (49%), con respecto a las salas de los otros niveles (p=0,01). El número de MNA por neonato fue de 2,29±1,7 (rango1 a 8). Las MNA más frecuentemente utilizadas fueron antibióticos (42%), omeprazol y ranitidina (11%) y los corticoides (9%). Conclusiones: La prevalencia de utilización de medicaciones no aprobadas fue elevada y se demostró asociación con el uso de asistencia respiratoria mecánica y presencia de infecciones.
Palabras clave: Neonatos, Medicaciones off label, medicaciones sin licencia (unlicensed).
ABSTRACT
Introduction: The scarcity of clinical studies on the efficacy and safety of medications in newborns leads to the use of alternative treatment using unapproved drugs. Objectives: To determine the prevalence of the use of drugs not approved by the U.S. Food and Drug Administration in newborns hospitalized at care facilities of various levels in Asuncion and Greater Asuncion. Methodology: We conducted a cross-sectional observational and descriptive study with an analytic component. Included were newborns in intensive care, intermediate care, and minimal care wards of five hospitals. Variables were birth weight, gestational age, gender, route of delivery, postnatal age on inclusion in the study, ward in which hospitalized, mechanically assisted ventilation, and type and number of unapproved drugs (UD) administered to each patient at the time of completing the questionnaire. The data were entered and analyzed using SPSS 17 and expressed as proportions and means. The Chi squared test was used and an Alpha error deemed as 5%. Results: We analyzed 105 patients aged 12±8 days upon inclusion in the study and with 11±8 days of hospitalization. UD were administered to 41 newborns (39%), comprising 92 prescriptions, most commonly (49%) in intensive care wards (p=0.01) compared to other care-level wards. The number of UD administered per newborn was 2.29±1.7 (range: 1-8). The UD most commonly used were antibiotics (42%), omeprazol and ranitidine (11%), and corticosteroids (9%). Conclusions: The prevalence of use of unapproved medications was high and demonstrated association with mechanically assisted ventilation and diagnosis of infection.
Keywords: Newborn, neonate, unlicensed drugs, unapproved drugs, off-label use.
INTRODUCCIÓN
La seguridad del paciente es un factor esencial de la calidad de la asistencia en salud y constituye una de las actividades más complejas en medicina. Comprende acciones y decisiones que deben tomar médicos, enfermeras, farmacéuticos y el propio paciente y sus familiares(1). Un aspecto fundamental de la seguridad del paciente hospitalizado es la administración de medicamentos, herramienta terapéutica que debe ser utilizada con criterios científicos y técnicos. La prescripción médica, acto muy personal del médico, para que sea realizado con responsabilidad, requiere de conocimientos, experiencia profesional y actitud ética. Antes de prescribir un medicamento el médico debe tener elaborada una estrategia de tratamiento, acto que implica un ejercicio intelectual, orientado a lograr el bienestar del paciente (principio de beneficencia)(2).
La seguridad en la administración de medicamentos adquiere particular importancia en los pacientes pediátricos, debido a que la mayoría de los mismos fueron estudiados y probados en la población adulta; y muchas veces las dosis de adultos simplemente se extrapolan a la población pediátrica, con todos los riesgos que implica(3). Estas medicaciones no aprobadas se clasifican en medicaciones o drogas utilizadas sin licencia (unlicensed) aquellas no autorizadas para su uso en pediatría o neonatología, y drogas utilizadas fuera de etiqueta (off label) las drogas cuyas dosis, intervalos, indicaciones, no fueron aprobados para el grupo etario o enfermedad en la que se la utiliza. En este estudio las reunimos como medicaciones no aprobadas (MNA).
Dentro del grupo pediátrico, los neonatos son especialmente sensibles a la administración de medicaciones, porque los cálculos se realizan no solo considerando el peso corporal sino también en función de la edad gestacional y la edad post natal. El grado de madurez de los sistemas metabólicos y de excreción de las drogas, contenido de agua corporal y uniones proteicas, varía en torno a esas variables. Consecuentemente son las unidades de internación neonatal y especialmente el área de cuidados intensivos, con gran porcentaje de prematuros y recién nacidos de término muy enfermos, los más expuestos a la utilización de medicaciones que no fueron suficientemente estudiadas(4,5). Las reacciones adversas a los medicamentos se observa en el 23 al 60% cuando se utiliza MNA(6).
El año 2007 la OMS lanzó la lista de medicamentos esenciales para uso pediátrico (niños hasta 12 años de edad(7). Considerando la magnitud del problema de administración de medicamentos, la OMS estableció las Guías de Reporte de Eventos Adversos e implementó estrategias para mejorar su utilización. Para el efecto definió como uso racional de medicamentos, si los pacientes reciben la medicación adecuada a sus necesidades clínicas, en la dosis correcta, durante un período de tiempo adecuado y al menor costo posible(8,9).
En nuestro país, los hospitales en general, no cuentan con secciones de vigilancia activa del uso racional de medicamentos tal como monitorización de los eventos adversos, a pesar de que el Ministerio de Salud Publica y Bienestar Social (MSPyBS) tiene un Departamento de Farmacovigilancia que cuenta con una hoja de reporte de eventos adversos. Hasta donde sabemos no existe una publicación sobre los reportes.
Esta investigación, se enmarca dentro del Sistema Nacional de Investigación para la salud, coordinada por el MSPyBS y consensuado con otras instituciones como el Consejo Nacional de Ciencias y Tecnología (Conacyt), el Instituto Nacional de Salud, la Universidad Nacional de Asunción entre otras. El concepto de investigación para la salud cubre toda investigación que se oriente a mejorar el estado de salud de la población ya sea biomédica, social o clínica. Es muy importante que cada país conozca el estado de utilización de las drogas en la población en general y en la pediátrica y neonatal en particular, orientado no solo a la seguridad del paciente sino a darle un marco legal. El objetivo del presente estudio es conocer la prevalencia del uso de medicaciones no aprobadas en cinco hospitales, públicos y de la seguridad social de Asunción y gran Asunción, que concentran el mayor número de partos al año.
METODOLOGÍA
Estudio observacional descriptivo con componente analítico de corte transverso, temporalmente prolectivo. Se incluyeron recién nacidos (edad postnatal comprendida entre 0 y 28 días cumplidos), hospitalizados en salas de terapia intensiva neonatal (UCIN), cuidados intermedios (CIM) y cuidados mínimos (CM) de dos hospitales generales, dos materno infantiles y sala de terapia intensiva pediátrica polivalente de un hospital pediátrico. Se excluyeron aquellos pacientes hospitalizados en las unidades neonatales, cuyas hojas de datos no fueron llenadas correctamente. Las variables estudiadas fueron peso de nacimiento, edad gestacional, sexo, vía del parto, edad postnatal al ingreso al estudio, sala de internación en el momento de la toma de datos, asistencia respiratoria mecánica (ARM) y tipo y numero de medicaciones que recibía cada paciente en el momento de llenarse el cuestionario. Se consideraron medicaciones no aprobadas (MNA) tanto las medicaciones sin licencia (unlicensed) así como las utilizadas fuera de etiqueta (off label) en neonatos de acuerdo a la FDA (Food and Drug Administration) de los EEUU.
Los datos se consignaron en una hoja elaborada para el efecto y fueron recogidos en cada hospital participante bajo la supervisión de un coordinador, seleccionado en forma aleatoria los días de la semana, en 3 tomas separadas por 2 semanas en algunos casos y 3 semanas en otros durante los meses de marzo, abril y mayo del año 2013. Considerando que la proporción de medicaciones no aprobadas en un estudio similar en la región fue del 50%, para un intervalo de confianza del 95% y un nivel de significación estadística de 0,05 se necesitaron 96 pacientes.
Los resultados fueron analizados con el paquete estadístico SPSS 17. Las variables continuas se expresaron en proporciones y medias y se analizaron de acuerdo a su distribución, con el T student aquellas homogéneas y por el test de Mann Whitney las de distribución anormal. El análisis de las variables cualitativas se realizó con la prueba de chi cuadrado y regresión logística múltiple para analizar asociaciones. Se consideró un error alfa del 5%. Para el cálculo de la p se utilizó el test de Yates o Fisher según lo ameritaban. El protocolo fue aprobado por el Comité Institucional de Investigación y Ética de Investigación del Hospital Pediátrico participante con el número de aprobación 0030.
RESULTADOS
Se recogieron datos de 112 pacientes que llenaron los criterios de inclusión. Se excluyeron siete, uno por error en la edad postnatal y seis por llenado irregular de la hoja de datos. Al ingreso al estudio la edad postnatal promedio fue de 11±8 días (IC 95% 9,4 – 12,5), el 38% tenían igual o menor a 7 días de vida en el momento de la recolección de datos, llevaban hospitalizados en promedio 10,7±8 días (IC 95% 9 – 12,2) y la edad gestacional promedio fue de 34,8±3,6 (IC 95% 34 – 35,5 semanas) (rango de 26 a 41 semanas). La distribución por peso de nacimiento, edad gestacional, sexo, tipo de parto y nivel de complejidad de atención de la población analizada se presentan en la tabla 1.
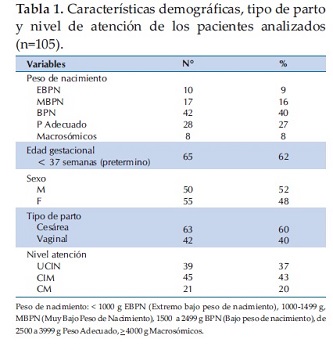
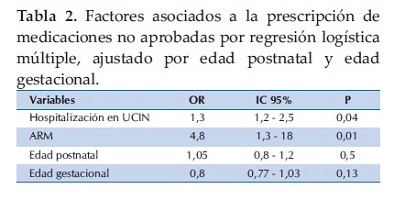
El 25% (26/105) se encontraba en asistencia respiratoria mecánica (ARM) y 39% (41/105) de los recién nacidos recibían medicaciones no aprobadas en el momento de la recolección de datos, con un total de 92 prescripciones, recibiendo cada paciente un promedio 2,3±1,7 medicaciones, (IC 95% 1,8 – 2,8) (rango1 a 8). En el análisis univariado la mayor prescripción de MNA se asoció a la hospitalización en la UCIN (p =0,01), la mayor edad postnatal (p=0,02), mayor día de hospitalización en el momento de la recolección de datos (p=0,03) y estar en ARM (p=0,01). No hubo diferencias en la edad gestacional y el peso de nacimiento. En el análisis multivariado por regresión logística la mayor prescripción de MNA se asoció a estar en ARM, OR = 4,8 (IC 95% 1,5 – 18), (p=0,01) y estancia en la UCIN OR =1,3 (IC95% 1,2 – 2,5) p=0,04 (Tabla 2).
En cuanto a la frecuencia de prescripciones de MNA (número de veces en que se ha utilizado MNA) por grupos de medicamentos, sobre un total de 92 prescripciones, el mayor porcentaje corresponde al grupo de los antibióticos, 42% (39/92), seguido del grupo de protectores gástricos, como ranitidina y omeprazol, con 11% (10/92) y en tercer lugar los corticoides, tanto por vía parenteral como en inhalación en un 9% (8/92). El resto de las MNA se encontraban por debajo de estas cifras (tabla 3).
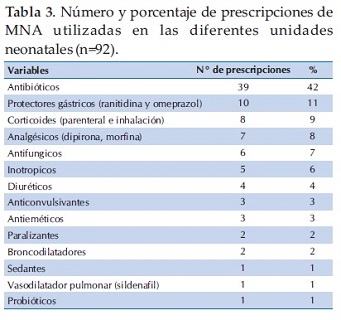
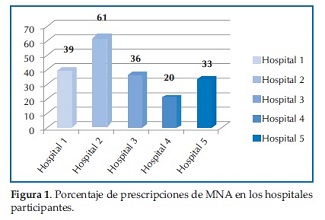
El porcentaje de utilización de MNA en los diferentes hospitales participantes fue similar excepto en uno, que mostró una frecuencia mucho más elevada (Figura 1). La frecuencia de prescripciones se mantuvo en forma similar cuando se analizó el porcentaje de prescripciones por grupos de medicamentos, en los diferentes hospitales participantes.
DISCUSIÓN
La prevalencia de MNA que encontramos en el presente estudio, si bien es elevada, es inferior a algunas cifras reportadas en otras publicaciones. En la unidades de cuidados intensivos neonatales (UCIN) la utilización de medicaciones sin licencia (unlicensed) y fuera de etiqueta (off label) está entre el 40 y el 80%. Los neonatos hospitalizados en las UCIN pueden llegar a recibir hasta 60 medicaciones parenterales durante la internación, particularmente aquellos que necesitan mayor estadía hospitalaria como los prematuros más pequeños(10).
En estudios realizados en Europa específicamente en Inglaterra sobre 70 recién nacidos encontraron una prevalencia de 65% de utilización de MNA en una población compuesta por un 70% de recién nacidos de pretermino de menos de 1500g de peso de nacimiento(11). Esta población es diferente a la nuestra, con un 62% de prematuros pero mucho más grandes, ya que la proporción de menores de 1500g fue del 25% (27 neonatos). Otro estudio similar, aunque con algunos pacientes de más de 28 días de vida, realizado en Francia con una población menor (n=40) que incluyó 88% de pretermino de los cuales 25% pesaron menos de 1000g al nacer, demostró una incidencia de prescripción de medicaciones no aprobadas del 73%(12). Este dato es preocupante ya que se trata de recién nacidos muy prematuros con marcada inmadurez de todos los sistemas principalmente los responsables del metabolismo y excreción de drogas. Datos muy similares se reportan en España con una incidencia de 63% de utilización de MNA en un grupo de 48 neonatos, la mayoría de pretermino (60%)(13). La distribución de peso de nacimiento fue bastante similar a la nuestra.
Ante la elevada incidencia de utilización de medicaciones no aprobadas tanto en la población pediátrica como neonatal en Europa, la Agencia Europea de Medicamentos (EMA) declaró la obligatoriedad de estudios clínicos controlados en la población pediátrica a la que está enfocado el producto antes de ser autorizado su ingreso al mercado, a partir del año 2007(14-16). Posterior a dicha declaración, un estudio multicéntrico italiano reciente sobre el uso de medicaciones con y sin licencia y fuera de etiqueta en la UCIN mostró un porcentaje muy inferior a los estudios europeos citados anteriormente. Así, solo el 11,4% de las medicaciones utilizadas no estaban aprobadas (unlicensed), con un rango de 1,9 a 27 % de acuerdo a las diferentes UCIN(17). Esto es un ejemplo que con medidas de control y basados en evidencias, los países más desarrollados han mejorado la seguridad en la prescripción de medicamentos en grupos vulnerables. Sin embargo, no ha sido posible evitar totalmente las prescripciones de MNA porque, ante un paciente gravemente enfermo, muchas veces no hay alternativas terapéuticas y se recurre al uso “piadoso” de medicaciones no bien estudiadas. Por otro lado son escasos los estudios bien diseñados, controlados y ciegos de los efectos de las drogas en neonatos especialmente en los de pretermino(18).
Sin embargo los países en vías de desarrollo aun presentan cifras elevadas de utilización de MNA, como lo demuestra un estudio reciente realizado en Turquía, en un estudio multicéntrico (con 17 unidades neonatales) y 464 recién nacidos, donde la prevalencia de utilización de MNA fue de 63%, cifras similares a los estudios europeos antes del 2007(19). Porcentajes similares (67%) fueron reportados en países con igual nivel de desarrollo de Europa del este(20).
Existen pocos estudios publicados en la región. Uno de los más importantes es el de Carvahlo y cols. en Brazil, quienes encontraron que el 79% de los neonatos en la UCIN recibieron medicaciones sin licencia (unlicensed) o fuera de etiqueta (offlabel) según la FDA, en un trabajo con diseño longitudinal (cohortes), de un grupo de pacientes de la UCIN exclusivamente, por tanto incluyeron solo a los más graves(21). En cambio el nuestro, por ser descriptivo transversal de prevalencia, hemos incluido pacientes en los diferentes niveles de atención y de gravedad, con porcentaje elevado de pacientes en cuidados intermedios, factores que pueden explicar la menor prevalencia encontrada.
En Argentina, un estudio recientemente publicado, realizado en un hospital de Córdoba, con el objetivo de analizar las drogas expedidas por el Departamento de Farmacia a la Unidad neonatal y determinar el porcentaje de drogas autorizadas por la Administración Nacional de Medicamentos, Alimentos y Tecnología de la Argentina (ANMAT), encontraron una prevalencia muy elevada de utilización de drogas no aprobadas (70%)(22).
La mayoría de la literatura consultada muestra una prevalencia superior a la que encontramos. Atribuimos esta diferencia no solo al diseño de nuestra investigación sino además a la población muy heterogénea que analizamos, con diferentes niveles de gravedad y escaso número de neonatos muy pequeños. En cambio tuvimos una proporción elevada de pacientes que recibían antibióticos, la mayoría por infecciones nosocomiales, en el momento de la recolección de datos, en prácticamente todos los hospitales participantes.
En general, como lo demuestran los estudios analizados, los pacientes mas graves son los que se exponen a recibir MNA. Nosotros encontramos asociación similar considerando que, ajustando por otras variables como el peso de nacimiento y la edad gestacional, la proporción de utilización de MNA fue mayor en la UCIN y en pacientes en ARM, que obviamente pertenecen al grupo de neonatos mas graves. Incluimos las salas de CIM y CM porque muchos pacientes que aun están recibiendo medicaciones se trasladan tempranamente a salas de menor complejidad por la alta demanda de unidades de cuidados intensivos neonatales en el país.
En cuanto al grupo de medicaciones los agentes antinfecciosos, principalmente los antibióticos están entre las MNA más utilizadas seguida de inhibidores de la secreción gástrica (ranitidina y omeprazol) y los corticoides en sus diferentes presentaciones (parenteral e inhalación). Estos resultados son muy similares a los encontrados en otros estudios que analizaron los grupos de medicaciones(18,20). Con respecto al uso de inhibidores de la secreción gástrica, el segundo medicamento off label más utilizado en nuestro estudio, hay reportes recientes de estudios observacionales que asocian la administración de ranitidina con el incremento de enterocolitis necrotizante y mortalidad en neonatos de MBPN(23).
Este estudio a pesar de la limitación del diseño, aporta datos inéditos en el país acerca de la utilización de medicaciones no aprobadas, en una población muy vulnerable como son los recién nacidos en las unidades neonatales con mayor número de pacientes de Asunción y Gran Asunción. Es posible que con un diseño de cohortes analizando la incidencia en cada nivel de atención las cifras pudieran variar.
En conclusión, la utilización de las MNA en hospitales que atienden neonatos de Asunción y Gran Asunción es elevada, y se asoció a la hospitalización en UCIN y la asistencia respiratoria mecánica.
Necesitamos crear conciencia en los neonatólogos sobre los riesgos que implica la utilización muy liberal de ciertas medicaciones, promover el monitoreo y control de las mismas desde un organismo especializado y en forma activa. No deberíamos agregar a nuestros neonatos, con riesgo elevado de mortalidad, (uno de las más elevadas de la región) a un riesgo adicional por el mal uso de las medicaciones.
REFERENCIAS
1. Organización Mundial de la Salud. Curso virtual de introducción a la investigación en seguridad del paciente [Internet]. OMS; 2012 [citado 2014 Jun]. [ Links ] Disponible en: http://www.who.int/patientsafety/research/curso_virtual/es/
2. Ministerio de Sanidad y Consumo, Secretaria General de Sanidad, Estrategia en Seguridad del paciente. Recomendaciones del taller de expertos celebrado el 8 y 9 de febrero del 2005 [Internet]. Andalucía, España: Ministerio de Sanidad y Consumo; 2005 [citado 2012 Abr]. [ Links ] Disponible en: http//www.msssi.gob.es/organización/sns/planCalidadSNS/pdf/excelencia/0psc_sp1.pdf
3. Pérez Rodríguez J. Errores médicos en pediatría y neonatología: un nuevo enfoque multidisciplinario es necesario. An Pediatr (Bar). 2006;64:327-29. [ Links ]
4. Warrier I, Du W, Natarajan G, Salari V, Aranda J. Patterns of drug utilization in a neonatal intensive care unit. J Clin Pharmacol. 2006;46:449-55. [ Links ]
5. Blake MJ, Castro L, Leeder JS, Kearns GL. Ontogeny of drug metabolizing enzymes in the neonate. Semin Fetal Neonatal Med. 2005;10:123-38. [ Links ]
6. Cuzzolin L, Atzei A, Fanos V. Off-label and unlicensed prescribing for newborns and children in different settings: a review of the literature and a consideration about drug safety. Expert Opin Drug Saf. 2006;5:703-18. [ Links ]
7. Organización Mundial de la Salud. Lista Modelo OMS de medicamentos pediátricos esenciales, 1ª lista, octubre de 2007 [Internet]. OMS; 2007 [citado 2011 Abr]. [ Links ] Disponible en: http://www.who.int/medicines/publications/essentialmedicines/en/index.html
8. World Alliance for Patien Safety. WHO draft guidelines for adverse event reporting and learning systems: from information to action. Geneva: World Health Organization; 2005. [ Links ]
9. World Health Organization. The pursuit of responsible use of medicines: sharing and learning from country experiences [Internet]. WHO; 2012 [citado 2013 Feb]. [ Links ] Disponible en: http://www.who.int/medicines/publications/responsible_use/en/
10. Dotta A, Braguglia A, Salvatori G. Pharmacological research in neonatology. J Matern Fetal Neonatal Med. 2011;24:44-6. [ Links ]
11. Conroy S, McIntyre J, Choonara I. Unlicensed and off label drug use in neonates. Arch Dis Child Fetal Neonatal Ed. 1999;80:F142-44. [ Links ]
12. Avenel S, Bomkratz A, Dassieu G, Janaud JC, Danan C. Incidence des prescriptions hors authorisation de mise sur le marché en réanimation néonatale. Arch Pédiatr. 2000;7:143-47. [ Links ]
13. López Martínez R, Cabañas Poy MJ, Oliveras Arenas M, Clemente Bautista S. Drug use in a neonatal ICU: a prospective study. Farm Hosp. 2005;29:26-29. [ Links ]
14. European Medicines Agency. Evidence of harm from off label or unlicensed medicines in children. EMA/11207/04 [Internet]. 2004 [Citado 2012 Abr]. [ Links ] Disponible en: www.ema.europa.eu
15. European Medicines Agency. Ethical consideration for clinical trials performed in children. EMA guidelines [Internet]. 2006 Octubre [citado 2012 Abr]. [ Links ] Disponible en: www.ema.europa.eu
16. European Medicines Agency. Report on survey of all paediatrics uses of medicinal products in Europe. EMA/794083/2009 [Internet]. 2009 [citado 2012 Abr] [ Links ] Disponible en: www.ema.europa.eu
17. Laforgia N, Nuccio MM, Schettini F, Dell'aera M, Gasbarro AR, Dell'erba A, Solarino B. Off-label and unlicensed drug use among neonatal intensive care units (NICUs) in Southern Italy. Pediatr Int [Internet]. 2013 [citado 13 Aug]. [ Links ] Disponible en: http://onlinelibrary.wiley.com/doi/10.1111/ped.12190/pdf
18. d'Aloja E, Paribello F, Demontis R, Müller M. Off-label drugs prescription in neonatology: a physician's duty or a medical hazardous attitude?. J Matern Fetal Neonatal Med. 2011;24 Suppl 1:99-100. [ Links ]
19. Oguz SS, Kanmaz HG, Dilmen U. Off-label and unlicensed drug use in neonatal intensive care units in Turkey: the old-inn study. Int J Clin Pharm. 2012;34:136-41. [ Links ]
20. Lass J, Käär R, Jõgi K, Varendi H, Metsvaht T, Lutsar I. Drug utilisation pattern and off-label use of medicines in Estonian neonatal units. Eur J Clin Pharmacol. 2011; 67:1263-71. [ Links ]
21. Carvalho CG, Ribeiro MR, Bonilha MM, Fernandes Jr M, Procianoy RS, Silveira RC. Use of off-label and unlicensed drugs in the neonatal intensive care unit and its association with severity scores. J Pediatr (Rio J). 2012;88:465-70. [ Links ]
22. Fungo MSM,Vega EM. Drugs dispensed a the division of neonatology at University Hospital Rio Cuarto Cordoba, Argentina. Arch Argent Pediatr. 2013;111:120-27. [ Links ]
23. Terrin G, Passariello A, De Curtis M, Manguso F, Salvia G, Lega L, Messina F, Paludetto R, Canani RB. Ranitidine is associated with infections, necrotizing enterocolitis, and fatal outcome in newborns. Pediatrics. 2012;129(1):e40-5. [ Links ] doi: 10.1542/peds














