Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Pediatría (Asunción)
On-line version ISSN 1683-9803
Pediatr. (Asunción) vol.33 no.1 Asunción July 2006
ARTICULO DE REVISION
Trastornos del equilibrio ácido-básico
Acid-base disturbances
Dr. Oscar Doldán Pérez
Médico de Planta del Servicio de Cardiocirugia del Instituto de Previsión Social. Jefe de la Unidad de Cuidados Intensivos Pediátricos del Sanatorio Migone. Asunción – Paraguay.
PERSPECTIVA HISTORICA
En la historia de los conocimientos ácido-básicos la observación clínica antecedió casi un siglo a los estudios fisiológicos y químicos. Fue W.B. O'Shaugnessy en 1831 quien observa y comunica al Lancet, durante la epidemia del cólera asiático, que en las deposiciones de los pacientes están presentes todas las sales que faltan en la sangre, especialmente el carbonato de sodio. Al desaparecer la epidemia de cólera esta comunicación pasó al olvido y recién a fines del siglo XIX y comienzos del siglo XX aparecen varias observaciones experimentales clínicas sobre la acidez intensa de la orina y el efecto beneficioso del bicarbonato sódico en las victimas del cólera, así como la excreción de amoniaco observada en diabéticos (1) ( Stadelman, 1883 ), o la hiperpnea intensa que se registraba en conejos con una intoxicación ácida fatal con ácido clorhídrico (Walter, 1877 ) (2).
Se denomina el periodo danés del conocimiento ácido-básico, a los 7 años transcurridos entre 1909 y 1916. Henderson, en 1909 publicó una monografía sobre el estado ácido básico y describió la famosa ecuación que lleva su nombre, Sorensen, en el mismo año implantó el símbolo logarítmico pH y desarrollo su significado en las reacciones enzimáticas, Hasselbalch en 1910 diseño el electrodo de hidrógeno con el que Lundsgaard en 1912 determinó por primera vez el pH de la sangre, Gammeltoft y Hasselbalch, en 1915 demostraron la influencia de la respiración sobre el pH de la sangre, siendo éste último, en 1916 el que dio forma logarítmica a la ecuación de Henderson. En 1920, W. Mansfield Clark publicó la primera edición de The Determination of Hydrogen Ions, cuya contribución a los avances teórico-prácticos del estado acido básico fue trascendental. Estos fueron los inicios del conocimiento en este campo que a partir de entonces hasta nuestros días se ha desarrollado en forma vertiginosa (3).
FISIOLOGIA
Existen 2 aspectos del equilibrio ácido-básico:
- RESPIRATORIO
- METABÓLICO
Cuando la concentración de bicarbonato (Hco3) experimenta una desviación importante, hay acidosis si se reduce y alcalosis si se incrementa, denominadas metabólicas (4).
Cuando la concentración de dióxido de carbono (Pco2) aumenta, se produce acidosis, y cuando se reduce alcalosis, llamadas respiratorias.
Acidosis y Alcalosis
La terminología utilizada ha originado muchas confusiones desde su creación, éstos términos deben usarse con criterio fisiológico para referirse a los disturbios que desvían el pH de la normalidad, siempre que NO se trate de alteraciones secundarias a un proceso etiológico primario, por ejemplo, si el factor etiológico primario es una diabetes descompensada con acumulación de ácidos, el pH descenderá presentándose una acidosis metabólica primaria; si en un intento por normalizar el trastorno la respuesta secundaria del organismo es la hiperventilación, al removerse el ácido carbónico se producirá una alcalosis respiratoria secundaria (5).
Se propuso el cambio de los términos por los de acidemia (pH inferior a 7,35) y alcalemia (pH superior a 7,45) pero el mismo fue desechado ya que el subfijo emia se refiere solo al pH plasmático, mientras que el subfijo osis refleja el compromiso de la homeostasis acidobásica que puede afectar o no al pH. Siempre que exista una acidemia, el trastorno primario es una acidosis
En condiciones normales, durante los procesos fisiológicos, que son fundamentalmente aeróbicos, el organismo produce 2 tipos de sustancias ácidas (6).
- Ácidos respiratorios: volátiles o débiles (ácido carbónico o H2Co3).
- Ácidos metabolicos: fuertes, son de mayor tamaño molecular y derivan normalmente del metabolismo intermedio de los aminoácidos cuyos productos terminales son urea e hidrogeniones, y de los lípidos e hidratos de carbono que tienen como elementos terminales co2 y agua. Los mismos son excretados por los riñones (7).
En condiciones anaerobias se produce el ácido láctico. El término metabólico es en realidad poco feliz ya que el dióxido de carbono es también un producto del metabolismo, sin embargo se ha considerado tradicionalmente que el ácido carbónico es un ácido respiratorio, mientras que cualquier otro ácido endógeno o exógeno es metabólico (8).
Sistemas tampones o amortiguadores
Para evitar los disturbios que se producen al alterarse el pH, el organismo dispone de los sistemas tampones, los cuales son elementos químicos que pueden encontrarse en:
A- El líquido extracelular:
1. El sistema bicarbonato-ácido carbónico:
- Es el principal protector del pH del compartimiento extracelular - Amortigua dentro del eritrocito, el CO2 producido por el metabolismo endógeno y contribuye al transporte de CO2 de los tejidos a los pulmones
- Proporciona sustrato para la secreción de ácidos del riñón (9),
Según las necesidades fisiológicas este sistema actúa en uno u otro sentido: Co2 + H2O « H2 Co3 « H + H Co32. Proteínas séricas que constituyen sistemas que actúan con rapidez para neutralizar los trastornos producidos por ácidos o bases fuertes.
B- Las células: proteínas intracelulares, fosfatos y hemoglobina, cuya función amortiguadora es mas lenta, requiriendo varias horas para cumplir su cometido (10).
A nivel celular también se realiza la amortiguación biológica: en la acidosis el exceso de H+ en el líquido extracelular difunde pasivamente hacia el interior de las células. Para mantener el equilibrio de cargas a través de las membranas, las células liberan potasio hacia la sangre; por cada 0,1 que se reduce el pH, el potasio aumenta alrededor de 0,6 mEq/L. Este efecto es más prominente en acidosis no orgánicas que en acidosis orgánicas y respiratorias En la alcalosis, ocurre el fenómeno inverso (11).
Mecanismos compensadores
Si los sistemas tampones no son suficientes para mantener el equilibrio ácido-básico, se ponen en marcha los mecanismos compensadores respiratorios, renales o biológicos.
La compensación respiratoria se inicia inmediatamente, gracias a una estimulación o inhibición directa del centro respiratorio ubicado en el tallo cerebral en respuesta a los niveles de Pco2, en relación directamente proporcional (12).
La compensación renal retarda más tiempo en su inicio de acción, y se implementa a nivel de las células tubulares, en donde se produce la síntesis de bicarbonato y la eliminación de hidrogeniones (H+), activada por la enzima anhidrasa carbónica. La eliminación de H+ puede registrarse en forma libre (pH urinario), ligada a fosfatos (acidez titulable) o ligada al amoniaco (amonio urinario) (Tabla 1).
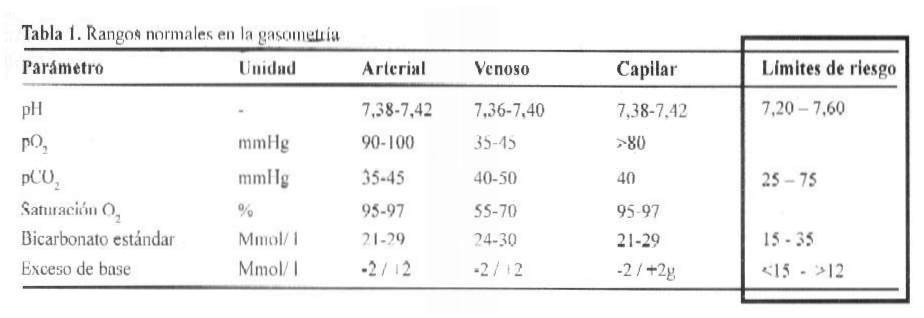
Los valores de gravedad ácido básicos con los siguientes:
pH: 7,20 – 7,60
PCO2: 25 – 75 mm Hg
Bicarbonato: 15 – 35 mEq/L
Exceso/déficit de base: -15 - +12 mEq/L
¿Que es el pH?
Es el logaritmo negativo de la concentración de hidrogeniones generados durante los procesos fisiológicos ya citados, por su calidad de cifra negativa se explica que el aumento de H+ derive en una disminución del pH y viceversa, y como se trata de un número logarítmico es preciso advertir que pequeños desplazamientos de 0,3 puntos aumentan o disminuyen al doble o a la mitad la cifra inicial (13).
La cifra 7,40 es el resultado de la siguiente ecuación de Henderson-Hasselbalch:
pH= Pk + log . Base/Acido
El Pk es el pH de una sustancia en solución disociada al 50%.
Pk de la sangre=6,1
pH= 6,1+ log. Bicarbonato/ Acido Carbónico
pH= 6,1 + log. 25,4/ 1,27 (20/1)
Ph= 6,1 + log.20
pH= 6,1 + 1,3 => 7,4
ACIDOSIS METABOLICA
Es el estado caracterizado por un exceso de ácidos o por una disminución de bases en el organismo (14).
Concepto de brecha aniónica
El hueco aniónico o Anion gap mide la diferencia entre los cationes y aniones no mensurados (Fig.1).
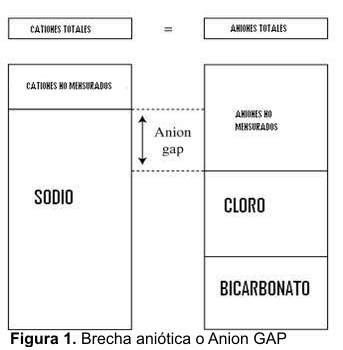
Se mide según la siguiente fórmula:
Sodio - (cloro + bicarbonato)
El valor normal es de 12 mEq/L., siendo fundamentalmente las proteínas de carga negativa y sobre todo la albúmina , la que contribuye en mayor medida a ésta cifra, ya que los demás iones se neutralizan entre si (Cationes: potasio, calcio, magnesio, etc. contra aniones: fosfato, sulfatos, ácidos orgánicos, etc.) en condiciones fisiológicas (15).
Cuando la brecha aniónica es elevada, 14 mEq/L. o mas, sugiere la presencia de acidosis metabólica normoclorémica , debiéndose buscar aniones endógenos no registrados como lactatos, cetonas, etc., o ácidos exógenos como sucede en la intoxicación con etilenglicol, con sus correspondientes implicancias terapéuticas (15).
La brecha aniónica puede elevarse también por reducción de las concentraciones séricas de potasio, calcio, magnesio o el aumento de las proteínas.
Una acidosis metabólica con una brecha aniónica normal sugiere pérdida de bicarbonat o , ya sea por vía digestiva o renal.
La reducción del hueco aniónico sugiere hipoalbuminemia, aumento de la concentración sérica de potasio, calcio, magnesio, intoxicación por bromuros o error de laboratorio (15).
Etiología
Acidosis metabólica con brecha aniónica normal (hiperclorémica)
A- Pérdida extra-renal de bicarbonato
1- Diarrea
2- Fistula de drenaje intestinal, pancreática o biliar
3- Ureterosigmoideostomía
4- Drogas: a) Cloruro de calcio
b) Sulfato de magnesio
c) Colestiramina
B- Pérdida renal de bicarbonato
1- Acidosis tubular renal próximal (tipo 2)
a) Primaria: - Transitoria
- Genética e idiopática
b) Deficiencia, inhibición o alteración de la anhidrasa carbónica:
-Drogas: acetazolamida, sulfanilamida, acetato de mafenida
- Deficiencia de anhidrasa carbónica II
2- Síndrome de Fanconi
C- Defectos de acidificación urinaria
1- Acidosis tubular renal distal (tipo1)
2- Disfunción generalizada del nefrón distal:
a) Deficiencia primaria de mineralocorticoides
b) Hipoaldosteronismo hiporreninémico
c) Hiperkalemia resistente a mineralocorticoides
D- Sobrecarga ácida
1- Cloruro de amonio
2- Hidrocloruro de arginina y lisina
3- Alimentación parenteral
Acidosis metabólica con brecha aniónica aumentada (normoclorémica)
A- Cetoácidos
1- Diabetes mellitus
B- Errores innatos del metabolismo
1- Alteraciones del metabolismo de los aminoácidos
2- Acidemias orgánicas
3- Alteraciones del metabolismo de los hidratos de carbono
C- Intoxicaciones
1- Salicilatos
2- Etilenglicol
3- Metanol
4- Aldehidos
D- Insuficiencia renal
E- Acidosis láctica
1- Tipo A: hipoperfusión tisular e hipoxia
2- Tipo B: Sin hipoperfusión ni hipoxia (drogas, toxinas o errores congénitos del metabolismo) (16,17).
Fisiopatología
A medida que se acumula ácido en el organismo, los tampones químicos del líquido extracelular y celulares se unen al exceso de hidrogeniones.
Compensación respiratoria
El exceso de H+ no captado por los tampones reduce el pH sanguíneo y estimula a los quimiorreceptores del tallo cerebral incrementando la frecuencia respiratoria, con lo que se reduce la concentración de CO2, esto permite que se una al bicarbonato una mayor concentración de hidrogeniones. Este fenómeno aparece cuando el pH desciende por debajo de 7,20 (10). La compensación respiratoria se produce en pocos minutos, pero si el trastorno de base subsiste, la misma no será suficiente. El paciente presenta hiperventilación, fatigabilidad muscular y disnea (18).
Compensación renal
Los riñones sanos intentan compensar la acidosis secretando el exceso de H+ hacia los túbulos renales. Estos hidrogeniones se eliminan aisladamente (pH urinario) o combinados con fosfatos (acidez titulable), o con amonio (amonio urinario). Se excretan así por la orina como ácidos débiles (14).
Por cada H+ secretado en el túbulo renal, un ion sodio y un ion bicarbonato son absorbidos de los túbulos y devuelto al torrente sanguíneo.
Repercusión en el medio interno y manifestaciones clínicas
Como ya se mencionó, a través de la amortiguación biológica a nivel celular, se produce un intercambio entre H+ y potasio con la consiguiente hiperkalemia. Además se altera el equilibrio normal de los demás iones, como el sodio y el calcio, alterándose la excitabilidad neuronal, produciendo depresión progresiva del sistema nervioso central, a la que se suma la debilidad muscular y arritmias cardiacas propias de la hiperkalemia. La acidosis deprime la contractilidad miocárdica, reduce en forma importante la respuesta vascular periférica a las catecolaminas exógenas, incrementa la resistencia vascular pulmonar, dilata los lechos vasculares arteriales sistémicos, con constricción venosa (13).
A nivel bioquímico reduce la actividad de las vías de glicólisis y altera la síntesis de ATP.
Las manifestaciones gastrointestinales, tales como nauseas y vómitos son comunes en ciertos tipos de acidosis metabólicas como la cetoacidosis diabética y la uremia. El aumento de la acidez gástrica inhibe el normal vaciamiento.
En algunos casos, como en los lactantes con errores congénitos del metabolismo, la acidosis puede transcurrir sintomática, y a menudo se la descubre por consultas por síntomas asociados (18).
Acidosis metabólica en el paro cardiopulmonar
Durante el paro cardiopulmonar existe una combinación de escaso flujo sanguíneo y pobre ventilación pulmonar. La acidosis metabólica intracelular que se produce está mal reflejada en un gas arterial. Luego de la intubación, ventilación y compresión cardiaca, la sangre que atraviesa los pulmonares se hallan mejor oxigenadas y con un nivel de Pco2 reducido, el flujo pulmonar total sin embargo, está a menudo disminuido. En la determinación de gases en sangre se puede constatar un pH normal e inclusive elevado con alcalosis respiratoria. Una gasometría de sangre venosa mixta simultánea demostrará a menudo una profunda acidosis respiratoria y metabólica (19).
La causa de ésta hipercapnia venosa mixta se explica por la diferencia existente entre la Co2 arterial y la venosa mixta cuando el gasto cardiaco disminuye o se incrementa la producción de Co2 (20).
El contenido total de Co2, por influencia de la ventilación solo cambia en su fracción arterial. Este efecto es menor cuando el gasto cardiaco es bajo: la combinación de bajo flujo cardiaco e incremento de la producción de Co2 tisular genera la hipercapnia venosa (21,22).
La clave de la terapia de la acidosis, es aquí, restaurar la perfusión tisular, mejorando el rendimiento cardiaco y brindando un adecuado soporte circulatorio, valorando la necesidad de una expansión vascular con fluidos a través de un modesto bolo de 5 a 10 ml/kg., que podrá ser repetido según la evaluación clínica. Un relleno vascular a razón de 20 ml./kg puede ser causa de edema pulmonar si la función de bomba del miocardio está alterada (23).
Acidosis hiperclorémica dilucional
Es habitual la utilización de solución salina al 0,9% o mal llamada fisiológica , en la reexpansión vascular. La misma produce un excedente de cloro en el líquido extracelular que desplaza a los iones bicarbonato y que podría exacerbar la acidosis metabólica preexistente, apareciendo la denominada acidosis por dilución. Es preferible emplear una solución que contenga una distribución más fisiológica de iones que la solución fisiológica, tal como la solución Ringer Lactato, que contiene 109 mEq/L de cloruros y 28 mEq/L de lactato que luego se metaboliza a bicarbonato (24,25).
ALCALOSIS METABOLICA
Estado en el que hay un exceso de iones bicarbonato o una reducción de la concentración de iones H+ como consecuencia de una pérdida importante de ácidos no volátiles.
Etiología
- Generación de la alcalosis metabólica:
* Pérdida de hidrogeniones:
A-Gastrointestinal:-vómitos
-aspiración nasogástrica
-diarrea congénita perdedora de cloro
B-Renal:
I-diuréticos (tiacidas, furosemida, ácido etacrinico)
II-exceso de mineralocorticoides:
a) endógeno (hiperaldosteronismo,enfermedad de Cushing, síndrome adrenogenital)
b) exógeno (tratamiento con esteroides,tabaco de mascar)
c) síndrome de Bartter
d) fórmulas para lactantes deficientes en cloro
III-después de la hipercapnia
* Ganancia de bicarbonato
-sustancias alcalinas exógenas (Hco3, citrato, acetato, lactato)
* Contracción del volumen extracelular
-fibrosis quística (lactante)
- Conservación de la alcalosis metabólica
a) insuficiencia renal
b) deficiencia del volumen extracelular
c) aumento de los mineral o corticoides
d) deficiencia de potasio
e) deficiencia de cloro (16,17)
Fisiopatología
Al acumularse en el organismo los iones de bicarbonato, los tampones se unen al mismo para neutralizar la alcalemia.
- Compensación respiratoria
El exceso de bases eleva el pH sanguíneo deprimiendo los quimiorreceptores encefálicos, produciendo bradipnea que incrementan los niveles de dióxido de carbono en sangre, el mismo se combina con H2O para formar ácido carbónico. La compensación respiratoria se ve limitada por la hipoxia (26).
- Compensación renal
Los riñones sanos eliminan por la orina el exceso de bicarbonato, mientras se retienen los iones H+. Cuando la concentración de bicarbonato supera los 28 mEq/L, la capacidad de reabsorción de los túbulos se ve superada. Para mantener el equilibrio electroquímico se eliminan los iones de sodio y agua junto con el bicarbonato (27).
- Repercusión en el medio interno y manifestaciones clínicas
La disminución de los niveles de H+ en sangre produce la difusión pasiva de los mismos hacia afuera de las células.
Para conservar el equilibrio de cargas a través de la membrana celular (amortiguación biológica), hay un pasaje de iones potasio extracelulares hacia el interior de las células con la consiguiente hipokalemia (debilidad muscular, hipo- reflexia, arritmias cardiacas, distensión abdominal). Además se reduce la ionización del calcio, lo que permite que aumente la permeabilidad de las células nerviosas al ión sodio, las cuales al penetrar a las células estimulan la transmisión de impulsos nerviosos que se traduce por una hiperexcitabilidad del SNC y periférico (tetania, irritabilidad, confusión y convulsiones) (28).
En niños con enfermedad pulmonar crónica, tratados con oxigeno, diuréticos o drenaje nasogástrico, la alcalosis metabólica es peligrosa, porque la inhibición del centro respiratorio o la administración de oxigeno pueden agravar el cuadro (10).
ACIDOSIS RESPIRATORIA
Se establece cuando el sistema respiratorio es incapaz de eliminar el dióxido de carbono con la misma rapidez con que genera el metabolismo celular.
Etiología
La misma puede deberse a cualquier trastorno que dificulte la respiración.
A- Obstrucciones bronco pulmonares agudas o crónicas
- Enfisema pulmonar
- Bronquiolitis
- Asma bronquial
- S.D.R.A.
- Obstrucción mecánica de traquea o bronquios por agua, sangre, secreciones, pus o cuerpo extraño.
B- Obstrucción de vías respiratorias superiores
- Laringoespásmo
- Cuerpo extraño
- Parálisis de cuerdas vocales
- Difteria
- Edema de glotis
- Epiglotitis, laringitis
C- Hipoventilación alveolar generalizada
a) Alteraciones de la caja torácica
- Cifoescoliosis
- Espondilitis anquilosante
- Respiración torácica paradojal post-trauma
b) Disturbios neuromusculares
- Distrófia muscular
- Miastenia gravis
- Intoxicaciones (pesticidas, curares)
- Afecciones crónicas o agudas: (poliomielitis, síndrome de Guillain-Barré, difteria, tetános, botulismo)
c) Afecciones del sistema nervioso central
- Accidente vascular cerebral
- Hipertensión intracraneana
- Meningoencefalitis
- Depresión por drogas: barbitúricos, opiáceos, sedantes.
d) Parámetros inadecuados de ventilación mecánica
e) Otras : paro cardiopulmonar, distensión abdominal, hipotiroidismo, etc.
D- Patologías pulmonares restrictivas
- Neumotorax, hidrotorax, hemotorax, quilotorax
- Atelectasia, neumonía.
- Enfermedad de la membrana hialina
- Edema pulmonar severo
- Afectación pleural (fibrosis, calcificaciones)
E- Apnea de sueño (28).
Fisiopatología
Al disminuir la ventilación pulmonar, el CO2 retenido se combina con el H2O para formar grandes cantidades de ácido carbónico, el mismo se disocia en hidrogeniones libres (H+) y bicarbonato (HCO3) (4).
- Compensación por el tampón hemoglobina
La hemoglobina reducida que es fuertemente básica, capta H+ y CO2, eliminando de ésta manera parte de los H+ libres y el exceso de CO2.
A medida que se reduce el pH, se desvía a la derecha la curva de disociación de la hemoglobina (efecto Bohr) lo que origina una menor afinidad, pero una mayor liberación de oxigeno hacia los tejidos. Al persistir la acidosis se reduce el índice de glucólisis y la concentración de 2-3 difosfoglicerato (2-3 DPG) en el interior de los hematíes, lo que ocasiona que dicha curva se desplace a la izquierda(efecto Aldane) (29).
- Compensación respiratoria
Al aumentar la PCO2, la concentración de CO2 aumenta en todos los tejidos y humores. El CO2 reacciona con el H2O para formar ácido carbónico (H2 CO3) que se disocia en H+ y HCO3.
El aumento de la PCO2 y de H+ estimula el centro respiratorio lo que eleva la frecuencia respiratoria, destinada a reducir la concentración de CO2.
- Acción sobre el aparato circulatorio
La hipercapnia aguda produce vasodilatación periférica y estímulo de la actividad simpática. Los efectos cardiovasculares varían de acuerdo al grado de hipoxemia y acidemia, y a la patología de base (10).
- Repercusión sobre el SNC
El CO2 y los H+ dilatan los vasos sanguíneos encefálicos aumentando el aporte de sangre al sistema nervioso central, esto provoca edema cerebral con la consiguiente aparición de cefalea, letárgia, nauseas, vómitos y bradicardia (3).
- Compensación renal
Al persistir la falla de los mecanismos respiratorios, el aumento de la PCO2 estimula a los riñones a retener bicarbonato e iones sodio y a eliminar H+, consecuentemente se dispone de mas bicarbonato de sodio para tamponar los hidrogeniones libres.
- Repercusión en el medio interno y sintomatología
Cuando la concentración de H+ desborda los mecanismos compensadores, los mismos penetran en las células y los iones de potasio salen de ellas. Sin oxigeno suficiente, el metabolismo anaerobio produce ácido láctico. El desequilibrio electrolítico y la acidosis deprimen las funciones cardiaca y cerebral hasta niveles que pueden resultar críticos (7).
ALCALOSIS RESPIRATORIA
Se produce cuando el aparato respiratorio elimina una excesiva cantidad de dióxido de carbono, disminuyendo la PCO2 en sangre.
Etiología
A- Estímulo del Sistema Nervioso Central
a) Vías corticales: - histeria
- voluntario
b) Centro respiratorio:
- fiebre
- intoxicación salicílica
- trauma
- infección
- dolor
- drogas (xantinas)
- tumor
B- Estímulo del Sistema Nervioso Periférico
a) Ramos aferentes: - insuficiencia cardíaca congestiva
- neumonía
- embolia pulmonar
b) Estímulo de quimiorreceptores: - hipoxemia
- anemia
- altitud
C- Otros
- insuficiencia hepática
- sepsis
- inadecuados parámetros de ventilación mecánica
- progestágenos
- gravidez (17)
Fisiopatología
Al producirse la hiperventilación se expulsa al exterior el exceso de CO2, la hipocapnia resultante provoca una disminución del ácido carbónico, pérdida de H+ y de iones bicarbonato, con lo que se incrementa el pH (10).
- Compensación del medio interno
Para contrarrestar el aumento del pH sérico, los H+ son extraídos de las células y pasan a la sangre a cambio de iones de potasio. Los hidrogeniones se combinan con el bicarbonato disponible para formar ácido carbónico, lo que reducirá el pH.
- Acción cardiovascular
La hipocapnia estimula los cuerpos carotideos y aorticos, lo que provoca un aumento de la frecuencia cardiaca, que puede agravarse aun más por efectos de la hipokalemia. No se altera la presión arterial (26).
- Acción sobre la vasculatura
Se produce una vasoconstricción en la mayoría de los lechos vasculares incluyendo los vasos arteriales cerebrales, lo que reduce el riego sanguíneo encefálico. Se hiperexcita el tallo cerebral y el sistema nervioso vegetativo, observándose sudoración, ansiedad, mareos, alternancia de disnea, hiperventilación y apneas (10).
- Compensación renal
Si la hipocapnia persiste el bicarbonato plasmático disminuye a través el aumento de la excreción renal y la reducción de la eliminación de los hidrogeniones.
- Repercusión en el medio interno y cuadro clínico
La alcalosis inhibe la ionización del calcio, aumentando la excitabilidad nerviosa y las contracciones musculares, se presentan: vértigo, confusión, parestesis en los miembros, hiperrreflexia, tetania, arritmias, convulsiones y coma (26,30).
Diagnostico
1- Antecedentes y examen físico
2- Determinación de gases en sangre
a) Verificar la compatibilidad matemática del resultado (ver reglas de oro , mas adelante).
b) Recordar que la compensación no siempre normaliza el pH
3- Medición de electrólitos séricos
a) Calcular la brecha aniónica
b) Kalemia
c) Urea y creatinina
d) Fosfato
4- Calcular el gradiente alveolo-arterial de oxigeno
5- En la orina:
a) Determinación del pH
b) Cloro urinario: de importancia en las alcalosis metabólicas, cuyas causas más frecuentes cursan con cloro urinario bajo (<10 mEq/L) y constituyen l grupo sensible al cloro ; otras cursan con cloro urinario alto (>10mEq/L) y se denominan resistentes al cloro.
Correlación clínico-gasométrica y terapéutica
La gasometría consta de 2 partes bien diferenciadas: La oximetría y el estado del balance ácido-básico.
Oximetría:
Permite conocer el estado de oxigenación del paciente y actuar en consecuencia con oxigenoterapia si el caso lo requiere o reduciendo la concentración del mismo para minimizar su toxicidad.
La oximetría informa sobre las dos maneras en que se transporta el oxigeno: las fracciones disuelta y ligada.
- Presión arterial de oxigeno
Mide la fracción de oxigeno disuelto en el plasma, se expresa en mm de Hg o unidades Torr. Para conocer el contenido de O2 disuelto se debe multiplicar la PaO2 por la cifra 0,003 (20).
- Saturación de oxigeno
Informa la concentración de oxigeno transportada por la hemoglobina, expresada en porcentaje. Podemos calcular el contenido de O2 ligado, multiplicando la saturación por la cifra de Hgb. por 1,34.
- El contenido normal de oxigeno: Los valores normales son:
Hemoglobina=12 g., Po2=100 mm Hg, Sat.de O2=0,98
- Disuelto: 100 C 0,003 = 0,30 ml.
- Ligado: 12 C 1,34 C 0,98 = 15,75 ml .
Oxigeno total en sangre = 16,05 ml.
Hipoxia sin anemia:
Hemoglobina= 12; Po2= 40; saturación de oxigeno= 0,75
- Disuelto: 40 C 0,003 = 0,12 ml.
- Ligado: 12 C 1,34 C 0,75 = 12,06 ml .
Total = 12,18 ml.
El transporte debe ir complementado por un gasto cardiaco eficiente
Anemia sin hipóxia:
Hemoglobina = 4; Po2= 100; saturación de oxigeno= 0,98
-Disuelto: 100 C 0,003= 0,30 ml.
-Ligado: 4 C 1,34 C 0,98= 5,25 ml.
Total = 5,55 ml.
Se puede advertir que una buena oxigenación con una anemia severa mejora muy poco el transporte de oxigeno (16).
El balance ácido-básico:
El mismo puede ser evaluado a partir de solamente 2 determinaciones, pues los demás valores se deducen de manera secundaria. Los mismos son:
- pH
Representa la concentración total de iones H+ como logaritmo negativo, así al disminuir el pH aumentan los hidrogeniones y viceversa. Un cambio de 0,3 del pH duplicará o reducirá a la mitad la concentración de H+, por lo que pequeños desplazamientos del pH implican grandes modificaciones en la concentración de hidrogeniones.
- PaCO2
Mide la tensión arterial de dióxido de carbono disuelta en el plasma, expresada en mm de Hg o unidades Torr. Es un reflejo fiel de lo que sucede con la fracción respiratoria del equilibrio ácido-básico (16).
Hacia una determinación ideal de los gases en sangre
Cuando determinamos los gases sanguíneos arteriales, a menudo los resultados se ven alterados por el llanto o la alteración del patrón respiratorio del niño. Esto no ocurre cuando el niño está sedado y con una línea arterial instalada; en algunas ocasiones es de gran valor una determinación venosa mixta que requiere un catéter en la arteria pulmonar, cuya colocación es poco común en pediatría.
Con la medición transcutanea de PO2, PCO2 y saturación de oxigeno se ha posibilitado la reducción del número de extracciones sanguíneas.
La monitorización continua invasiva de los gases arteriales consiste en el continuo análisis del pH, PaO2 y PaCO2 a través de un sensor de fibra óptica intra-arterial. Estudios clínicos se requieren para comprobar su utilidad, factibilidad, confiabilidad y costos. Potenciales aplicaciones incluyen: inestabilidad cardiorrespiratoria que requiere de frecuentes gasometrías, manejo intra y post-operatorio de cirugía cardiovascular, utilización de membrana de oxigenación extracorpórea (ECMO), ventilación de alta frecuencia, y el síndrome de distress respiratorio de tipo adulto (SDRA) (31).
LAS 3 REGLAS DE ORO
Nos permiten una evaluación y terapéutica adecuadas, según el caso.
La primera regla nos ubica en el componente respiratorio, la segunda regla en el componente metabólico, y la tercera enfoca el tratamiento de ésta última.
FRACCION RESPIRATORIA 1ª REGLA DE ORO
POR CADA 10 mm Hg QUE VARIA LA PCO2, EL pH SE INCREMENTARA O REDUCIRA EN 0,08 UNIDADES EN FORMA INVERSAMENTE PROPORCIONAL Así, si la PCO2 aumenta 10 mm Hg, el pH caerá 0,08. Por el contrario si la PCO2 desciende 10 mm Hg, el pH aumentará en 0,08 unidades (32).
Ejemplos:
- Si la PCO2 es de 40 mm Hg, el pH será de 7,40 (normal) en ausencia de acidosis metabólica.
- Una PCO2 de 50 mm Hg (hipoventilación o acidosis respiratoria) se traducirá por un pH de 7,32 (sin compensación metabólica).
- A una PCO2 de 30 mm Hg (hiperventilación o alcalosis respiratoria) corresponderá un pH de 7,48 (descontando siempre el factor metabólico).
- PCO2 de 48 = pH de 7,34
- PCO2 de 25 = pH de 7,52
Para descartar que el componente metabólico esté interactuando en el resultado del pH , se deben seguir los siguientes pasos:
1- Calcular en cuanto la PCO2 obtenida está por encima o por debajo de lo normal (40 mm Hg).
2- Calcular el pH correspondiente a la PCO2 determinada, aplicando la 1º regla de oro.
3- Comparar el pH medido con el calculado.
Si el pH medido se aproxima razonablemente al pH calculado, todos los cambios serán respiratorios; si por el contrario el pH es inferior al calculado, existirá una acidosis metabólica adicional; si el pH es mayor que el calculado, la alteración consistirá en una alcalosis metabólica.
Terapéutica : El tratamiento de los disturbios respiratorios se encamina a normalizar la función pulmonar.
FRACCION METABOLICA
2ª REGLA DE ORO
POR CADA 0,15 UNIDADES QUE SE MODIFICA EL pH, SE INCREMENTA O DISMINUYE EL EXCESO O DEFICIT DE BASE EN 10 UNIDADES QUE PUEDEN EXPRESARSE EN meq/l DE BICARBONATO (22)
Ejemplos:
-PCO2 de 52 mm Hg, evidentemente existe una acidosis respiratoria dado por el aumento de 12 unidades con respecto al valor normal; el pH calculado por la 1ª regla de oro será de 7,30. Si el pH medido también fuera de 7,30, concluimos que existe una acidosis respiratoria pura .
- Por el contrario si la PCO2 se determina en 40 mm Hg y el pH es de 7,25, aplicando la 1ª regla de oro, obtendremos un pH calculado de 7,40. Pero como el pH medido es de 7,25, existe una diferencia de 0,15 unidades. Aplicando la 2ª regla de oro, encontraremos un déficit de base de 10 mEq/L, es decir que estamos ante una acidosis metabólica pura .
- PCO2 de 50 y pH de 7,26. Ph calculado (1ª regla )= 7,32. Entre pH calculado y medido hay una diferencia de 0,06 por debajo de lo estimado en la aplicación de la 1º regla. Utilizando la 2ª regla llegamos a la conclusión de que existe un déficit de base de 4 mEq/L, es decir que a la acidosis respiratoria se le suma una acidosis metabólica. Es una acidosis mixta.
- PCO2 de 32 mm Hg y pH de 7,26, el pH calculado es de 7,46(1ª regla), existiendo una diferencia de 0,20 por encima del pH real, lo que determina un exceso de base de 13 meq/l (2ª regla), es decir que coexiste una alcalosis respiratoria con una acidosis metabólica . El juicio clínico determinará cual es el disturbio de origen y cual el compensatorio.
TERAPEUTICA
3ª REGLA DE ORO
SE TRADUCE POR LA SIGUIENTE FORMULA: MEQ DE BIC.A REPONER=DEF.BASE C KG.PESO C 0,3(NO CORREGIR MAS DE 10 PUNTOS POR VEZ) (19)
Permite calcular la cantidad de bicarbonato que debe administrarse.
El déficit de base expresa el déficit de bicarbonato de sodio en miliequivalentes por litro de líquido extracelular, que equivale a 1/3 del peso corporal.
- Paciente de 10 kg con una PCO2 de 35 Torr y un pH de 7,19; el pH calculado de acuerdo a las 5 unidades que disminuyó la PCO2 (1ª regla) será de 7,44, la diferencia entre el pH calculado y el real es de 0,25 por lo que se obtiene un déficit de base de -17 mEq/L. (2ª regla). Estamos ante una acidosis metabólica parcialmente compensada . El disturbio de la fracción metabólica se trataría teóricamente aplicando la 3ª regla de oro: 10 x 10 x 0,3 = 32 meq de bicarbonato, sin embargo hay aspectos clínicos a considerar (33).
La administración rápida de bicarbonato de sodio no está indicada, salvo en el paro cardiaco, ya que el bolo del mismo produce un desplazamiento veloz de los iones a través de las membranas celulares, que pueden conducir a disrritmias cardiacas y/o convulsiones por los disturbios del medio interno que acarrea: hiperosmolaridad, hipernatremia, acidosis paradojal en el LCR y alteraciones en la hemodinamia (34).
La administración total del déficit de base tampoco está indicada, por los mismos motivos antedichos y porque además el organismo moviliza por su parte los mecanismos tampones ya descriptos.
La conducta adecuada es la corrección lenta, en la medida que el buen criterio clínico lo sugiera. Habitualmente se corrige un 50% del déficit y luego conducir el tratamiento según los resultados de las gasometrías sucesivas.
La sobredosis de bicarbonato de sodio lleva a la alcalosis metabólica , temible disturbio de difícil tratamiento, con la consiguiente perturbación en la liberación de oxigeno por la hemoglobina, la hipokalemia e hipocalcemia, cuyas consecuencias mas peligrosas son las arritmias cardiacas.
Alternativas al bicarbonato de sodio:
- Carbicarb: es una mezcla equimolar de bicarbonato de sodio con carbonato de sodio. Es un tampón que no produce Co2, ni reduce el pH intracelular como ocurre con el bicarbonato. A pesar de su teórica ventaja sobre el bicarbonato de sodio, no ha demostrado ser mas efectiva en paros cardiacos en modelos animales, es sin embargo mas efectiva en la acidosis láctica mientras se mantiene o mejora la función circulatoria. Su mayor desventaja es su hiperosmolaridad y alcalinidad, por lo que debe ser administrada solo por vía central (11,35).
- THAM (tris-hidroxi amino metano): es un tampón orgánico que atraviesa fácilmente las membranas celulares y la barrera hematoencefálica, por lo que es un amortiguador intracelular efectivo, con el inconveniente de su excreción renal exclusiva lo que lo limita en los estados de hipo perfusión. Sus efectos adversos limitan su utilización clínica, entre ellos se incluyen: hiperkalemia, hipoglucemia, depresión respiratoria, daño tisular en caso de extravasación, y necrosis hepática en neonatos (35). En los modelos animales el THAM no es más efectiva que el bicarbonato y puede reducir la presión de perfusión coronaria, en los traumatismos de cráneo, ensayos clínicos y en modelos sugieren mejoría en los resultados neurológicos (28).
Tratamiento de la Alcalosis metabólica
Paciente recientemente reanimado, con PCO2 de 40 Torr y un pH de 7,62, la 1ª regla de oro no indica que no hay componente respiratorio en el disturbio ácido-básico, la diferencia entre el pH real y el calculado nos da 0,22 unidades por encima del calculado (1ª regla de oro), lo que traduce un exceso de base de 15 mEq/L. (2ª regla de oro). Se trata de una alcalosis metabólica pura debida a la administración iatrogénica de bicarbonato y que puede exacerbarse por pérdidas aumentadas de líquido gástrico a través de la SNG.
El tratamiento debe orientarse a corregir el déficit de volumen, cloruros, potasio y calcio. El uso de ácidos para corregir la alcalosis a través de la infusión de cloruro de amonio o ácido clorhídrico diluido, rara vez se utiliza y se reserva para los pacientes con alcalosis grave y que no toleren la reposición de volumen.
La prueba diagnóstica más útil para identificar las causas de alcalosis metabólica es la determinación del cloro urinario medida en una muestra de orina tomada al azar:
1. Cl U < 10mEq/L, signo de resorción renal ávida de cloro: vómitos, aspiración nasogástrica, diarrea congénita perdedora de Cl, fórmula deficiente en Cl, síndrome ulterior a hipercapnia y fibrosis quística. Estos casos se tratan con expansión volumétrica con Cl Na
2. Cl U > 10 mEq/L, o alcalosis resistente a la solución salina: ingestión reciente de diuréticos, producción o ingestión de mineralocorticoides en exceso, síndrome de Bartter o hipopotasemia profunda. Se debe tratar el trastorno subyacente, corregir el déficit de Cl K (17).
Corrección de acidosis con brecha aniónica aumentada
Los pacientes con acidosis metabólica con brecha aniónica aumentada deben ser corregidos con pequeñas dosis de bicarbonato y solamente cuando el pH es peligrosamente bajo (menor de 7,20) según la fórmula: brecha aniónica - 12 C kg. peso C 0,3, ya que el propio organismo genera bicarbonato por incremento de la excreción neta de ácido por el riñón.
Compensación completa
Paciente con cuadros bronco-obstructivos crónicos, presenta una PCO2 de 55 Torr y un pH de 7,38; el pH calculado sería de 7,28, existiendo una diferencia de 0,10 unidades, calculándose un exceso de base de 7 mEq/L., debido a que el organismo acumula base en forma crónica, consiguiendo de ésta manera mantener el pH normal.
La correcta aplicación de éstas 3 reglas, es decir, los criterios de aplicación del cuadro clínico que presenta el paciente con los datos obtenidos por la determinación de los gases en sangre, conduce al camino que permite instituir la terapéutica apropiada.
BIBLIOGRAFIA
1. O'Shaughnessy WB. Experiments on the blood in cholera. Lancet. 1831-32;I:490.
2. Stadelman E. Ueber die ursache der pathologische amoniakaus- scheidung diabetes mellitus und des coma diabeticum. Arch. Exp. Path. Pharm. 1833;42:149.
3. Winters R. Visión histórica del campo ácido básico. En: Winters R, editor. Líquidos orgánicos en pediatría. España: Elisien; 1978.p.3-19.
4. Velásque z-Jones L. Alteraciones hidroelectroliticas y ácido-base. Acidosis metabólica. Bol Med Hosp Inf Mex. 1990;47(3):186-96.
5. Arruda JA, Kniaz D, Talor Z. Disorders of acid-base physiology. Curr. Nephr. 1989;12:135.
6. Bidani A. Electrolyte and acid-base disorders. Med Clin North Am. 1986;70(5):1013-36.
7. Brunow de Carvalho W. Metabolismo ácido-básico. En: Brunow de Carvalho W, editor. Manual de Terapia Intensiva Pediatrica. Brasil:Atheneu; 1993.p.396-410.
8. Clark WM. The Determination of Hydrogen Ions. Baltimore: Williams & Wilkins; 1920.
9. Riverón CR, Mena MV. Desequilibrio hidroelectrolítico y acido-base en la diarrea. Rev Cubana Pediatr. 2000;72(3):170-82.
10. Ichikawa I, Narins R, Harris W. Alteraciones ácido-base. En: Ichikawa I, editor. Tratado de líquidos y electrólitos en pediatría: Intermédica; 1992.p.207-41.
11. Adrogué H, Madias N. Management of life. Threatening acid-base disorders. N. England J. Med. 1998;338(1):26-34.
12. Pires A. Disturbios ácido-básicos. En: VI Congresso Brasileir o de Terapia Intensiva Pediátrica. Curso de revisao e actualizaçao em Terapia Intensiva Pediátrica. Brasil: Interlivros; 1996.p.105-107.
13. Sladen A. Balance ácido-básico. En: Mcintyr e K, Lewis J, editores. Texto de Cuidados Avanzados de Resucitación. Dallas: American Heart Association; 1983.p.1-11.
14. Taylor Lake D. Acidosis y alcalosis metabólica. Nursing. 1991:44-47.
15. Goodkin DA, Krishna GG, Narins RG. T he role of the anion gap in detecting and managing mixed metabolic acid-base disorders. Clin endocrinol Metab. 1984;13:333.
16. Shapiro BA. Clinical application of blood gases. Chigago: Year book medical; 1973.
17. Brewer E. Trastornos del equilibrio ácido básico. Pediatr Clin North Am. 1990;2:453-475.
18. Taylor Lake D. Acidosis y alcalosi s respiratoria. Nursing.1991:32-35.
19. Zaritsky A. Cardiopulmonary Resuscitation. In: Green T, Weigle C (eds). Current concepts in pediatric critical care - 1995. Anaheim , Society of Critical Care Medicine; 1995.p.33-50.
20. Weil M, Rackow E, Trevino R. Difference in acid-base state between venous and arterial blood during cardiopulmonary resuscitation. N. England J. Med.1986;315:153-56.
21. Sivan Y, Newth JL. Monitoring and assessment of the pulmonary function in ventilated infants and children. En: Tibboel D, Van der Voort E, editores. Intensive care in childhood. A challenge to future. 2nd.ed. Berlin ;Springer; 1996.p.413-438.
22. Luft WC, Loeppy JA, Mostyn DM. Mean Alveolar gases and alveolar-arterial gradients in pulmonary patients. J Appl Physiol. 1979;46:534-40.
23. Zaritsky A. Resuscitation pharmacology. En: Chernow B, editor. The Pharmacologic Approach to the Critically Ill Patient. 3 ed. Baltimore: Williams & Wilkins. 1994.p.233.
24. Griffel M, Kaufman B. Pharmacology of colloids and crystalloids. Crit Care Clin. 1992;8(2):235-253.
25. Kallen R. Trastornos del equilibrio ácido básico. Pediatr Clin North Am. 1990;2:263-288.
26. Michel-Behnke Y, Schnittker C, Schmid FX, Wipperman CF, Thul J, Huth RG, et al. Metabolic alkalosis in children following cardiac surgery with cardiopulmonary bypass. Int Care Med. 1996:233.
27. Bjerneroth G, Sammeli O, Wiklund L. Effect of alkaline buffers on citoplasmic pH. Critical Care Med.1994;22(10):1555-556.
28. Hirschheimer M, Kuperman H; Alteracoes do equilibrio hidro-electrolitico e ácido-básico na ventilacao pulmonar mecanica. En: Brunow de Carvalho, W, editor. Ventilacao pulmonar mecánica em pediatría. Brasil: Atheneu; 1993.p.199-209.
29. Castro Sánchez, A. Acidosis metabólica grave. En: Asociación Mexicana de Pediatría. Temas de pediatría. México:Mc Graw-Hill Interamericana; 1998.p.305-314.
30. Ruza F. Fisiología aplicada del medio interno (agua y electrolitos). En: Ruza F, editor. Tratado de Cuidados Intensivos Pediátrico. 3ra ed. Madrid: Ediciones Norma; 2003.p.1020-1033.
31. Fanconi S, Doherty P, Edmonds JF, Barker GA, Bohn DJ. Pulse oximetry in pediatric intens ive care: Comparison wit h measured saturations and transcutaneous tension. J Pediatric. 1985;107(3):362-66.
32. Aoki B, McCloskey B. Priciples of stabilization. En: Aoki B, editor. Evaluation, stabilization, and transport of the critically Ill Child. St. Louis: Mosby Yearbook; 1992.p.1-16.
33. Narins RG, Cohen JJ. Bicarbonate therapy for organic acidosis. The case for its continued use. Ann Intern Med. 1987;106(4):615-18.
34. Mizock BA, Falk JL. Lactic acidosis in critical illness. Crit Care Med. 1992;20(1):80-93.
35. Leung J, Landow L, Franks M, Soja-Strzepa D, Heard S, Arieff A, Mangano D. Safety and efficacy of intravenous Carbicarb in patients undergoing surgery: Comparison with sodium bicarbonate in the treatment of mild metabolic acidosis. Critical Care Med.1994;22(10):1540-549.














