INTRODUCCIÓN
La tuberculosis (TB) es una de las principales enfermedades infecciosas a nivel mundial y sigue siendo un grave problema de salud pública en muchos países. La Organización Mundial de la Salud (OMS) estima que un tercio de la población está infectada con TB y la tasa de infección aumenta casi un 1% por año1. La TB es relativamente común en mujeres embarazadas; la prevalencia de TB activa en mujeres embarazadas y puérperas de países con alta carga es superior a 60 casos por 100 000 habitantes por año y de países con baja carga de TB, la prevalencia es inferior a 20 casos por 100 000 habitantes por año o es más baja aproximadamente 10 casos en total2. Aunque rara, la transmisión vertical conlleva un mal pronóstico. La incidencia de TB en el embarazo está aumentando en países con recursos socioeconómicos limitados. En la mayoría de estos países, el aumento de la incidencia se asocia con una mayor prevalencia de TB en la población de mujeres en edad fértil. La TB de patrón latente en el embarazo se correlaciona con un alto riesgo de progresión a patrón activo que aumenta el riesgo de transmisión de madre infectada a hijo en las primeras 3 semanas de vida. La tuberculosis congénita es causada porMycobacterium tuberculosis adquirida en el útero o en el momento del parto. La enfermedad es una complicación rara de la infección tuberculosa intrauterina debida a diseminación hematógena materna. La TB congénita es difícil de diagnosticar porque rara vez se distingue de otras infecciones neonatales o congénitas, por lo que el caso de TB congénita ha sido ampliamente sub notificado. En la segunda o tercera semana después del parto, los síntomas suelen aparecer y el diagnóstico precoz es fundamental. La TB congénita se presenta con signos y síntomas inespecíficos, como fiebre, letargo, dificultad respiratoria y hepatoesplenomegalia, entre las 2 y 3 semanas de edad. Las manifestaciones clínicas inespecíficas dificultan la distinción entre la TB y la sepsis bacteriana o la infección viral intrauterina. Por lo tanto, se necesita una alta sospecha para un diagnóstico precoz y un tratamiento meticuloso. Los patrones miliares son hallazgos de imagen comunes en muchos bebés con TB congénita. Sin embargo, la presentación clínica de la TB durante el embarazo y la infancia suele ser inespecífica, lo que dificulta el reconocimiento3,4. A pesar del difícil diagnóstico, la sospecha clínica y los antecedentes familiares apoyan el diagnóstico de TB congénita y el diagnóstico precoz evita la muerte en la infancia. La incidencia de TB congénita es baja; sin embargo, su importancia radica en una tasa de mortalidad de hasta el 50%5. Presentamos un neonato con TB miliar congénita en las primeras semanas de vida con evolución final favorable.
PRESENTACIÓN DEL CASO
El caso corresponde a paciente masculino de 24 días de vida, de 36 semanas EG por Capurro, parto por cesárea por RPM menor a 6 horas de evolución, sin complicaciones aparentes, alta a las 24 horas. Nació con peso: 2680 gramos (P50), talla: 44 cm (P10), perímetro cefálico: 33 cm (P50), APGAR: 9/9. Recibió vacuna de hepatitis B, no BCG. Antecedentes maternos nulípara, gestante de 23 años de edad, procedente de Fernando de la Mora, universitaria, con controles siete prenatales, VDRL y HIV test rápido no reactivos, infección del tracto urinario (ITU) en último trimestre tratado con antibiótico vía oral (no se especifica germen, tipo y duración de tratamiento antibiótico). Además, presentó 14 días previos al parto infección por SARS-COV-2 que requirió internación durante siete días. Cinco días después del parto presenta adormecimiento y debilidad de miembros inferiores y dedos cianóticos, sin síntomas respiratorios, por lo cual acude a facultativo; se realiza Resonancia Magnética Nuclear (RMN) de columna vertebral que informa inflamación de medula espinal; posteriormente es dada de alta con tratamiento sintomático, presenta sensación febril de cinco días de evolución graduada en 38-39°C. Se realiza radiografía de tórax con hallazgos patológicos que se atribuye a infección previa por SARS-COV-2. Persiste febril se realiza RMN de torax y cráneo en la última evidencia parenquima cerebral con multiples anomalias de señal T1 y T2 rodeado de edema, mismas lesiones en la union de sustancia blanca y gris en ambas regiones frontales y temporales, parietal derecha, nucleo lenticular, y pedunculo cerebral izquierdo. En parietal izquierda hipointensidad de señal T2 cortical compatible con depósito de hemoderivados, cambios de señal del hueso y partes blandas adyacentes; por ultimo engrosamiento mucoso con ocupacion completa del oido medio y mastoides derecha compatible con proceso inflamatorio. En biopsia cerebral informa: proceso inflamatorio crónico, con extensa necrosis central con histiocitos y células gigantes multinucleadas tipo Langhans. Tejido cerebral con cambios hemorrágicos focales y cambios inflamatorios leves inespecíficos, sin evidencia de granulomas, tinción Ziehl-Neelsen no se observa BAAR, cultivo para Gram, aerobios y hongos negativos. Se realiza 3 esputos en días consecutivos donde no se observa BAAR, Quantiferón positivo, no se realizó PPD. Madre con diagnósticos de post operada de drenaje absceso cerebral, TB cerebral e ITU tratada. Inició tratamiento antibacilar con esquema Isoniazida, Rifampicina, Pirazinamida, Etambutol (HRZE). Antecedentes patológicos familiares niegan contacto con TB, no precisa otra fuente de contagio. Paciente RN con historia de fiebre de 3 días de evolución, 3 picos diarios graduado hasta 38.7ºC, que cede con la ingesta de antipiréticos comunes y medios físicos y tos de 3 días, seca esporádica. Al inicio del cuadro le solicitan orina simple con retorno no patológico y frotis de sangre periférico (FSP) que informa serie roja con anisocitosis, serie y plaquetas normales en número. Recibe tratamiento ambulatorio sintomático. Ante persistencia del cuadro consulta nuevamente, con resultado laboratorial: Hb: 12.2 Hto: 37.6 GB: 13.300 N: 66% L: 32% M: 1% E: 1% granulaciones tóxicas: 3% PCR: 96, orina simple no patológica, radiografía de tórax con trama pulmonar e infiltrado intersticio alveolar bilateral ante sospecha de sepsis neonatal tardía recibe Cefotaxima (200mg/kp/día) y Ampicilina (200mg/kp/día), recibe 1 dosis. Por antecedente de infección materna actual de tuberculosis pulmonar y meníngea lo remiten a nuestro servicio para internación. Al ingreso RN afebril, activo reactivo a estímulos, fontanela anterior normotensa, reflejos arcaicos presentes, eupneico, sin requerimiento de O2 suplementario, saturación 97% con aire ambiental, MV conservado no ruidos sobreagregados, hemodinámicamente estable, eutrófico, con mucosas húmedas, abdomen globuloso simétrico, se palpa hepatomegalia a 4.5 cm RCD, no esplenomegalia. No adenopatías. Se plantean al ingreso los diagnósticos de sospecha de sepsis neonatal tardía, probable tuberculosis congénita pulmonar, PIMS a descartar (nexo epidemiológico). Se solicita analítica laboratorial Hb 12.2 g/dL, Hto 35%, VCM 98, HCM 35, GB 11.610/mm3, N 66%, L 26%, Plaquetas 304.000/mm3,VSG 74 mm (R 20mm), PCR 16 g/dL (R < 6), PCR ultrasensible 110 mg/L (R 0.1-2.8), Procalcitonina 1.04 ng/mL (R <0.5), Dímero D 2.4 ug/mL (R <0.5), Ferritina >1.157 ng/mL (R 30-400), LDH 867 U/l (R 240-480), GOT 47 (R 10-50) U/l, GPT 15 U/l (R 10-50), FA 109 U/l (R <460), BT 1.48 mg/dL (R 0-1.1), BD 0.81 mg/dL (R 0.30), BI 0.67 mg/Dl (R 0.2-0.6); reactantes de fase aguda aumentados y perfil hepático alterado a expensas de bilirrubina, electrolitos y función renal en rango. HIV test rápido y VDRL no reactivos, STORCH negativo, SARS-COV-2 PCR, IgG e IgM negativos. Orina simple normal, urocultivo con búsqueda de gérmenes comunes y micobacterias negativo, HMCx2 negativo. Se inició cobertura antibiótica en contexto de sospecha de sepsis neonatal tardía con Cefotaxima (300mg/kp/dia) más Ampicilina (300mg/kp/día). Punción lumbar LCR aspecto de cristal de roca, glucosa 46, proteínas 54, leucocitos 5, hematíes GRAM, tinta china y tinción de Ziehl-Neelsen negativos, cultivo de LCR negativo gérmenes comunes y micobacterias negativo con lo cual se desciende ambos antibióticos a (200mg/kp/día). PPD no reactivo. Además de toma de muestras seriadas durante 3 días de líquido gástrico tinción de Ziehl-Neelsen BAAR +++ en las tres muestras y GENEXPERT M. tuberculosis detectado y secreción traqueal tinción de Ziehl-Neelsen BAAR +++. Radiografía de tórax del ingreso se observa infiltrado nodulillar difuso bilateral compatible con diseminación miliar tuberculosa Figura 1. Inicio terapia antibacilar H10/R20/Z20/E20 por sonda nasogástrica ante la no tolerancia de la vía oral. Posteriormente durante su internación presenta alteración de perfil hepático por lo cual se ajusta dosis H5/R10/Z15/E15 el cual se administra en suspensión con buena tolerancia de la vía oral. Estudios complementarios durante internación ecocardiograma despegamiento pericárdico laminar, ecografía cerebral, ecografía abdominal fondo de ojo dentro de parámetros normales. Es dado de alta en su 11 día de internación, con 10 días de tratamiento antibacilar, en buen estado general. A los 8 meses de tratamiento antibacilar se realiza ecografía abdominal con hígado de tamaño conservado, formaciones nodulares calcificadas en hígado, las ubicadas en lóbulo derecho son de tamaño mayor y aún no están completamente calcificadas, como las ubicadas en lóbulo izquierdo (¿activas aun?). Adenomegalias calcificadas en hilio hepático y paraaorticas Figura 2 así como ecografía cerebral de control con dilatación leve de los ventrículos laterales en ambos lados Figura 3. Recibió 2 meses de HRZE y 10 meses de HR completando 12 meses totales de tratamiento según normas del programa nacional de tuberculosis. Piridoxina como neuroprotector hasta 10 días posterior a la suspensión de antibacilares y antibioticoterapia completo 9 días totales durante internación. Al finalizar tratamiento al examen físico se constató hígado a 2 cm RCD al año de vida, crecimiento y desarrollo normal para la edad, controles oftalmológicos y auditivos sin hallazgos patológicos. La madre recibió 4 meses de HRZE y 8 meses de HR completando 12 meses de tratamiento antibacilar.
Tabla 1. Resumen de estudios de laboratoriales de paciente con tuberculosis congénita.
| Parámetros | 04/01/2021 | 08/01/2021 | 09/01/2021 | 14/01/2021 |
| Hb / Hto | 12.2 / 35 | 10.6 / 29 | 10.5 / 29 | 10.2 / 28 |
| VCM / HCM | 98 / 35 | 95 / 34 | 80 / 34 | 95 / 35 |
| GB | 11.610 | 12.910 | 13.770 | 13.010 |
| N / L | 66% / 26% | 51% / 40% | 53% / 35% | 47% / 38% |
| M / E | 6% / 2% | 6% / 3% | 8% / 4% | 12% / 3% |
| Plaquetas | 304.000 | 245.000 | 280.000 | 409.000 |
| VSG / PCR | 74 / 16 | 86 / 6 | ||
| Glicemia | 62 | |||
| Urea | 18 | 11 | 9 | |
| Creatinina | 0.29 | 0.27 | 0.25 | |
| K / Na | 5.02 / 136 | 5.14 / 137 | 5.75 / 136 | |
| Cl / Mg | 95 / 2.1 | 100 / - | 100 / - | |
| Ca / P | 9.7 / 5.7 | |||
| GOT | 47 | 37 | 35 | |
| GPT | 15 | 15 | 16 | |
| FA | 109 | 122 | 183 | |
| BT / BD / BI | 1.48/0.81/0.67 | 2.62/1.97/0.65 | 3.12/2.41/0.71 | |
| Prot T/Albumina | 5.95 / 3.23 | 5.97/3.61 | ||
| TP / TTPA | 100% / 29 | 100% / 30 | ||
| Fibrinógeno | 584 | 279 | ||
| PCR ultrasensible | 110 | |||
| Procalcitonina | 1.04 | |||
| Dímero D | 2.4 | |||
| Ferritina | >1157 | |||
| LDH | 867 | |||
| Troponina I | 0.14 | |||
| HIV / VDRL | NR / NR | |||
| SARS-COV-2 IgG e IgM | Negativo Negativos | |||
| TSH / T3 / T4 | 2.75 / 1.41 / 10.2 |
Tabla 2. STORCH de paciente con tuberculosis congénita.
| Toxoplasmosis IgG | <0.130 | |
| Toxoplasmosis IgM | NR | |
| CMV IgG | 10.19 | |
| CMV IgM | NR | |
| Rubeola IgG | 81.4 | |
| Rubeola IgM | NR | |
| Anti HAV IgM | NR | |
| Hepatitis C IgM | NR | |
| HBsAg | NR | |
| Chagas IgG | NR | |
| Chagas IgM | NR |
Tabla 3. Citoquímico y cultivo de LCR de paciente con tuberculosis congénita.
| Citoquímico de LCR 04/01/2021 | Aspecto cristal de roca | Cultivo de LCR 04/01/2021 | |
| Glucosa | 46 | Desarrollo bacteriano | Negativo |
| Proteínas | 54 | Coloración Ziehl-Neelsen | No se observa BAAR |
| Leucocitos | 5 | Cultivo para micobacterias (60 días) | Negativo |
| Hematíes | No se observan | ||
| Gram / Tinta china | No se observan |
Tabla 4. Liquido gástrico BAAR y GENEXPERT de paciente con tuberculosis congénita.
| Liquido gástrico | |
| 1º muestra 04/01/2021 Coloración Ziehl-Neelsen Genexpert | BAAR +++ M. tuberculosis detectado Resistencia a Rifampicina no detectada |
| 2º muestra 05/01/2021 Coloración Ziehl-Neelsen | BAAR +++ |
| 3º muestra 06/01/2021 Coloración Ziehl-Neelsen | BAAR +++ |
Tabla 5. Secreción traqueal y PPD de paciente con tuberculosis congénita.
| Secreción traqueal 04/01/2021 Coloración Ziehl-Neelsen | BAAR +++ |
| PPD 06/01/2021 | 0 mm |
Tabla 6. Hemocultivo y urocultivo de paciente con tuberculosis congénita.
| HMCx2 04/01/2021 Desarrollo bacteriano | Negativo |
| Urocultivo 04/01/2021 Desarrollo bacteriano | Negativo |
| Con búsqueda de micobacterias Coloración Ziehl-Neelsen Cultivo (60 días) | No se observa BAAR Negativo |
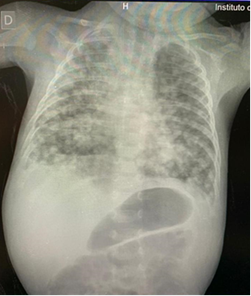
Figura 1. Radiografía de tórax al ingreso que muestra infiltrado nodulillar difuso bilateral compatible con diseminación miliar tuberculosa.

Figura 2. Ecografía abdominal a los 10 meses de tratamiento antibacilar que muestra múltiples formaciones nodulares calcificadas en hígado, siendo de mayor tamaño las ubicadas en el lóbulo derecho en comparación al lóbulo izquierdo; adenomegalias calcificadas en hilio hepático y paraaorticasx
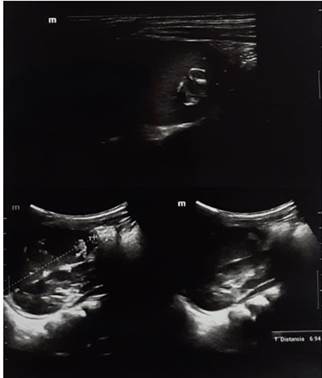
Figura 3. Ecografía cerebral a los 10 meses de tratamiento antibacilar que muestra dilatación leve de los ventrículos laterales en ambos lados.
DISCUCIÓN
La tuberculosis es una enfermedad prevalente en Paraguay, pero la infección congénita es raramente diagnosticada y requiere un alto grado de sospecha para diagnosticarse lo antes posible para evitar resultados fatales. Nuestro paciente fue un neonato con TB congénita con fiebre y tos de 3 días de evolución a los 24 días de edad con hepatomegalia como presentación clínica inicial, y la radiografía de tórax inicial reveló un infiltrado nodulillar difuso bilateral compatible con diseminación miliar tuberculosa. Su familia negó que la madre del neonato tuviera antecedentes de contactos de TB. La infección tuberculosa se confirmó mediante tinción de Ziehl-Neelsen BAAR +++ en 3 muestras seriadas de líquidos gástricos y secreción traqueal. Durante su seguimiento presentó alteración ecográfica a nivel del hígado evidenciando múltiples calcificaciones en lóbulo tanto derecho como izquierdo. Dado que la TB congénita sigue siendo una presentación rara de una enfermedad infecciosa frecuente en todo el mundo, solo se han notificado 300 casos hasta 1989. Desde entonces, se han notificado y documentado más de 80 casos nuevos adicionales. La mayor parte del estudio que se ha recopilado y analizado consiste en informes de casos individuales, series de casos y revisiones. La TB congénita se estima en un 2% en países con alta endemia de TB. Es menor en los países desarrollados, lo que la convierte en una enfermedad desconocida y difícil de evocar6. La tasa de mortalidad es muy importante y alta, cerca del 50 %, que a menudo se debe a un diagnóstico tardío seguido de un tratamiento tardío7, y un 22 % entre los pacientes que reciben quimioterapia8. Además, los recién nacidos que padecen TB congénita después de las 4 semanas de vida tienen una tasa de supervivencia del 77 % en comparación con el 44 % de supervivencia en los que la padecen antes de las 4 semanas9. Los criterios para presentar tuberculosis congénita, inicialmente propuestos por Beitke en 1935 y revisados por Cantwell y col. en 199410. define el cuadro cuando se cumple una o más de las siguientes condiciones: 1) lesión en la primera semana de vida, 2) complejo primario hepático con granulomas caseosos, 3) confirmación de tuberculosis en la placenta o tracto genital de la madre (útero o anexos) y 4) exclusión de exposición post-natal a foco bacilífero incluido el personal hospitalario. En Argentina se conocen los casos informados por González Faryna T y col.11 y Domínguez Jorge D. y col.12 y la evolución favorable se asoció al diagnóstico materno con la posibilidad de tratamiento específico precoz (Hospital Posadas).
La TB congénita puede transmitirse durante el período intrauterino o durante el parto. La transmisión de la TB congénita puede ser transplacentaria, donde el complejo primario está en el hígado, o por aspiración del líquido amniótico o material infectado, donde el complejo primario está en el pulmón o el intestino13. Los órganos infectados más comunes son el tórax y los órganos abdominales, lo que provoca fiebre, tos, dificultad respiratoria, hepatomegalia, ictericia, esplenomegalia y distensión abdominal. Otros órganos infectados pueden incluir el cerebro, el oído, los ganglios linfáticos y la piel14. La sospecha es difícil sin un diagnóstico materno adecuado, pues en el parto las madres aparentan estar sanas y la prueba de Mantoux neonatal suele ser negativa y no confiable. Hageman et al15 muestran solo 2 de 14 RN con pruebas cutáneas positivas. Chotpitayasunon T el al16 presenta 9 casos en 20 años de seguimiento con pruebas cutáneas positivas sólo en 2 niños, con una media de peso al nacer de 2.500g y mortalidad del 33%. Nuestro caso coincide con los hallazgos encontrados en el estudio de Hageman et al donde se refieren a la prueba de Mantoux neonatal como negativa y no confiable lo cual documentamos con nuestro paciente. En nuestro caso, la placenta no estuvo disponible para el diagnóstico, así como la madre no se realizó la prueba de Mantoux, en paralelo nuestro paciente no se realizó Quantiferón por falta de disponibilidad en el servicio. La distinción entre los patrones neonatales adquiridos de tipo congénito y los posnatales adquiridos es todavía un desafío para determinar en la práctica clínica y tiene sólo interés epidemiológico. La TB congénita es una enfermedad mortal sin tratamiento, y la tasa de mortalidad es alta incluso con un tratamiento adecuado. En nuestro caso, el diagnóstico se realizó con relativa rapidez, lo que resultó en una respuesta primaria favorable y el recién nacido se recuperó bien de la infección.
CONCLUSIÓN
El diagnóstico de TB perinatal requiere un alto índice de sospecha y es obligatoria una evaluación exhaustiva tanto de la madre como del bebé para establecer el diagnóstico. En ausencia de antecedentes asociados de TB materna, es difícil diagnosticar clínicamente la enfermedad, mientras que es fácil iniciar el tratamiento oportuno. Esta revisión destaca que cuando la TB materna no se trata, un diagnóstico tardío en los niños conduce a un pronóstico fatal y puede ocurrir la muerte después de una sepsis abrumadora. La necesidad de desarrollar protocolos específicos para hacer frente a esta situación es obligatoria. Finalmente, en caso de mala respuesta a la terapia antibiótica convencional en el recién nacido, especialmente en áreas endémicas para la tuberculosis o si la madre tiene factores de riesgo para la tuberculosis, los médicos deben estar atentos para evocar una tuberculosis congénita.
















