INTRODUCCIÓN
El género Alphavirus incluye a 31 especies virales1 cuyo genoma consiste en una cadena de ARN 49S de sentido positivo de aproximadamente 11.400 nucleótidos que codifica para las proteínas estructurales y no estructurales2. Se clasifican basados en las características fenotípicas y filogenéticas que los dividen en dos grupos: los virus artríticos o del Viejo Mundo, donde resaltan los virus O´nyong nyong (ONNV), Sindbis (SINV), chikungunya (CHIKV), Semliki Forest (SFV) y Ross River (RRV). Y por otro lado, los virus encefalíticos o del Nuevo Mundo con referentes como el virus Mayaro (MAYV), virus de encefalitis equina venezolana (VEEV), virus de encefalitis equina del este (EEEV) y el virus de encefalitis equina occidental (WEEV)2.
Para establecer y mantener un ciclo de transmisión viral tres factores son esenciales: el virus, un artrópodo que actúa como vector y un vertebrado, que actúa como hospedador2. Los vectores son casi en su totalidad mosquitos de la familia Culicidae de los géneros Aedes y Culex3. La mayoría de aquellos transmitidos por Culex tienen reservorios aviares y causan enfermedades similares a encefalitis en los huéspedes3. Los que son transmitidos por especies del género Aedes tienen por reservorios a primates o circulan entre humanos y mosquitos, sin un reservorio animal adicional en los llamados ciclos selvático o urbano3.
Los síntomas clínicos de las alfavirosis varían de fiebre y sarpullidos a patologías inflamatorias significativas incluyendo encefalitis y artritis severa2.
La distribución de los alfavirus es mundial y han sido reportados en todo el continente americano4. Entre los de importancia médica detectados en Brasil y Argentina se encuentran el VEEV (Pixuna y Río Negro), EEEV, WEE, MAYV, CHIKV (5). En lo que respecta a Paraguay, en junio del 2014 se reportó el primer caso de alfavirosis, específicamente atribuido al CHIKV6, siendo este el único de su género estudiado hasta la fecha en el país. Sin embargo, es de esperar que circulen otros alfavirus debido a la presencia de gran variedad de especies de mosquitos7 y de aves8 en el territorio que pueden actuar como vectores y reservorios, respectivamente además de las condiciones climáticas, la deforestación y otros factores favorables3.
La transcripción reversa de ARN seguida de una reacción en cadena de la polimerasa (RT-PCR) anidada es una herramienta rápida, sensible y específica en el estudio de virus(9-11). Los cebadores diseñados por Sánchez Seco et al.9 amplifican el gen nsP4, altamente conservado en todos los alfavirus2, lo que permite una detección genérica. Por ello, se diseñó este estudio con el objetivo de estandarizar y determinar el límite de detección de una técnica de RT-PCR anidada para la detección de alfavirus.
MATERIALES Y MÉTODOS
Diseño y muestras utilizadas
Se llevó a cabo un estudio observacional descriptivo de corte transverso.
Como control positivo para la optimización de la RT-PCR anidada para alfavirus se utilizaron aislados de las cepas de VEEV IAB (TC-83) y VEEV subtipo VI (AG80-663), que fueron cedidos por el Laboratorio de Arbovirus del Instituto de Virología JM Vanela de la Universidad Nacional de Córdoba, UNC, Argentina. Como control negativo se utilizó agua libre de RNAsa (Amresco, Canadá).
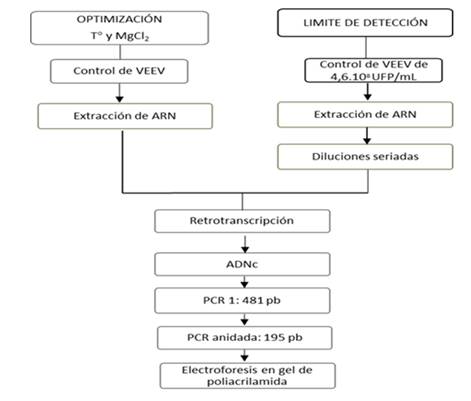
Para determinar el límite de detección se utilizó una cepa de VEEV subtipo VI (AG80-663) aislado de mosquitos Culex (Melanoconion) delpontei con título de 4,6.108 UFP/mL. En la Figura 1 se observa un flujograma del trabajo llevado a cabo.
Extracción de ARN viral
Para extraer ARN a partir de controles positivos se utilizó un kit comercial (QIAamp Viral RNA, USA) de acuerdo a las instrucciones del fabricante. El volumen de muestra utilizado para la extracción fue de 140 µl y la elución se realizó en un volumen total de 60 µL de tampón de elución agregado en dos etapas de 30 µL para aumentar el rendimiento. El ARN extraído fue almacenado a -70°C hasta su procesamiento.
Retrotranscripción
La retrotranscripción se realizó para la obtención de ADN complementario (ADNc) utilizando cebadores aleatorios que consisten en un ADN sintético de seis nucleótidos con secuencias aleatorias de las bases A, T, C y G (Biodynamics, Argentina).
Esta reacción se llevó a cabo de acuerdo a las instrucciones de la transcriptasa reversa (Thermo Scientific RevertAid H Minus Reverse Transcriptasa, EEUU)12. Se preparó la mezcla de reacción con 5 µl de la muestra de ARN extraído, 4 µL de buffer 5x, 8 µL de desoxinucleótidos trifosfato 2,5 mM (dNTPs: dATP, dTTP, dCTP, dGTP), 1 µL de cebador aleatorio, 1 µL de transcriptasa reversa 200 U/µl, 0,5 µL de inhibidor de ribonucleasa 40 U/µL (Termo Scientific RiboLock RNase Inhibitor, USA) y 0,5 µL de agua libre de ARNsa y de ADNsa (Amresco, Canadá). Los tubos, con un volumen final de 20 µL, fueron incubados en termociclador Esco Healthcare Swift - Max Pro a 25°C por 10 minutos, luego 120 minutos a 42ºC y 10 minutos a 70ºC12.
Optimización de la PCR anidada
La detección del genoma de alfavirus en controles positivos se realizó a través de la reacción de RT-PCR anidada genérica descripta por Sánchez Seco et al. en el 200110.
Posteriormente, los productos de amplificación obtenidos fueron sometidos a corrida electroforética en gel de poliacrilamida al 7% seguida de tinción con nitrato de plata descripta por Sanguinetti et al.13. Para identificar el tamaño de banda se utilizó marcador de 100 pares de bases (Thermo Scientific, USA). La técnica se probó con concentraciones diferentes de MgCl2 y diferentes temperaturas de alineamiento (Ta) para la PCR anidada.
Determinación del límite de detección
Para hallar el límite de detección fueron preparadas diluciones seriadas tomando 5 µL del ARN extraído y mezclándolo con 45 µL de agua libre de ARNsa (Amresco, Canadá). Las diluciones para llevar a cabo la reacción fueron entre 10-4 hasta 10-11 a fin de determinar hasta qué título es posible detectar el genoma de alfavirus.
Posteriormente se realizó la transcripción reversa, tal como ya se describió, y la amplificación del gen nsP4 por la RT-PCR anidada previamente optimizada. El límite de detección se calculó en base a la última dilución donde fue observada amplificación mediante la aparición de las bandas en gel de poliacrilamida teñido con nitrato de plata13. El ensayo se realizó por triplicado.
RESULTADOS
Estandarización de la RT-PCR anidada para detección de alfavirus
Respecto a la temperatura de alineamiento (Ta), al utilizar el control VEEV VI (AG80-663) se observó amplificación a ambas temperaturas testadas, 52ºC y 54ºC, sin diferencias en la intensidad de las bandas obtenidas. Por otro lado, con la utilización del control VEEV IAB (TC 83) a 52ºC se visualizaron bandas, tanto en la amplificación del control puro como de la dilución ½, pero fueron más tenues que las obtenidas con el control anterior. Sin embargo, a 54ºC no se visualizaron bandas. En la Figura 2 se observa la corrida electroforética de los productos de amplificación obtenidos en las diferentes temperaturas testadas con los dos controles utilizados.
Al comparar los resultados obtenidos con ambos controles se evidenció que en los casos donde se obtenía una banda de amplificación más tenue a 52ºC no se observó amplificación a 54ºC. Con base en estos resultados la temperatura seleccionada fue de 52ºC.
Con respecto a la concentración de MgCl2 para la reacción de PCR anidada, como puede apreciarse en la Figura 3, al no observarse diferencias en la definición de las bandas a dos diferentes concentraciones, se optó por utilizar la concentración final de 2,0 mM.
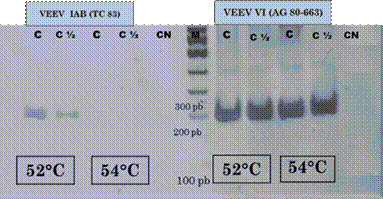
Figura 2. Electroforesis en gel de poliacrilamida al 7% de los productos amplificados para el fragmento del gen nsP4 de alfavirus probado a diferentes temperaturas. Carriles 1 al 5 control VEEV IAB (TC 83). (1) Control puro, Ta= 52°C. (2) Dilución 1:2, Ta= 52°C. (3) Control negativo, Ta= 52ºC. (4) Control positivo puro, Ta= 54°C (5) Dilución 1:2, Ta= 54°C. (6) marcador de 100 pb. Carriles 7 al 10 control VEEV VI (AG80-663). (7) Control puro, Ta= 52ºC. (8) Control diluido, Ta=52ºC. (9) Control puro, Ta=54ºC. (10) Control diluido, Ta=54ºC. (11) Control negativo Ta= 54ºC.
Finalmente, para la electroforesis en gel de poliacrilamida al 7%, efectuada según Sanguinetti et al.13, el tiempo de corrida fue optimizado a 120 minutos, ya que así se mejoró la visualización de las bandas.
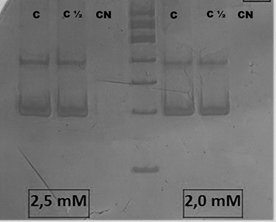
Figura 3. Electroforesis en gel de poliacrilamida al 7% de los productos amplificados para el fragmento del gen nsP4 de alfavirus utilizando el control VEEV VI (AG80-663). (1) Control puro, [MgCl2]= 2,5 mM. (2) Dilución 1:2, [MgCl2]= 2,5 mM (3) Control negativo. (5) marcador de 100 pb. (4) control puro [MgCl2]= 2,0 mM. (5) dilución 1:2 del control, [MgCl2]= 2,0 mM. (6) Control negativo.
Límite de detección
El límite de detección obtenido fue de 0,46 UFP/mL o 5,36.10-3 UFP/reacción. En la Figura 4 se puede observar que el control de alfavirus de la cepa VEEV (AG86-663) con título de 4,6.108 UFP/mL resultó positivo hasta la dilución 10-9.
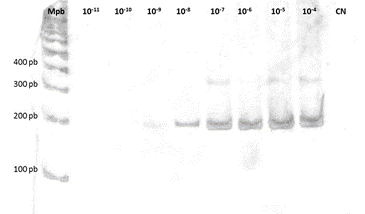
Figura 4. Límite de detección de la RT-PCR anidada para alfavirus utilizando los cebadores de Sánchez Seco et al.9. Electroforesis en gel de poliacrilamida al 7% de los productos amplificados para el fragmento del gen nsP4 de alfavirus. Carril 1: marcador de 100 pb (Mpb). Carriles 2 al 9: diluciones del control positivo de VEEV 663 desde 10-11 al 10-4 (ensayo realizado por triplicado).
DISCUSIÓN
Los alfavirus son considerados un problema de importante impacto en salud pública pudiendo causar desde casos febriles hasta casos fatales2,14,15. También constituyen un desafío en sanidad animal16. Esta técnica fue seleccionada debido a que ha demostrado ser útil para detectar alfavirus de varias especies9,10,11. En este trabajo fueron incluidas algunas modificaciones a la reacción descripta por Sánchez Seco et al.9, como la utilización de cebadores aleatorios en la retrotranscripción, lo cual confiere ciertas ventajas como el aprovechamiento de un mismo ADNc para otros fines como el estudio de otros arbovirus, ahorrando de esta forma tiempo y reactivos. Otra ventaja es que se evitan los múltiples descongelamientos que pueden conducir a la degradación del ARN viral.
Al utilizar la temperatura de alineamiento de 52ºC con el control VEEV VI (AG80-663), se observó amplificación con bandas de intensidad fuerte a ambas temperaturas, sin embargo, al utilizar el control VEEV IAB (TC 83) se evidenció una amplificación con bandas tenues a 52ºC y no se observó amplificación a 54ºC. Esto podría sugerir que a 52ºC la sensibilidad es favorecida pero, para confirmarlo debe hacerse el ensayo con controles de carga viral conocida. La temperatura de alineamiento elegida finalmente fue de 52ºC, tal como lo describieron Sánchez Seco et al.9.
Con respecto a la concentración final de MgCl2 para la PCR anidada, la reacción se probó a 2,0 mM y a 2,5 mM. Las bandas obtenidas presentaron las mismas características a ambas concentraciones por lo que se optó por utilizar la menor de ellas a diferencia del trabajo de Sánchez Seco et al.9, donde se utilizó 2,5 mM.
El límite de detección obtenido para la RT-PCR anidada fue de 0,47 UFP/mL, (5,36.10-3 UFP/reacción) que resulta menor al obtenido por otros autores, como Sánchez Seco et al.9 con un valor de 25 UFP/tubo para una RT-PCR anidada, y Pfeffer et al. con una sensibilidad 1,2 UFP/mL para una RT-PCR semi anidada (10); ambos trabajos también para detección genérica de alfavirus. Este resultado indica que la técnica podría ser capaz de detectar cargas virales muy bajas en una variedad de muestras humanas y animales y además, en el estudio de sus vectores mosquitos2,10,12.