Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Memorias del Instituto de Investigaciones en Ciencias de la Salud
versión On-line ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud v.12 n.2 Asunción dic. 2014
ARTICULO ORIGINAL
Estandarización de la técnica PCR-RFLP del gen mitocondrial cyt bcomo herramientapara la identificación de fuentes de alimentación de insectos hematófagos
Standardization of a PCR-RFLP technique based on mitochondrial cyt b gen as a tool to identify feeding sources of hematophagous insects
Chena L, *Nara E, Sánchez Z, Espínola E, Russomando G
Departamento de Biología Molecular y Genética, Instituto de Investigaciones en Ciencias de la Salud, Universidad Nacional de Asunción, Paraguay
RESUMEN
La identificación de la fuente de alimentación de insectos hematófagos puede proporcionar información sobre la capacidad vectorial, patrones de alimentación en condiciones naturales y proveer indirectamente datos sobre probables reservorios de enfermedades. Varias técnicas de identificación son empleadas, entre ellas las más utilizadas son las basadas en reacciones antígeno-anticuerpo. Actualmente, se han desarrollado ensayos moleculares, algunos de ellos permiten detectar e identificar solo sangre humana. Otros como la reacción en cadena de la polimerasa (PCR) del gen mitocondrial citocromo b (cyt b), que ha mostrado alto grado de sensibilidad y especificidad, permite detectar e identificar otras especies de vertebrados. El objetivo del trabajo fue estandarizar la técnica PCR-RFLP del gen mitocondrial citocromo b(cyt b) para determinar la fuente de alimentación sanguínea de insectos. Inicialmente se realizó un análisis bioinformático para la búsqueda y alineamiento de secuencias del gen cyt bde los potenciales huéspedes, con secuencias que están disponible en el GenBank. Se utilizaron 10 muestras de sangre de potenciales huéspedes vertebrados (humano, perro, gallina y roedor) y para la reacción de PCR se empleó un par de cebadores universales que amplifican una región del gen cyt b, seguido de cortes con dos enzimas de restricción (RFLP) (HaeIII y MwoI), generando patrones de electroforesis específicos para los diferentes vertebrados. Se logró la estandarización de la técnica de PCR del gen cyt b que fue capaz de detectar ADN de al menos 1 µL de sangre observándose el producto de amplificación de 358 pb. El análisis de los patrones de bandas obtenidos con el corte de las enzimas mostró los tamaños de fragmentos esperados para humano, gallina, perro y roedor. Estos resultados muestran la utilidad de la técnica PCR-RFLP del gen cyt bque, con un simple par de cebadores seguido del corte con dos enzimas de restricción, permitió diferenciar las diferentes especies de vertebrados de nuestro interés a través de los patrones obtenidos sin llegar a la secuenciación y también presenta la ventaja de utilizar pequeños volúmenes de sangre.
Palabras clave: PCR, RFLP, citocromo b, fuente de alimentación, leishmaniosis.
ABSTRACT
Identification of feeding sources of hematophagous insects can provide information about the vectorial capacity, feeding patterns in natural conditions and indirectly provide data on possible disease reservoirs preferences. Several identification techniques are used, most of them based on antigen-antibody reactions. Recently molecular assays have been developed and, some of these assays can detect and identificate only human blood. Other assays, like the polymerase chain reaction (PCR) based on mitochondrialcytochrome bgene, have shown high sensitivity and specificity allowing detection and identification of other vertebrate species. The aim of this study was to standardize a PCR-RFLP based on mitochondrial cytochrome bgene (cyt b) in order to determine blood meal from insects. Initially bioinformatic analysis was performed for searching and alignment of cyt bsequences of potential hosts available at the GenBank database. Blood samples from potential vertebrate hosts were used and PCR was performed using specific primers that amplify a region of cyt b gene. The products were digested with restriction enzymes (RFLP), generating specific electrophoresis patterns for several vertebrates.The PCR technique for cyt bgene was standardized allowing the detection of at least 1 µL of blood. The 359 bp band was correctly amplified and the profiles obtained after the enzyme digestion with HaeIII and MwoI were the expected for human, chicken, dog and rodents. These results showed the usefulness of the PCR-RFLP of cyt bgene that, with a single pair of primers followed digestion using two restriction enzymes, allowed the differentiation of the vertebrate species of our interest through the patterns obtained without sequencing having also the advantage of detecting small volumes of blood sample.
Keywords: PCR, RFLP, cytochrome b, feeding source, leishmaniasis.
INTRODUCCION
Las enfermedades transmitidas por vectores tienen gran importancia en la salud de la población humana y la mayoría se mantiene en la naturaleza debido a los animales que actúan como reservorios, agravando la situación los cambios ambientales y la deforestación ya que contribuyen al aumento del contacto entre el hombre y los animales silvestres (1). Identificar huéspedes reservorios de patógenos zoonóticos transmitidos por vectores siempre ha sido una labor intensa ya que requiere la captura de los potenciales huéspedes silvestres e infecciones experimentales con los patógenos de interés (1).
La identificación de la fuente de alimentación de insectos hematófagos surge como una alternativa, porque puede proporcionar información no solo sobre la capacidad vectorial de los insectos ylos patrones de alimentación en condiciones naturales, sino indirectamente incriminar a posibles reservorios (2-5). La mayoría de las Leishmaniasson patógenos zoonóticos, por lo que caracterizar los hábitos alimentarios de los flebótomos en zonas endémicas es crucial también para dilucidar los ciclos de transmisión y desarrollar estrategias eficaces de control (4).
El origen de la fuente de alimentación de insectos ha sido identificado por una variedad de métodos. Los más ampliamente utilizados son los basados en reacciones antígeno-anticuerpo (ej. por precipitación, difusión en gel y ELISA), pero presentan algunas limitaciones técnicas tales como la posibilidad de reacciones cruzadas entre las especies, el requerimiento para producir anticuerpos específicos a gran escala para un amplio rango de potenciales reservorios, el tiempo que consumen y la falta de sensibilidad (1,6,7). También han sido desarrolladas técnicas de biología molecular que han mejorado la sensibilidad y especificidad, sin embargo la mayoría de los estudios se ha centrado en la detección e identificación de sangre humana para estudios epidemiológicos o forenses, donde se utilizan marcadores genéticos hipervariables tal como minisatélites y microsatélites. Solo algunos estudios relacionados a preferencia alimentarias han sido desarrollados para detectar e identificar otras especies de vertebrados (2), la mayoría está dirigida principalmente al ADN mitocondrial (ADN mt) que se encuentra en un gran número de copias por célula y están basadas en el análisis del gen citocromo b(cyt b) que, en combinación con el corte con enzimas y el análisis del polimorfismo de los fragmentos de restricción (PCR-RFLP), ha sido ampliamente utilizado en estudios filogenéticos de vertebrados (2-4, 6-11), también ha sido desarrollado un ensayo con alta sensibilidad y especificidad basado en la amplificación específica y análisis por secuenciación del gen prepronociceptin (PNOC) que permite la identificación de 64 especies de mamíferos cuyas secuencias están publicadas en el Gen-Bank, pero tiene la desventaja de requerir necesariamente de secuenciación (2).
En este estudio elegimos la PCR-RFLP del gen cyt bya que el ADN mt presenta muchas ventajas, evoluciona más rápido que el ADN nuclear lo que produce regiones con suficiente variación dentro de una población, pero lo suficientemente conservadas para establecer relaciones filogenéticas (7,10,11) y en nuestro caso nos permitiría diferenciar las especies de vertebrados de nuestro interés.
En nuestro país los reservorios silvestres de la leishmaniosis siguen siendo poco conocidos. En estudios previos fueron descritas algunas especies de roedores y marsupiales que fueron encontrados infectados naturalmente con Leishmania,en zonas endémicas de la enfermedad (12-13). Al igual que en países de la región como Brasil, muchas especies de roedores de los géneros Akodon, Oryzomys, Proechimys, Bolomysy Rattustambién fueron encontrados infectados naturalmente con Leishmania y algunas especies han sido incriminadas como reservorios naturales (14-15), de ahí la importancia de contar con otras herramientas que ayuden a incriminar a estos animales como potenciales reservorios y se plantea realizar este trabajo con el objetivo de estandarizar la técnica PCR-RFLP del gen mitocondrial cyt b, ya descrita por Oshagui et al. (8) para ser aplicada en la identificación de la fuente de alimentación de flebótomos y que estos datos contribuyan al conocimiento de los patrones de transmisión de Leishmaniaentre las diferentes especies de flebótomos y de animales, potenciales vectores y reservorios de la enfermedad.
MATERIALES Y METODOS
1. Muestras: en este estudio descriptivo de corte transverso fueron utilizadas 10 muestras de sangre de vertebrados: de perros (N=3) y gallinas (N=3) proporcionadas por laboratorios de análisis clínicos (Diagnovet, Facultad de Veterinaria), de humanos (N=2) (voluntarios) y de roedores (BALB/c) (N=2) proveídas por el bioterio del IICS. Las muestras fueron colectadas con EDTA en un volumen de 1,5 ml y conservadas a -20°C hasta el momento de la extracción de ADN. El protocolo fue aceptado por los Comités Científico y Ético del Instituto de Investigaciones en Ciencias de la Salud (IICS-UNA).
2. Extracción de ADN: la extracción de ADN de las muestras de sangre humana, perro, gallina y roedores se realizó por el método de fenol-cloroformo. Las muestras fueron sometidas previamente a una lisis de proteínas mediante un tampón de lisis (10 mM Tris, 10% SDS, 200 µg/mL), con proteinasa K (concentración final: 200 µg/mL). El proceso de extracción consistió en dos pasos de fenol-cloroformo (25:24) y uno de cloroformo puro final. El ADN fue precipitado con acetato de sodio 3M, pH 5.3, etanol99,5% p.a. helado y una noche a –20°C. Finalmente, el producto de la extracción fue resuspendido en 100 µl de agua destilada y empleado como templado para la reacción de PCR. Esta metodología desarrollada se basó en la combinación de diversos protocolos pre establecidos y modificados, tomando como referencia la propuesta por Sambrook et al. (16).
3. Cuantificación del ADN: la cuantificación de ADN de las muestras de sangre de los diferentes vertebrados fue realizada por la medida de absorbancia a 260 nm. Se realizó la lectura de la absorbancia utilizando un cuantificador de ADN (Biowave DNA WPA, UK), teniendo en cuenta la relación 1 OD 260 nm equivale a 50 ng/µL de ADN (16).
4. Reacciones de PCR:para la amplificación se utilizaron los cebadores cyt b1:5´-CCC CTC AGA ATG ATA TTT GTC CTC A-3´ (Forward) cyt b2:5´-CCA TCC AAC ATC TCA GCA TGA TGA AA-3´ (Reverse) publicados por Oshaghi et al.(8) que amplifican el gen mitocondrial citocromo b(cyt b) y el siguiente esquema de termociclado: 5 min a 95°C, seguido de 35 ciclos de 30 seg a 95°C, 30 seg a 58°C, 1 min a 72°C. Se utilizó un termociclador Biorad MJ-PTC 200 (MJ Research, USA). La mezcla de reacción contenía: Buffer1X, 1,5 mM MgCl2, 0,2 mM dNTPs (BIOLINE, UK), 0,5 mM de cada cebador, 1 unidad de Taq polimerasa (BIOROM, Alemania)para un volumen total de 50 µL. Se utilizó entre 50 y 150 ng de ADN de muestras de sangre para cada reacción.
5. Análisis de los productos de amplificación: los productos amplificados de aproximadamente 358 pb fueron analizados por electroforesis en geles de agarosa al 2%, empleando solución tampón TAE (0,04 M Tris-acetato, 0.001 M EDTA). La electroforesis se realizó en cubas MUPID-3 (Japón) a 100 Volts durante 30 minutos. El tamaño de las bandas se verificó corriendo en paralelo un marcador de tamaño molecular en escalera de 100 pb (BIOLINE, UK) y visualizados con luz UV previa tinción con bromuro de etidio (5 µg/mL). Los geles de agarosa fueron registrados en formato digital.
6. Digestión enzimática de los productos de amplificación: los productos de PCR obtenidos con los cebadores cyt b1y cyt b2 fueron digeridos con las enzimas de restricción HaeIII (10U/µL) a 37 °C y MwoI (10 U/µL) (New England Biolabs, UK)a 60°C durante toda la noche en estufa y los patrones obtenidos fueron visualizados por electroforesis en geles de agarosa al 2%, utilizando solución tampón de corrida TAE(0,04M Tris-acetato, 0,001 M EDTA) en cubas MUPID-3 (Japón) a 100 Volts durante 30 minutos y para visualizar las bandas de tamaño muy próximos entre sí se realizó electroforesis en geles de acrilamida al 10%, utilizando solución tampón de corrida TBE (0,045M Tris-borato, 0,001 M EDTA) durante una hora y 30 minutos a 5 Watts constante equivalente a 100 Volts. Para la confirmación de los tamaños de los productos de la digestión los patrones fueron comparados con un marcador de tamaño molecular de 100 bp (BIOLINE, UK) y visualizados con luz UV previa tinción con bromuro de etidio (5 µg/mL). Los resultados fueron registrados en formato de fotos digitales y analizados con el software UN SCAN IT GEL 6.1 (Silk Scientific, USA).
7. Alineamiento de secuencias de cebadores de cyt be identificación de sitios de corte con enzimas de restricción: para obtener información del apareamiento entre la secuencia de los cebadores cyt b1 (Figura 1a) y cyt b2 (Figura 1b) con regiones correspondientes en la secuencia del mismo gen en vertebrados, potenciales fuentes de alimentación de flebótomos, se realizó la búsqueda de secuencias similares utilizando el algoritmo blast (17) del National Centre of Biotechnology Information (www.ncbi.nlm.nih.gov). Se incluyeron nueve secuencias: de humano (Homo sapiens)(N=1), perro (Canis familiaris) (N=1), gallina (Gallus gallus)(N=1), roedores (N=5) (Mus musculus,Oryzomys couesi, Calomys callosus, Oligoryzomys nigripes,Holochilus chacarius)y marsupial(Didelphis virginiana)(N=1) (Figuras 1a y 1b). Los sitios de restricción teóricos del producto de amplificación de 358 pb fueron analizados con las enzimas Hae II, Hae III, Hind III, EcoR I, Rsa I y Mwo I utilizando la base de datos NEBCutter v2.0 (http://tools.neb.com/NEBcutter2/index.php). Sobre la base de estos resultados preliminares, dos enzimas (Hae III y Mwo I) fueron seleccionadas para su posterior análisis experimental. La selección de Hae III y Mwo I para los ensayos experimentales se basó en la capacidad para discriminar las especies de interés con el número mínimo de enzimas disponibles en nuestro laboratorio.
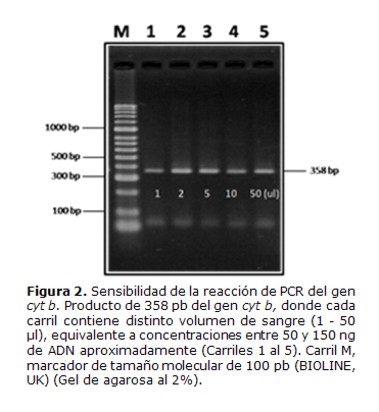
8. Pruebas de sensibilidad y especificidad de la PCR del gen cytb: para la sensibilidad se realizó la reacción de PCR con ADN extraído de sangre humana, usandoun volumen de sangre comprendido entre1 y 50 µL, equivalente a cantidades de ADN en el rango entre 50 y 150 ng aproximadamente. La especificidad de la reacción fue determinada por la capacidad de la técnica para diferenciar vertebrados (humano, perro, roedor y gallina) con el análisis de los tamaños de los fragmentos de restricción en correspondencia con el análisis bioinformático del corte con las enzimas Hae III y Mwo I.
RESULTADOS
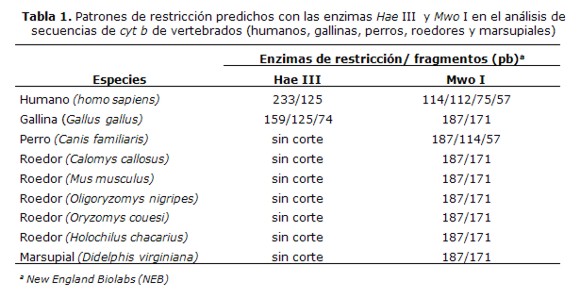
1. Predicción de patrones de corte del producto de 358- pb del gen cyt b, con las enzimas Hae III y Mwo I
La predicción de los patrones de restricción se realizó con el alineamiento de las secuencias del gen cyt b de las especies de vertebrados de interés con las secuencias de referencia del GenBank y la identificación teórica de los sitios de restricción con 6 enzimas (datos no mostrados). Los diferentes tamaños de fragmentos generados conlas enzimas Hae III y Mwo I están indicados en la Tabla 1.
2. Ensayos de sensibilidad de la técnica de PCRdel gen cyt b para detección desangre de vertebrados
Se realizaron ensayos de sensibilidad de la reacción de PCR, utilizando ADN obtenido a partir de sangre humana. La técnica fue capaz de detectar al menos 1µL de sangre aproximadamente 50 ng de ADN, dando el producto de amplificación esperado de 358 pb (Figura 2).
3. Ensayos de especificidad de la técnica de PCRdel gen cyt b para detección de ADN de distintos vertebrados
Se realizaron ensayos para determinar la capacidad de la técnica para diferenciar vertebrados, amplificando ADN de sangre humana, perro, gallina y roedores y el análisis de los tamaños de los fragmentos de restricción (RFLP) en correspondencia con el análisis bioinformático del corte con las enzimas Hae III y Mwo I (Tabla 1).
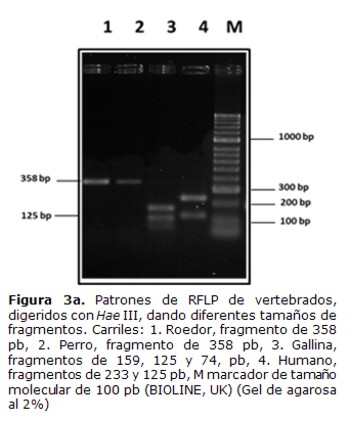
El análisis de restricción del producto amplificado de 358 pb, con la enzima Hae III mostró fragmentos de 233 y 125 pb, que corresponden al patrón de sangre humana, fragmentos de 159, 125 y 74 pb que corresponden al patrón de gallina y el fragmento de 358 pb que no fue cortado que corresponde a lo esperado para perros y la mayoría de los roedores, que no tienen sitios de restricción para esta enzima (Tabla 1) (Figura 3a). Entre los roedores existen especies que pueden presentar sitios de corte para Hae III (datos no mostrados), por lo cual se empleó la enzima Mwo I que muestra un patrón específico para todos los roedores (Tabla 1).
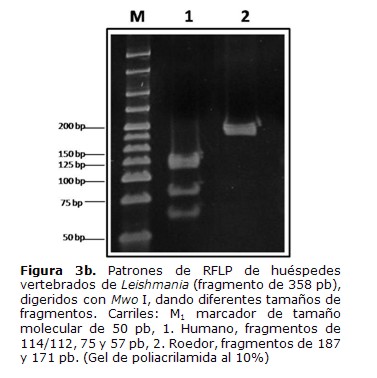
El análisis de los patrones de bandas obtenidos con el corte de la enzima Mwo I mostró fragmentos de 114/112, 75 y 57 pb que corresponden al patrón esperado parahumanos y fragmentos de 187 y 171 pb que corresponden al patrón esperado para roedores y gallina (Tabla 1) (Figura 3b).
DISCUSIÓN
Varios aspectos epidemiológicos están relacionaos con la identificación de las fuentes de alimentación de los insectos, por un lado la preferencia por algún huésped puede dar una idea indirecta de probables reservorios y por otro lado, el hábito o la conducta alimentaria de los mismos, lo que les permitiría actuar como vectores. Con este trabajo nuestro objetivo principal fue estandarizar la técnica PCR-RFLP del gen cyt bya descrita por Oshagui et al., previo análisis bioinformatico de los sitios de restricción para seis enzimas (Hae II, Hae III, Hind III, EcoR I, Rsa I y Mwo I), y seleccionar el menor número de enzimas que nos permita discriminar vertebrados de nuestro interés.
Los resultados que obtuvimos mostraron que es posible emplear la técnica con dos enzimas seleccionadas (Hae III y Mwo I), que permitieron diferenciar sangre humana y de otros vertebrados que pueden ser fuentes de alimentación de los flebótomos, vectores de la leishmaniosis. Además, presenta varias ventajas, es una técnica relativamente sencilla y utiliza solo un par de cebadores específicos que amplifican una región del gen cyt bpresente en varios vertebrados. Estos cebadores ya habían sido utilizados exitosamente en diversos estudios con ADN mitocondrial de mamíferos y aves incluyendo humanos, bovinos, roedores, oveja, cabra, caballo, cerdo y pavo (1,2,6-8,18). Otra ventaja es que permite la identificación de la sangre ingerida por los insectos a través de los patrones obtenidos de los cortes con enzimas sin llegar a la secuenciación y aunque los métodos inmunológicos son los más utilizados, tienen limitantes: consumen mucho tiempo, baja sensibilidad y requieren de la preparación de antisueros específicos para cada huésped vertebrado (1,8,9). Por el contrario, en nuestro estudio demostramos la utilidad de la técnica, las especies fueron diferenciadas y se pudo discriminar en grupos de vertebrados: humanos, perros, gallinas y roedores, orientando así hacia posibles reservorios, esto en concordancia con estudios anteriores con otros insectos hematófagos (8,9). Sin embargo, en los casos donde existe un gran número de potenciales huéspedes y se requiere una identificación de especies específicas, probablemente la elección sea directamente la secuenciación nucleotídica (4).
También demostró ser muy sensible siendo capaz de detectar pequeñas cantidades de ADN logrando la amplificación de 1 µL de sangre aproximadamente de 50 ng de ADN (1). Se debe tener en cuenta, sin embargo, que estudios realizados en mosquitos alimentados experimentalmente, mencionan otros parámetros además de la cantidad de sangre, el tiempo de almacenamiento, las condiciones químicas y físicas de almacenamiento, que pueden ser críticos para aislar y detectar intacto el ADN de los huéspedes y ser empleado en las reacciones de PCR (8).
Por otro lado constituye una limitación que los roedores, vertebrados particularmente importantes en el mecanismo de transmisión de la leishmaniosis, comprenden algunas especies que pueden presentar sitios de corte para HaeIII, pero se puede recurrir al uso de otras enzimas como Mwo I, Rsa I, Alu I e Hinf I que muestran patrones específicos para tales especies de roedores, según el análisis bioinformático realizado (datos no mostrados).
Finalmente, esta técnica estandarizada puede ser aplicada directamente a los flebótomos u otros insectos hematófagos, para detectar la sangre ingerida y en el caso de la leishmaniosis combinando con la identificación de las especies de flebótomos y la detección de infección natural por Leishmania provee información valorable sobre el rol vectorial de las diferentes especies de flebótomos. Por otro lado, el conocimiento de la identidad de los animales potenciales huéspedes, sería muy valioso en el diseño e implementación de sistemas de control y vigilancia de enfermedades transmitidas por vectores.
AGRADECIMIENTOS
Al Dr. Rolando Oddone coordinador del proyectoLeishEpiNetSA(UE). A las Dras, Paola Vera y Raquel Pedrozo por la provisión de muestras de sangre de perros y gallinas.
REFERENCIAS BIBLIOGRÁFICAS
1.Che Lah EF, Ahamad M, Haron MS, Ming HT. Establishment of a molecular tool for blood meal identification in Malaysia. Asian Pac J Trop Biomed. 2012; 2(3): 223-7. [ Links ]
2. Haouas N, Pesson B, Boudabous R, Dedet J, Babba H, Ravel C. Development of a molecular tool for the identification of Leishmaniareservoir hosts by blood meal analysis in the insect vectors. Am J Trop Med Hyg. 2007; 77(6): 1054-9. [ Links ]
3. Pizarro JC, Lucero D, Stevens L. A method for the identification of guinea pig blood meal in the Chagas disease vector, Triatoma infestans. Kinetoplastide Biology and Dis 2007; 6(1):1-6. [ Links ]
4.Abbasi I, Cunio R, Warburg A. Identification of Blood Meals Imbibed by Phlebotomine Sand Flies Using Cytochrome b PCR and Reverse Line Blotting. Vector Borne Zoonotic Dis. 2009; 9(1): 79-86. [ Links ]
5. Ngo KA, Kramer LD. Identification of mosquito bloodmeals using polymerase chain reaction (PCR) with order-specific primers. J Med Entomol. 2003; 40(2): 215-22. [ Links ]
6. Steuber S, Abdel-Rady A, Clausen P. PCR-RFLP analysis: a promising technique for host species identification of blood meals from tsetse flies (Diptera: Glossinidae). Parasitol Res. 2005; 97(3): 247-54. [ Links ]
7. Maleki-Ravasan N, Oshaghi M, Javadian E, Rassi Y, Sadraei J, Mohtarami F. Blood Meal Identification in Field-Captured Sand flies: Comparison of PCR-RFLP and ELISA Assays. Iran J Arthropod Borne Dis. 2009; 3(1):8-18. [ Links ]
8. Oshaghi MA, Chavshin AR, Vatandoost H. Analysis of mosquito bloodmeals using RFLP markers. Exp Parasitol. 2006; 114(4): 259-64. [ Links ]
9. Bosseno MF, Garcia LS, Baunaure F, Magallon- Gastelum E, Gutierrez MS, Kasten FL. Identification in triatomine vectors of feeding sources and Trypanosoma cruzi variants by Heteroduplex Assay and a Multiplex Miniexon Polymerase Chain Reaction. Am J Trop Med Hyg. 2006; (74): 303-5. [ Links ]
10. Mota J, Chacon JC, Gutierrez AF, Sánchez V, Wirtz A, Ordoñez R et al. Identificatioon of Blood Meal Source and Infection with Trypanosoma cruziof Chagas Disease Vectors using a Multiplex Cytocrhrome b Polymerase Chain Reaction. Vector Borne and Zoonotic Diseases. 2007; 7 (4): 617-27. [ Links ]
11. Pizarro JC, Stevens L. A New Method for Forensic DNA Analysis of the Blood Meal in Chagas Disease Vectors demonstrated using Triatoma infestansform Chuquisaca, Bolivia. Plos One. 2008; 3 (10): e3585. [ Links ]
12. Chena L, Nara E, Oddone R, Canese A, Russomando G. Identificación de posibles reservorios silvestres de la leishmaniosis tegumentária empleando técnicas moleculares. VII Congreso Paraguayo de Infectologia. 2009 Nov 6-7; Asunción: Sociedad Paraguaya de Infectología; 2009. [ Links ]
13. Oddone R, Drechsel U, Chena L, Drechsel S, Acosta ME, Nara E. Roedores y marsupiales como posibles reservorios silvestres de Leishmaniaen Paraguay. I Jornada Paraguaya de Mastozoologia; 2013 Ago 1-3; Asunción: Sociedad de Mastozoologia del Paraguay;2013. [ Links ]
14. Grimaldi G, Tesh RB and McMahon-Pratt D. A review of the geographic distribution and epidemiology of leishmaniasis in the world. Am J Trop Med Hyg. 1989; 41(6): 687-725. [ Links ]
15. Oliveira FS, Pirmez C, Pires MQ, Brazil RP, Pacheco RS. PCR-based diagnosis for detection of Leishmania in skin and blood of rodents from an endemic area of cutaneous and visceral leishmaniasis in Brazil. Vet Parasitol. 2005; 129(3-4): 219-27. [ Links ]
16. Sambrook J, Fritsch E, Maniatis T. Molecular cloning: A laboratorymanual. New York: Cold Spring Harbor Laboratory Press; 1994. [ Links ]
17. Altschul SF, Madden TL, Schäffer AA, Zhang J, Zhang Z, Miller W, et al. Gapped BLAST and PSI-BLAST: a new generation of protein database search programs. Nucleic Acids Res. 1997; 25(17): 3389-402. [ Links ]
18. Bellagamba F, Moretti V, Comincini S, Valfre F. Identification of Species in Animal Feedstuffs by Polymerase Chain Reaction-Restriction Fragment Length Polymorphism Analysis of Mitochondrial. J Agric Food Chem. 2001; 49: 3775-81. [ Links ]
*Autor Correspondiente: Dra. Eva Nara. Departamento de Biología Molecular y Genética, Instituto de Investigaciones en Ciencias de la Salud, UNA. San Lorenzo Paraguay
E-mail: megunara@hotmail.com
Fecha de recepción: junio 2013; Fecha de aceptación: agosto 2014