INTRODUCCIÓN
El crecimiento de la población humana ha ejercido una presión enorme sobre las comunidades naturales, resultando en un significativo desgaste de la mayoría de los ecosistemas del planeta. Consecuentemente, esfuerzos para preservar la mayor cantidad de especies están siendo aplicados en todos los países, para lo cual es necesario conocer la diversidad con la que cuenta cada región, y posteriormente desarrollar y aplicar planes de conservación eficaces y adecuados para las especies y comunidades presentes en las mismas 1. La República del Paraguay no está exenta de esta crisis ecológica. La deforestación, el cambio de uso de los suelos con fines agropecuarios, el crecimiento y expansión de la población hacia zonas rurales, son tan solo algunas de las causas de la destrucción acelerada de los hábitats naturales, por lo cual, la conservación de la biodiversidad en el Paraguay es un asunto de gran interés social y ambiental. En este sentido, la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (UICN), constituye una poderosa herramienta para informar y catalizar las acciones en pro de la conservación de la biodiversidad 2.
Más de 150 300 especies han sido evaluadas para la Lista Roja 2. En lo que respecta a plantas, el análisis de especies recientemente se ha duplicado con la inclusión de unas 19 000 evaluaciones entre 2017 y 2019 3. No obstante, existe poca o nula información de estudios de campo para la mayoría de las especies vegetales, lo que representa una gran limitación en el momento de evaluar su estado de conservación; a esto se suma la falta de financiación para trabajo de campo y la falta de experiencia para la evaluación de datos, lo que dificulta aún más las acciones de conservación 4.
Como en las poblaciones vegetales las observaciones in situ son a menudo limitadas y las identificaciones pueden ser inexactas, debido a la gran diversidad florística, la utilización de ejemplares de herbario es muy útil 5. Los especímenes de herbario son relativamente estables e incluyen metadatos (registrados durante la colección), como observaciones ecológicas, nombre del colector y número de colección, fecha, localidad y coordenadas geográficas. Rivers et al. 6, mencionan que con los datos de herbario es posible analizar el estado de conservación las especies según el Criterio B de UICN, que se enfoca en la distribución geográfica, considerando aspectos como la extensión de las poblaciones, el área de ocupación, la fragmentación del hábitat y el número de localidades o subpoblaciones conocidas 7. Además, con la utilización de herramientas como GeoCAT (Geospatial Conservation Assessment Tool) 8, es posible facilitar el proceso de clasificación de especies en categorías de UICN a partir de los mismos datos. Esta herramienta ha sido ampliamente utilizada por botánicos para realizar evaluaciones del estado de conservación de especies a nivel global, y es citada en artículos científicos más de 100 veces al año 3, en análisis de conservación preliminares 9-12 y detallados 13-19.
En cuanto a la riqueza de la flora paraguaya, Mereles 20 estima que cuenta con unas 6500-7000 especies de plantas vasculares, mientras que Zuloaga et al. 21 numeran un total de 5296 especies, distribuidas entre 197 familias y 1356 géneros. Sin embargo, entre los años 2008 y 2018 se han descrito 15 nuevas especies para la ciencia originarias de Paraguay 9,22. La Secretaría del Ambiente 23 había reconocido tan solo 23 especies como endémicas (de distribución limitada dentro del territorio paraguayo), mientras que Peña-Chocarro y De Egea 22, presentaron un listado de 374 taxa, equivalente a 328 especies de plantas y 46 entidades subespecíficas, estrictamente restringidos al territorio nacional. Este mismo trabajo destaca el escaso conocimiento que existe sobre las especies de plantas endémicas del país, o compartidas en áreas transfronterizas. A esto se suma que, por lo general, las especies endémicas constituyen un objetivo muy especial para la conservación, porque al tener una distribución muy restringida su supervivencia depende de los países que las albergan.
Las evaluaciones sobre el estado de conservación de la flora aún son escasas en el país. Aunque se cuenta con un listado oficial de 132 especies amenazadas, emitido por resolución del Ministerio del Ambiente y Desarrollo Sostenible (MADES) 24, éstas en su mayoría no cuentan con estudios o análisis de conservación detallados; los realizados son los de De Egea et al. 1 y Kubota et al. 25, en los que analizaron 82 y 2 especies, respectivamente.; solo 7 de las especies estudiadas por De Egea et al. se encuentran en el listado del MADES. Aún queda mucho trabajo para evaluar especies importantes, como el caso de las endémicas, raras y aquellas bajo sospecha de encontrarse amenazadas. Tales evaluaciones sentarían las bases para las normativas y conservación de éstas, acorde con las políticas ambientales del país.
Este trabajo busca contribuir con los esfuerzos nacionales e internacionales enfocados en la ambiciosa meta de incrementar las evaluaciones del estado de conservación de especies para la Lista Roja de UICN, con el objetivo principal de analizar la distribución y el estado de conservación de las siguientes especies de plantas endémicas presentes en Paraguay; Baccharis illinitoides Malag., Casimirella guaranitica Hassler, Neltuma rojasiana (Burkart) C.E. Hughes & G.P. Lewis y Piptadeniopsis lomentifera Burkart.
MATERIALES Y MÉTODOS
2.1 Área de estudio
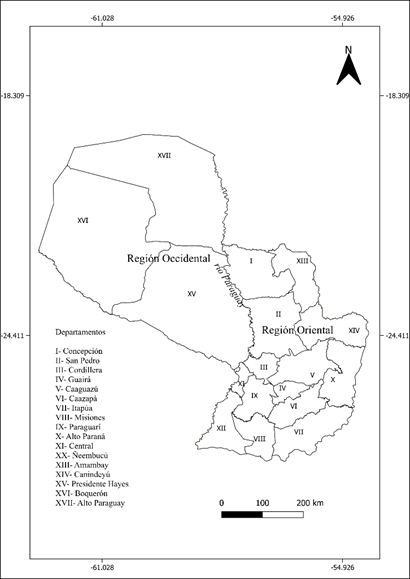
La República del Paraguay (Fig. 1), se ubica en el centro de Sudamérica (25°18’00” S; 57°38’00” O), y se divide en dos regiones; la Occidental o Chaco, que representa el 61% del territorio; y la región Oriental, en el 39% restante del territorio 26. El clima se clasifica en tres tipos; al sur de la región Oriental predomina el clima subtropical húmedo mientras que al norte de esta región predomina el clima tropical de sabana, al igual que en casi toda la región Occidental, excepto por el noroeste, donde el clima predominante es el semiárido cálido. En general, las precipitaciones anuales van desde 400 mm en el noroeste a 2000 mm en el sureste, distribuyéndose equitativamente en la región Oriental, pero en la región del Chaco el 80% de la lluvia cae durante los meses de verano. La temperatura media anual es de 22,5°C, pero varía entre el rango de 20°C a 25°C, con una máxima de 45°C (en el año 2009) y una mínima de -7°C (en el año 2000) 27. Paraguay no cuenta con costas sobre océanos, pero se encuentra dentro del sistema de drenaje del Río de la Plata con sus dos ríos principales, el río Paraguay (que divide al país en las regiones Oriental y Occidental) y el río Paraná (que fluye por el este del país hacia el sur-suroeste). Además, posee una variedad de cauces hídricos, distribuidos inequitativamente en ambas regiones, que contribuyen a determinar las características locales de la flora 26.
El Paraguay, a pesar de ser un país relativamente pequeño (406 752 km² de superficie), posee una gran riqueza florística. Esto se debe a que, en su territorio, se distribuyen en forma de mosaico varios tipos de vegetación 22,28,29; en la región Oriental se encuentran las ecorregiones del Bosque Atlántico del Alto Paraná, el Cerrado, una extensión del Chaco húmedo, y áreas de pastizales naturales y humedales, además de extensas áreas con características ecotonales; mientras que en la región Occidental se encuentran las ecorregiones de Chaco seco, Chaco húmedo, Pantanal, además de áreas con médanos y cerrados. Spichiger et al. 30 califican al territorio paraguayo como una zona ecotonal en donde varias floras y tipos de vegetación confluyen y compiten mutuamente.
La flora paraguaya presenta niveles relativamente bajos de endemismos en comparación con los países vecinos, con menos de 6,5% de su flora compuesta por especies endémicas 22, contra 16,9% reportada para Argentina, 39,1% para Chile y 15,29% para Bolivia 21,31. Este bajo nivel de endemismos ya había sido señalado por Bernardi 32 y Spichiger et al. 30, atribuido al hecho de que Paraguay no presenta ni la topografía, ni la posición biogeográfica que favorecerían el aislamiento y subsecuente especiación. Además, los ríos Paraguay, Paraná y Pilcomayo actúan como vías de dispersión de la flora 32,33. Aun así, el conocimiento sobre las especies endémicas y su distribución representa un objetivo importante para las iniciativas nacionales y globales de conservación 22.
2.2 Selección de especies para el estudio
Para la selección de especies se tomó como línea de base al trabajo de Peña-Chocarro y De Egea 22, en donde se mencionan 374 taxa endémicos del Paraguay. De este listado, fueron seleccionadas cuatro especies endémicas en base a dos criterios; a) la disponibilidad de ejemplares de herbario en instituciones nacionales que permita la revisión morfológica y taxonómica para caracterizar a las especies; y b) la disponibilidad de más de cinco ejemplares de herbario en instituciones nacionales e internacionales, con el fin de garantizar que el análisis pueda contar con una suficiente cantidad de datos. Las especies seleccionadas son las siguientes; Baccharis illinitoides Malag. (Asteraceae), Casimirella guaranitica Hassl. (Icacinaceae), Neltuma rojasiana (Burkart) C.E. Hughes & G.P. Lewis (Fabaceae) y Piptadeniopsis lomentifera Burkart (Fabaceae).
2.3 Muestreo
El muestreo de las especies de interés incluyó la revisión y análisis de ejemplares de herbario, con la aplicación de técnicas de taxonomía tradicional, el uso de lupa estereoscópica y de claves dicotómicas para la identificación certera de las identidades. Se visitaron las colecciones de la Universidad Nacional de Asunción (FCQ), del Centro de Estudios y Colecciones Biológicas para la Conservación (PY) y de la Facultad de Ciencias Exactas y Naturales (FACEN, UNA), y se consultaron las imágenes disponibles en los sitios de internet de los herbarios del Field Museum of Natural History (F), Conservatoire et Jardin botaniques de la Ville de Genève (G), Missouri Botanical Garden (MO), entre otros 34-37, además de la literatura y de la base de datos GBIF 38. Los especímenes fueron debidamente caracterizados en su morfología, taxonomía y ecología, y posteriormente incorporados a una base de datos donde fue registrado lo siguiente: identidad botánica del ejemplar, colectores y su número de colección, fecha, localidad de colecta con coordenadas geográficas y datos ecológicos. Para los ejemplares sin localidad consignada o georreferenciación exacta se calculó una aproximación de las mismas mediante la utilización del programa Google Earth Pro 39.
Se elaboraron mapas de distribución con el software QGIS 3.32.3 40 y se desarrolló un análisis del estado de conservación de las mismas, basado en el criterio B de UICN 7 y la herramienta GeoCAT 8. Se obtuvieron valores, expresados en km2, de la extensión de presencia (EOO; área contenida dentro de los límites imaginarios continuos más cortos que pueden dibujarse para incluir todos los sitios conocidos, inferidos o proyectados en los que un taxón se encuentre presente) y del área de ocurrencia (AOO; área dentro de la extensión de presencia que es ocupada por un taxón). Las colecciones de herbario fueron discriminadas entre históricas y recientes 25; se consideraron como históricas a las colecciones realizadas entre el siglo XIX y 1979, y como recientes a las realizadas a partir del año 1980 en adelante. Se evaluó el estado del hábitat de las localidades registradas en función a los cambios ecológicos ocurridos entre los años 1986 y 2022, y a la proyección de cobertura para el 2030, a través de la comparación de datos y mapas oficiales de cobertura del Instituto Forestal Nacional y MADES 41-43. Finalmente, se propuso una categoría de estado de conservación para cada especie, con la correspondiente fundamentación.
RESULTADOS
Caracterización y análisis de Baccharis illinitoides
Familia: ASTERACEAE (Fig. 2A) Baccharis illinitoidesMalag., Mem. Soc. Ci. Nat. La Salle 37: 138 (1977).
Descripción: Arbustos o subarbustos de 1-2 m de altura, glabros. Tallos rojizos, glabrescentes en la parte superior, no alados. Hojas alternas, distribuidas por todo el tallo; láminas obovadas a orbiculares, glabras; base cuneada, margen con dientes anchos, ápice agudo; pecíolos breves. Capítulos en panículas terminales, más largos que las brácteas foliáceas, pedicelados; involucro acampanado o hemisférico; filarios agudos, dispuestos en varias series, los exteriores gradualmente menores. Flores blanquecinas, las estaminadas tubulosas, las pistiladas filiformes. Aquenio cilíndrico; papus formado por pelos delgados 44,45.

Figura 2 A. Baccharis illinitoides. B. Casimirella guaranitica. C-D. Neltuma rojasiana, inflorescencia (C) y ramas (D). E-F. Piptadeniopsis lomentifera, capítulos (E) y hojas (F). (Fotografías A,B,E,F: Lidia Pérez de Molas; C-D: Juana De Egea).
Fenología: Florece y fructifica de enero a abril, aunque se ha registrado floración y fructificación extendidas hasta junio.
Ecología: Crece asociada a cursos de agua menores, en campos bajos inundables y en humedales con agua permanente.
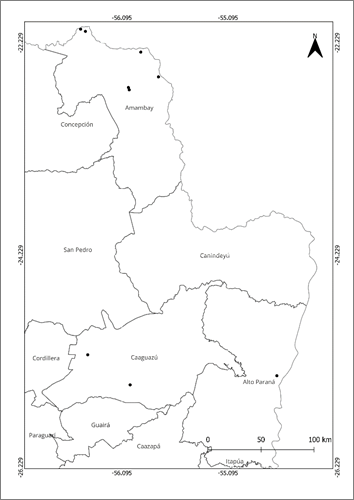
Distribución: Fue registrada en los departamentos de Alto Paraná, Amambay y Caaguazú. No se han encontrado registros de esta especie en países limítrofes (Fig. 3).
Material examinado: PARAGUAY. Alto Paraná: Reserva Natural Tati Yupi. Humedal al Oeste de la Reserva [25°21’51”S; 54°38’5”W], 5-III-2020, Lombardo & al. 213 (FCQ). Amambay: Arroyo Estrella. Sierra de Amambay ad margines rivi Estrella [22°06’S; 56°29’W], I-1907/1908, Hassler & Rojas 10049 (G); Arroyo Estrella. Sierra de Amambay ad margines rivi Estrella [22°06’S; 56°29’W], I-1907/1908, Hassler & Rojas 10049a (BM, G, MO); Estrella (Pedro Juan Caballero). Sierra de Amambay ad ripas rivularum pr. Estrella [22°19’S; 55°55’W], I-1907/1908, Hassler & Rojas 10049b (G); Punta Porá. Sierra de Amambay in campis Punta Porá [22°33’S; 55°45’W], IV-1907/1908, Hassler & Rojas 10392 (G); In altaplanitie et declivibus. Sierra de Amambay in campis Punta Porá [22°33’S; 55°45’W], IV-1907/1908, Hassler & Rojas 10392a (F, G-HOLOTYPUS!, MO); Ruta 5, 32 km SW de P.J. Caballero, Parque Nacional Cerro Corá [22°39’S; 56°02’W], 18-IV-1995, Schinini & Espinoza 29271 (CTES, FCQ, G); Parque Nacional Cerro Corá. Frente a la entrada. Arroyo Aceite'i [22°40’19”S; 56°01’31”W], 6-VI-1996, Soria 7606 (FCQ, MO); Parque Nacional Cerro Corá. Arroyo Aceite [22°40’19” S; 56°01’31”W], 14-VI-1996, Zardini & Cardozo 45205 (MO); rail to Arroyo Estrella [22°07’16”S; 56°26’17”W], 8-V-2000, Zardini & Guerrero 54140 (FACEN). Caaguazú: Caaguazú, dans les campos [25°10’S; 56°25’W], 1-IV-1876, Balansa 970 (G); Coronel Oviedo. Prope Caaguazú in paludibus [25°27’S; 56°01’W], III-1905, Hassler 9054 (F, G); Coronel Oviedo. Prope Caaguazú in paludibus [25°27’S; 56°01’W], III-1905, Hassler 9054a (F, G).
Análisis de conservación de la especie: Los especímenes de herbario registrados para esta especie fueron 13, coleccionados entre los años 1876 y 2020; 8 de ellos constituyen colecciones históricas y 5 son recientes. En la base de datos GBIF se encontraron 12 registros para esta especie 46; 6 de ellos y sus duplicados (4 registros) coincidieron con los ejemplares revisados, y 2 representaron nuevos registros para este estudio, correspondientes a colecciones realizadas en los Estados Mato Grosso do Sul 47 y Goiás 48, Brasil. Sin embargo, estos registros fueron excluidos, debido a sus localizaciones notablemente disyuntas, a que no fue posible confirmar su identificación, y a que B. illinitoides no se encuentra aún citada formalmente para el Brasil, ni en la base de datos de Flora do Brasil 37, ni en The Global Compositae Database 49. Por lo expuesto, se consideraron a estos dos registros como dudosos.
Aunque la especie ocupa una extensa EOO, propia de la categoría Casi amenazada (NT), el AOO es reducida debido al escaso número de colecciones de la especie, particularmente de colecciones recientes, lo cual sugiere que se trata de una especie poco común (Tabla 1). Siguiendo el concepto de localidad definido por UICN 7, se han identificado 4 localidades en donde existen, o existieron en el pasado, poblaciones de Baccharis illinitoides: 1) Caaguazú (incluyendo alrededores de las ciudades de Caaguazú y Coronel Oviedo); 2) el Parque Nacional Cerro Corá y alrededores, hasta las cercanías de la ciudad de Pedro Juan Caballero (Amambay); 3) el curso del arroyo Estrella (Amambay); y 4) el Refugio Biológico Tati Yupi (Alto Paraná).
Según Yanosky y Salas-Dueñas 50, la deforestación y el avance de la agricultura han tenido serias consecuencias sobre los humedales de la cuenca del río Paraná (área de distribución de esta especie), específicamente por el aumento de la erosión de los suelos, de los sistemas de drenaje y del arado de llanuras aluviales, lo que produjo, en las últimas décadas, una reducción considerable de la funcionalidad de estos humedales. Por lo tanto, se considera que la EOO de la especie se encuentra severamente fragmentada, ya que las 4 localidades identificadas se encuentran separadas entre sí por extensas áreas de uso agrícola y por núcleos urbanos y periurbanos. La cantidad de 4 localidades se ajusta a los umbrales de la categoría En peligro (EN) para el subcriterio Ba.
Por otro lado, se infiere una disminución continua de las poblaciones de B. illinitoides (subcriterio Bbi+ii) en base a los análisis de predicción de cobertura para la región Oriental de INFONA 41, que presentó escenarios desalentadores para el 2030. Amambay, principalmente en la zona sur de Cerro Corá, resultó como potencialmente deforestada, con certidumbre alta basada en dos modelos predictivos, al igual que el oeste de Capitán Bado, que presentó un pequeño frente de deforestación de manera concentrada según uno de los modelos de simulación. Vale señalar que estos escenarios, y el consecuente cambio de uso de los suelos para producción agropecuaria y forestal, esta última en marcado crecimiento 51, trae consigo impactos que afectan directamente la calidad y funcionalidad de los humedales.
En cuanto a la calidad del hábitat en las localidades identificadas (subcriterio Bbiii), tanto la localidad de Caaguazú como la de arroyo Estrella, de donde sólo existen registros históricos de la especie, se encuentran en la actualidad profundamente modificados a zonas urbanas y rurales 42,43, con lo cual, es posible que existan escasas o nulas poblaciones viables de B. illinitoides en estas áreas. Por el contrario, las localidades Parque Nacional Cerro Corá y Refugio Biológico Tati Yupi, constituyen ambas áreas silvestres protegidas 52 y cuentan con registros recientes de poblaciones de la especie, por lo cual se debe destacar que estos sitios serían clave para garantizar su conservación. No se tiene datos sobre fluctuaciones extremas de la especie analizada (subcriterio Bc).
Consecuentemente, y atendiendo a la recomendación de UICN de favorecer a la categoría más alta obtenida del análisis de los diferentes criterios y subcriterios para una especie según el principio de precaución 7 se propone para B. illinitoides la categoría En peligro; EN B2ab (i,ii,iii).
Tabla 1 Valores obtenidos en los análisis de conservación de las cuatro especies estudiadas
| Especie | Baccharis illinitoides | Casimirella guaranitica | Neltuma rojasiana | Piptadeniopsis lomentifera | |||||
| Criterio | Valores obtenidos | Categoría resultante | Valores obtenidos | Categoría resultante | Valores obtenidos | Categoría resultante | Valores obtenidos | Categoría resultante | |
| B1: Extensión de presencia (EOO) | 42 512 km2 | NT | 18 151 km2 | VU | 143 691 km2 | LC | 131 734 km2 | LC | |
| B2: Área de ocupación (AOO) | 36 km2 | EN | 60 km2 | EN | 136 km2 | EN | 96 km2 | EN | |
| Ba: Número de localidades | 4 | EN | 5 | EN | 8 | VU | 8 | VU | |
| Bb: Disminución observada, estimada, inferida o proyectada | i,ii,iii | n/a | i,ii,iii | n/a | i,ii,iii | n/a | i,ii,iii | n/a | |
| Bc: Fluctuaciones extremas | n/a | n/a | n/a | n/a | n/a | n/a | n/a | n/a | |
Caracterización y análisis de Casimirella guaranitica
Familia: ICACINACEAE
Casimirella guaraniticaHassl., Repert. Spec. Nov. Regni Veg. 12: 250 (1913). (Fig. 2B).
Sinónimos taxonómicos: Casimirella guaranitica f. calvata Hassl., Dichapetalum pranceiFern. Casas.
Descripción: Sufrútices xilopodíferos de hasta 1 m de altura, con tallos subterráneos, luego emergentes. Ramas vilosas. Hojas de 7-20 × 3,5-10,5 cm; pecíolos hasta 0,5 cm, vilosos; láminas elípticas, oblongas u ovadas, subcoriáceas, vilosas en ambas caras; base cordada a redondeada, margen entero, ápice obtuso y emarginado, a veces agudo; nervadura pinnada, 5-7 pares de nervios secundarios visibles. Inflorescencias en tirsos terminales de hasta 15 cm, densamente tomentosas. Flores cortamente pediceladas, blancas o amarillo-verdosas, a veces con máculas oscuras; bractéolas aciculares; sépalos con 5-6 lóbulos de 0,5 × 0,1 cm, triangulares u ovados, agudos, vilosos, apenas unidos a la base; pétalos 5(-6), de 0,5-0,7 × 0,2-0,3 cm, elíptico-oblongos, agudos, vilosos en la cara externa y barbados en la interna; estambres (4-)5(-6), alternipétalos; ovario subgloboso, hirsuto, estilos 1-3, curvados, estigma levemente capitado. Fruto drupa ovoide de 2 × 1,3 cm, densamente hirsuto-tomentosa, color amarillo-anaranjado 53.
Fenología: Florece de junio a noviembre y fructifica de octubre a enero.
Ecología: Habita en cerrados, matorrales y sabanas sobre suelos arenosos.
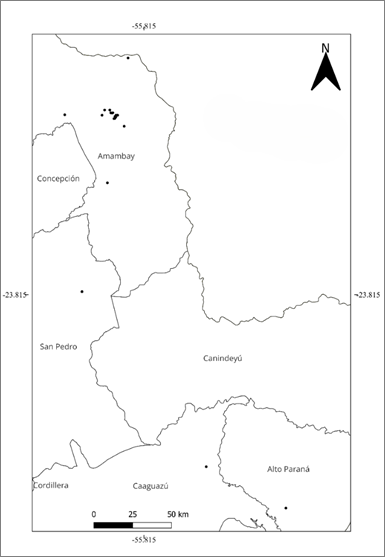
Distribución: Fue registrada en los departamentos de Alto Paraná, Amambay, Caaguazú y San Pedro. Si bien Duno de Stefano 53 menciona que esta especie podría también encontrarse en Matto Grosso, Brasil, a la fecha no se cuenta con ningún registro de la especie en el vecino país (Fig. 4).
Material examinado: PARAGUAY. Alto Paraná: Campo Limpio, camino a Itakyry [25°10’53”S; 54°54’25”W], 9-X-1995, Schinini & Caballero Mármori 29942 (CTES). Amambay: Camino a la colonia Tayi [22°44’14”S; 55°56’30”W], 31-X-1997, Basualdo 6318 (FCQ); Parque Nacional Cerro Corá, cerca del monumento [22°38’S; 56°02’W], 2-XI-1997, Basualdo 6424 (FCQ, G, MO); Cerro Corá versus Cerro Guazú [23°05’58”S; 56°02’56”W], 9-XII-1978, Bernardi 19008 (BM, NY); Parque Nacional Cerro Corá. Cerro Muralla. 1,5 km al norte de la administración [22°38’S; 56°04’W], 19-X-1984, Brunner & al. 974 (G, MO, PY); Parque Nacional Cerro Corá. Alrededores de la administración y lugar de camping [22°38’S; 56°04’W], 16-XI-1985, Brunner 1419 (MO, PY); Parque Nacional Cerro Corá, Picada Lorito [22°40’44”S; 55°50’42”W], 24-XI-2015, De Egea & al. 1471 (BM, CTES, FCQ, G); Parque Nacional Cerro Corá, cerca de la Casa Forestal [22°38’S; 56°02’W], IX/X-1980, Deguchi & Tsugaru B-1664 (NY); Parque Nacional Cerro Corá. Cerca de la Casa Forestal [22°38’S; 56°2’W], 4-X-1980, Fernández Casas & Molero 4054 (G, MA, MO, NY); Parque Nacional Cerro Corá [22°40’S; 56°05’W], 1-XI-1983, Hahn 1705 (MO, PY); Sierra de Amambay, in campis serrados pr. Cerro Corá [22°40’S; 55°59’W], XI-1907/1908, Hassler & Rojas 9375 (G); Sierra de Amambay, in campis serrados pr. Cerro Corá [22°40’S; 55°59’W], XI-1907/1908, Hassler & Rojas 9735 (G); Sierra de Amambay (Norte), in campis arenosis Sierra de Amambay, Esperanza [22°18’S; 55°55’W], IX-1907/1908, Hassler & Rojas 10633 (G-HOLOTYPUS!, MO, NY, SI); Parque Nacional Cerro Corá, en campo cerrado camino al cerro Muralla [22°38’S; 56°02’W], 24-X-1994, Krapovickas & al. 45965 (G, U); Parque Nacional Cerro Corá, cerro Muralla [22°39’60”S; 55°59’37”W], 11-XII-2003, Múlgura de Romero 3656 (FCQ, CTES, SI); Near Lorito [22°41’17”S; 56°00’06”W], 21-X-1986, Pedersen 14708 (F, U); Parque Nacional Cerro Corá [22°40’30”S; 56°00’03”W], 11-I-2003, Schinini & Quintana 36388 (PY); Cordillera de Amambay. 13-15 km S de ruta 5, Cerro Corá, Colonia Picada Lorito [22°41’17”S; 56°00’06”W], 11-XII-1997, Schinini & Dematteis 33722 (FCQ); Parque Nacional Cerro Corá. Camino a la Administración [22°39’04”S; 56°00’50”W], XI-1992, Soria 5619 (FCQ, NY); Parque Nacional Cerro Corá. Camino al cerro Alambique [22°39’10”S; 56°01’03”W], XI-1994, Soria 6796 (FCQ, MO); Parque Nacional Cerro Corá, entrada a la parte histórica [22°39’04”S; 56°01’37”W], 8-VI-1995, Soria 7019 (FCQ); Parque Nacional Cerro Corá. En la entrada a la parte histórica [22°39’04”S; 56°01’37”W], 20-VIII-1995, Soria 7297a (FCQ); Parque Nacional Cerro Corá. Entrada del Parque [22°39’04”S; 56°01’37”W], 7-XII-1995, Soria 7420 (FCQ, MO); National Park Cerro Corá [22°39’51”S; 56°19’18”W], 10-XI-1999, Zardini & Báez 52234 (AS, MO); National Park Cerro Corá [22°41’19”S; 56°00’25”W], 11-XI-1999, Zardini & Báez 52504 (AS, MO). San Pedro: Yaguareté Forest (Sustainable Forest Systems Site). Around aserradero. North side [23°47’46”S; 56°12’41”W], 24-VIII-1995, Zardini & Vargas 43599 (MO, PY); Yaguareté Forest (Sustainable Forest Systems Site). Around aserradero. North side [23°47’46”S; 56°12’41”W], 24-VIII-1995, Zardini & Vargas 43639 (MO, PY); Yaguareté Forest (Sustainable Forest Systems Site). Around aserradero. South side [23°47’46”S; 56°12’41”W], 24-VIII-1995, Zardini & Vargas 43650 (MO, PY); Yaguareté Forest (Sustainable Forest Systems Site). Around aserradero. South side [23°47’46”S; 56°12’41”W], 24-VIII-1995, Zardini & Vargas 43662 (MO, PY); Yaguarete Forest (Sustainable Forest Systems site). Around aserradero [23°47’46”S; 56°12’41”W], 30-X-1996, Zardini & Zavala 45636 (AS, MO); Yaguarete Forest (Sustainable Forest Systems site). Around aserradero [23°47’46”S; 56°12’41”W], 30-X-1996, Zardini & Zavala 45624 (AS, MO). Caaguazú: Palomares, camino de Itakyry a Curuguaty [24°55’S; 55°25”W], 10-X-1995, Schinini & Caballero Mármori 30021 (CTES).
Análisis de conservación de la especie: Los especímenes de herbario encontrados para esta especie fueron 32, coleccionados entre los años 1908 y 2015; 4 de ellos constituyen colecciones históricas y 28 son recientes. En la base de datos GBIF se encontraron 85 registros para esta especie, todos de material de herbario 54; 22 de ellos y sus duplicados (60 registros) coincidieron con los ejemplares revisados, y sólo 3 de ellos representaron nuevos registros para este estudio, que fueron incluidos.
Los resultados obtenidos indican una EOO y AOO reducidas (Tabla 1); la EOO cae dentro de la categoría Vulnerable (VU) y el AOO de En peligro (EN), sugiriendo una distribución bastante restringida de la especie. Se han identificado 5 localidades en donde existen, o existieron en el pasado, poblaciones de C. guaranitica, cantidad que se ajusta a los umbrales de la categoría En peligro (EN): 1) La Cordillera de Amambay a la altura de la localidad Esperanza (norte de Amambay); 2) El Parque Nacional Cerro Corá y alrededores (norte de Amambay); 3) El área del Cerro Guazú (centro-sur de Amambay); 4) el área de Yaguareté Forest (San Pedro), y; 5) áreas asociadas al curso superior río Acaray (límite entre Alto Paraná y San Pedro). Estas 5 localidades se encuentran actualmente separadas entre sí por zonas de uso agrícola y por núcleos urbanos y periurbanos, por lo cual se puede considerar que la EOO de la especie se encuentra fragmentada (subcriterio Ba).
Se infiere una disminución continua de las poblaciones de C. guaranitica (subcriterio Bbi+ii) en base a los análisis de predicción de cobertura al 2030 para la región Oriental de INFONA 41. La zona sur del Parque Nacional Cerro Corá y el Cerro Guazú son localidades que presentan una alta probabilidad de deforestación en los próximos siete años, mientras que para el área de Yaguareté Forest también se proyectan áreas deforestadas, aunque con una probabilidad de solo 25%. Por otro lado, el cambio de uso de los suelos a áreas agropecuarias se inicia con el reemplazo de cobertura no boscosa, como pastizales, matorrales y cerrados, ya que estos ambientes (que justamente albergan a esta especie) no cuentan con una protección especial por ley, a menos que constituyan áreas silvestres protegidas. De hecho, el departamento San Pedro ya ha perdido casi la totalidad de su vegetación original, lo que se evidencia con la comparación entre mapas de cobertura de 1986 y 2022 42,43.
En cuanto a la calidad del hábitat en las localidades identificadas (subcriterio Bbiii), los alrededores de Yaguareté Forest, de Esperanza y del curso superior del río Acaray se encuentran en la actualidad profundamente modificados a zonas rurales y urbanas 42,43, con lo cual, es posible que existan escasas o nulas poblaciones viables de C. guaranitica en estas áreas. Por el contrario, el Parque Nacional Cerro Corá es un área silvestre protegida 52 que cuenta con registros recientes de poblaciones de la especie y sería clave para garantizar su conservación. En cuanto al Cerro Guazú, comparando los mapas de 1986 y 2022 42,43 se observa que su cobertura vegetal se mantiene relativamente bien conservada, y aunque podría constituir un sitio potencial para poblaciones de la especie, al carecer de alguna categoría de protección, gubernamental o privada, no se garantiza su preservación. No se tiene datos sobre fluctuaciones extremas de la especie analizada (subcriterio Bc).
Consecuentemente, se propone para C. guaranitica la categoría de amenaza En peligro; EN B2ab(i,ii,iii).
Caracterización y análisis de Neltuma rojasiana
Familia: FABACEAE
Neltuma rojasiana(Burkart) C.E. Hughes & G.P. Lewis, PhytoKeys 205: 184 (2022). (Fig. 2C-D).
Basónimo: Prosopis rojasianaBurkart
Descripción: Árboles o arbustos de 1-6 m de altura, muy espinosos, casi áfilos, glabros. Ramas cilíndricas, estriadas longitudinalmente, verdosas. Espinas axilares hasta 11,5 cm de longitud, 2 por axila, finas, atenuadas en el extremo, muy abundantes, similares a las ramas. Hojas bipinnadas, uniyugas, glabras, caducas; pecíolos 0,5-2 cm, engrosados en la porción distal, donde llevan una glándula cupuliforme sésil; folíolos opuestos, con 12-17 pares de foliólulos de 0,15-0,4 cm de longitud, oblongo-elípticos. Inflorescencias en racimos espiciformes de 2,5-5,5 cm de longitud; pedúnculos pubérulos con brácteas escamosas dispersas. Flores pentámeras, amarillas, rojas o granates, sésiles o subsésiles; cáliz gamosépalo, campanulado; corola con pétalos lanceolados; estambres 10, en dos ciclos, anteras oblongas, liláceas; ovario velloso, estipitado, estilo lineal, glabro, estigma apical. Fruto legumbre hasta 5 cm, arqueada, comprimida, de color verdoso, grisáceo o blanquecino 32,55,56.
Fenología: Florece de junio a diciembre y fructifica desde septiembre; los frutos se mantienen en el árbol por tiempo prolongado, hasta el otoño.
Ecología: Habita bosques y matorrales chaqueños xerófitos y mesoxerófitos; sobre suelos salinos y sobre suelos temporalmente inundables.
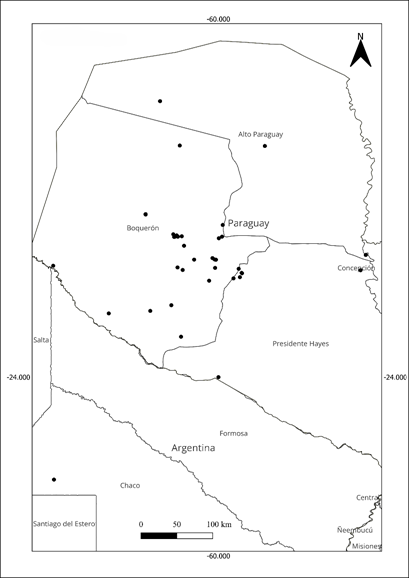
Distribución: Fue registrada en los tres departamentos de la región Occidental del Paraguay, y en la Argentina, en la provincia del Chaco (Fig. 5).
Material examinado: ARGENTINA. Chaco: Almirante Brown, A 66 km al W de Fuerte Esperanza hacia Taco Pozo, cerca de la intersección con RP 20 [25°26’S; 62°18’W], 21-XI-1990, Fortunato & al. 1520 (BAB, MO). PARAGUAY. Alto Paraguay: A 30 km de la station T, vers Ingavi [20°08’16”S; 60°49’01”W], 6-II-1975, De Sloover 121 (BM, BR); Sector Puerto Casado, Km 145 [22°17’24”S; 57°56’23”W], II-1931, Rojas 5589 (SI); Sector Puerto Casado, Km 145 [22°17’24”S; 57°56’23”W], VIII-1934, Rojas 7102 (SI); Reserva Natural Riacho Florida [20°45’54”S; 59°21’03”W], 23-XI-2011, Vogt & Araújo 1162 (FACEN). Boquerón: Colonia Farnheim, Filadelfia [22°21’22”S; 60°02’06”W], 10-XI-1987, Arenas 3327 (FCQ); Piste de Mariscal Estigarribia vers Cerro Leon [20°45’31”S; 60°32’26”W], 5-VI-1984, Billiet & Jadin 3315 (BR); Estancias La Gama y Agropil [23°06’27”S; 61°32’01”W], 15-XII-2004, De Egea & Elsam 678 (BM); Colonia Neuland [22°39’00”S; 60°07’48”W], 3-IX-1992, Degen & Mereles 2737 (FCQ, MO); Trincheras de Toledo. Cementerio de los Soldados [22°21’18”S; 60°20’23”W], 14-IX-1992, Degen & Mereles 2756 (FCQ, MO); Filadelfia-Fortín Teniente Montanía, km 35 [22°03’23”S; 59°59’42”W], 11-X-1977, Évrard 8105 (BR); Fortín Tte. Montanía. Cerca del Fortín Teniente Montanía [22°02’S; 59°57’W], 18-X-1980, Fernández Casas & Molero 4275 (G, MO); Ruta Transchaco, km 520. Gran Chaco. 10 km SE de Mariscal Estigarribia [22°02’S; 60°34’W], 26-I-1984, Little 40084 (G, MO, PY); Mariscal Estigarribia [22°01’S; 60°35’W], 2-VI-1980, Mereles 1084 (G); Mariscal Estigarribia. Tte Ochoa [22°01’S; 60°35’W], 20-II-1987, Mereles 2261 (G); Km 470 Ruta Transchaco. Picada [22°28’16”S; 60°02’48”W], 30-VI-1992, Mereles & Degen 4498 (FCQ); Pirizal [22°59’35”S; 60°39’33”W], 29-VIII-1992, Mereles & Degen 4644 (FCQ, MO); Tyto. Mcal. Estigarribia. Km. 470. Estancia Remonia [22°09’40”S; 60°28’51”W], 13-X-1992, Mereles & Degen 4700 (FCQ, MO); Cruce Mcal. Estigaribia - Lagerenza [22°00’03”S; 60°37’54”W], 10-XII-1993, Mereles & Degen 5453 (FCQ, MO); 2 km SE de teniente Ochoa sobre Ruta Transchaco [21°43’28”S; 61°01’05”W], 24-VIII-1994, Mereles 5747 (FCQ, MO); Línea 9, Estancia Margarita, Retiro 1,9 km E [23°04’21”S; 60°57’12”W], 26-X-1994, Mereles & Degen 5840 (CTES, FCQ, MO); Mcal. Estigarribia. Centro Agropecuario, Ministerio de Agricultura y Ganadería [22°01’57”S; 60°36’15”W], 18-VII-2002, Mereles & Eliceche 8764 (FCQ); Estancia Toro Mocho, 178 km W desde Pozo Colorado, trayecto a Gral. Díaz [23°26’03”S; 60°31’22”W], 21-IX-2014, Mereles & al. 10038 (FCQ); Fortín Tte. E. Ochoa [21°43’07”S; 61°01’07”W], 11-XII-1987, Palacios 1489 (FCQ); Aprox. 10 km al este de Mcal. Estigarribia [22°01’42”S; 60°30’46”W], 12-XII-1987, Palacios 1501 (FCQ); Filadelfia. Cabecera del Aeropuerto [22°21’12”S; 60°03’07”W], 18-X-1986, Pérez de Molas & Vera 1291 (MO, PY); Chaco Paraguayo, Cap. López de Filipis [22°30’S; 60°30’W], IX-1938, Rojas 8310 (SI-HOTOTIPUS!); Chaco Paraguayo, Margariños, sector Pilcomayo [22°26’27”S; 62°18’38”W], IX-1938, Rojas 8314 (SI); Chaco Paraguayo, Cap. López de Filipis [22°30’S; 60°30’W], X-1938, Rojas 8421 (SI); Filadelfia [22°20’S; 60°05’W], 13-III-1979, Schinini & Bordas 16571 (CTES, MO); Mariscal Estigarribia [22°02’17”S; 60°37’07”W], 7-I-1979, Schinini & Bordas 18152 (CTES); Mariscal Estigarribia [22°02’17”S; 60°37’07”W], 23-VIII-1981, Schinini & al. 21125 (CTES, F); Gesudi, Km 22 N Montania, Nueva Asunción [21°52’12” S; 59°56’24”], 31-X-1990, Schmeda 1352 (US); Teniente Ochoa [21°43’07”S; 61°01’07”W], 26-II-1987, Soria 1316 (FCQ, MO); Isla Poí, Col. Menno, Laguna Capitán [22°29’S; 59°43’W], 12-IX-1990, Vanni & al. 2026 (CTES); Comunidad Indígena San Miguel de Campo Loa [22°27’53” S; 60°34’20”W], 4-XII-2010, Vera & al. 2231 (FCQ). Presidente Hayes: Estancia Palo Santo; Puerto Casado & Vicinity [22°30’13” S; 58°00’44”W], 24-X-1956, Pedersen 4171 (BR, CTES, SI, US); Laguna Capitán [22°32’26”S; 59°40’32”W], 18-X-2004, Peña-Chocarro & al. 1906 (BM); Reserva Natural Laguna Capitán [22°32’43,2”S; 59°40’12,4”W], 17-I-2011, Vogt 1114 (FACEN); Transchaco, camino Asunción-Filadelfia, a 10 km de Filadelfia [22°37’04”S; 59°47’22”W], 12-X-1987, Zardini & Basualdo 3558 (FCQ, MO, PY); Between Laguna Capitán and Cruce to Loma Plata [22°36’S; 59°42’W], 9-VIII-1994, Zardini & Guerrero 40405 (AS, MO).
Análisis de conservación de la especie: Los especímenes de herbario encontrados para esta especie fueron 41, coleccionados entre los años 1931 y 2011; 8 de ellos constituyen colecciones históricas y 33 son recientes. En la base de datos GBIF se encontraron 52 registros para esta especie, todos de material de herbario 57; 29 de ellos y sus duplicados (15 registros) coincidieron con los ejemplares revisados, uno se encontraba erróneamente determinado como N. rojasiana, y 7 de ellos representaron nuevos registros para este estudio, por lo que fueron incluidos.
La EOO es relativamente extensa, y sitúa a la especie bajo la categoría de Preocupación menor (LC). El AOO, en cambio, es reducida, y se clasifica como En peligro (EN) (Tabla 1). Se consideran 8 localidades, valor que cae bajo el criterio Vulnerable (VU): 1) Mariscal Estigarribia (Boquerón); 2) Colonias menonitas y alrededores (Boquerón); 3) Pirizal y alrededores (Boquerón); 4) Zona Pilcomayo (Boquerón); 5) Parque Nacional Defensores del Chaco y alrededores (Alto Paraguay); 6) Reserva Natural Riacho Florida (Alto Paraguay); 7) Puerto Casado (Alto Paraguay); y 8) Almirante Brown (Provincia Chaco, Argentina). Las localidades se encuentran actualmente separadas entre sí por campos ganaderos que se alternan con remanentes de vegetación natural, por lo cual la EOO de la especie se encuentra moderadamente fragmentada (subcriterio Ba).
Considerando la proyección de cobertura deforestada del INFONA para el 2030, las zonas de Pirizal, Fortín Madrejón, La Patria y Picada 500, que se encuentran dentro del área de distribución natural de la especie, presentaron altas probabilidades de deforestación en distintos modelos de simulación (41). Consecuentemente, se estima un proceso de disminución continua inferida para las poblaciones de N. rojasiana (subcriterio Bbi+ii).
En cuanto a la calidad del hábitat (subcriterio Bbiii), las de Mariscal Estigarribia, Colonias menonitas, Pirizal, Zona Pilcomayo y Puerto Casado se encuentran actualmente muy modificadas por la expansión de la producción agropecuaria en el Chaco 58, que ha resultado en una tasa anual de deforestación de 278 880 hectáreas entre 2005-2022 43; por lo tanto, es posible que las poblaciones de N. rojasiana en estas áreas se encuentren en disminución. Por el contrario, el Parque Nacional Defensores del Chaco y la Reserva Natural Riacho Florida (al sureste del mismo parque) constituyen áreas silvestres protegidas 52 y cuentan con registros recientes de poblaciones de la especie, lo que indica que ambos serían clave para garantizar su conservación. En cuanto a el registro de la especie en Argentina, éste fue realizado en los alrededores del Parque Natural Provincial Fuerte Esperanza, que constituye un área natural protegida de la provincia Chaco 59. No se tiene datos sobre fluctuaciones extremas (subcriterio Bc).
Consecuentemente, se propone para N. rojasiana la categoría de amenaza Vulnerable; VU B2ab(i,ii,iii).
Caracterización y análisis de Piptadeniopsis lomentifera
Familia: FABACEAE
Piptadeniopsis lomentiferaBurkart, Darwiniana 6: 478 (1944). (Fig. 2E-F).
Descripción: Árboles o arbustos de 1-7 m de altura, espinosos, caducifolios. Ramas cilíndricas, con estrías longitudinales, algo flexuosas y divaricadas, pubescentes a glabrescentes. Estípulas modificadas en espinas de 1-3 mm, agudas, rectas, ascendentes y divergentes entre sí. Hojas alternas o en fascículos sobre braquiblastos, bipinnadas, uniyugas, pubescentes; pecíolo 0,3-1 cm con glándula circular sésil en el lugar de inserción de las pinas; folíolos opuestos, cada uno con (2)3 pares de foliólulos; foliólulos 1,4-8 × 0,7-0,3 cm, herbáceos, obovado-elípticos, obtusos o emarginados, 3-4-nervados, el par distal mayor que los demás. Inflorescencias en capítulos globosos, axilares, solitarios; pedúnculos de 1-2 cm; bractéolas romboideo-acuminadas, estipitadas, caducas, de punta rojiza. Flores hermafroditas, actinomorfas, pentámeras, tubulosas, sésiles, de color blanco, verdoso, amarillo o anaranjado-rojizo; sépalos de 0,16-0,28 cm, lanceolados o anchamente triangulares, algo desiguales, soldados entre sí en casi toda su longitud; pétalos de 0,26-0,28 cm, oblongo-lanceolados, soldados en el botón floral, luego libres en la antesis; estambres 10, libres; ovario ovoide, largamente estipitado, velloso a hirsuto, negruzco, estilo filiforme y glabro, estigma apical cóncavo. Fruto legumbre tipo lomento, de 8 × 0,8-1 cm, lineal, recto, comprimido, pajizo, con suturas prominentes, algo contraído entre las semillas. Semillas de 0,7 × 0,1 cm, comprimidas 32,60,61.
Fenología: Ha sido colectada en estado fértil (con flores y/frutos) a lo largo de prácticamente todos los meses del año. Aparentemente, comienza la floración a partir del mes de julio y se extiende hasta el verano, observándose frutos desde la primavera y hasta el mes de marzo.
Ecología: Habita bosques y matorrales xerófitos, con frecuencia sobre suelos arenosos y salinos.
Distribución: Fue registrada en los tres departamentos de la región Occidental de Paraguay, y en Bolivia, en los departamentos de Santa Cruz y Chuquisaca (Fig. 6).
Material examinado: BOLIVIA. Chuquisaca: Provincia de Luis Calvo. El Salvador-Cimboc. Laguna El Panta [20°40’S; 63°30’W], 26-XI-1991, Saravia Toledo & Joaquín 10154 (CTES, G). Santa Cruz: Cordillera [19°06’23”S; 61°42’45”W], 13-XII-1983, Saravia Toledo 2683 (CTES); Cordillera [19°06’23”S; 61°42’45”W], 12-IV-1993, Saravia Toledo 11755 (CTES). PARAGUAY. Alto Paraguay: Parque Nacional Defensores del Chaco, Madrejón [20°40’S; 59°50’W], 15-VIII-1983, Hahn 1619 (CTES, G, K, MO, PY); Tte. Montanía, Km 10 E [22°03’15”S; 59°57’23”W], 19-X-1992, Mereles & Degen 4795 (FCQ, MO, SI); Puerto Casado & Vicinity. Estancia Palo Santo [22°17’S; 57°57’W], 24-X-1956, Pedersen 4159 (G); Línea 3 (Oeste), km 50, 46 km al este de la pista de aviación de Cabrera [19°42’S; 61°16’W], 9-XI-1992, Ramella & al. 2936 (G); Puerto Casado [22°17’24”S; 57°56’23”W], XII-1916, Rojas 2133 (SI-HOLOTYPUS!); Sector Puerto Casado [22°17’24”S; 57°56’23”W], X-1938, Rojas 8457 (K, SI). Boquerón: Delegación de Gobierno (Fortín Mr. Long), Nueva Asunción, Gral. Eugenio A. Garay, Picada de la Muerte, ca. 10 km al N de la Deleg. de Gob. de Nueva Asunción [20°38’S; 62°03’W], 9-V-1988, Charpin & Ramella 21494 (G); Destacamento Nueva Asunción [20°31’03”S; 62°08’35”W], 17-IX-1992, Degen & Mereles 2766 (FCQ, MO); 2 km N of Buena Vista, on the road to Laguna Capitán [22°33’09”S; 59°42’45”W], 18-II-2002, Luckow et al. 4505 (BAB); Trayecto E. Garay-Sto. Rodríguez. Estancia La Patria-Teniente Enciso [21°22’40”S; 61°29’30”W], 18-XI-1992, Mereles & Degen 4902 (FCQ, MO); Nueva Asunción, picada Mr. Long [20°38’S; 62°03’W], 30-IV-1993, Mereles & Degen 5060 (FCQ, MO); Picada Sirascuas [21°03’S; 61°46’W], 11-XII-1993, Mereles & Degen 5483 (FCQ, MO); Isla Poí, 200 km sureste de Puerto Casado [22°31’34”S; 59°43’40”W], VIII-1934, Rojas 7033 (SI); Picada 104 (Sur), km 10, 11 km al norte de Pozo Olga (Dorado) [21°30’S; 61°56’W], 14-X-1987, Spichiger & al. 2273 (FCQ, G); Isla Poí. Col. Menno, Laguna Capitán [22°29’S; 59°43’W], 12-IX-1990, Vanni & al. 2025 (CTES, G); Fortín Isla Poí. Isla Poí, 30 Km SE de Loma Plata [22°29’S; 59°43’W], 26-II-1991, Vanni & al. 2279 (CTES, G); Parque Nacional Tte. Enciso [21°00’07”S; 61°46’06”W], 14-XII-2011, Vera & al. 3224 (FCQ). Presidente Hayes: Colonia Menno, Misión Nueva Vida [23°05’S; 59°40’W], 2-II-1976, Arenas 1514 (SI); Ingreso al desvío a Laguna Capitán desde la ruta de Concepción con ruta 9 [22°34’S; 59°40’W], 13-III-2005, Fortunato & al. 8795 (FCQ); Pozo Colorado, Retiro Montelindo [23°43’44”S; 59°08’33”W], 25-IX-1993, Mereles 5436 (FCQ, MO); Reserva Natural Campo María [22°34’38”S; 59°22’53”W], 20-II-2010, Vogt & Dujak 915 (FCQ); Between Laguna Capitán and Cruce to Loma Plata [22°36’S; 59°42’W], 9-VIII-1994, Zardini & Guerrero 40422 (AS, MO); Between the Río Verde and Tacuara [23°58’S; 58°35’W], 14-XII-1996, Zardini & Vera 46115 (AS, BAB, MO); Laguna Capitán [22°32’21”S; 59°40’31”W], 29-VII-1997, Zardini & Guerrero 47059 (AS, F, MO); Cruce Loma Plata-Estancia Zalazar [22°50’S; 59°40’W], 29-VII-1997, Zardini & Vera 47117 (AS, MO).
Análisis de conservación de la especie: Los especímenes de herbario encontrados para esta especie fueron 28; fueron coleccionados entre los años 1916 y 2011; 4 de ellos constituyen colecciones históricas y 24 son colecciones recientes. En la base de datos GBIF se encontraron 46 registros 62; 26 de ellos y sus duplicados (18 registros) coincidieron con los ejemplares revisados. Los 2 restantes no fueron incluidos; uno de ellos por tratarse de un duplicado determinado incorrectamente como P. lomentifera (el original fue revisado en FCQ), y el otro por ser un registro de un individuo cultivado en Colombia.
La EOO es relativamente extensa, situando a la especie bajo la categoría de Preocupación menor (LC). El AOO, en cambio, es reducida; categoriza a la especie como En peligro (EN) y sugiere que se trata de una especie poco común (Tabla 1). Se han identificado 8 localidades en donde existen, o existieron en el pasado, poblaciones de P. lomentifera, cantidad que se ajusta a los umbrales de la categoría Vulnerable (VU): 1) Noroeste de Boquerón (Boquerón); 2) Colonias menonitas y alrededores (zona fronteriza entre Boquerón y Presidente Hayes); 3) Puerto Casado (Alto Paraguay); 4) Parque Nacional Defensores del Chaco (Alto Paraguay); 5) Hito Cerro Cabrera y alrededores (Alto Paraguay); 6) Pozo Colorado y alrededores (Presidente Hayes); 7) Santa Cruz (Bolivia); 8) Chuquisaca (Bolivia). Cabe destacar que estas 8 localidades se encuentran actualmente muy separadas entre sí por extensas áreas agropecuarias que se alternan con remanentes de vegetación natural, por lo cual se puede considerar que la EOO se encuentra moderadamente fragmentada (subcriterio Ba).
Considerando la proyección de cobertura deforestada del INFONA para el 2030, las zonas de Fortín Madrejón, La Patria y Picada 500, que se encuentran dentro del área de distribución natural de la especie, presentaron altas probabilidades de deforestación en distintos modelos de simulación 41. Consecuentemente, se estima un proceso de disminución continua inferida para las poblaciones de P. lomentifera (subcriterio Bbi+ii).
En cuanto a la calidad del hábitat (subcriterio Bbiii), las localidades Colonias menonitas, Puerto Casado y Pozo Colorado se encuentran en la actualidad modificados a áreas rurales y núcleos urbanos menores 43, resultado de la expansión agrícola y ganadera en el Chaco 58, con lo cual, es posible que las poblaciones de P. lomentifera en estas áreas se encuentren en disminución. Por el contrario, las localidades del Parque Nacional Defensores del Chaco, el Hito Cerro Cabrera (ubicado en el Reserva Natural Cerro Cabrera/Timane) y el Noroeste de Boquerón, que incluye los Parques Nacionales Médanos del Chaco y Teniente Agripino Enciso, y la Reserva Natural Ñu Guazú, constituyen áreas silvestres protegidas 52 y cuentan con registros recientes de poblaciones de la especie. En cuanto a las localidades en territorio boliviano, la especie fue registrada dentro del área protegida Parque Nacional y Área Natural de Manejo Integrado Kaa-Iya, en el Departamento de Santa Cruz 63, mientras que la localidad de Chuquisaca no se encuentra bajo protección. No se tiene datos sobre fluctuaciones extremas en esta especie (subcriterio Bc).
Consecuentemente, se propone para P. lomentifera la categoría de amenaza Vulnerable; VU B2ab (i,ii,iii).
DISCUSIÓN
Los datos derivados de la revisión de ejemplares de herbario y de bases de datos han sido notablemente afines entre sí. En general, la mayoría de los registros obtenidos por revisión de herbario también fueron encontrados en la base de datos GBIF, aunque algunos encontrados en esta última fueron excluidos por tratarse de ejemplares provenientes de individuos cultivados, de determinaciones incorrectas (detectadas ya sea por la observación del ejemplar en alguno de los herbarios visitados o en imágenes digitales de las instituciones que lo albergan), o de determinaciones dudosas, como fue el caso de dos ejemplares de B. illinitoides ya determinados entre los años 2004 y 2016, pero que aún no fueron incorporados formalmente en la Flora del Brasil 37. Sin embargo, para las cuatro especies estudiadas, se destaca el limitado número de registros disponibles, tanto en herbarios como en GBIF, lo cual reafirma que se trata de especies raras y de limitada distribución.
Por otro lado, los resultados obtenidos valorizan las revisiones taxonómicas de ejemplares de herbario como primera fuente de datos para el análisis del estado de conservación de especies de plantas. Considerando que bases de datos como GBIF no cuentan con una revisión de pares 64, o que las determinaciones de los registros pueden encontrarse desactualizadas o equivocadas 5, consideramos fundamental que estos estudios estén basados principalmente en ejemplares de herbario bien curados y revisados, con el fin de que posteriormente se pueda evaluar a ojo crítico la información digital disponible.
Se confirmó que dos de las especies tratadas, B. illinitoides y C. guaranitica, serían, hasta la fecha, endémicas del territorio paraguayo; ambas se asocian a suelos arenosos y pobres, aunque B. illinitoides demuestra una clara preferencia por los suelos anegables o inundables y C. guaranitica por las formaciones de cerrados del norte de la región Oriental. Respecto de los dos registros en Brasil de B. illinitoides considerados dudosos, su exclusión responde a un criterio conservador y precautorio, y la categorización de la especie dentro de EN es adecuada para una primera evaluación de esta especie. De confirmarse la identidad de estos dos ejemplares y la presencia de esta especie en Brasil, el análisis resultaría igualmente en una categoría de amenaza para B. illinitoides, en este caso Vulnerable (VU) ya que, aunque la especie incrementaría su EOO, seguiría demostrando una fragmentación considerable y un escaso número de localidades. Por lo tanto, consideramos que la categoría de EN es precautoria y contribuye a depositar la atención sobre esta especie de distribución claramente restringida, con el fin de aumentar esfuerzos de muestreo y motivar una actualización de su estado de conservación en un futuro próximo.
Las dos especies restantes; N. rojasiana y P. lomentifera, anteriormente consideradas como endémicas de Paraguay 22, han sido coleccionadas también en la Argentina y en Bolivia, respectivamente. Se infiere que ambas especies habitan exclusivamente en la Ecorregión Chaco Seco 65-67, parte del Gran Chaco Americano 68, que abarca el sur de Bolivia, el oeste de Paraguay y el norte de Argentina. Es una región semiárida donde predominan bosques y matorrales xerófitos caducifolios, aunque también se presentan sabanas tropicales, palmares y formaciones halófilas 66. La distribución de estas especies, restringida a la Ecorregión Chaco Seco, indica que deben ser consideradas como endemismos ecorregionales, y ya no como endemismos de la flora paraguaya.
Siguiendo los criterios propuestos por la UICN 7, se propone considerar a las cuatro especies analizadas como amenazadas; B. illinitoides y C. guaranitica bajo categoría EN, y N. rojasiana y P. lomentifera bajo categoría VU. Para B. illinitoides y C. guaranitica, donde el resultado EN se dio en dos de los criterios, se siguió el principio de precaución de la UICN 7, que recomienda en estos casos seleccionar la categoría más alta. En el caso de N. rojasiana y P. lomentifera, con resultados diferentes para cada subcriterio (LC, VU y EN) se justifica la aplicación de la categoría VU a modo de promediar los indicadores. Cabe mencionar que Morales et al. 69, han realizado análisis de conservación preliminares para N. rojasiana y P. lomentifera con una menor cantidad de ejemplares de herbario, y han propuesto la categoría EN para estas especies.
Según los registros de herbario estudiados, las cuatro especies cuentan con poblaciones presentes tanto en áreas silvestres protegidas como en localidades sometidas, en las últimas décadas, a presiones ambientales como el cambio de uso de suelo, la deforestación, la fragmentación y la degradación de sus hábitats naturales; estas actividades fueron identificadas como la principal amenaza a estas especies silvestres.
Los Parques Nacionales Cerro Corá, Defensores del Chaco, Médanos del Chaco y Teniente Enciso; el Refugio Biológico Tati Yupi, el Hito Cerro Cabrera (ubicado en el Reserva Natural Cerro Cabrera/Timane) y las Reservas Naturales Riacho Florida y Ñu Guazú constituyen áreas silvestres protegidas 52 dentro de las cuales se existen registros recientes de las especies tratadas, evidenciando la existencia de poblaciones viables y susceptibles de planes de conservación a corto y largo plazo. Estos sitios son clave para garantizar la conservación de las mismas, ya que el patrimonio natural que se sitúa dentro de los mismos se encuentra bajo el amparo de las leyes del país.
En cambio, localidades como el arroyo Estrella, Puerto Casado, Pozo Colorado, las colonias menonitas, entre otras, al no formar parte de las áreas protegidas, actualmente se encuentran considerablemente modificadas y bajo una enorme presión de cambio que influye sobre las comunidades vegetales presentes en las mismas. Todas son áreas con activa producción agropecuaria, que, sumada a la resultante fragmentación y degradación de los remanentes de vegetación silvestre, constituirían las principales amenazas para las especies estudiadas.
Los resultados de este trabajo destacan la importancia de las áreas silvestres protegidas para la conservación de las especies endémicas y amenazadas, y de otras que podrían ser tratadas con la metodología implementada en este trabajo. Sin embargo, cabe señalar que estos resultados, de ser incorporados en la creación de planes de desarrollo sostenible en áreas productivas, podrían contribuir con una producción agroganadera que sea compatible con la conservación de especies, a través de la identificación de poblaciones silvestres de especies amenazadas y su integración en los planes de desarrollo con propuestas de conservación local o urbana, creación de corredores biológicos, entre otras acciones de responsabilidad ambiental dentro del marco de un desarrollo económico sostenible.
CONCLUSIONES
La sistematización de datos y el análisis distribución y estado de conservación, según los criterios de UICN, de las cuatro especies de plantas endémicas estudiadas, Baccharis illinitoides, Casimirella guaranitica, Neltuma rojasiana y Piptadeniopsis lomentifera, respaldan apropiadamente la propuesta preliminar de categorización de estas especies como amenazadas; las dos primeras en la categoría EN, y las últimas en la categoría VU. Los resultados obtenidos avalan la aplicación del Criterio B de UICN a partir de ejemplares de herbario, datos georreferenciados y registros disponibles en bases de datos en línea apropiadamente curados, para el desarrollo de análisis de conservación en especies de plantas con la utilización de la herramienta GeoCAT. Los resultados permitieron identificar sitios clave para la preservación de estas especies, así como para guiar acciones de conservación.












 uBio
uBio