INTRODUCCIÓN
El síndrome de distrés respiratorio agudo (SDRA) es una enfermedad aguda y compleja, de carácter devastador, con una alta morbimortalidad tanto en la población adulta como la pediátrica, carente de terapia farmacológica efectiva y tratamiento específico1. Se caracteriza por el desarrollo de edema pulmonar no cardiogénico e hipoxemia refractaria con disminución de la distensibilidad pulmonar posterior a una injuria pulmonar. Varios trastornos clínicos pueden precipitar el SDRA, incluyendo neumonía, sepsis, broncoaspiración y trauma; también, puede desarrollarse en el contexto de una falla multiorgánica.
A pesar de la diversidad de criterios diagnósticos utilizados en el pasado y las distintas metodologías de investigación del SDRA, se estima una incidencia en niños de 1.5-80 casos por 100.000 habitantes; llegando a ser reportado en algunos estudios epidemiológicos una prevalencia de 0.86% al 7.8% de las admisiones en cuidados intensivos y del 5% al 20.5% en pacientes con ventilación mecánica, con tasas de mortalidad entre 14% y 61%2,3.
Las intervenciones terapéuticas en el tratamiento del SDRA han mejorado en la última década, con el avance en la comprensión de los mecanismos responsables de la patogénesis y en la resolución de la lesión pulmonar; lo que ha permitido una evolución de la ventilación pulmonar protectora, así como de las maniobras de reclutamiento alveolar. Sin embargo, a pesar de la mejoría en la sobrevida, la mortalidad se mantiene elevada. Por otra parte, los factores de riesgo que comúnmente se mencionan en la literatura, tienen más fundamentos en la población adulta que en la pediátrica, al igual que los criterios para su definición.
El mecanismo exacto a través del cual ocurre la interacción entre los factores de riesgo y la patogénesis del SDRA es aún desconocido. Hay muchos factores, solos o en combinación, que han sido implicados en su patogénesis. Algunos de ellos son el síndrome de respuesta inflamatoria sistémica, contusión pulmonar, inhalación de sustancias tóxicas, casi-ahogamiento, entre otros. El reconocimiento temprano de factores de riesgo durante la estadía hospitalaria del paciente puede contribuir a disminuir el desarrollo del SDRA. El objetivo primario del estudio fue identificar factores de riesgo asociados a SDRA en niños.
MATERIALES Y MÉTODOS
Se trata de un estudio de casos y controles con pacientes admitidos en la unidad de cuidados intensivos pediátricos "Dr. Francisco Finizola Celli" del Hospital Universitario de Pediatría "Dr. Agustín Zubillaga" (Estado Lara, Venezuela), entre Mayo del 2012 y Mayo del 2016, con edades entre 1 mes y 15 años de edad. Todos recibieron ventilación mecánica invasiva por más de 48 horas. Los casos con SDRA fueron identificados por un equipo específico de pediatras intensivistas y seguidos hasta su descarga del hospital (egreso o fallecimiento). A cada caso le fue asignado 3 controles que no desarrollaron SDRA durante su estadía en cuidados intensivos, con edad ± 1 año, PRISM ± 5 puntos y promedio de PaCO2 en las primeras 24 horas de ventilación mecánica ± 5 mm de Hg. con respecto al caso índice. Se excluyeron aquellos pacientes que desarrollaron hipoxemia refractaria con cambios radiológicos pulmonares en las 6 horas posteriores a la transfusión de derivados sanguíneos (para evitar incluir pacientes con lesión pulmonar aguda por transfusión), aquellos con edema pulmonar cardiogénico y fallecidos antes de las 72 horas de admitido en cuidados intensivos. Se creó una base de datos codificados para proteger la confidencialidad. Hubo consentimiento informado.
La definición de SDRA se realizó de acuerdo con la definición propuesta por el consenso del grupo de lesión pulmonar aguda pediátrica del 20154, incluyéndose para el diagnóstico de SDRA solo aquellos niños con índice de oxigenación igual o mayor a 8. Además, se registraron variables demográficas: edad, grupo etario, sexo, PRISM (Pediatric Risk of Mortality), PELOD (Pediatric Logistic Organ Dysfunction), modo de ventilación mecánica: CMV/IPPV (Controlled Mandatory Ventilation/Intermittent Positive Pressure Ventilation), cardiopatía congénita cianógena, enfermedad pulmonar crónica (asma, displasia broncopulmonar) e inmunosupresión (sida, diabetes, enfermedad hematológica maligna); datos clínicos: neumonía, broncoaspiración, contusión pulmonar, casi-ahogamiento; sepsis de origen no respiratorio, según criterios de la conferencia internacional del consenso para sepsis pediátrica del 20055; politraumatismo (sin contusión pulmonar), shock (hipotensión que requiere tratamiento vasopresor por más de 24 horas), pancreatitis aguda, coagulación intravascular diseminada (CID), quemado (más del 15% de la superficie corporal), patología neurológica (accidentes cerebro-vasculares, polirradiculoneuropatías y tumores cerebrales); insuficiencia renal aguda, según criterios de la guía KDIGO6, transfusión de glóbulos rojos (todas fueron a 10 cc/Kg de peso, excepto en pacientes con cardiopatía donde fueron realizadas a 5 cc/ Kg de peso, a criterio del grupo de médicos tratantes y sin un protocolo predeterminado de transfusión), sobrecarga hídrica (balance de fluidos de las primeras 72 horas de admitido en UCI superior al 10% del peso corporal del ingreso) y cirugía. También, los resultados en los promedios de la relación PaO2/FiO2, índice de oxigenación (IO = [FiO2 × Presión media de vía aérea × 100] ÷ PaO2), volumen tidal, presión inspiratoria pico (PIP), presión positiva al final de la espiración (PEEP), pH sérico, PaCO2 antes del diagnóstico del SDRA en el grupo de casos y la mortalidad general. Las infecciones registradas fueron adquiridas en la comunidad. Todas las variables en el grupo control fueron tomadas hasta el momento del diagnóstico de SDRA correspondiente al caso índice asignado en el grupo de casos, siempre que este no desarrollara la enfermedad posteriormente, tomando en cuenta el tiempo de inicio de la lesión clínica o del nuevo deterioro de los síntomas respiratorios.
De acuerdo con estudios en pacientes con SDRA7,8, para una proporción de casos con ventilación mecánica expuestos a factores de riesgo conocidos que desarrollan SDRA del 42.0%, proporción de controles expuestos del 19.3%, Odds Ratio esperado de 3.0, controles por caso de 3, con un nivel de confianza del 95% y una potencia del 90%, la muestra se estimó en 61 sujetos con SDRA y 183 sin SDRA, con corrección de Yates. El programa utilizado para el cálculo de la muestra del estudio fue el Epidat 3.1. El SPSS Statistics versión 17.0 fue utilizado en el análisis estadístico de los datos. Las diferencias entre medias de variables con distribución no normal fueron analizadas mediante U test de Mann - Whitney, aquellas con distribución normal con t de Student y las diferencias en la distribución de variables categóricas fueron analizadas con test de X 2. La significancia estadística fue establecida como p < 0.05. La fuerza de asociación fue reportada como Odds Ratio con 95% de intervalo de confianza. Se procuró transformar variables cuantitativas de interés en el estudio a variables dicotómicas. Las variables clínicamente relevantes y asociadas a SDRA en el análisis univariable, fueron utilizadas para crear un modelo de regresión logística binaria con un valor de p < 0.05 como criterio de entrada. En función de un principio jerárquico en la regresión logística fue utilizado un procedimiento de "introducir". La prueba de bondad de ajuste de Hosmer y Lemeshow fue hecha para evaluar la significancia del modelo, considerando significativo un p > 0.05. También se calculó R2 de Nagelkerke.
RESULTADOS
Se incluyeron 244 niños con más de 48 horas de ventilación mecánica entre 1 mes y 15 años de edad, 61 (25%) con SDRA comparados con 183 controles sin SDRA. La edad promedio fue de 6.1 ± 4.6 años, el promedio de puntuación del PRISM fue 15 ± 4 puntos, PELOD 16 ± 4 puntos, 71.3% ventilados en modo CMV/IPPV, 7% con enfermedad pulmonar crónica, los datos clínicos más frecuentes fueron: shock 33.2%, coagulación intravascular diseminada con 31.1%, cirugía 26.2%, sepsis no respiratoria 24.6%, neumonía 23.8%, y sobrecarga de fluidos 17.6%. El tiempo en desarrollar el SDRA fue de 4.2 ± 1.3 días posteriores a la lesión pulmonar. La mediana de transfusión de glóbulos rojos fue de 2 (0 - 5). El promedio de la relación PaO2/FiO2 fue de 291 ± 80 mm de Hg., con IO de 12 ± 3 y la mortalidad general fue de 13.9% (Tabla 1).
Tabla 1 Características de la población de estudio.

PRISM: Pediatric Risk of Mortality
PELOD: Pediatric Logistic Organ Dysfunction
CMV/IPPV: Controlled Mandatory Ventilation/ Intermittent Positive Pressure Ventilation
PIP: Presión inspiratoria pico
PEEP: Presión positiva al final de la espiración
SDRA: Síndrome de distrés respiratorio agudo
PaO2: Presión arterial de oxígeno
FiO2: Fracción inspiratoria de oxígeno
PaCO2: Presión arterial de dióxido de carbono
¥Promedio de casos y controles antes del diagnóstico de SDRA en caso índice
§Mediana y rango
*Grupo de casos
Las variables que mostraron diferencias significativas en el análisis univariable fueron: mayor puntuación del PELOD (19 ± 5 vs. 15 ± 3 puntos, p < 0.0001), mayor frecuencia de contusión pulmonar (13.1% vs. 5.5%, p = 0.048), de politraumatismo (23.0% vs. 8.7%, p = 0.003), de shock (62.3% vs. 23.5%, p < 0.0001), con mayor frecuencia de transfusiones de glóbulos rojos [3(0 - 5) vs. 2(0 - 4), p < 0.0001] con mayor proporción de más de 3 transfusiones (41.0% vs. 22.3%, p = 0.004), con mayor proporción de sobrecarga de fluidos (29.5% vs. 13.7%, p = 0.005), con menor relación PaO2/FiO2 (215 ± 32 vs. 317 ± 75 mm de Hg., p < 0.0001), con mayor IO (15.8 ± 2.1 vs. 11.3 ± 2.8 puntos, p < 0.0001) y mayor proporción de IO > 8 (34.4% vs. 16.9%, p < 0.0001), con mayor PEEP (6 ± 2 vs. 5 ± 2 cm de agua, p = 0.003) y menor pH sérico (7.30 ± 0.07 vs. 7.33 ± 0.07, p = 0.004) en el grupo que desarrolló SDRA. La mortalidad fue mayor en el grupo con SDRA (37.7% vs. 6.0%, p < 0.0001). El resto de las variaciones están representadas en la tabla 2.
Tabla 2 Análisis univariable según SDRA.

PRISM: Pediatric Risk of Mortality
PELOD: Pediatric Logistic Organ Dysfunction
CMV/IPPV: Controlled Mandatory Ventilation/ Intermittent Positive Pressure Ventilation
PIP: Presión inspiratoria pico
PEEP: Presión positiva al final de la espiración PaO2: Presión arterial de oxígeno
FiO2: Fracción inspiratoria de oxígeno
PaCO2: Presión arterial de dióxido de carbono
*Χ 2 de Pearson o test de Fisher para datos cualitativos y t de Student o Test U de Mann-Whitney para datos cuantitativos
§Mediana y rango
¥Promedios antes del diagnóstico de SDRA en el caso índice
Posteriormente, se realizó el análisis de regresión logística binaria multivariable (Tabla 3), considerando las variables potencialmente predictores (variables independientes) que resultaron significativas como factores asociados en el análisis univariable. Ajustando el modelo de regresión logística con SDRA como variable de desenlace (variable dependiente), los factores independientes asociados al desarrollo de SDRA en niños con más de 48 horas de ventilación mecánica fueron: Más de 3 transfusiones de glóbulos rojos (OR: 1.5; 95% IC 1.2 - 1.9, p = 0.010), sobrecarga de fluidos (OR: 1.3; 95% IC 1.1 - 5.7, p = 0.012) e índice de oxigenación mayor de 8 sin otros criterios de SDRA (OR: 1.9; 95% IC 1.4 - 2.6, p < 0.0001). No resultaron asociados en la regresión: PELOD, contusión pulmonar, politraumatismo, shock, relación PaO2/FiO2, PEEP y pH sérico. El modelo clasifica correctamente al 89.3% de los casos. La R2 de Nagelkerke fue de 0.659, indicando que el 65.9% de la variación observada en los pacientes con SDRA es explicado por las variables incluidas en el modelo. La prueba de bondad de ajuste de Hosmer y Lemeshow mostró un valor de p = 0.103, lo que permite determinar que el modelo propuesto puede explicar las variaciones observadas.
Tabla 3 Análisis de regresión logística multivariable.
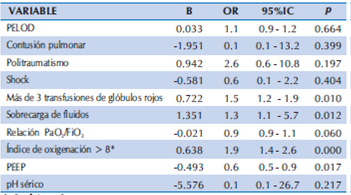
β: Coeficiente β
OR: Odds ratio
IC: Intervalo de confianza
PELOD: Pediatric Logistic Organ Dysfunction
PEEP: Presión positiva al final de la espiración
*Sin otros criterios de SDRA
El modelo clasifica correctamente al 89.3% de los casos
Prueba de Hosmer y Lemeshow = 0.103 R2 de Nagelkerke = 0.659
DISCUSIÓN
El SDRA se caracteriza clínicamente por un inicio agudo, hipoxemia refractaria severa, infiltrados bilaterales en la radiografía de tórax y edema pulmonar no cardiogénico, con una alta morbimortalidad. Los factores de riesgo clásicos para el desarrollo de esta enfermedad tienen la mayoría de sus evidencias en poblaciones de adultos. Se ha descrito que el SDRA tiene tasas de mortalidad distintas entre pacientes pediátricos y adultos, con hallazgos histológicos diferentes y con pronósticos distintos en el SDRA desencadenado por causas similares entre niños y adultos9. Estos hallazgos sugieren que el SDRA de los pacientes pediátricos podría tener una evolución diferente al de los pacientes adultos, aludiendo así la necesidad de disponer de estudios con factores de riesgo propios de la población pediátrica.
A pesar de la falta de disponibilidad de instrumentos terapéuticos específicos de alta tecnología (ventilación de alta frecuencia o equipos de oxigenación por membrana extracorpórea) en las áreas de atención del paciente críticamente enfermo donde se realizó la investigación, la tasa de mortalidad encontrada en esta serie fue del 37.7 % en el grupo con SDRA, lo que es similar a lo reportado en otros estudios10.
En la serie estudiada más de 3 transfusiones de glóbulos rojos, la sobrecarga de fluidos y el índice de oxigenación mayor de 8 resultaron asociados en la regresión logística al desarrollo del SDRA. Las transfusiones de derivados sanguíneos se han asociado con lesión pulmonar aguda, frecuentemente en pacientes adultos con trauma, neumonía, broncoaspiración o sepsis, considerándose poli-transfusión la administración de más de 10 unidades de paquetes de hematíes en 24 horas. El evento más frecuentemente reportado es TRALI (Transfusion-Related Acute Lung Injury) o la lesión pulmonar aguda producida por transfusión, sin embargo se ha asociado también con SDRA11. El hallazgo de la asociación entre transfusión de glóbulos rojos y desarrollo del SDRA es consistente con lo reportado en la literatura, pero su explicación en base a la cantidad de unidades de sangre es posible que sea diferente. La poli-transfusión tal como se define para adultos, no es aplicable en una población infantil; sin embargo, es posible que los mecanismos involucrados en la lesión pulmonar sean similares. Identificándose de esta manera, subpoblaciones donde con un menor volumen administrado, se puede desencadenar la lesión pulmonar y desarrollar el SDRA.
Existen mecanismos sugeridos a través de los cuales se puede aclarar la naturaleza de la asociación entre la trasfusión y los cambios eventuales de la lesión pulmonar hasta desarrollar SDRA12, tales como: la edad de almacenamiento de los productos sanguíneos, la interacción con la transfusión de otros productos distintos a los glóbulos rojos, el porcentaje de leucocitos de la sangre filtrada (leucodeplesión), la carga de hierro libre en la sangre almacenada; así como también, la disminución en la producción de interleucina-2 y un aumento en la producción de prostaglandina E2, con una disminución en los linfocitos T CD4 helper y del receptor positivo para la interleucina-2 en células auxiliares, han sido documentados. Sin embargo los mecanismos exactos en la asociación entre transfusiones y SDRA son inciertos. Por otra parte, la sobrecarga de volumen debe ser excluida para realizar el diagnóstico de SDRA, pero la transfusión podría resultar en un edema pulmonar desapercibido.
Se puede argumentar que la asociación entre el número de trasfusiones de glóbulos rojos y el desarrollo de SDRA representa una relación casual y no causal, dada por la mayor gravedad de la enfermedad en los pacientes que requieren transfusiones de productos sanguíneos, mismos que posteriormente desarrollan la enfermedad. El PRISM fue utilizado como indicador de severidad en el niño críticamente enfermo, y en base a la observación de que en los niños con o sin SDRA presentaron un promedio de PRISM similar, se podría inferir que la severidad de la enfermedad no constituyó un factor de riesgo para realizar la transfusión o una variable confundente o modificadora del efecto asociada a la transfusión de glóbulos rojos en la serie estudiada.
Los mecanismos a través del cual la sobrecarga de fluidos puede influir en el pronóstico de los pacientes o en su asociación con SDRA también permanecen desconocidos. La hipervolemia e hiperosmolaridad pueden exacerbar la fuga capilar, contribuyendo a edema generalizado, aumento de la presión intra-abdominal e intra-torácica y edema pulmonar; acumulándose de esta forma un balance hídrico positivo asociado al desarrollo de hipoperfusión sistémica y regional, y subsecuentemente a falla multiorgánica13. Esta disfunción de órganos también se observó en esta serie, donde el grupo que desarrolló SDRA presento un puntaje de PELOD significativamente más alto que el grupo control. Así mismo, es conocido el desarrollo frecuente de síndrome de dificultad respiratoria aguda en pacientes sépticos, debido a que la sobrecarga de fluidos genera una lesión aguda al pulmón, ocasionando así una mayor estadía hospitalaria, un incremento en los días de asistencia respiratoria mecánica e incremento en la mortalidad, independientemente de la magnitud de la falla de los índices de oxigenación o la gravedad de la disfunción orgánica14.
El índice de oxigenación se ha utilizado como elemento para la toma de decisiones con respecto a la ventilación mecánica, como criterio de severidad y como factor para discriminar la mortalidad con riesgo estratificado en pacientes con SDRA15. Su importancia también podría estar en su posible participación en las definiciones para futuras investigaciones y terapias dirigidas a los niños con diferentes grados de lesión pulmonar, dado que hay claras diferencias en el resultado en base a la gravedad de la enfermedad, así como también en perfiles de riesgo, que pueden diferir en función de la severidad16. Sin embargo, su variación antes del diagnóstico de SDRA no ha sido asociada como factor de riesgo para el desarrollo posterior de la enfermedad en niños. Este índice agrega un parámetro importante, la presión media de la vía aérea, lo que permite incluir cambios inflamatorios tempranos, que se traducen en un incremento precoz de las presiones de la vía aérea, siendo así detectados con este índice.
Los rangos discriminatorios del índice de oxigenación muestran variaciones importantes en la literatura, sin embargo, se tomó la recomendación del estudio combinado del Hospital de Niños de los Ángeles y de la Sociedad de Cuidados Intensivos de Australia - Nueva Zelanda17, por estar avalados por el consenso del grupo de lesión pulmonar aguda pediátrica y su fácil reproducibilidad. Estos rangos fueron estandarizados específicamente para discriminar mortalidad, sin embargo, se encontró que un valor de IO > 8 se asocia como predictor de SDRA antes de que ocurran cambios en la evolución clínica y en la radiografía de tórax del paciente para realizar el diagnóstico de la enfermedad.
Existen importantes limitaciones en los resultados observados, un diseño observacional no intervencionista y una muestra, que a pesar de contar con un cálculo adecuado de su tamaño, el número de sujetos estudiados es bajo en comparación con estudios multicéntricos. Se sincronizó el tiempo de inicio de la injuria clínica entre casos y controles, pero no hubo emparejamiento en las patologías basales y comorbilidades. Por otra parte, debe tenerse en cuenta que no hubo análisis estratificado de acuerdo a la edad. Aunque se incluyeron variables comúnmente asociadas al desarrollo del SDRA, es posible la omisión de otros factores o de la intervención de variables confundentes debido a la complejidad del síndrome. Finalmente, otros factores a considerar son: determinación de biomarcadores, la predisposición genética, el uso de esteroides, el uso de diuréticos y el tipo de ventilación mecánica inicial.
CONCLUSIONES
El SDRA continúa siendo una enfermedad con alta morbimortalidad, a pesar de la evolución de las estrategias ventilatorias desarrolladas para su tratamiento. Más de 3 transfusiones de glóbulos rojos, la sobrecarga de fluidos y el índice de oxigenación mayor de 8 podrían constituir elementos predictores para el desarrollo del SDRA en niños. Optimizar las indicaciones de transfusión de glóbulos rojos en niños con soporte ventilatorio mecánico, evitar la sobrecarga de fluidos con un uso más cautelosos de los líquidos y utilizar el IO para la toma de decisiones en el manejo ventilatorio del paciente críticamente enfermo podría disminuir la frecuencia del SDRA. En el análisis de factores de riesgo la puntuación del PELOD, la contusión pulmonar, politraumatismo, shock, relación PaO2/FiO2, PEEP y pH sérico no fueron identificados como predictores independientes para el desarrollo de SDRA. El reconocimiento temprano de factores de riesgo puede contribuir a disminuir el desarrollo del SDRA.














