Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.8 no.1 Asunción June 2010
ARTICULO ORIGINAL
Embarazo como factor de riesgo de hospitalización y muerte en la pandemia por influenza A (H1N1) en Paraguay
Pregnancy as a risk factor for hospitalization and death during influenza A (H1N1) pandemic in Paraguay
*Barúa CI, Allende II, Cabello AI, Von Horoch MI, Vera AI, Ojeda AI, Morel GI, Samudio MII
IDirección General de Vigilancia de la Salud, Ministerio de Salud Pública y Bienestar Social. Asunción, Paraguay
IIInstituto de Investigaciones en Ciencias de la Salud. Universidad Nacional de Asunción, Paraguay
RESUMEN
La influenza A (H1N1) se ha identificado como la causa de epidemia de Infección Respiratoria Aguda en Paraguay y en el mundo. Se analizaron los factores de riesgo asociados a la morbimortalidad en embarazadas con sospecha de infección por H1N1 notificadas a la Dirección General de Vigilancia de la Salud (DGVS) del MSPBS durante los primeros cuatro meses de la pandemia, en comparación con mujeres en edad fértil no embarazadas con sospecha de infección por H1N1. A partir del 28 de abril de 2009, la DGVS comenzó sistemáticamente la vigilancia de H1N1 en todas sus unidades notificadoras, siendo la notificación inmediata y por planilla individual basándose la notificación en la definición de casos confirmado establecidas por el país. Hasta el 25 de agosto del 2009 fueron notificadas 2268 mujeres con sospecha de H1N1, de las cuales 1120 tenían entre 15 a 40 años, y de ellas 117 estaban embarazadas. El 68% (79/117) de las embarazadas requirió hospitalización y la mortalidad fue de 21% (25/117), mientras que en grupo de las no embarazadas el 21% se hospitalizó (288 /1003) y la mortalidad fue de 1,5% (16/1003). Todos los casos fallecidos desarrollaron Infección Respiratoria Aguda Grave caracterizado por un síndrome de distrés respiratorio que en algunos casos requirieron asistencia respiratoria mecánica (ARM). Ninguna de las embarazadas refirió antecedente de co-morbilidad. El 22% (26/117) de las embarazadas y 2,9% (30/1003) de las no embarazadas recibieron Oseltamivir como tratamiento. Se evidencian que la infección produce alta morbimortalidad en embarazadas en comparación con mujeres del mismo grupo de edad, los cuales apoyan la recomendación de un tratamiento antiviral precoz en gestantes, así como un seguimiento clínico cercano.
Palabras clave: Influenza A (H1n1), embarazada, vigilancia, factores de riesgo, Paraguay.
ABSTRACT
Influenza A (H1N1) has been identified as the cause of the Acute Respiratory Infection epidemic in Paraguay and the world. Risk factors associated to morbid-mortality in cases of pregnant women with suspicion of H1N1 infection and notified to the General Direction of Health Surveillance (DGVS in Spanish) of the Ministry of Public Health and Social Welfare (MSPBS in Spanish) during the fourth first months of the pandemic were analyzed in comparison to non-pregnant fertile women with suspicion of H1N1 infection. From April 28, 2009 the DGVS started a systematic surveillance of H1N1 in all its notifying units, being the notification immediate and by individual spreadsheet basing the notification in the case definition established by the country. Until August 25, 2009 2,268 cases of women with suspicion of H1N1 were notified, 1,120 of them were between 15 to 40 years and from them 117 were pregnant. Sixty eight percent (79/117) of the pregnant women required hospitalization and mortality was 21% (25/117) while in the non-pregnant women, 21% were hospitalized (288 /1003) and mortality was 1.5% (16/1003). All deceased cases developed Serious Acute Respiratory Infection characterized by a respiratory distress syndrome that, in some cases, required mechanical respiratory assistance (MRA). None of the regnant women referred history of co-morbidity. Twenty two percent (26/117) of the pregnant women and 2.9% (30/1003) of the non-pregnant women received Oseltamivir as treatment. These results show that the infection produces high morbid-mortality in pregnant women in comparison to women of the same age group, supporting the recommendation of an early antiviral treatment in pregnant women as well as a close clinical follow-up.
Keywords: Influenza A (H1N1), pregnant, risk factors, surveillance, Paraguay.
INTRODUCCION
Infecciones humanas con una nueva cepa de influenza A (H1N1) virus que es fácilmente transmisible entre seres humanos se ha identificado por primera vez en abril de 2009 (1).
La epidemiología y la clínica de estas infecciones se encuentran actualmente bajo investigación. No hay suficientes datos disponibles en este momento para determinar que grupos están en mayor riesgo de complicaciones de la nueva gripe A (H1N1). Sin embargo, es razonable suponer que la edad y grupos de riesgo que tienen mayor frecuencia de complicaciones de la gripe estacional también deban considerarse de alto riesgo para la nueva gripe A (H1N1) 1-4).
Pruebas de que la gripe puede ser más grave en mujeres embarazadas provienen de observaciones en anteriores pandemias y de estudios entre las mujeres embarazadas que tenían la gripe estacional. Un aumento de la gripe por influenza asociada a un aumento de muertes entre las mujeres embarazadas se informó durante las pandemias de 1918-1919 y 1957-1958 (3,5-7).
Resultados adversos del embarazo se han comunicado luego de anteriores pandemias de gripe, con aumento de las tasas de aborto espontáneo y parto prematuro, especialmente entre las mujeres con neumonía (1-3,7,8).
Varios informes de casos y estudios epidemiológicos realizados durante los períodos inter pandémicos también indican que el embarazo aumenta el riesgo de complicaciones de la gripe en estas pacientes y puede aumentar el riesgo de resultados perinatales adversos o complicaciones del parto (2,3,5,7,9-12).
Las mujeres embarazadas con la nueva gripe A (H1N1) se espera que se presenten con la típica enfermedad respiratoria aguda (por ejemplo, tos, dolor de garganta, rinorrea) y fiebre o fiebre con escalofríos. Muchas mujeres embarazadas van a tener un curso típico de la gripe sin complicaciones. Sin embargo, para algunas mujeres embarazadas, la enfermedad puede avanzar rápidamente, y puede ser complicada por infecciones bacterianas secundarias como neumonía (1,9). La enfermedad materna grave puede derivar en un sufrimiento fetal (11).
TRATAMIENTO Y QUIMIPROFILAXIS
La cepa que actualmente está circulando de la gripe A (H1N1) virus es sensible a los medicamentos antivirales inhibidores de la neuraminidasa zanamivir (Relenza ®) y oseltamivir (Tamiflu ®), pero es resistente a los medicamentos antivirales adamantane, amantadina (Symmetrel ®) y la rimantadina (Flumadine ®). (2,3,13,14).
Las mujeres embarazadas que cumplen con las definiciones de caso confirmado, probable o sospechoso de gripe A (H1N1), deben recibir tratamiento antiviral empírico (3).
Las mujeres embarazadas que están en estrecho contacto con las personas con sospecha, probables o confirmadas de nuevos casos de gripe A (H1N1) deben recibir quimioprofilaxis (3).
Como se recomienda para otras personas que son tratadas, con tratamiento antiviral, oseltamivir o zanamivir deben iniciarse tan pronto como sea posible después de la aparición de síntomas de gripe, con beneficios mayores si se inicia tratamiento dentro de las 48 horas del inicio, sobre la base de datos de los estudios de la gripe estacional (13).
Sin embargo, algunos datos de estudios sobre la gripe estacional indican beneficio para los pacientes hospitalizados, incluso si el tratamiento se inicia más de 48 horas después del inicio de los síntomas (1,3,13). Duración recomendada del tratamiento es de cinco días, y para la quimioprofilaxis es de 10 días (1,3,13). Oseltamivir y el zanamivir en regímenes de tratamiento y la quimioprofilaxis recomendada para las mujeres embarazadas son las mismas que las recomendadas para los adultos que tienen la gripe estacional (1, 8, 9, 13, 15). Uno de los más bien estudiados los efectos adversos de la gripe es su asociación a hipertermia. Los estudios han demostrado que la hipertermia materna durante el primer trimestre de embarazo duplica el riesgo de defectos del tubo neural y pueden estar asociados con otros defectos de nacimiento (11). Los datos limitados sugieren que el riesgo de defectos de nacimiento asociados con fiebre pueden ser mitigados por los medicamentos antipiréticos o multivitaminas que contienen ácido fólico (11,12).
La fiebre materna durante el trabajo de parto ha demostrado ser un factor de riesgo neonatal, incluyendo convulsiones neonatales, encefalopatía, parálisis cerebral, y muerte neonatal (11,12). El embarazo no debe considerarse una contraindicación para el uso de oseltamivir o zanamivir. Las mujeres embarazadas podrían estar en mayor riesgo de complicaciones graves de la nueva gripe A (H1N1), y los beneficios de la quimioprofilaxis o tratamiento con oseltamivir o zanamivir probablemente superan a los riesgos teóricos de uso de antivirales (8, 9, 11,12). Oseltamivir y el zanamivir son Embarazo Categoría C", lo que indica que los estudios clínicos no se han llevado a cabo para evaluar la inocuidad de estos medicamentos para las mujeres embarazadas (11-13,17).
Debido a los efectos no conocidos de los medicamentos antivirales en las mujeres embarazadas y sus fetos, oseltamivir o zanamivir debe utilizarse durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial para el embrión o feto (13).
Aunque unos pocos efectos adversos, se han registrado en las mujeres embarazadas que tomaron estos medicamentos, no existe relación entre el uso de estos medicamentos y los efectos adversos en la gestación (1,9,11-13). Tanto el oseltamivir como el zaminivir son considerados compatibles con la lactancia materna (11,12).
Los lactantes que no reciben lactancia materna son particularmente vulnerables a la infección y hospitalización por enfermedad respiratoria grave (9).
Las mujeres deben ser alentadas a iniciar la lactancia materna temprana y con frecuencia. Idealmente, los bebés deben recibir la mayor parte de su nutrición de la leche materna. Eliminar la innecesaria administración de suplementos de fórmula, para que el niño pueda recibir la mayor cantidad de anticuerpos maternos como sea posible (9).
Si una mujer está enferma, debe continuar la lactancia materna y aumentar la frecuencia de alimento. El riesgo para la nueva gripe A (H1N1) de transmisión a través de la leche materna es desconocido. Sin embargo, los informes de viremia por leche materna en la infección por la gripe estacional son raros (9).
Algunas mujeres embarazadas que contrajeron el virus H1N1 2009 desarrollaron una enfermedad grave. En general, las mujeres embarazadas tuvieron tasas de hospitalización más altas que la población general (1,18,19). Aproximadamente el 6% de las muertes confirmadas por influenza H1N1 durante el 2009 en los EE.UU. fueron de mujeres embarazadas, mientras que sólo alrededor del 1% de la población en general son mujeres embarazadas en un momento dado (20). Un estudio de control de casos a gran escala reciente (17) reveló que la vacuna contra la gripe de temporada (vacuna inactiva contra la gripe) administrada a mujeres embarazadas redujo la enfermedad en los bebés menores de 6 meses en un 63%. Se confirmó entonces que la vacunación contra la gripe de temporada en mujeres embarazadas puede beneficiar tanto a las madres como a sus bebés (20). El Comité Asesor sobre Prácticas de Inmunización (ACIP) determinó que las mujeres embarazadas son uno de los grupos prioritarios iniciales para recibir la vacuna monovalente contra la gripe H1N1 2009 en cuanto esté disponible (21). Los ensayos clínicos que evalúan la vacuna en mujeres embarazadas los lleva a cabo el Instituto Nacional de Alergia y Enfermedades Infecciosas (NIAID, por sus siglas en inglés) (22,23).
Una de las medidas más importantes que pueden adoptar los proveedores de cuidados obstétricos es recomendar firmemente a sus pacientes que reciban la vacuna. Se ha demostrado reiteradamente que la recomendación de los proveedores es un punto clave en la aceptación de la vacunación contra la influenza (24,25).
Los proveedores que brindan asistencia a las mujeres embarazadas se encuentran en una posición ideal para proporcionar la vacuna monovalente contra la influenza H1N1 2009 debido a la frecuencia de las consultas durante el embarazo (6). Existen muchas maneras en que las clínicas y los consultorios pueden promover la vacunación de sus pacientes embarazadas (26,27). Algunas sugerencias incluyen la vacunación de sus pacientes en el momento de la consulta prenatal u ofrecer días o instalaciones de vacunación independientes cuando todas las pacientes embarazadas pueden recibir la vacuna (28). Se debe ofrecer la vacuna durante las consultas clínicas regulares incluso en las prácticas con días o instalaciones de vacunación independientes a fin de abarcar a las mujeres embarazadas que no aprovechen esas oportunidades (15).
La Administración de Alimentos y Medicamentos de EE.UU (FDA) aprobó el uso de una dosis de la vacuna para la protección completa de las personas de 10 años de edad en adelante. Por consiguiente, se recomienda que una mujer embarazada reciba una dosis de la vacuna monovalente contra la gripe H1N1 2009 (29,30).
No existen estudios sobre la vacuna viva atenuada contra la influenza en mujeres embarazadas o que están planeando quedar embarazadas. Sin embargo, el virus de la vacuna está adaptado al frío y se reproduce en los tejidos nasofaríngeos en vez de a la temperatura corporal. En consecuencia, es muy poco probable que un feto se contagie el virus vivo, atenuado, de influenza. No es necesario demorar un embarazo durante un intervalo específico luego de recibir la vacuna viva atenuada contra la influenza (17).
Las madres en período de lactancia deben colocarse tanto la vacuna contra la gripe de temporada como la vacuna monovalente contra la influenza H1N1 2009. La lactancia es perfectamente compatible con la vacunación contra la gripe, y la prevención de la infección maternal brinda protección secundaria al bebé (20). La vacunación maternal es especialmente importante para los bebés menores de 6 meses que no son elegibles para la vacunación. Además, la transmisión de los anticuerpos relacionados con la vacunación mediante la lactancia reduce aún más las posibilidades de que el bebé contraiga la gripe. Las mujeres embarazadas deben recibir la vacuna contra la influenza en forma inactiva inyectable y las madres lactantes deben recibir la vacuna ya sea en forma inyectable o en spray nasal (17). No existen pruebas de que las vacunas contra la gripe afecten a las mujeres embarazadas o a sus bebés. Se ha recomendado la vacuna contra la gripe de temporada para las mujeres embarazadas durante muchos años (30). La vacuna monovalente contra la gripe H1N1 2009 se preparará utilizando los mismos procesos que para la vacuna contra la gripe de temporada. Las pruebas clínicas sobre la seguridad de la vacuna monovalente contra el virus H1N1, en niñas y mujeres que no están embarazadas, mostraron resultados similares a los obtenidos en estudios de la vacuna contra la gripe de temporada. Los estudios que prueban la vacuna monovalente contra la gripe H1N1 2009 comenzaron en septiembre. Los viales de dosis múltiples de la vacuna contienen el conservante timerosal para evitar el desarrollo de bacterias. No existe evidencia de que el timerosal sea perjudicial para una mujer embarazada o un feto. Sin embargo, debido a que algunas mujeres están preocupadas por la exposición a los conservantes durante el embarazo, los fabricantes están preparando vacunas contra la gripe de temporada y vacunas monovalentes contra la gripe H1N1 2009 libres de conservantes, en jeringuillas de dosis única. Los CDC recomiendan que las mujeres embarazadas reciban la vacuna contra la influenza con o sin timerosal (29).
Se recomienda la vacuna contra la gripe de temporada a todas las mujeres embarazadas en cualquier momento del embarazo, y no existen pruebas de que afecte a las mujeres embarazadas o a sus bebés. El Comité Asesor sobre Prácticas de Inmunización (ACIP, por sus siglas en inglés) también recomienda que se administre la vacuna monovalente contra la gripe H1N1 2009 a todas las mujeres embarazadas en cualquier momento del embarazo (30).
No está previsto que la vacuna contra la gripe de temporada proteja contra la gripe H1N1 2009. Del mismo modo, la vacuna monovalente contra la gripe H1N1 2009 no brindará protección contra la gripe de temporada.
Las vacunas inactivas contra la gripe de temporada y las vacunas monovalentes contra la gripe H1N1 2009 podrán ser administradas en el mismo día pero aplicadas en diferentes partes del cuerpo (ejemplo: una inyección sobre el brazo izquierdo y la otra inyección sobre el brazo derecho). Las mujeres pueden recibir la vacuna en forma de spray nasal (vacuna atenuada de virus vivos) luego del parto o de la pérdida del feto. Sin embargo, no se recomienda la administración simultánea de dos vacunas vivas contra la influenza el mismo día. Deberían administrarse separadas por 4 semanas como mínimo (20). El uso de la vacuna en forma de spray nasal no está permitido en mujeres embarazadas. Las mujeres embarazadas no deberían recibir la vacuna contra la gripe de temporada o la gripe H1N1 2009 en forma de spray nasal. Después de dar a luz, las mujeres pueden recibir la vacuna en forma de spray nasal, incluso si están en período de lactancia (17). Se desconoce si las mujeres embarazadas tienen mayor riesgo de sufrir efectos secundarios de la vacuna contra la gripe. Se estima que los efectos secundarios de la vacuna monovalente contra la gripe H1N1 2009 serán los mismos que los de las vacunas contra la gripe de temporada. Se cree que los efectos secundarios más comunes luego de la vacunación serán leves, como dolor, enrojecimiento, sensibilidad o inflamación donde se administre la inyección. Algunas personas probablemente experimenten dolores de cabeza, dolores musculares, fiebre, fatiga y náuseas. De producirse estos síntomas, por lo general, se presentarán inmediatamente después de recibida la dosis y probablemente tengan una duración de 1-2 días. El desmayo se puede presentar inmediatamente después de recibir cualquier inyección y se informó extraordinariamente después de la vacuna contra la gripe. Al igual que cualquier otro medicamento, las vacunas pueden originar problemas graves, como severas reacciones alérgicas. Sin embargo, las reacciones alérgicas que ponen en peligro la vida ocasionadas por las vacunas son muy raras (17).
Todas las personas que sufren una alergia grave (riesgo para la vida) a los huevos o cualquier otra sustancia incluida en la vacuna no se deben vacunar, sin tener en cuenta si están o no embarazadas. Los proveedores deben preguntar a los pacientes si tienen alguna alergia grave o si alguna vez tuvieron una reacción alérgica grave después de recibir una vacuna contra la gripe (16). Durante el programa de vacunación de 1976 para la gripe porcina en los EE.UU., con el uso de una vacuna contra el virus muy diferente al virus H1N1 2009, se asoció la vacuna de 1976 con los casos de una enfermedad paralizante grave denominada Síndrome de Guillain-Barré (GBS). Se produjo aproximadamente 1 caso adicional de GBS por cada 100,000 personas vacunadas contra la gripe porcina de 1976. La mayoría de los estudios realizados en las vacunas contra la gripe de temporada después de la vacuna de 1976 no mostraron mayor riesgo de GBS. Sin embargo, dos estudios demostraron un pequeño riesgo de aproximadamente 1 caso adicional de GBS por cada 1 millón de personas vacunadas. El GBS se produce en una proporción de 10 a 20 casos por cada 1 millón de adultos por año, independientemente de la vacunación. Existe evidencia sustancial de que múltiples enfermedades infecciosas, en particular las infecciones gastrointestinales por Campylobacter jejuni y las infecciones en las vías respiratorias superiores, incluyendo una enfermedad respiratoria contagiosa provocada por la influenza, se asocian con el GBS (16). En general, no se ha detectado que la vacuna contra la gripe aumente el riesgo de GBS. Si existe un riesgo, es bajo (es decir, aproximadamente un caso adicional por cada 1 millón de personas vacunadas). Los beneficios potenciales de la vacunación contra la gripe en la prevención de enfermedades graves, la hospitalización y las muertes superan ampliamente la estimación del riesgo de GBS asociado con la vacuna contra la gripe. Las personas que hayan padecido GBS anteriormente no deben recibir la vacuna contra la influenza (16). Aún no se estudió el efecto de las vacunas contra la influenza atenuadas en virus vivos (vacunas LAIV contra la gripe de temporada o la gripe H1N1) en mujeres embarazadas. No se recomiendan las vacunas LAIV en mujeres embarazadas. Se recomiendan las vacunas inactivas contra la influenza (contra la gripe de temporada y las monovalentes contra la gripe H1N1 2009) en el caso de mujeres embarazadas. Sin embargo, si una mujer embarazada recibe una vacuna LAIV, desconociendo por ejemplo que está embarazada, se supone que no correrá ningún riesgo adicional en relación a las mujeres que no están embarazadas. El virus de la vacuna contra la influenza se reproduce en la nariz donde la temperatura corporal es más baja y nunca se vio que se replicara en otras partes del cuerpo o que se transmitiera al bebé en gestación (16).
No existen medidas especiales en caso de que una mujer embarazada haya recibido la vacuna viva, es decir, una segunda vacunación con la vacuna inactiva, toma de medicamentos antivirales o una prueba mejorada. Debe realizarse una prueba y un monitoreo del embarazo como se indica en forma clínica (16).
Otras formas de reducir el riesgo para las mujeres embarazadas
- El riesgo para la gripe A (H1N1) podría reducirse mediante la adopción de medidas para disminuir la posibilidad de estar expuesto a las infecciones respiratorias.
- Estas acciones incluyen:
- Lavado de manos frecuente
- Uso de tapabocas
- Manejo de la tos
- Personas enfermas deben quedarse en casa, excepto para buscar atención médica,
- Reducir al mínimo el contacto con otras personas en el hogar.
- Medidas adicionales que pueden limitar la transmisión de una nueva cepa de la gripe incluyen la cuarentena voluntaria de origen de los miembros de hogares con casos probables o confirmados de gripe A (H1N1) (1,9,4).
- La reducción de contactos sociales innecesarios
- Evitar siempre que sea posible la aglomeración y el hacinamiento de personas.
DEFINICION DE CASO DE INFLUENZA POR NUEVO SUBTIPO VIRAL CASO SOSPECHOSO: Enfermedad febril respiratoria aguda (fiebre = 38° grados) con un espectro que va desde enfermedad tipo influenza (ETI) hasta neumonía y que presenta nexo epidemiológico con un país o área afectada con transmisión humano a humano del nuevo subtipo viral.
ENFERMEDAD TIPO INFLUENZA (ETI): Fiebre súbita mayor de 38°C y tos o dolor de garganta en ausencia de otros diagnósticos y con nexo epidemiológico con un caso o área afectada con transmisión humano a humano del nuevo subtipo viral.
INFECCION RESPIRATORIA AGUDA GRAVE (IRAG):Paciente de cualquier edad con historia de aparición súbita de fiebre mayor de 38°C y tos o dolor de garganta, disnea o dificultad para respirar y necesidad de hospitalización, con nexo epidemiológico con un caso o área afectada con transmisión humano a humano del nuevo subtipo viral.
CASO CONFIRMADO: persona con una enfermedad aguda respiratoria con infección por influenza pandémica A (H1N1) confirmada por laboratorio por una o varias de las siguientes pruebas:
- PCR-RT en tiempo real
- Cultivo viral
- Elevación de 4 veces los títulos de anticuerpos neutralizantes específicos para virus influenza.
Este trabajo tuvo por objetivo analizar los factores de riesgo asociados a la morbimortalidad en mujeres embarazadas con sospecha de infección por influenza A (H1N1) notificadas a la DGVS durante los primeros cuatro meses de la pandemia, en comparación con mujeres en edad fértil no embarazadas con sospecha de infección por influenza A (H1N1).
MATERIALES Y MÉTODOS
Es un estudio descriptivo, observacional, transversal con componente analítico. Se recibieron notificaciones de casos de enfermedad tipo Influenza desde 28 de abril de 2009, hasta el 25 de agosto de 2009, totalizándose 117 casos notificados en la DGVS, sobre gestantes con sospecha de ETI e IRA. Casos sospechosos y confirmados que fueron notificados a través de ficha epidemiológica de enfermedad tipo influenza (ETI) y de infección respiratoria aguda grave (IRAG) de mujeres en edad fértil, a la DGVS en los primeros 4 meses de la pandemia de influenza A (H1N1). Los datos obtenidos, mediante ficha de notificación y cuestionario específico fueron codificados y almacenados en una base de datos en computadora, en planilla Excel y analizados por estadística descriptiva.
Se mantuvo la confidencialidad de los datos de las fichas de notificación, así como los resultados. Este estudio no significo riesgo adicional alguno para las personas estudiadas, debido a que solo se obtuvieron los datos a partir de los análisis indicados por el medico y de una ficha de notificación de caso sospechoso de la enfermedad. Si bien los sujetos de estudio no recibirán un beneficio directo, los resultados que aporte este estudio contribuirán a ampliar los conocimientos sobre la influenza en esta población.
RESULTADOS
En abril del 2009 se identificaron por primera vez infecciones en seres humanos por un virus de la influenza tipo A (H1N1) que se transmite con facilidad entre las personas. En el Paraguay, la confirmación oficial del primer caso de influenza tipo A (H1N1) por parte del Ministerio de Salud de la Nación, se realizó el 27 de mayo del 2009. Al 23 de agosto del 2009, se reportan 4681 casos sospechosos, 430 casos confirmados y 39 fallecidos en todo el territorio nacional. La distribución de los casos confirmados evidencia una mayor cantidad de casos en niños, adolescentes y adultos jóvenes.
En el caso de las mujeres, el 52% de los casos ocurren en etapa reproductiva: de los 2268 casos sospechosos, 1082 casos ocurrieron en mujeres de 15 y 40 años de edad, de estos 117 casos se dieron en mujeres embarazadas.
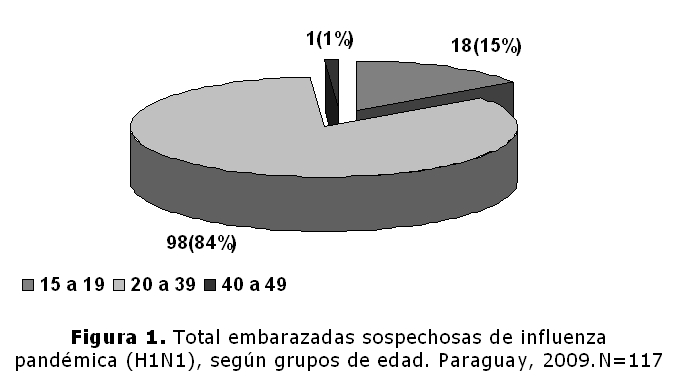
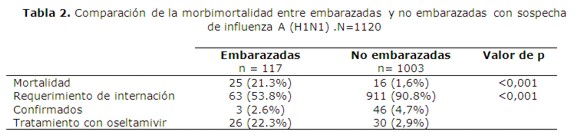
Este dato es particularmente importante, si se tiene en cuenta que las mujeres embarazadas tendrían un riesgo mayor de presentar complicaciones y morir por esta enfermedad tanto en influenza estacional como en los periodos pandémicos. Hasta Agosto de 2009, se había reportado un total de 25 muertes en embarazadas en todo el país, pero se estima un subregistro elevado. Del total de mujeres en edad fértil, fueron hospitalizados 79 casos (68%) de mujeres embarazadas, del grupo de mujeres no gestantes 1003, fueron hospitalizados 288 casos (21%). La mortalidad dentro del grupo de pacientes gestantes fue de 25 casos de 117 (21%), y dentro del grupo de pacientes no gestantes en número de fallecidas fue de 16 casos de 1003 (1,5%). Basado en un primer análisis de los datos recibidos por la Dirección General de Vigilancia de la Salud, sobre los 117 casos de ETI – IRAG, recibidos, podemos afirmar los siguientes puntos: total de embarazadas sospechosas de influenza Pandémica (figura 1) 117, 15 a 19 anos: 17 (15%), 20 a 39 años: 98 (84%),40 a 49 años: 2 (1%).
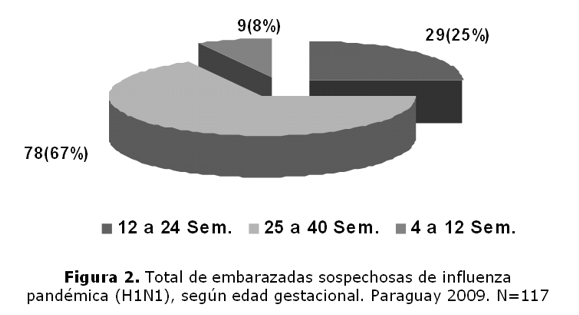
En la figura 2 se describen las semanas de gestación al tiempo de la infección.
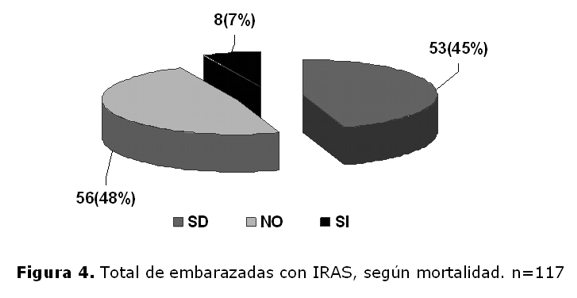
Embarazadas con previa vacunación para influenza estacional (2009) (figura 3).Sin vacunación: 56 (48%), con vacunación: 8 (7%), sin datos: 53 (45%).
Mortalidad (figura 4): número de fallecidos en subgrupo embarazadas: 25 (21%).
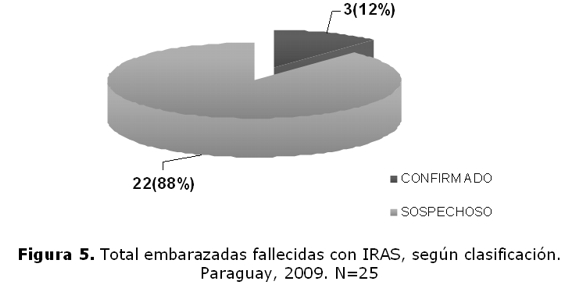
Total de embarazadas fallecidas según clasificación (figura 5): 3 confirmados, 22 sospechosos.
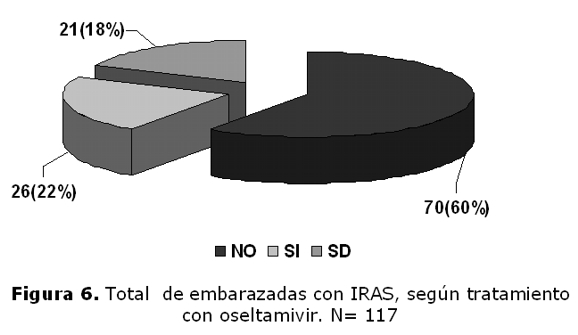
Total de embarazadas con ETI–IRAS, según tratamiento con oseltamivir (figura 6). Con tratamiento: 26, sin tratamiento: 70, sin datos de tratamiento: 21.
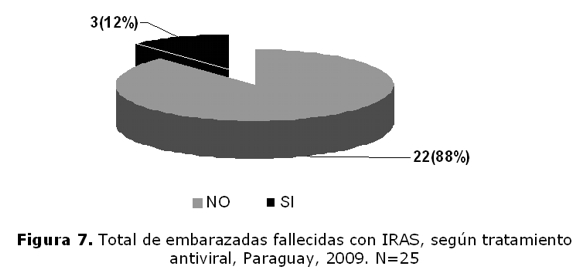
Total de embarazadas fallecidas por IRAS, según recibieron o no tratamiento antiviral, (figura 7), de las cuales 3 estaban con tratamiento y 22 sin tratamiento.
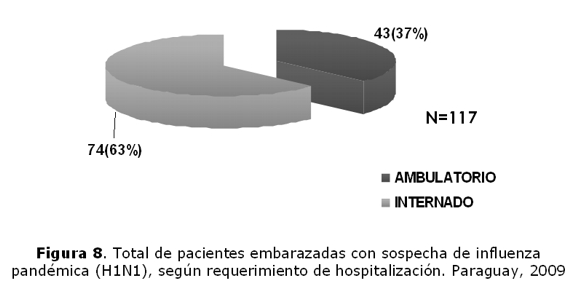
Total de pacientes embarazadas con sospecha de ETI–IRAS, según requerimiento de internación (figura 8).
Mortalidad
Del total de embarazadas fallecidas con IRAS, según tratamiento antirretroviral (figura 7) 3 recibieron tratamiento y 22 no recibieron tratamiento.
Todos los casos fallecidos desarrollaron infección respiratoria aguda grave (IRAG) caracterizado por un síndrome de distrés respiratorio que en algunos casos requirieron asistencia respiratoria mecánica (ARM). Ninguna de las embarazadas refirió antecedente de co-morbilidad. El 22% (26/117) de las embarazadas y 2,9% (30/1003) de las no embarazadas recibieron oseltamivir como tratamiento (tabla 1 y 2).
DISCUSION
Sobre el riesgo de influenza en embarazadas: de acuerdo a las observaciones realizadas en los periodos pandémicos como ínter pandémicos, las embarazadas constituyen un grupo de riesgo para presentar complicaciones graves e incluso muerte por influenza, en particular durante el segundo y tercer trimestre del embarazo. En la pandemia actual, se reporto un número significativo de casos de mujeres embarazadas afectadas por el virus de la influenza A, algunas de las cuales evolucionaron con complicaciones graves, incluso, la muerte.
Sobre el riesgo de desarrollo para el feto: la evidencia sobre los efectos del virus de la influenza en el feto es menos consistente. Algunos estudios encontraron una asociación de la infección de influenza durante el embarazo con la aparición de anomalías congénitas, aunque en general se considera que esta relación podría estar más vinculada a la hipertermia que al virus per se. Es difícil diferenciar los efectos teratogénicos de la causa de la fiebre y de la fiebre en sí misma; sin embargo, es conveniente tratar la fiebre en toda mujer embarazada teniendo en cuenta el riesgo que la hipertermia parece tener sobre el feto. El acetominofeno es la droga de elección.
Sobre la seguridad de antirretrovirales en embarazadas: existe escasa evidencia sobre la seguridad del uso de oseltamivir y zanamivir en embarazadas. Según la FDA (Food and Drugs Administration) se trata de medicamentos categoría C, lo que significa que no se han realizado estudios clínicos para evaluar su inocuidad en esta población.
A la fecha, la evidencia sobre la seguridad de estas drogas en embarazadas proviene de estudios de laboratorio y/o en animales así como de resultados de la vigilancia post–comercialización.
Sobre la seguridad del oseltamivir en embarazadas: los estudios en animales, en placenta humana ex vivo así como la revisión de los casos de embarazadas expuestas al oseltamivir durante el embarazo (en particular, en el primer trimestre) realizada a partir de la vigilancia post–comercialización de la droga, indicarían que el riesgo de anomalías congénitas asociados al uso del oseltamivir no sería mayor al observado en la población general.
Sobre la seguridad de uso de zanamivir en embarazadas: la evidencia sobre la seguridad del uso del zanamivir en embarazadas es aún muy escasa que la que se posee del oseltamivir; sin embargo, un número importante de expertos e investigadores considera que su potencial riesgo teratogénico seria bajo dada su reducida biodisponibilidad y pasaje a sangre.
Sobre recomendaciones de tratamiento de influenza A (H1N1) en embarazadas: existe consenso para la indicación de tratamiento a las embarazadas durante la pandemia en curso, dado que los beneficios y los riesgos de no tratar son mayores que el potencial riesgo teratogenico del antiviral. A favor de esta recomendación, se publicaron dos revisiones sobre la seguridad de uso de oseltamivir en embarazadas.
Las recomendaciones acerca del tipo de droga a utilizar varían de acuerdo al organismo que efectúa la recomendación.
Algunos recomiendan zanamivir por su baja biodisponibilidad y por ende, su potencial menor riesgo teratogénico. Otros recomiendan oseltamivir, ya que consideran que la influenza por el nuevo virus de influenza A (H1N1) posee un riesgo muy elevado en población de embarazadas, por lo que se necesita una droga activa sistemáticamente para controlar la infección. Una posición intermedia a las descritas, recomienda zanamivir para tratamiento de formas leves y que ocurren en el primer trimestre (riesgo más alto que ocurra efecto teratogénico y evidencia que muestra que el mayor riesgo de complicaciones de influenza se observa principalmente en el segundo y tercer trimestre) y oseltamivir para las formas moderadas a graves y/o para tratamiento de la infección en el segundo y tercer trimestre.
Se recomienda el uso de la profilaxis en las embarazadas que han tenido un contacto estrecho con un caso confirmado o probable de influenza A (H1N1) pandémica.
La droga más recomendada es el zanamivir, por su menor biodisponibilidad en comparación con el oseltamivir.
REFERENCIAS BIBLIOGRÁFICAS
1. Jamieson DJ, Honein MA, Rasmussen SA,Williams JL, Swerdlow DL, Biggerstaff MS, et al. H1N1 2009 Influenza Virus Infection during pregnancy in the USA. Lancet 2009; 374(9688): 451-8. [ Links ]
2. Torres-Ramirez A. Pandemic influenza caused by A(H1N1) in pregnant women. Ginecol Obstet Mex 2010 Feb;78(2):121-7. [ Links ]
3. Rasmussen SA, Jamieson DJ, Bresse JB. Pandemic Influenza and Pregnant Women. Emerg Infect Dis 2008; 14(1): 95-100. [ Links ]
4. Hartert TV, Neuzil KM, Shintani AK, Mitchel EF Jr, Snowden MS, Wood LB. et al. Maternal morbidity and perinatal outcomes among pregnant women with respiratory hospitalization during influenza season. Am J Obstet Gynecol 2003; 189; 1705–12. [ Links ]
5. Cox S, Posner SF, McPheeters M, Jamieson DJ, Kourtis AP, Meikle S. Hospitalization with respiratory illness among pregnant women during influenza season. Obstetr Gynecol 2006; 107(6): 1315-22. [ Links ]
6. Rassmusen S, Jamieson D, MacFarlane K. Pandemic Influenza and Pregnant Women: Summary of Meeting of Experts. American Journal of Public Health 2009; (99) Supplement 2: 1-7. [ Links ]
7. Center for Diseases Control and prevention. Pregnant Women and Novel Influenza A(H1N1) Virus: Consideration for Clinicians. USA.GOV (online). 2009, (cited June 30 2009). Disponible online: http://www.blackwellpublishing.com/medicine /bmj/nnf5/pdfs/uk_guidelines/swine_flu_risk_in_pregnancy.pdf. [ Links ]
8. Irwin WL, James DK, Stephenson T, Lain P, Lameson P, Oxford JS et al. Influenza virus infection in the second and third trimesters of pregnancy: a clinical and seroepidemilogical study. BJOG 2000; 107: 1282-9. [ Links ]
9. Centro para el control y prevención de enfermedades (CDC). Información para los médicos sobre las mujeres embarazadas y la influenza porcina. CDC (online) 2009 (acceso Mayo 2009). Disponible en: http://espanol.cdc.gov/enes/h1n1flu/. [ Links ]
10. Mullooly JP, Barker WH, Nolan TFJr. Risk of Acute Respiratory Disease among pregnant women during influenza An epidemics. Pub Health Rep 1986; 101:205-11. [ Links ]
11. Czeizel AE, Puho EH, Acs N. High Fever-related maternal diseases as possible causes of multiple congenital abnormalities: a population-based case-control study. Birth Defects Res a clin mol teratol. 2007; 79: 544-51. [ Links ]
12. Li Z, Rem A, Lui J, Pei L, Zhang L, Guo Z et al. Maternal Flu or Fever, medication use, and neural tube defects : a population-based study in Northern China. Birth Defects Res A Clin Mol Teratol 2007, 79 (4): 295–300. [ Links ]
13. Hayashi M, Yamane R, Tanaka M. Pregnancy outcome after maternal expousure to oseltamivir phosphate during the first trimester: a case series survey (Japanese). Nihon yoin Yakuzaishi Gakkai Zasshi 2009; 45: 547-50. [ Links ]
14. Freund Gravenstein S, Elliot M, Miller I. Zanamivir: a review of clinical safety. Drug Saf 1999; 21: 267-81. [ Links ]
15. Gallaher WR. Towards a sane and rational approach to management of Influenza H1N1 2009. Virology Journal 2009, 6:51. [ Links ]
16. Louie JK, Acosta M, Jamieson DJ, Honein MA. Pandemia de California (H1N1) Grupo de Trabajo. Severe 2009 H1N1 Influenza in Pregnant and Postpartum Women in California. N Engl J Med 2010; 362:27-35. [ Links ]
17. Tanaka T, Nakajima K, Murashima A, Garcia-Bournissen F, Koren G, Ito S. Safety of neuraminidases inhibitors against novel influenza A(H1N1) in pregnant and breastfeeding women. CMAJ 2009; 181:1-2. [ Links ]
18. European Medicines Agency. Follow-up recommendations from CHMP on Novel Influenza (H1N1) outbreak Tamiflu (oseltamivir) – Relenza (zanamivir). Doc. Ref. EMEA/CHMP/326095/2009;London: European Medicines Agency. 2009. [ Links ]
19. Philippe M. Pandemic Influenza: What obstetricians need to know. Obstet-Gynecol 2009; 114:206-8. [ Links ]
20. American College of Obstetricians and Gynecologists. Influenza Vaccination and Treatment during pregnancy. ACOG Committee Opinion No. 305. Obstet Gynecol 2004; 104: 1125-6. [ Links ]
21. Ward P, Small I. Osealtamivir (Tamiflu) and its potential for use in the event of an influenza pandemic. J Antimicrob Chemother 2005; 55 (Suppl 1):i5-21. [ Links ]
22. Public Health Agency of Canada. Intern Clinical Guidance for Pregnant and Breastfeeding Women with Influenza-Like Illness in the context of the Pandemic H1N1 2009. Virus-Public Health Agency of Canadá. 2009 (acceso 15/02/2010). Disponible en: http://www.phac-aspc.gc.ca/alert-alerte/h1n1/guidance-orientation-07-09-eng.php. [ Links ]
23. WHO. Human infection with new influenza A (H1N1) virus: clinical observations from Mexico and other affected countries. Mexico: WHO Weekly epidemiological record, No. 21. 2009. [ Links ]
24. Shu Y, Yu H, Li D. Lethal avian influenza A(H5N1) infection in a pregnant woman in Anhui Province, China. N Engl J Med. 2006;354:1421–2. [ Links ]
25. Gu J, Xie Z, Gao Z. H5N1 infection of the respiratory tract and beyond: a molecular pathology study. Lancet 2007;370:1137–45. [ Links ]
26. Griffiths PD, Ronalds CJ, Heath RB. A prospective study of influenza infections during pregnancy. J Epidemiol Community Health 1980;34:124-8. [ Links ]
27. ML Lim, CY Chong, T-WS, WY Lim, Chee JJ. Influenza A/H1N1 (2009), la infección durante el embarazo-una perspectiva asiática. BJOG. 2010; 117(5):551-6. [ Links ]
28. Mouzoon ME, Munoz FM, Greisinger AJ, Brehm BJ, Wehmanen OA, Smith FA, et al. Improving influenza immunization in pregnant women and healthcare workers. Am J Manag Care. 2010;16(3):209-16. [ Links ]
29. Centers for Disease Control and Prevention (CDC).Update: influenza activity-United States, August 30, 2009-March 27, 2010, and composition of the 2010-11 influenza vaccine. MMWR Morb Mortal Wkly Rep. 2010;59(14):423-30. [ Links ]
30. National Center for Immunization and Respiratory Diseases, CDC; Centers for Disease Control and Prevention (CDC).Use of influenza A (H1N1) 2009 monovalent vaccine: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2009. MMWR Recomm Rep. 2009;58(RR-10):1-8. [ Links ]
*Autor Correspondiente: Dr. Carlos Christian Barúa, Dirección General de Vigilancia de la Salud, Ministerio de Salud Pública y Bienestar Social. Asunción, Paraguay Email: carloschrisbarua@gmail.com
Fecha de recepción: setiembre de 2009 , Fecha de aceptación: mayo de 2010