Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Memorias del Instituto de Investigaciones en Ciencias de la Salud
On-line version ISSN 1812-9528
Mem. Inst. Investig. Cienc. Salud vol.4 no.2 Asunción Dec. 2006
ARTICULO ORIGINAL
Identificación de especies de candida aisladas de pacientes ambulatorios, hospitalizados, e inmunocomprometidos en Paraguay
Identification of candida species isolated from ambulatory, hospitalized and immune-depressed patients in Paraguay
*Sanabria RI,II, Samudio MI, Fariña NI,II, Laspina FI,V, Ortellado de Canese JIII. Arbizu Ledesma GIV, Laconich Romero MIII,V, Rodríguez HIV,V
IInstituto de Investigaciones en Ciencias de la Salud (IICS). Universidad Nacional de Asunción (UNA),
IILaboratorio San Roque,
IIIHospital de Clínicas (UNA),
IVInstituto de Medicina Tropical, MSP y BS,
VInstituto de Previsión Social
RESUMEN
Objetivo: Identificar las especies de candida aisladas de varias muestras clínicas. Métodos: Se aislaron 310 cepas de Candida sppde pacientes internados (n=133), ambulatorios (n=134) e inmunocomprometidos (n=43) que concurrieron a cuatro centros médicos en Asunción, desde enero del 2004 a octubre del 2005. Para la identificación de especies, las colonias fueron cultivadas en placas de CHROMagar Candida® e incubadas a 35º; por 18-24 horas. Aquellas colonias que no pudieron ser identificadas por el método cromogénico fueron identificadas con el microsistema de identificación API candida (Biomérieux). Resultados: De las 310 cepas estudiadas, 188 (60,6%) correspondió a C. albicans, 79 (25,5%) a C. tropicalis, 33 (10,6%) a C. glabrata, 8 (2,6%) a C. krusei, y 2 (0,7%) a C. parapsilosis. C. albicans fue la especie más frecuentemente aislada tanto en las muestras de origen comunitario como en los pacientes inmunocomprometidos, 81% y 58%, respectivamente. Sin embargo, en las muestras hospitalarias especies de C. tropicalis fueron más frecuente que C. albicans (47% y 41%, respectivamente). Conclusión:Las especies de candida no albicans predominaron en las muestras hospitalarias por lo que su tipificación rutinaria debería hacerse en forma rutinaria.
Palabras claves: Candida albicans. Candida non-albicans. Pacientes inmudeprimidos.
ABSTRACT
Objective: the typing of Candida species isolated from various clinical samples. Methods: We included in this study 310 isolates of Candida spp from hospitalized (n=133), ambulatory (n=134) and immune-depressed (n=43) patients from four medical centers in Asunción from January 2004 to October 2005. In order to identify the species, the colonies were cultured in CHROMagar Candida® plates and incubated at 35º for 18-24 hours while the API candida microsystem (Biomérieux) was used for those colonies that were not identified by the chromogenic method. Results: Out of the 310 strains, 188 (60.6%) were identified as C. albicans, 79 (25.5%) as C. tropicalis, 33 (10.6%) as C. glabrata, 8 (2.6%) as C. krusei and 2 (0.7%) as C. parapsilosis. C. albicans was the leading species in the samples of ambulatory patients as well as in immune-depressed patients, 81% and 58%, respectively. However, species of C. tropicalis were more frequent than C. albicans in the samples from hospitalized patients (47% and 41%, respectively). Conclusion: Species of Candida non-albicans predominated in samples from hospitalized patients, therefore their typing has to be performed on a routine basis.
Keywords: Candida albicans, Candida non-albicans, immune-depressed patients.
INTRODUCCIÓN
Los microorganismos del género cándida constituyen los agentes etiológicos de micosis oportunistas por excelencia1,2. Con el uso indiscriminado de antibióticos de amplio espectro, la implantación de material protésico y de órganos, la corticoterapia e inmunosupresión terapéutica o adquirida se han registrado un aumento significativo de las infecciones producidas por levaduras en los últimos años1.
En general C. albicans es la especie más frecuentemente aislada de muestras clínicas, sin embargo en muestras de origen hospitalario el aislamiento de especies de candida no albicans van en aumento3,4 y existen variaciones en el hallazgo micológico, según diferentes sitios geográficos e inclusive entre diferentes instituciones dentro de un país5. En algunos centros de los Estados Unidos existe una mayor prevalencia de C. glabrata sobre C. albicans y en otros de Latinoamérica y España se observa mayor frecuencia de C. tropicalis y C. parapsilosis,4,6.
Varios estudios han utilizado el CHROMagar Candida®, para la identificación de especies de levaduras, demostrándose una excelente concordancia en la identificación de las especies de Candida cuando se compara con los métodos convencionales de identificación1,7
En el Paraguay no existen aún trabajos publicados sobre tipificación de candida, motivo por el cual realizamos el presente estudio de identificación de levaduras de origen comunitario, hospitalario y de pacientes inmunocomprometidos de manera a conocer las especies prevalentes lo que orientaría al médico en la selección del tratamiento inicial de infecciones por levaduras.
MATERIALES Y MÉTODOS
Fueron estudiadas 310 cepas de Candida spp provenientes de aislamientos significativos de muestras clínicas, 134 cepas de secreciones vaginales de pacientes ambulatorios, 133 de pacientes internados (66 de orina, 32 de tracto respiratorio, 18 de punta de catéter, 6 de hemocultivo, 11 de varios orígenes) y 43 cepas de candidiasis orofaríngea de pacientes con SIDA (Síndrome de Inmunodeficiencia Adquirida) (ver tabla 1).
Las muestras fueron derivadas al Departamento de Microbiología del IICS, de los laboratorios San Roque, Hospital de Clínicas, Instituto de Medicina Tropical e Instituto de Previsión Social, desde enero del 2004 a octubre del 2005. Con el fin de obtener colonias puras, las levaduras aisladas de muestras clínicas fueron sub-cultivadas en agar Sabouraud glucosado, con cloranfenicol al 1% y para la identificación de especies fueron sembradas e incubadas a 35º por 18-24 horas en placas de CHROMagar Candida® (Becton & Dickinson) compuesto de agar, peptona, glucosa, cloranfenicol y una mezcla de sustratos cromogénicos8. Las especies de candida fueron identificadas por la pigmentación de las colonias: las decolor verde como C. albicans, las de color azul como C. tropicalis, y las de color rosa podrían corresponder a una variedad de especies como C. krusei (colonias secas), C. glabrata, C. parasiplosis y otras. Todas las colonias de color rosa fueron diferenciadas con el microsistema de identificación API candida (Biomérieux, Francia).
RESULTADOS
De las 310 cepas cultivadas en placas de CHROMagar Candida®, 188 (60,6%) desarrollaron color verde característico de C. albicans, 79 (25,5%) color azul de C. tropicalis, 8 (2,6%) colonias secas de color rosa claro presuntivamente identificadas como C. krusei y 35 (11,3%) cepas de color rosa (ver tabla 2).
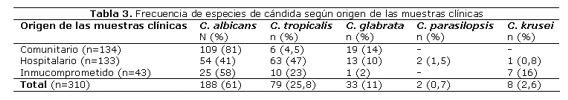
Las cepas de color rosa fueron posteriormente identificadas por API candida como C. glabrata 33 (10,6%), C. krusei8 (2,6%) y C. parasilopsis 2 (0,7%) (ver tabla 3).
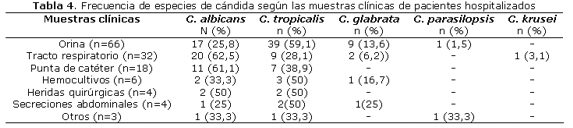
La frecuencia de las especies de candida, según el origen de las muestras clínicas en pacientes hospitalizados, se observa en la tabla 4.
DISCUSIÓN
En las muestras de origen comunitario (vaginitis) C. albicans fue la especie más frecuentemente aislada (81%), seguido C. glabrata (14%) y C. tropicalis (5%). Nuestros resultados son similares a los obtenidos por Kwon Chung y col9 en Tailandia, donde encontraron un 84% de vaginitis debida a C. albicans, 11,7% a C. glabrata, 5,3% a C. tropicalis y 4,6% a otras especies. Todos los trabajos en la literatura coinciden en que la especie de candida más frecuentemente aislada de pacientes con vaginitis es C. albicans seguida de C. glabrata. Así en España la prevalencia de C. albicans es de 78,7%7, en Brasil va de 65,4% a 86%10-12, en Italia es de 50%13. Ocasionalmente también se reportan aislamientos de C. parapsilosis en muestras vaginales, y excepcionalmente otras especies como C. guillermondii, C. lusitaniae, C. krusei y C. famata son reportadas7. Ninguna de estas últimas especies fue aislada en nuestro estudio.
Sin embargo, cuando hacemos referencia a las muestras hospitalarias de nuestro estudio C. albicans y C. tropicalis se presentaron en proporción similar, con una frecuencia ligeramente superior de C. tropicalis (47%) sobre C. albicans (41%), a diferencia de varios estudios en pacientes internados, donde también le citan a C. albicans como la más prevalente4,6,7. Cuando se considera el origen de las muestras, las especies de candida no albicans son más prevalentes en muestras de orina (59,1% de C. tropicalis y 13,6% de C. glabrata), encontrándose solo un 25,8% de C. albicans, como fuera observada en el trabajo de Wang et al en Taiwan4, quienes encontraron en 26 muestras de orina 29,9% de C. albicans y 70,1% de Candida no albicans (49% C. glabrata y 6,5% C. tropicalis). Consideramos que la mayor prevalencia de C. tropicalis sobre C. albicans en los pacientes hospitalizados en este estudio se debe al gran número de muestras de orina incluidas en este estudio (50% de las muestras de internados).
Actualmente el aislamiento de especies de candida no albicans va en aumento, a pesar de que en la mayoría de los estudios C. albicans continua siendo la especie predominante7. En los Estados Unidos se ha registrado una significativa disminución de C. albicans como agente etiológico de fungemias junto con un aumento en la incidencia de C. glabrata entre los años 1989 y 1999, según datos del National Nosocomial Infections Surveillance System6. En Taiwán en un Hospital universitario, Candida tropicalis fue la segunda especie más aislada de fungemias entre las candidas no albicans después de C. glabrata y la prevalencia de C. tropicalis aumentó del 14% durante el periodo 1981-1993 al 23% durante 1996 a 200214.
Hay varios factores que condicionan las diferencias geográficas de la distribución de las especies de candida. En los Estados Unidos, según Pfaller et al, el aumento de C. glabrata en relación a otras regiones se puede explicar por el uso profiláctico de fluconazol a bajas dosis (<400mg/día) lo que selecciona a dicha especie. Por el contrario, el aislamiento frecuente de C. parapsilosis en otras regiones puede reflejar problemas de cuidado inadecuado de los catéteres6.
La candidiasis orofaringea es la infección oportunista más frecuente en pacientes inmunocomprometidos, ocurriendo en el 80 a 95% de estos pacientes cuando el recuento de linfocitos T CD4 (+) cae por debajo de 200 células/mm15. Candida albicans es el principal patógeno en la candidiasisorofaríngea9, encontrándose en el presente estudio en un 58%. En la actualidad se observa aumento de aislamientos de candida no albicans en esta patología, debido probablemente a exposición previa a imidazoles. En estos pacientes C. albicans es seguido en frecuencia por C. glabrata, C. tropicales, C. krusei, C. parapsilosis y otras especies de candida. En esta serie las frecuencias de C. tropicalis y C. krusei son las más altas (23% y 16%) reportadas, probablemente por el uso previo de fluconazol debido a las lesiones orofaringeas recidivantes que son frecuentes en los pacientes inmunocomprometidos. Cabe destacar que C. krusei es naturalmente resistente al fluconazol y su identificación es fundamental para la elección del antifúngico a utilizarse.
El medio CHROMagar Candida® nos permitió identificar las especies de levaduras como C. albicans por el color verde de las colonias, C. tropicalis por el color azul., además la identificación presuntiva de C. krusei por las colonias secas de color rosa claro, presunción posteriormente confirmada en un 100% de los casos por el método API Candida. Para la identificación de otras colonias de color rosa fue necesaria la utilización de otro método, el microsistema API Candida; Biomérieux. Si bien el sistema CHROMagar Candida® no permite la identificación definitiva de las especies como C. parasilopsis, C. glabrata y otras, posibilita discriminar con mucha fiabilidad las especies más frecuentes, este método es de menor costo en relación a los microsistemas comerciales, es rápido y simple a diferencia de las laboriosas pruebas bioquímicas utilizadas para la identificación de especies de candida. Según Odds et al, la sensibilidad y especificidad de este método cromogénico para la identificación de C. albicans, C. tropicalis y C. krusei es del 98%16.
En pacientes infectados por VIH se ha descrito una nueva especie de candida C. dubliniensis17, con características fenotípicas similares a C. albicans con la que puede ser confundida cuando se identifica mediante las pruebas mínimas utilizadas convencionalmente porque también tiene la capacidad de formar clamidosporas y tubos germinativos como la C. albicans. La prevalencia de C. dubliniensis en Latinoamérica es aun baja, oscila entre 2 a 3%18, a diferencia de los países del norte donde la prevalencia es de 11%-17,5% en Estados Unidos19 y 18-32% en Irlanda20. Cuando se utiliza el método cromogénico CHROMagar Candida® estas dos especies pueden ser confundidas, debido a C. albicans desarrolla un color verde esmeralda y C. dubliniensis un tono verde oscuro. Consideramos que en este estudio no se ha aislado C. dubliniensis, porque no se visualizó tonalidad verde oscuro en el CHROMagar Candida®21, la identificación confirmatoria se realiza exclusivamente por técnicas Moleculares18,21.
El medio CHROMagar Candida® utilizado nos permitió la identificación del 89% de las especies de levaduras estudiadas. Este medio además puede ser utilizado como placa primaria de cultivo, en la que se puede sembrar directamente las muestras clínicas con sospecha de infección fúngica, permitiendo el aislamiento y la identificación de levaduras en 24 a 48hs, por lo que recomendamos el uso de este medio especialmente en pacientes graves en donde es fundamental la rapidez del diagnóstico y el conocimiento de la especie.
La mayoría de las especies de candida no albicans frecuentemente aisladas como C. glabrata y C. tropicalis, presentan mayor resistencia a los antifúngicos azólicos como el fluconazol6,7, que es el más utilizado en el tratamiento de la candidiasis, tanto en pacientes ambulatorios, internados como inmunocomprometidos. Si bien el aislamiento de C. krusei no es muy frecuente se destaca la importancia de la identificación de esta especie, debido a su conocida resistencia natural al fluconazol, lo que obligaría al médico tratante a utilizar antifúngicos no azólicos.
Consideramos de gran utilidad este estudio para el conocimiento de las especies de candida más frecuentemente aisladas en nuestro país y recomendamos a los laboratorios la realización de la identificación de las levaduras a nivel de especie, sobre todo en los pacientes hospitalizados e inmunodeprimidos, poblaciones en las que obtuvimos alto porcentaje de aislamientos de candida no albicans, que son los que presentan mayor resistencia a los antifúngicos, de manera a orientar al médico en el tratamiento de los pacientes.
AGRADECIMIENTOS
Este trabajo fue realizado con el apoyo de los fondos de la Dirección de Investigación y Postgrado de la Universidad Nacional de Asunción.
BIBILIOGRAFIA
1. Giusano G, Mangiaterra M. Diferenciación e identificación presuntiva rápida de levaduras con el medio CHROM agar cándida. Rev Arg Microbiología 1998; 30(2):100-3. [ Links ]
2. Hazen KC. New and emerging yeast pathogens. Clin Microbiol Rev 1995; 8:462-78. [ Links ]
3. Pfaller MA, Jones RN, Doern GV, Sader HS, Hollis RJ, Messer SA. International surveillance of bloodstream infections due to candida species: Frequency of occurrence and antifungal susceptibilities of isolates collected in 1997 in the United States, Canada, and South America for the SENTRY Program For The Sentry Participant Group. J Clin Microbiol 1998; 36:1886-9. [ Links ]
4. Wang JL, Chang SC, Hsueh PR, Chen YC. Species distribution and fluconazole susceptibility of candida clinical isolates in a medical center in 2002. J Microbiol Immunol Infect 2004; 37:236-41. [ Links ]
5. Pfaller MA, Diekema DJ, Jones RN, Sader HS, Fluit AC, Hollis RJ, et al. International surveillance of bloodstream infections due to candida species: Frequency of occurrence and In vitro susceptibilities to Fluconazole, Ravuconazole, and Voriconazole of isolates collected from 1997 through 1999 in the SENTRY Antimicrobial Surveillance Program. J Clin Microbiol 2001; 39: 3254–9. [ Links ]
6. Odds FC, Bernaerts R. CHROMagar Candida, a new differential isolation médium for presumptive identification of clinically important candida species. J Clin Microbiol 1994; 32:1923-9. [ Links ]
7. Muriel M, Vizcaino MJ, Bilbao R, Herruzo R. Identificación de levaduras y sensibilidad in vitro a diversos antifúngicos. Enferm Infecc Microbiol Clin 2000; 18:120-4. [ Links ]
8. Cooke VM, Miles R, Price R, Midgley G, Khamri W, Richardson C. New chromogenic agar médium for the identification of Candida spp. Applied and Environmental Microbiology 2002, 68(7):3622-7. [ Links ]
9. Kwon-Chung KJ, Bennett MD. Medical mycology. Philadelphia: Lea & Febiger, 1992. p. 280-335. [ Links ]
10. Linhares LM, Witkin SS, Miranda SD, Fonseca AM, Pinotti JA, Ledger WJ. Differentiation between women with vulvovaginal symptoms who are positive or negative for Candida species by culture. Infect Dis Obstet Gynecol 2001; 4: 221-5. [ Links ]
11. Ferrazza MHSH, Ferrarezi Maluf ML, Lopes Consolaro ME, Shinobu CS, Estivalet Svidzinski TI, Batista MR. Caracterização de leveduras isoladas da vagina e sua associação com candidíase vulvovaginal em duas cidades do sul do Brasil. Rev Bras Ginecol Obstet 2005; 27(2): 58-63. [ Links ]
12. Chiari Galle L, Soares Mendes Gianinni MJ. Prevalência e susceptibilidade de leveduras vaginais. J Bras Patol Med Lab 2004; 40(4):229-36. [ Links ]
13. Arseni D, Del Poeta M, Simonetti O, Offidani AM, Lamura M, Balducci M et al. Prevalence and antifungal susceptibility of vaginal yeast in outpatient attending in a gynecoloigcal center in Ancona, Italy. Eur J Epidemiol 1997; 13:447-50. [ Links ]
14. Shen SH, Jang TN, Huang CS, Lee SH. Nosocomial fungemia in a medical center in Northern Taiwan. Nosocom Infect Control J 2000; 11:255-64. [ Links ]
15. Crowe S, Carlin JB, Steward KI, Lucas CR, Hoy JF. Predictive value of CD4 lymphocyte numbers for the development of opportunistic infections and malignances in HIV-infected persons. J Acquir Immune Defic Syndr 1991; 4:770-6. [ Links ]
16. De Laet Sant'Ana P, Pipolo Milan E, Martinez R, Queiroz-Telles F, Ferreira MS, Alcantara AP, et al. Multicenter brazilian study of oral candida species isolated from Aids patients. Mem Inst Oswaldo Cruz, Rio de Janeiro; 2002; 97(2):253-7. [ Links ]
17. Pinjon E, Sullivan D, Salkin I, Shanley D, Coleman D. Simple, inexpensive, reliable method for differentiation of Candida dubliniensis from Candida albicans. J Clin Microbiol 1998; 36:2093-5. [ Links ]
18. De Laet Sant'ana Mariano P, Pipolo Milan E, Da Matta Da, Lopes Colombo A. Candida dubliniensis identification in brazilian yeast stock collection. Mem Inst Oswaldo Cruz, Rio de Janeiro 2003; 98(4):533-8. [ Links ]
19. Kirkpatrick WR, Revankar SG, McAtee RK, Lopez-Ribot JL, Fothergill AW, McCarthy DI et al. Detection of Candida dubliniensis in oropharyngeal samples from human immunodeficiency virus-infected patients in North America by primary CHROMagar Candida screening and susceptibility testing of isolates. J Clin Microbiol1998; 36:3007-12. [ Links ]
20. Coleman DC, Sullivan DJ, Bennett DE, Moran GP, Barry HJ, Shanley DB. Candidiasis: the emergence of a novel species, Candida dubliniensis. 1997; Aids 11:557-67. [ Links ]
21. Mesa L, Arcaya N, Cañas O, Machado Y. Evaluación de los caracteres fenotipicos para diferenciar Candida albicans de Candida dubliniensis. Rev Iberoam Micol 2004; 21:135-8. [ Links ]
*Autor correspondiente: Dra. Rosa Sanabria
Dpto. de Microbiologia, Instituto de Investigaciones en Ciencias de la Salud, UNA
Asunción_Paraguay
Email:microbiologia@iics.una.py